كروماتوگرافي مايع با كارآيي بالاي دناتوره
دکتر مهدی فصیحی رامندی (عضو هیئت علمی دانشگاه علوم پزشکی بقیها… (عج))
زهرا کریمی (مرکز تحقیقاتی زیست سلول پژوهان تدبیر)
دکتر رضا میرنژاد (دانشیار دانشگاه)
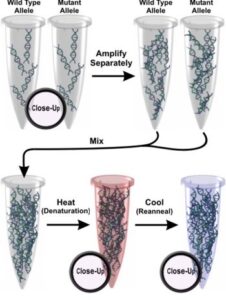
كروماتوگرافي مايع با كارآيي بالاي دناتوره[1](dHPLC) روشي سريع و قابل اعتماد براي غربالگري تغييرات DNA ميباشد. اين تكنيك ميتواند در چند دقيقه، جانشيني تك نوكلئوتيدي و حذف و اضافههاي در حد 1500-80 نوكلئوتيدي را با حساسيت و اختصاصيت در حدود 100% شناسايي كند. در اين تكنيك محصول PCR نمونۀ سالم (وحشي[2]) و نمونۀ بيمار (حاوي جهش[3]) را با هم مخلوط كرده و با حرارت دناتوره (دگرگون) ميكنند. سپس با سرد كردن اين مخلوط، رشتههاي همودوبلكس و هترودوبلكس ايجاد خواهند شد (شکل 1و 2).
شکل (1): نحوه انجام كروماتوگرافي مايع با كارآيي بالاي دناتوره
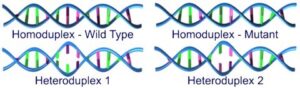
اگر نمونه حاوي جهش باشد، در اين مرحله چهار نوع رشته حاصل خواهد شد.
شکل 2: نمایی از چهار رشته تشکیلشده در صورت وجود جهش در رشتهها
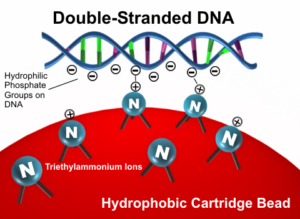
سپس اين مخلوط را از درون ستون كروماتوگرافي خاصي عبور ميدهند. اين مخلوط حاوي هترودوبلكس و همودوبلكس بوده و به مسير حاوي ترياتيل آمونيوم استات و استونيتريل تزريق ميشود. در اين حالت يون ترياتيل آمونيوم با بار مثبت حاصل شده كه هم داراي سر آبگريز و هم سر آبدوست ميباشد. ستون كروماتوگرافي كه درون آون قرار دارد داراي ذرات با بار مثبت ميباشد. ترياتيل آمونيوم مثبت به فسفات منفي DNA متصل شده و خاصيت آبگريزي را القاء ميكنند. در اینجا DNA كه آبگريز شده است، به ذرات آبگريز متصل ميشود (شکل 3).
شکل 3: نحوه عملکرد ستون کروماتوگرافی
به اين ستون يك شيب دمايي با گسترۀ 67-48 درجه سلسیوس داده ميشود. در اين مرحله غلظت استونيتريل را رفتهرفته افزايش داده تا قدرت يوني ترياتيل آمونيوم كاهش يابد و قطعات DNA از ستون جدا شوند.
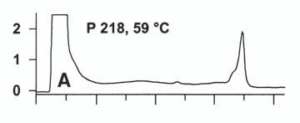
رشتههاي هترودوبلكس هنگام عبور از ستون زودتر و بيشتر دناتوره ميشوند. اين رشتههاي دناتوره شده كمتر در ماتريكس ستون باقي مانده و زودتر از درون ستون عبور ميكنند. بعد از عبور و خارج شدن رشتهها از ستون، آشكارساز UV آنها را تشخيص داده و نمودار مربوط به هرکدام از اين رشتههاي هترودوبلكس و همودوبلكس را بهطور جداگانه ترسيم ميكند. اگر هيچ جهشي وجود نداشته باشد، تنها يك قله ديده ميشود، ولي اگر جهش وجود داشته باشد 4-2 قله در كروماتوگرام مشاهده میگردد.
شکل 4: تفسیر قلههای تشکیلشده در کروماتوگرام
اين سيستم كروماتوگرافي شامل يك فاز ثابت آبگريز و فاز متحرك حاوي يك يون دوگانه دوست و يك يون آبدوست كوچك ميباشد. جذب يون مثبت ترياتيل آمونيوم بر سطح فاز ثابت و آبگريز، موجب ايجاد يك پتانسيل الكتريكي بر روي آن شده است. اتصال DNA بر روي سطح فاز ثابت، وابسته به اندازه مولكول DNA، ميزان پتانسيل سطحي فاز ثابت و نمونه و نهایتاً ناحيۀ تماس DNA با فاز ثابت ميباشد. با افزايش دماي ستون، DNA دورشتهاي شروع به دناتوره شدن نسبي كرده و حبابي را تشكيل ميدهد. با تشكيل اين حباب ميزان سطح بيروني DNA افزايش مييابد.
در نتيجه مقدار پتانسيل سطحي اين نقطه از DNA كاهش يافته و اتصال DNA به سطح فاز ثابت سستتر ميشود. در يك نمونه حاوي هترودوبلكس و همودوبلكس، چهار گونۀ متفاوت زنجيرهها، براساس ميزان ناپايايداري خود از هم جدا ميشوند. قطعات DNA كوچكتر از 150 جفت بازي ناپايدار بوده و جهشهاي موجود در آنها با دناتوره كردن نسبي[4] تعيين نميشود. براي تشخيص جهش در قطعات كوچك محصول PCR (50-150 جفت باز)، از تكنيك
[5]IP-RP-HPLC استفاده ميشود. در اين حالت نمونهها تحت شرايط دناتورهسازي كامل قرار ميگيرند. حفظ و نگهداري زنجيرههاي تکرشتهای اسيد نوكلئيك وابسته به توالي بازهاي زنجيره ميباشد. اين بازها و همچنين سطح فاز ثابت هر دو آبگريز بوده و تمايل به دوري و فرار از فاز متحرك[6] را دارند، در نتيجه اگر دو تكرشتۀ هماندازه حتي در يك باز با هم اختلاف داشته باشند، توسط اين تكنيك مشخص خواهد شد. در اين تكنيك فقط يك استثناء وجود دارد كه مربوط به جابجايي C و G ميباشد. تكنيك dHPLC حساس و با تکرارپذیری بالا بوده و براي افزايش كارآيي و مقرون بهصرفه بودن آن، بايد از ستونهاي كاپيلاري با قطر داخلي 320-50 ميكرومتري بهعنوان كانالهاي جداسازي استفاده نمود.
مهمترین مزيت استفاده از سيستم كاپيلاري، سيگنال بهتر اين سيستم ميباشد، زيرا اندازۀ قله نمودار نسبت معكوس با مجذور قطر ستون دارد. از لحاظ تئوري ارتفاع نمودار حاصل از يك نمونه با سيستم ستون 0/2 ميليمتري، 500 برابر نمودار همان نمونه با سيستم 4/6 ميليمتري ميباشد، اما در عمل ميزان نمونهاي كه به سيستم كاپيلاري تزريق ميشود به چندصد نانوليتر كاهش يافته و مصرف مواد موردنیاز PCR كاهش مييابد.
حساسيت بالاي روش كاپيلاري، امكان تركيب dHPLC را با تكنيك الكتروفورز كاپيلاري DNA بوجود آورده است. در اين تكنيك تشخيص SNP با كمك فلورسنت تهييج شده با ليزر صورت ميپذيرد. در اين تكنيك از پرايمرهاي نشاندار شده با رنگهاي فلورسنت متفاوت در PCR استفاده شده و در نتيجه محصولات مختلف PCR نشاندار ميباشند. نمونهها بهطور اتوماتيك در ستونهاي كروماتوگرافي آناليز شده و بر اساس طولموج تابشي آنها شناسايي ميشوند.
براي افزايش كارايي، ميتوان مشابه آنچه در الكتروفورز كاپيلاري انجام ميشود، ستونها را به هم متصل كرده و از يك پمپ، سيستم تزريق و دستگاه آشكارسازي استفاده نمود. نهایتاً فرار تركيبات فاز متــــــــــــحرك، جريان آرام مايع و خروج مداوم كاتيون از نمونه DNA باعث شده كه IP-RP-HPLC مناسبترين گزينه براي جفت شدن با ESI-MS[7] باشد. اسپكترومتري جرمي به تعيين دقيق ژنوتيپ محصولات PCR كمك ميكند.
مواد موردنیاز انجام آزمایش dHPLC:
محلول واكنش PCR:
10 mM Tris-HCl, pH 8.3
50 mM KCl
2.5 mM MgCl2
0.1 mM each of the four dNTPs
0.2 µM of each primer
1 U of AmpliTaq Gold (Applied Biosystems, Foster City, CA) in deionized distilled water
بهمنظور آشکارسازی با فلورسانس تهييج شده توسط ليزر، يكي از پرايمرها بايد با ماده فلوروفور نشاندار شده باشد.
ستونهاي كروماتوگرافي براي IP-RP-HPLC اسيد نوكلئيك:
- در HPLC معمولي فاز ثابت شامل ذرات قليايي و غشاءدار PS/DVB به قطر 2 ميكرون ميباشد. اين ذرات در ستونهاي 4/6×50 ميليمتري ريخته ميشوند.
- در HPLC كاپيلاري، ستونها (0/2×60 ميليمتري) حاوي چند فاز ثابت شامل استيرن و ديوينيل بنزن ميباشند.
محلولهاي مورد استفاده در IP-RP-HPLC اسيد نوكلئيك:
محلول ذخيرۀ M2 ترياتيل آمونيوم استات (TEAA) با pH=7.0. اين محلول با حل كردن تعداد مول مساوي از ترياتيل آمين و اسيد استيك گلاسيال در آب به دست ميآيد. براي ساخت محلولها از آب کاملاً خالص بايد استفاده شود.
- محلول A: mM100 ترياتيل آمونيوم استات با pH=7.0 و mM1/0 Na4EDTA
- محلول B: mM100 ترياتيل آمونيوم استات با pH=7.0 و 25% استونيتريل، mM0/1 Na4EDTA
اين محلولها به مدت يك هفته در دماي اتاق قابل نگهداري ميباشند.
روش انجام كار:
- واكنش PCR با حجم Lµ50 انجام ميشود. براي هر واكنش ng50 از DNA مصرف ميشود.
- برنامۀ واكنش PCR بهصورت زير ميباشد:
- دناتورهسازي اوليه: 95 درجه به مدت 10 دقيقه
- دناتورهسازي: 94 درجه به مدت 20 ثانيه
- اتصال پرايمر: يك دقيقه در دماي 63-56 درجه با 0/5 درجه كاهش در هر چرخه
- طويلسازي: 72 درجه به مدت 1 دقيقه
- تكرار سه مرحلۀ فوق براي 14 چرخه
- دناتورهسازي: 94 درجه به مدت 20 ثانيه
- اتصال پرايمر: دماي 56 درجه به مدت يك دقيقه
- طويلسازي: 72 درجه به مدت 1 دقيقه
- تكرار سه مرحله فوق براي 20 چرخه
- طويلسازي نهايي در دماي 72 درجه سلسیوس به مدت 5 دقيقه
- خنکسازی و نگهداري نمونه در دماي 6 درجه سلسیوس
تشكيل هترودوبلكس و همودوبلكس:
در اين تكنيك براي تشكيل دوبلكس، محصول PCR مربوط به هر آلل را با نسبت يكسان مخلوط كرده و در دمای 95 درجه سلسیوس به مدت 3 دقيقه قرار داده تا دناتوره شوند. دما را بهتدریج از 95 به 65 درجه كاهش داده و نيم ساعت در اين دما قرار دهيد تا رشتهها به هم متصل شده و دوبلكسها تشكيل شوند. در اين هنگام نسبتهاي يكساني از هترودوبلكس و همودوبلكسها بهوجود آمده است. اين محصولات را ميتوان به مدت چندين هفته در دماي 4 درجه سلسیوس نگهداري كرد.
كروماتوگرافي dHPLCبا استفاده از ستونهاي معمولي
آمادهسازی و آزمايش ستونها:
- ستونهاي جديد مورد استفاده در اين تكنيك، با استفاده از محلول A 50% و محلول B 50% و با سرعت جريان ml/min0/9 در دماي 50 درجه سلسیوس و به مدت 60 دقيقه آماده ميشوند.
- كارآيي اين ستونها با تزريق gµ0/5 (fmol300) از محصول هضمشدۀ pUC18 توسط آنزيم محدودگر Hae III به سيستم و سرعت جريان ml/min0/9 در دماي 50 درجه سلسیوس ارزيابي ميشود.
- محلولها بايد شيب غلظت خطي بهصورت زير را دارا باشند:
0.0–3.0 min 43–56% eluent B
3.0–10.0 min 56–68% eluent B
- ستونها را بايد با محلول B 95% به مدت 1 دقيقه شستشو داد.
- نحوۀ جداسازي قطعات مورد آزمايش، با استفاده از UV با طولموج nm254 موجود در قسمت خروجي ستون ارزيابي ميشود.
- با تزريق pUC18 هضم شده، بايد قطعات 257، 267، 434، 458 جفت بازي را با وضوح بالا به دست آورد.
آناليز كروماتوگرافي dHPLCبا استفاده از ستونهاي معمولي
بهمنظور تشخيص دقيق اتصال بازهاي ناجور، دما و شيب غلظتي محلولها بايد با دقت كامل انتخاب و كنترل شود. بهخصوص در مورد شرايط دمايي سيستم HPLC بايد حداكثر دقت را داشت. دماي بهينۀ تشخيص باز ناجور را ميتوان بهصورت تجربي و يا در صورت مشخص بودن توالي قطعات، توسط محاسبه به دست آورد. شيب غلظت محلول شروع و پايان را نيز ميتوان بهوسیله برنامه ذوب HPLC و يا براساس اندازه محصول PCR و مقايسۀ آن با زمان باقي ماندن قطعات هضم شدۀ DNA كه در هنگام آزمايش ستون به كار رفت، تعيين نمود.
نکات قابلتوجه
- پس از تنظيم سرعت جريان، شيب غلظت و دما، 10 ميكروليتر از نمونه به دستگاه HPLC تزريق ميشود.
- ماده مؤثره موجود در محلول، استونيتريل ميباشد. براي به دست آوردن كروماتوگرام برنامۀ شيب غلظتي زير بايد رعايت شود:
0.0–0.5 min 50–52% eluent B
0.5–4.0 min 52–59% eluent B
- نتايج آزمايش با استفاده از آشكارساز جذبي UV با طولموج 254 نانومتر به دست ميآيد.
- پس از اتمام آزمايش، ستونهاي دستگاه به مدت يك دقيقه بهوسیله محلول B 95% شسته ميشوند.
- بهمنظور حفظ كارآيي اين ستونها براي آزمايش هزاران نمونه، بايد از آلودگي سيستم به كاتيونهاي فلزي پرهيز شود.
- هنگامي كه از سيستم استفاده نميشود، بايد جريان بسيار كوچكي (ml/min0/05) از محلول A 50% و محلول B 50% از ستون عبور كند.
ارزيابي كروماتوگرامها:
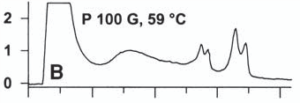
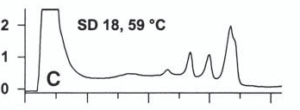
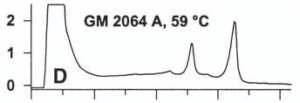
تشكيل هترودوبلكس در نتيجۀ وجود جهش در قطعۀ مورد بررسي، با وجود بيش از يك قله[8] در نمودار كروماتوگرام مشخص ميشود. شكل زير بررسي كروماتوگرافيك نمونۀ هموزيگوت را نشان ميدهد.
شکل 5: نتایج بررسي كروماتوگرافيك یک نمونۀ هموزيگوت
جهشهاي مختلف موجب ايجاد درجاتي از ناپايداري دوبلكسها در دماي دادهشده به سيستم ميشوند. اين درجات مختلف از ناپايداريها، خصوصيات پروفايل كروماتوگرافيك را تشكيل ميدهند. مثالهايي از اين پروفايل را در زير ميتوان مشاهده نمود.
شکل 6: پروفايل كروماتوگرافيك مختلف ناشی از وجود جهشهای متفاوت
جهشهايي كه در نواحي ذوب[9] مشابه رخ ميدهند، پروفايل يكسان يا مشابهي را ايجاد ميكنند. به اين دليل بهمنظور تشخيص دقيق نوع و محل جهش بايد از تعيين توالي قطعۀ موردنظر بهره جست. اين تكنيك براي بررسي و تشخيص بازهاي ناجور و حذف و اضافههاي يك يا چند بازي كاربرد دارد.
كروماتوگرافي dHPLC با استفاده از ستونهاي كاپيلاري
هنگامي كه ستونهاي كروماتوگرافي از قطر mm6/4 به قطر mm0/2 تبديل ميشوند، حجم نمونه، تغيير شيب غلظت، اتصالات و آشكارساز بايد تغيير يافته و بهينه شوند. در اين سيستم فاز متحرك بايد ابتدا گرم شود، به همين دليل از يك لوله موئينۀ[10] سيليكوني به طول 20 سانتيمتر و با قطر داخلي mµ25 استفاده شده كه اين لوله درون آون موجود در بين تزريقكننده[11] و ستون، قرار دارد.
آمادهسازي و آزمايش ستون:
- ستونهاي يكپارچۀ جديد موجود در اين تكنيك، با استفاده از محلول A 50% و محلول B 50% و با سرعت جريان µl/min3 در دماي 50 درجه سلسیوس و به مدت 60 دقيقه آماده ميشوند.
- كارآيي اين ستونها با تزريق ng3(fmol2) از محصول هضمشدۀ pUC18 توسط آنزيم محدودگر Hae III به سيستم (با سرعت جريان و دماي ثابت و مشابه فوق) آزمايش ميشود. برنامۀ شيب لازم براي اين آزمايش بهصورت زير ميباشد:
0.0–3.0 min 35–50% eluent B
3.0–10.0 min 50–62% eluent B
- ستونها را بايد با محلول B 95% به مدت 30 ثانيه شستشو داد. در اینجا نيز بايد قطعات 257، 267، 434، 458 جفت بازي را با وضوح بالا در كروماتوگرام UV به دست آورد.
آناليز كروماتوگرافي dHPLC با استفاده از ستونهاي كاپيلاري
در كروماتوگرافي با استفاده از لوله موئينه، محلول فاز متحرك با غلظت استونيتريل كمتري مورد استفاده قرار ميگيرد، زيرا سطح PS/DVB ستون كاپيلاري در مقايسه با ستونهاي معمولي قطبيتر ميباشد. از آنجا كه DNA دورشتهاي پايدارتر از ديگر مواد آلي است، بنابراين بايد دماي بالاتري را براي دناتورهسازي نسبي آن به سيستم داد. معمولاً يك افزايش دو درجه سلسیوس براي نيل به اين هدف كافي است.
- سيستم HPLC با جريان min/Lµ3 و دما و شيب غلظت اوليه، تنظيم ميشود.
- براي شروع آناليز، برنامۀ شيب غلظت بهصورت زير به پمپ دستگاه داده ميشود:
0.0–0.5 min 43–50% eluent B
0.5–4.0 min 50–54% eluent B
- nL500-1000 از محصول PCR به درون ستون كاپيلاري تزريق ميشود.
- از هنگام تزريق نمونه، كار ثبت كروماتوگرام توسط آشكارساز UV با طولموج nm254 آغاز ميشود.
- بعد از آزمايش هر نمونه، ستون به مدت 1 دقيقه با محلول B 95% شسته ميشود.
HPLC تحت شرايط دناتورهسازي كامل:
تمام تجهيزاتي كه قبلاً گفته شد، در اين روش نيز به كار ميرود.
- بهمنظور اطمينان از دناتوره شدن كامل نمونه، دماي ستون بر روي̊ 75 سلسیوس تنظيم ميشود.
- بعد از تنظيم جريان محلول B 29% با سرعت min/Lµ3 به مدت 5 دقيقه، يك شيب خطي از غلظت بهصورت زير به دستگاه داده ميشود:
0.0–10. min 29–39% eluent B
- nL500 از محصول PCR را به دستگاه تزريق نموده و كروماتوگرام توسط آشكارساز ثبت ميشود.
ارزيابي كروماتوگرام:
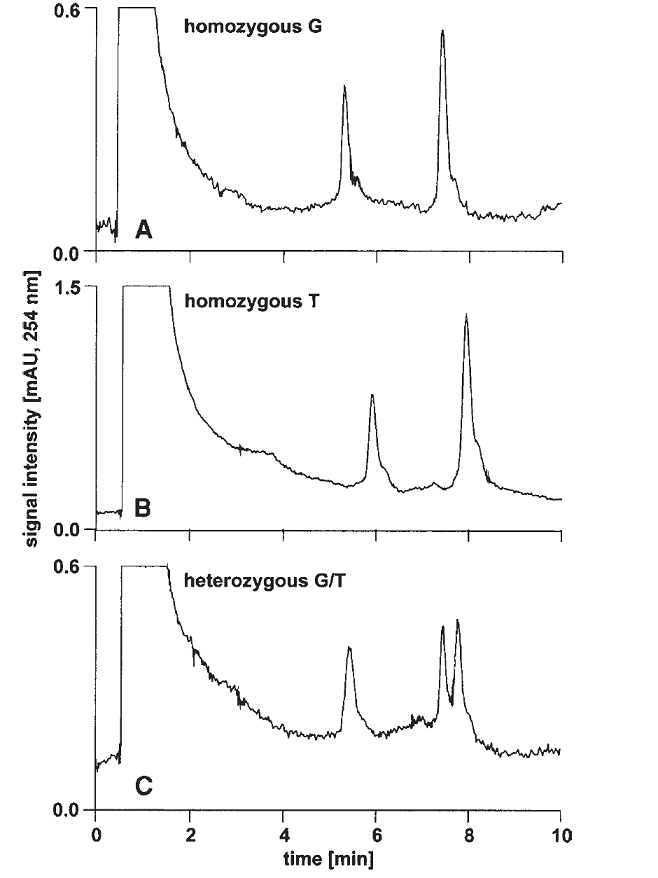
شكل زير مثالي از افتراق آللي براساس جداسازي زنجيرههاي تکرشتهای محصول PCR به طول 62 جفت بازي است. اين زنجيرهها داراي جهش G به T بوده كه با تكنيك dHPLC كاپيلاري و تحت شرايط دناتورهسازي كامل آشكار شده است.
در قسمت A و B از شكل زير نمونههاي هتروزيگوت نشان داده شده است. در اینجا هر دو زنجيرههاي تکرشتهای كه کاملاً دناتوره شدهاند، بهطور كامل توسط IP-RP-HPLC از هم جدا شدهاند. در نمونههاي هتروزيگوت سه قله مشاهده ميشود كه مربوط به وجود دو نوع تك رشته ميباشد. تغيير يك باز منجر به تغيير الگوي نگهداري تك رشته شده و افتراق نمونه حاوي جهش از نمونۀ وحشي (طبيعي) را موجب ميشود.
شکل 7: افتراق آللي براساس جداسازي زنجيرههاي تکرشتهای
در تكنيك dHPLC با دناتورهسازي كامل، بهمنظور تكثير قطعۀ موردنظر، از پرايمرهاي با طول كمتر از 20 باز استفاده ميشود. كاهش اختصاصيت پرايمر موجب تكثير قطعات اضافي شده و در كروماتوگرام بهصورت قلههاي اضافي ديده ميشود.
نكات قابلتوجه:
- از برخورد و تماس مستقيم ستون با ديوارۀ فلزي آون بايد پرهيز نمود، زيرا سطح آون از هواي درون آن گرمتر است، بنابراين اين تماس موجب گرم شدن بيش از حد فاز متحرك شده و تكرارپذيري آزمايش را كاهش ميدهد.
- دماي بهينۀ اين تكنيك̊ 68-48 سلسیوس ميباشد. بهمنظور به دست آوردن دماي بهينه، نمونۀ آزمايش را به دستگاه ميدهند و کمکم دما را افزايش داده تا زمان نگهداري قلۀ مربوط به زنجيرۀ دورشتهاي به حداقل (حدود 1 دقيقه) برسد. در اين هنگام، وجود باز ناجور با مشاهدۀ يك يا دو قله بلافاصله قبل از قله زنجيرۀ دورشتهاي مشخص ميشود. بايد مراقب نواحي با دماي ذوب پايين بود كه از ديد محقق مخفي نماند. اگر زنجيرهها بهطور كامل دناتوره شوند، احتمال از دست دادن جهشهاي موجود در اين نواحي بالا ميباشد.
[1] Denaturing high performance liquid chromatography
[2] Wild type
[3] Mutant
[4] partially denaturing HPLC
[5] Ion-pair reversed-phase high performance liquid chromatography
[6] Solvophobic
[7] Electrospray ionization mass spectrometry
[8] Peak
[9] Melting domain
[10] Capillary
[11] Injector
مقدمهای بر تکنیک واکنش زنجیرهای پلیمراز و انواع آن
تکنیکهای تعیین توالی اسید نوکلئیک
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام