تكنيك واكنش ‘5 نوكلئاز
دکتر مهدی فصیحی رامندی (عضو هیئت علمی دانشگاه علوم پزشکی بقیه ا…(عج))
زهرا کریمی (مرکز تحقیقاتی زیست سلول پژوهان تدبیر)
دکتر رضا میرنژاد (دانشیار دانشگاه)
در اين تكنيك پس از مخلوط كردن نمونه و ديگر تركيبات واكنش، آزمايش در ميكروتيوب دربسته انجام شده و احتياجي به فرايندهاي بعد از PCR نيست. پس از اتمام واكنش، با اندازهگيري فلورسنت، نتيجۀ آزمايش مشخص خواهد شد. با حذف فرايندهاي پس از PCR، زمان آزمايش، ميزان كار، هزينه آزمايش، احتمال آلودگي متقاطع و منابع خطا كاهش خواهد يافت. حساسيت روش به اندازۀ PCR است، در نتيجه با ميزان خيلي كم DNA ميتوان آزمايش را انجام داد. اندازهگيري ميزان فلورسنت بهعنوان نتيجۀ آزمايش موجب ميشود كه بتوان در واحد زمان تعداد بيشتري SNP را مورد شناسايي قرار داد.
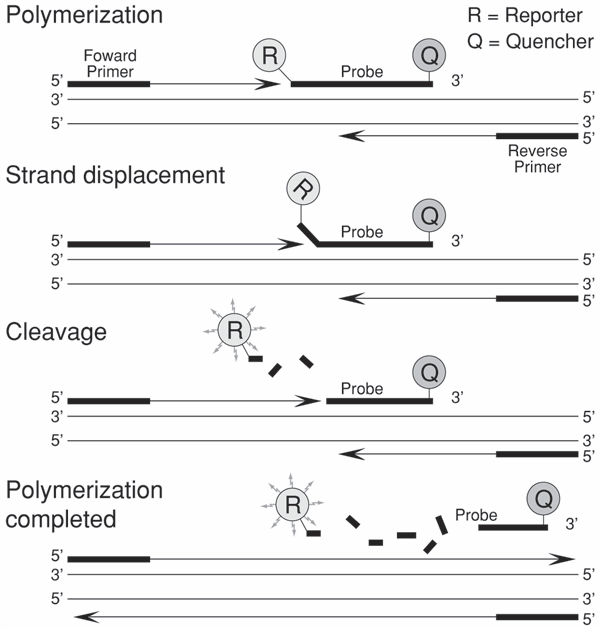
در واكنش ‘5 نوكلئاز[1] كه اولين بار توسط Holland و همكاران توضيح داده شد، يك كاوشگر به تركيبات واكنش PCR اضافه شده و در هنگام واكنش PCR، با فعاليت ‘5 نوكلئازي آنزيم Taq پليمراز تجزيه ميشود. كاوشگر فلورسنتۀ اين واكنش داراي رنگ فلوروفور گزارشگر و خاموشکننده[2] ميباشد. نزديكي خاموشکننده، موجب كاهش پيغام فلورسنت میگردد. برش كاوشگر فلوروژن در طي PCR، موجب آزاد شدن فلوروفور و تشديد پيغام فلورسنس ميشود (شکل 1). امروزه دستگاههاي ترموسايكلر به سيستم آشكارسازي فلورسنس مجهز بوده و طي هر سيكل PCR، افزايش فلورسنت را بهصورت زمان واقعي[3] نشان ميدهند.
شکل 1: انجام واکنش PCR و تشخیص محصول به کمک کاوشگر فلوروژن در واکنش ‘5 نوكلئاز. مراحل اصلی این واکنش پلیمریزاسیون، جایگزینی رشته و برش است. دو رنگ گزارشگر و خاموشکننده به کاوشگر متصل شده است و تا هنگامی که این اتصال برقرار است، تهییج گزارشگر رخ نمیدهد. در هر چرخه از طویل سازی، آنزیم DNA پلیمراز گزارشگر را از کاوشگر بریده و جدا میکند. گزارشگر آزاد رنگ فلورسانس از خود ساطع میکند.
تشخيص SNP
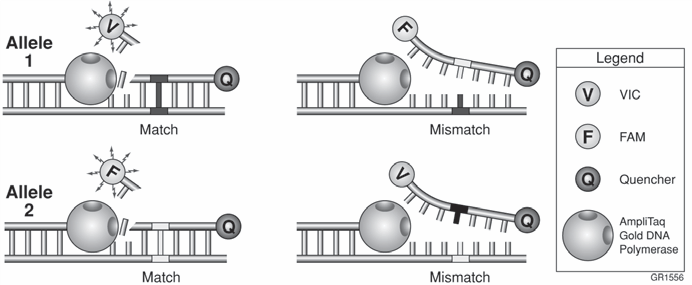
در سيستمهاي دو آللي، كاوشگرهاي اختصاصي هر آلل به واكنش PCR اضافه ميشوند. ازآنجاکه هر كاوشگر يك فلوروفور اختصاصي با رنگ مشخص دارد، بنابراين شناسايي آنها آسان خواهد بود. عدم اتصال يك باز بين كاوشگر و هدف و ايجاد يك باز ناجور، موجب كاهش دورگهسازی و عدم برش كاوشگر ميشود. افزايش هرکدام از رنگهاي فلورسنت، نشاندهنده وجود آن آلل در نمونه ميباشد. همچنين افزايش هر دو رنگ، حكايت از هتروزيگوسيتي نمونه دارد (شکل 2).
چندين فاكتور در تشخيص و افتراق آللها- بر اساس عدم اتصال يك باز- دخيل ميباشند. يكي از اين عوامل تأثیر ترموديناميكي عدم اتصال يك باز بر روي تشكيل دورگه ميباشد. يك كاوشگر حاوي باز ناجور، دماي ذوب (Tm) پائينتري نسبت به يك كاوشگر کاملاً متصل را دارا ميباشد، به همين دليل در انتخاب دماي اتصال پرايمر و طويلسازي بايد دقت بيشتري شود. دوم اينكه واكنش تحت شرايط رقابتي انجام ميشود، زيرا هر دو كاوشگر در واكنش حضور دارند، بنابراين تا حدودي كاوشگري كه بهطور كامل به DNA هدف متصل ميشود، از اتصال كاوشگر حاوي باز ناجور ممانعت به عمل ميآورد. سوم اینکه انتهاي ‘5 كاوشگر بايد قبل از برش نوكلئاز، از هدف جدا و جابهجا شود. فعاليت ‘5 نوكلئازي آنزيم Taq پليمراز، ساختار چنگال مانند حاصل از جدا شدن 3-1 نوكلئوتيد انتهاي ‘5 كاوشگر را شناسايي ميكند. در اين حالت كه چند نوكلئوتيد ابتداي كاوشگر جدا شده است، كاوشگر حاوي باز ناجور سريعتر از كاوشگر کاملاً متصل، جدا خواهد شد. اين بدان معناست كه زمان كمتري براي برش كاوشگر حاوي باز ناجور وجود دارد؛ به عبارت ديگر وجود باز ناجور موجب ميشود تا كاوشگر بهجای بريده شدن، از هدف جدا گردد.
شکل 2: افتراق آللی به کمک واکنش ‘5 نوكلئاز. حضور یک جفت باز ناجور بین کاوشگر و توالی هدف موجب ناپایداری این اتصال شده و کارآیی برش آنزیمی را کاهش میدهد.
مواد لازم جهت انجام واکنش ‘5 نوكلئاز:
1: كاوشگر TaqMan MGB: همانطور كه قبلاً نيز ذكر شد، يكي از نكات كليدي بهکارگیری تكنيك ‘5 نوكلئاز براي افتراق بين آللها، استفاده از كاوشگر حاوي باز ناجور ميباشد. اين كاوشگر داراي دماي ذوب (Tm) پايينتري نسبت به كاوشگر با اتصال كامل ميباشد. در اينجا اختلافي بين دماي ذوب (∆Tm) دو پرايمر، تحت عنوان اختلاف دماي پنجره[4] وجود دارد. افتراق بين آللها با استفاده از اين دماي پنجره صورت خواهد گرفت؛ بدين صورت كه دماي اتصال پرايمر و دماي طويلسازي را معادل اين دماي پنجره ميگيرند. هر چه كاوشگر بزرگتر باشد، نقش يك باز ناجور در اتصال كاوشگر كمتر ميشود. اين بدان معناست كه در كاوشگرهاي بزرگتر، دماي پنجره كوچكتر است، زيرا دماي ذوب دو پرايمر نزديك ميباشند و در نتيجه كاوشگرهاي كوچك بهتر ميتوانند بين آللها افتراق قائل شوند.
دانشمندان دريافتهاند كه با اتصال يك ماده متصلشونده به شيار كوچك [5](MGB) اوليگونوكلئوتيد، ساختار دو رشتهاي پايدار شده و دماي ذوب پرايمر بهشدت افزايش خواهد يافت. كاوشگرهاي بهکاررفته در اين تكنيك در انتهاي ‘3 خود داراي MGB ميباشند. اين ماده موجب بهبود دماي ذوب كاوشگرهاي كوچك (20-13 نوكلئوتيدي) ميشود، بنابراين استفاده از MGB باعث ميشود كه بتوان از كاوشگرهاي كوچك براي افتراق آللها بهره جست. در يك مطالعه، دماي ذوب 60 كاوشگر 13-10 نوكلئوتيدي حاوي MGB اندازهگيري شد. در اين آزمايش، اختلاف دماي ذوب كاوشگرهاي کاملاً متصل و كاوشگرهاي حاوي باز ناجور بهطور متوسط 9/7 درجه سلسیوس بود. اين اختلاف دماي گسترده، طراحي كاوشگر را آسان ميكند، بهطوریکه دماي ذوب كاوشگر کاملاً متصل، بالاتر از دماي اتصال پرايمر و دماي طويلسازي (معمولاً ̊60) و دماي ذوب كاوشگر حاوي باز ناجور پايينتر از آن قرار ميگيرد، در نتيجه كاوشگر کاملاً متصل، پيغامهاي قوي از خود ساطع ميكند. درحالیکه پيغام كاوشگر حاوي فقط يك باز ناجور، بسيار ضعيف خواهد بود.
2: تركيبات PCR: تمام تركيبات موردنیاز واكنش PCR در يك ميكروتيوب ريخته شده و بهصورت تجاري در دسترس ميباشد، بنابراين بايد مرحله بهينهسازي[6] تركيبات براي هر نمونه را حذف نمود. اين امر با توسعۀ روشها و رهنمودهاي اختصاصي انتخاب پرايمر و كاوشگر محقق شده است. اگر اين رهنمودها بهدرستی رعايت شوند، مواد مورد استفاده در TaqMan PCR، غلظت پرايمر و كاوشگر و برنامۀ دستگاه ترموسايكلر بهدرستی كار كرده و آزمايش جواب خواهد داد. مهمترين قسمت اين رهنمود مربوط به اندازه محصول PCR ميباشد، به عبارت ديگر اندازۀ محصولات PCR بايد تا حد ممكن كوچك باشند (150-50 جفت باز). اين بدان معنا نيست كه محصولات بزرگتر با اين تكنيك مورد آزمايش قرار نميگيرند؛ بلكه براي قطعات بزرگتر نياز به بهينهسازي بيشتري ميباشد. نكته ديگر اينكه در اين تكنيك بايد از DNA پليمراز AmpliTaq® Gold استفاده شود، زيرا اين پليمراز بهصورت Hot start بوده و در دماي بالا فعال ميشود. اين امر مانع ايجاد مشكلات و آرتیفكتهايي از قبيل دايمر پرايمر میگردد و در نتيجه طراحي پرايمر راحتتر صورت ميگيرد.
محلول PCR حاوي تمام مواد موردنیاز در واكنش ‘5 نوكلئاز، به استثناء كاوشگر، پرايمر و DNA نمونه ميباشد. اين محلول همچنين داراي AmpErase® UNG ميباشد. اين ماده موجب محافظت در برابر آلودگي شده و بهعنوان مرجع داخلي براي حذف فلورسانس زمينه به كار ميرود. بهتر است محلول حاصل را در دماي ̊ 8-2 نگهداري كرده تا نيازي به ذوب كردن مجدد آن نباشد.
نكات مورد توجه در طراحي كاوشگر:
- كاوشگر نبايد در انتهاي ‘5 داراي گوانين باشد، زيرا گوانيني كه در مجاورت رنگ فلوروفور قرار گرفته است، بهعنوان يك خاموشکننده عمل كرده و حتي پس از برش كاوشگر نيز فلورسانس را خاموش خواهد كرد.
- با استفاده از نرمافزار، كاوشگري را انتخاب كنيد كه دماي ذوب آن 67-65 درجه سلسیوس باشد.
- كاوشگر هر چه كوچكتر باشد، بهتر است. دقت شود كه كاوشگر كوچكتر از 13 جفت باز نشود.
- نبايد يك نوع باز بهصورت پشت سر هم در كاوشگر قرار گيرد. اين امر در مورد گوانين از اهميت بيشتري برخوردار است. تكرار يك باز نبايد به بيش از سه بار برسد.
- محل پليمورفيك در مركز كاوشگر قرار گيرد. اگر لازم است اين قانون نقض شود، پس اين محل در قسمت ‘3 كاوشگر قرار گيرد. در اين صورت باز ناجور در ناحيۀ اتصال به شيار كوچك قرار ميگيرد. دقت شود هرگز اين باز ناجور در اولين و دومين باز كاوشگر قرار نگيرد.
- در مورد كاوشگرهايي كه بيش از 50% CG دارند، بهتر است ميزان C آنها بيشتر از G باشد.
نكات مهم در طراحي پرايمر:
- دماي ذوب پرايمر در حدود 60-58 درجه سلسیوس باشد.
- نبايد يك نوع باز بهصورت پشت سر هم قرار گيرد. اين امر در مورد گوانين از اهميت بيشتري برخوردار است. تكرار يك باز نبايد به بيش از سه بار برسد.
- ميزان گوانين+ سيتوزين 80-20% باشد.
- هر دو پرايمر تا حد ممكن بايد در نزديكي كاوشگر قرار گيرند، ولي بر روي هم قرار نگيرند.
- در 5 نوكلئوتيد انتهاي ‘3 نبايد بيش از دو باز گوانين+ سيتوزين قرار گيرد.
براي طراحي پرايمر و كاوشگر از نرمافزار Primer Express Version 1.5 ميتوان استفاده نمود.
روش كار براي حجم lµ25:
پس از طراحي دقيق پرايمر و كاوشگر، استفاده از محلول PCR TaqMan و اضافه نمودن nM200 كاوشگر و nM900 پرايمر، واكنش با اطمينان كامل انجام خواهد شد. بهطور معمول مخلوط كاوشگر و پرايمر را با غلظت X10 بهصورت زير تهيه ميكنند:
2 µM VIC Probe
2 µM FAM Probe
9µM Forward Primer
9 µM Reverse Primer
10 mM Tris-HCl, pH 8.0
1 mM EDTA
اين محلول در دماي 20- درجه سلسیوس به مدت يك سال پايدار خواهد بود. دقت شود كه هنگام استفاده، محلول با كمترين مواجهه با نور- بهخصوص نور مستقيم آفتاب- ذوب شود. پس از ذوب، محلول بهآرامی مخلوط ميشود. بهسرعت بقيۀ مخلوط به فريزر 20- درجه منتقل ميشود.
ساير مواد براي انجام آزمايش بر روي 96 نمونه به مقدار زير ميباشد:
1300 µL 2X TaqMan Universal PCR Master Mix
260 µL10X Probe/Primer Mix
520 µL H2O
µl5 از DNA ژنومي (با غلظت ng/µl10-1) را درون چاهك پليت ريخته و سپس µl20 از محلول فوق را به آن اضافه كنيد. روي پليت را پوشانده و از نور محافظت كنيد. پليت را تا 72 ساعت در دماي 4 درجه سلسیوس ميتوان نگهداري كرد.
پليت را درون دستگاه ترموسيكلر قرار داده و برنامه زير به دستگاه داده شود:
اگر مقدار DNA كمتر از ng10 باشد، تعداد سيكلهاي PCR به 40 بار افزايش خواهد يافت.
نرمافزار SDS نتايج فلورسانس VIC را در مقابل FAM نشان ميدهد. در نمودار حاصل از اين نرمافزار، حداكثر تا 4 بخش مشاهده خواهد شد. اين بخشها شامل هموزيگوت آلل 1، هموزيگوت آلل 2، هتروزيگوت و نمونههاي بدون DNA و PCR نشده ميباشند.
در تشخيص SNP، موقعيت پليمورفيسم، مكان كاوشگر را تعيين ميكند، به همين دليل شايد مجبور شويد كاوشگري را طراحي و انتخاب كنيد كه هیچیک از شرايط ذکرشده را نداشته باشد.
[1] 5′ nuclease
[2] Quencher
[3] Real Time
[4] ∆Tm window
[5] Minor groove binder
[6] Optimization
انواع تکنیک « واکنش زنجیرهای پلیمراز (PCR)» و انواع آنزیمهای DNA پلیمراز مقاوم به حرارت
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام