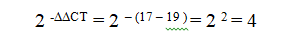روشهای عملی در Real Time- PCR
نویسندگان:
شهرام شجاع ( دانشجوی کارشناسی ارشد)
دکتر رضا میرنژاد ( باکتریولوژیست- استادیار دانشگاه)
در دو قسمت گذشته، کلیات تکنیک Real-Time PCR ذکر شد، در این مبحث و مبحث آینده سعی میشود نکاتی کاربردی و عملی در مورد این روش آورده شود. بطور کلی برای آشنایی بیشتر با این تکنیک بهتر است که برخی واژههای پرکاربرد آن را مرور نماییم.
|
اصطلاحات متداول در Real Time- PCR
|
آنالیزهای کمی درPCR Real- Time
دو روش عمده برای بررسی کمی درPCR Real- Time وجود دارد که در ادامه به شرح مختصر هر کدام پرداخته میشود.
روش منحنی استاندارد (مقایسۀ مطلق)
در این روش از نمونۀ RNA یا DNA با غلظت مشخص برای رسم منحنی استاندارد استفاده میشود. غلظت RNA یا DNA استاندارد با اسپکتروفتومتر (در طول موج nm260) تعیین میشود و سپس از روی وزن مولکولی نمونه به تعداد نسخههای آن تبدیل میگردد. لازم بذکر است که استانداردهای غلظتی ژنهای معروف به صورت تجاری قابل خریداری است، هر چند که بسیار گران قیمتاند.
برای حذف نوسانات مقادیر RNA وارد شده در واکنش و خطاهای عملکرد دستگاهها و فرد از استانداردهای داخلی استفاده میشود. این استانداردها باید در همۀ بافتها بیان ثابت داشته باشند و آزمایش ما نباید بیان آن را نسبت به نمونۀ کنترل تغییر دهد. بدین منظور از ژن بتا اکتین (Beta actin) و Glyceraldehyde-3-phosphate dehydrogenase (GAPDH) استفاده میشود. به این ژنها Housekeeping گویند. علاوه بر برپایی PCR با پرایمر اختصاصی ژن برای هر نمونه یک PCR همزمان با پرایمر بتا اکتین یا GAPDH هم انجام میشود و دادههای هر نمونه با ژن Housekeeping همان نمونه نرمالایز میشود، سپس با استفاده از نمودار استاندارد میتوان به غلظت نمونۀ مجهول پی برد.
روش آستانه نسبی (مقایسۀ نسبی)
در این روش نیازی به رسم منحنی استاندارد نیست و مقدار نرمالایز شدۀ CT نسبت به یک نمونۀ تیمار نشده سنجیده میشود. در این روش نیز به استانداردهای داخلی نیازمندیم و باید مقدار CT آنها از مقدار CT نمونۀ مورد نظر کسر گردد (نرمالایز کردن).
تفاوت نسبی نمونۀ آزمایش در مقابل کنترل با فرمول محاسبه میشود.
ΔCT عبارت است از CT ژن هدف (یا کالیبراتور) که از CT ژن خانهزاد کسر شده است.
طبق مقالۀ Pfaffle و همکارانش بهتر است برای هر تیمار سه تیوب تهیه شود و هر آزمایش سه بار تکرار شود (9 داده برای هر تیمار) سپس میانگین آن برای معادله بکار برده شود؛ به عنوان مثال اگر میانگین اختلاف CT یک تیمار با استاندارد داخلی 17 و میانگین اختلاف نمونۀ شاهد با استاندارد داخلیاش 19 شود داریم:
این عدد بازگو میکند که تیمار ما موجب افزایش 4 برابری ساخت mRNA هدف شده است.
کارایی Real- time PCR
قبل از اندازهگیری کمی باید کارایی PCR سنجیده شود. کیفیت و طراحی پرایمرها مهمترین عامل اثرگذار بر کارایی PCR است. علاوه بر آن نوع دستگاه، نوع کیت مصرفی و پروتکل آزمایش نیز بر کارایی PCR اثر میگذارند. بدین منظور باید از ژن مورد مطالعۀ خود یک سریال رقت تهیه گردد (دانستن غلظت اولیه اهمیت ندارد). این سریال رقت را Real- time PCR کنید. کارایی دستگاه طبق معادلۀ پافل بین 90 تا 110 درصد و رگرسیون خط باید حداقل 0/95 شود. همین آزمایشات را برای استاندارد داخلی نیز تکرار کنید. اعداد بدست آمده بايد به هم نزدیک باشند و در رنج نرمال قرار بگیرند (به مقالۀ Pfaffle مراجعه کنید).
نکاتی کاربردی در مورد طراحی پرایمر و پروب در تکنیک Real –Time PCR
در فصلهای گذشته اصول طراحی پرایمر در PCR ساده و همچنین نرم افزاری که برای این منظور استفاده میشود بصورت مشروح آورده شد. ضمن در نظر داشتن تمامی آن موارد در هنگام طراحی پرایمر و پروب میبایستی به نکات زیر نیز توجه گردد:
1-پروب به گونهای طراحی شود که دمای Tm آن 10-8 درجه بالاتر از Tm پرایمر باشد.
2- در روش TaqMan پرایمر طوری طراحی گردد که طول محصولات بین 150bp-200bp باشد و در روش Sybr Green حداکثر طول محصولات 250bp-300bp باشد، زیرا طول بیشتر از حد محصول، موجب اشباع شدن قسمت خوانشگر (دوربین دستگاه) میگردد.
3- همیشه ابتدا پروب قبل از پرایمر طراحی گردد و طول پروب حدود 25bp باشد، در قسمت انتهای 5′ پروب یک رنگ فلورسانس مانند FAM قرار میگیرد (کانال رنگی سبز) در صورتی که انجام آزمایش به صورت Multiplex Real-Time PCR باشد، میبایستی برای پروبهای دیگر رنگهایی با کانال رنگی متفاوت در نظر گرفته شود مانند رنگ joe و Hex (کانال رنگی زرد)، ولی خاموشگر نظیر TAMRA که در ناحیه انتهای 3′ قرار دارد میتواند در تمامی پروبها مشترک انتخاب گردد. دقت شود بین رنگ فلورسانس گزارشگر و قســــــــــمت خاموشگر 18bp- 25bpفاصله باشد.
4- با توجه به اینکه گوانین (G) میتواند دارای اثر خاموش کنندهای باشد، در طراحی پروب دقت شود از قرار گرفتن 4 تا گوانین پشت سر هم اجتناب گردد. همچنین گوانین نباید خیلی نزدیک به انتهای 5′ پروب باشد زیرا باعث خاموش شدن رنگ فلورسانس گزارشگر (Reporter) میگردد.
مرور چند نکته عملی مهم
همین طور که ذکر شد تکنیکReal –Time PCR روشی بسیار دقیق است و به همین جهت از نظر آلودگی بسیار حساس بوده و در صورت کم دقتی در مر احل انجام آزمایش، احتمال آلوده شدن مواد آزمایش و ایجاد خطا در نتیجه بسیار بالا میباشد، از این رو توجه به نکات زیر ضروری است:
1- ابتدا تمام وسایل از قبیل سمپلرها را با وایتکس 10% تازه تهیه شده استریل کنید و همچنین تمام میکروتیوبها و سر سمپلرها را به اندازه لازم استریل کرده و زیر هود قرار دهید.
2- قبل از اینکه درب هود باز شود موتور هود به مدت 5-3 دقیقه روشن گردد تا دستگاه شروع به مکش نماید.
3- از برخورد محلولهای آزمایش با موادی که اثر مهارکنندگی (Inhibitor ) دارند اجتناب شود؛ بعنوان مثال از استفاده دستکشهای واجد پودر خودداری گردد، همین طور از استخراج DNA با روشهایی که در آنها از کلروفرم استفاده میشود جداً اجتناب شود.
4- در هنگام کار ابتدا میکروتیوب حاوی مواد واکنش را برداشته و سپس نوک سمپلر برداشته شود و چنانچه نوک سمپلر در حین حرکت به هر کجا برخورد کرد دور انداخته شود.
5- پرایمر و پروبها را قبل از انجام آزمایش از فریزر خارج کرده و در مجاورت یخ قرار دهید تا به آرامی آب شوند و از آب کردن آنها با دست یا هیتر خودداری كنيد.
6- بهتر است همیشه تعداد آزمونهایی که قرار است انجام شود از قبل پیش بینی گردد و به همان اندازه از پروب و پرایمر در حجمهای کوچک الیکوت کرده و داخل فریزر قرار گیرد و پس از هر بار مصرف مقدار باقی مانده دور ریخته شود.
7- جهت ساخت Master Mix به گونهای عمل گردد که ابتدا پرایمرها و پروبها و سایر اجزاء واکنش با هم مخلوط گردند و پس از انتقال به فریزر Template DNA یا RNA به زیر هود منتقل شوند. بسیار مهم است که اجزاء واکنش Real-Time PCR و نمونههای مورد آزمایش با هم تداخلي نداشته باشند. این قضیه در ممانعت از آلوده شدن محلولها (Reagent contamination) بسیار ضروري است.
8- تمامی مراحل آزمایش دقیقاً طبق کیت یا پروتکل انجام شود.
9- دقت در Pipetting و همچنین مخلوط کردن وSpin محلولها در بدست آوردن نتیجه خوب تأثیرگذار است.
10- نتیجه کارها بصورت مرحله به مرحله پیگیری شود و پس از نوشتن گزارش کار روزانه، گرافهای بدست آمده همراه با تفسیر نتایج ثبت گردد.
11- میزان پروب و پرایمرها هر کدام به تنهایی از جهت مقدار ΔRnاپتیمایز گردد. همچنین اپتیمایز کردن میزان Template DNA یا RNA بسیار مهم میباشد.
12- به لحاظ حساسیت بالای این تکنیک توصیه مهم این است در هنگام کمبود وقت و یا بی حوصلگی از انجام آزمایش خودداری گردد.
روشهای عملی در Time PCR – Real قسمت5
روشهای عملی در Time PCR – Real قسمت6
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام