تکنیک ژل الکتروفورز حساس به ساختار (CSGE)
دکتر مهدی فصیحی رامندی عضو هیئتعلمی دانشگاه علوم پزشکی بقیه ا…(عج)
زهرا کریمی (مرکز تحقیقاتی زیست سلول پژوهان)
در مقالات قبلی اشارهای به تکنیکهای مولکولی که امروزه در آزمایشگاههای بالینی و مولکولی کاربرد فراوانی دارند، گردید در این مقاله به تکنیکی از زیرمجموعههای تکنیک الکتروفورز پرداخته میشود که یکی از تکنیکهای جدید در شناسایی جهشها بهخصوص در علم ژنتیک پزشکی میباشد.
تکنیک ژل الکتروفورز حساس به ساختار (CSGE)
بهترین روش برای شناسایی جهش، تعیین توالی ژن با استفاده از دستگاه DNA sequencer است که به دلیل هزینه بالا، همیشه و در همه موارد قابل انجام نیست، لذا معمولاً از روشهای غربالگري اولیه که هزینه کمتری داشته باشد، استفاده میشود. در این روشها عمدتاً منطقهای از ژن که دارای نقص بوده، مشخص شده و سپس آن قطعه تعيین توالي میشود.
تکنیک CSGE[1] ساده و ارزان بوده و تا حد قابل قبولی پتانسیل لازم برای تعیین جهش در بیماریهای ژنتیکی را دارا میباشد. اولین بار این تکنیک در سال 1993 توسط Ganguly و همکارانش توصیف شد. آنها در پی روش غربالگری جهشی بودند که سریع، غیر رادیواکتیو و بر اساس هترودوپلکس باشد. این روش بر اساس حرکت متفاوت هترودوپلکسهای DNA نسبت به همودوپلکسها در طی الکتروفورز ژل پلی آکریلامید، در شرایط نسبتاً دناتوره کننده تعریف میشود. باندهای حاصل توسط رنگآمیزی اتیدیوم بروماید و آشكارسازی توسط نور ماورای بنفش (UV) مشخص میشوند. نمونههای دارای حرکت غیرعادی، تعیین توالی شده و ماهیت تغییر نوکلئوتیدی مشخص میشود.
اصول CSGE:
در DNA همودوپلکس، تمام نوکلئوتیدها بر اساس جفت شدن واتسون-کریک که آدنین با تیمین و سیتوزین با گوانین جفت میشوند، قرار گرفتهاند، ولی در DNA هترودوپلکس این جفت شدن کامل بازها رخ نداده است. بهطورکلی دو حالت تشکیل هترودوپلکسها وجود دارد. در حالت اول تعداد نوکلئوتیدهای هر دو رشته برابرند، ولی یک یا چند نوکلئوتید این دو رشته مکمل همدیگر نیستند. در حالت دیگر، حذف و یا اضافه شدن در یکی از رشتهها رخ داده و لذا این ناحیۀ تغییر یافته فاقد نوکلئوتیدهای مکمل خواهد بود. در شرایط دناتوره کنندۀ نسبي، بازهای فاقد مکمل به بیرون مارپیچ دو رشتهای DNA چرخش کرده و ایجاد خمیدگی در قطعه موردنظر مینمایند. این خميدگي DNA موجب تفاوت در حرکت قطعۀ موردنظر در مقایسه با همودوپلکس بدون خمش میشود. در شرایط بهینه CSGE، چرخش باز به بیرون مارپیچ و ایجاد خمیدگی افزایش پیدا میکند. در حالت حذف و اضافه شدن نوکلئوتیدها در مقایسه با حالت تفاوت در بازها، میزان عقبماندگی در حرکت باند شدیدتر خواهد بود. به همین دلیل برای غربالگري جهشهايي كه از نوع حذف و اضافه شدن نوکلئوتیدها هستند، تکنیک CSGE روش مناسبی خواهد بود.
شرایط ژل CSGE:
عوامل دناتوره کنندۀ اتیلن گلیکول و فرمامید، ساختار فضايي DNA را در ژل CSGE تغییر داده و به ترتیب در غلظتهای 10% و 15% به کار میروند. در اين تكنيك بهجای سیستم بافری تریس-بورات که در الکتروفورز با آگارز و پلی آکریلامید استفاده میشود، از سیستم بافري تريس-تورين استفاده ميشود. علت اين امر تحمل بالاتر گلیسرول موجود در سیستم بافری تریس-تورین ميباشد.
شرایط طراحی پرایمر و PCR بهمنظور CSGE:
در تكنيك CSGE پرایمرها باید بهگونهای طراحی شوند که از هر دو انتهای قطعه موردنظر 80 تا 100 باز فاصله داشته باشند؛ زیرا اگر خمیدگی در دو انتهاي قطعه موردنظر تشکیل شود، امکان جداسازی در شرایط CSGE مشکل خواهد بود. بهتر است اگزونهای بزرگ به قطعات کوچکتری شکسته شده تا با يكدیگر 80 تا 100 باز همپوشانی داشته باشند. جهت بررسی خلوص و غلظت محصول PCR، آن را با استفاده از ژل آگارز 2% الکتروفورز میكنند. اگر در این مرحله مشخص شود كه غلظت محصول PCR پایین است، در مرحله CSGE مقدار بیشتری از محصول به چاهکها اضافه میگردد.
اگر باند محصول PCR در ژل حالت اسمیر داشت، بهتر است در مرحله PCR از بافر 10x (NH4)2SO4 استفاده شود.
روش انجام CSGE:
جهت استفاده از تكنيك CSGE باید مراحل زیر انجام شوند:
1) استخراج DNA و انجام PCR
2) ساخت هترودوپلکس
3) تهیه ژل و بافرهای موردنیاز
4) Pre Run و سپس الکتروفورز در ژل CSGE 10%
5) رنگآمیزی با اتیدیوم بروماید و مطالعه و ثبت باندها
لازم به ذکر است اصول مراحل PCR و ساخت ژلها و الکتروفورز همانند PCR معمولي میباشد و تنها تفاوت در نوع و مقدار مواد لازم ميباشد که در زیر به آنها اشاره میشود.
ساخت هترودوپلکس:
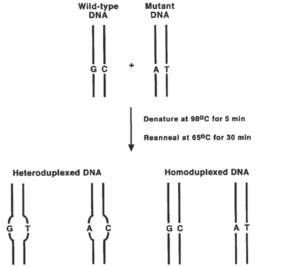
بهمنظور ساخت هترودوپلکسها، بعد از PCR و اطمینان از خالص بودن محصول آن، مقدار مساوی از نمونه موردبررسی را با محصول PCR نمونۀ طبیعی و سالم در یک میکروتیوب بريزيد و در دستگاه ترموسایکلر قرار داده و سپس برنامه زیر را به دستگاه دهيد:
min5 98ºC (Denaturating)
min30 65ºC (Annealing)
در مرحله 98ºC همه قطعات، چه نوع جهشیافته و چه نوع وحشی، دناتوره و تکرشتهای شده و سپس در مرحله 65ºC این رشتهها بهصورت تصادفی به همدیگر متصل ميشوند. لذا سه نوع اتصال زیر قابل پیشبینی ميباشد:
WT – WT
WT – MUT
MUT – MUT (WT= wild type, MUT= mutant)
در مراحل بعدی CSGE، این باندها از يكدیگر متمایز خواهند شد. در مواردی که جهش موردنظر هتروزیگوت باشد، به دلیل اینکه هر دو رشته طبیعی و جهشیافته حضور دارند، نیازی به ترکیب کردن نمونه با نوع وحشی نیست و بنابراین میتوان دو مرحله فوق را بلافاصله به دنبال برنامه PCR افزود.
شکل 1: تصویر شماتیک ساخت هترودوپلکس
.
مواد و وسایل موردنیاز:
همه وسایل موردنیاز جهت تهیه ژل پلی آکریلامید معمولي در این تكنيك نیز لازم ميباشند.
جدول 1: طرز تهیه TTE 20x (حجم ml 500)
| مقدار | مواد |
| 107.8 gr | Tris |
| 35.65 gr | Turine |
| 0.74 gr | EDTA |
مواد فوق را در بشر ریخته و سپس مقداری آب مقطر به آن افزوده و روی گرمکننده (هیتر) قرار دهيد. پس از حل شدن مواد، حجم محلول را به ml 500 برسانيد. این محلول در دمای اتاق به مدت 4 ماه پایدار است.
برای تهیه بافر x0/5 از x 20 از رابطه زیر استفاده میشود:
V1C1 = V2C2→20×V= 0.5 ×2000→V=50cc
cc 50 از بافر x20 را برداشته و با آب مقطر به حجم cc2000 برسانيد.
جدول 2: طرز تهیه محلول ذخیره : BAP 40% Acrylamide 99:1
| مقدار | مواد |
| 39.6 gr | Acrylamide |
| 0.4 gr | BAP |
مواد فوق را در آب مقطر حل كرده تا حجم نهایی آن ml 100 گردد. این محلول 4 ماه در 4 درجه سانتیگراد پایدار است.
جدول 3: طرز تهیه محلول CSGE 10%
| مقدار | غلظت نهایی | غلظت stock | مواد |
| 25 ml | 10% | 40% | 99:1 Acrylamide : BAP |
| 2.5 ml | 0.5 x | 20x | 20x TTE buffer |
| 15 ml | 15% | Formamide | |
| 10 ml | 10% | Ethylene Glycol | |
| 1 ml | 10% APS | ||
| 46.5 ml | ddH2O |
مواد فوق را در یک بطري بريزيد؛ خوب مخلوط كرده و در 4 درجه سانتیگراد نگهداری كنيد. در زمان تهیه ژل کافی است به آن ml 0/06 از TEMED افزوده و خوب هم زده، بقیه مراحل را مانند ژل معمولي ادامه دهيد.
روش انجام CSGE :
برای انجام CSGE ابتدا باید ژل CSGE 10% تهیه شود. برای این کار، مانند تهیه ژل برای الکتروفورز، ابتدا شیشهها با آب مقطر شسته شده، با الکل تمیز و با دستمال خشك ميشوند. سپس بین شیشهها spacer قرار داده شده و روی پایهها محکم شوند.
20 میلیلیتر از محلول ژل CSGE 10% (با توجه به اندازه شیشهها و حجم بین آنها) داخل یک استوانة مدرج ریخته، 200 میکرو لیتر از APS 10% و سپس 20 میکرولیتر TEMED اضافه كنيد. محلول حاصل را خوب مخلوط کرده و با استفاده از سرنگ، بهآرامی در فضای بین دو شیشه تخلیه كنيد. در این مرحله باید احتیاط شود تا حباب وارد محلول نشود؛ چراکه موجب اختلال در حرکت الکتروفورتیک باندها شده و تشخیص هترودوپلکسها را با مشکل مواجه میسازد. سپس شانههای مخصوص را در ژل قرار داده و صبر كنيد تا ژل ببندد. در اینجا نیز زمان خروج شانه مهم بوده و اگر زود بیرون کشیده شود، دیوارۀ چاهکها فرو میریزد و اگر دیر بیرون کشیده شود، ژل کاملاً بسته و درنتیجه با بیرون کشیدن شانه دیواره و کف چاهکها نامنظم شده و باعث کاهش کیفیت الکتروفورز میگردد. پس از بیرون کشیدن شانه، سریعاً چاهکها ابتدا با آب مقطر (3 مرتبه) و سپس با بافر 0/5x TTE شستشو داده میشود. در این مرحله ژل آماده است و باید Pre Run شود. این کار قبل از بارگیری محصول گرم شده برای CSGE و بهمنظور ایجاد تعادل یونی در ژل CSGE انجام میشود. برای Pre Run، ژل درون تانک الکتروفورز قرار گرفته و به مدت 45 دقیقه در ولتاژ V 300، Run میشود. سپس ژل از داخل تانک بیرون آورده شده و سه مرتبه با بافر 0/5x TTE چاهکها را شستشو داده و دوباره درون تانک قرار دهيد. حال ژل برای بارگذاری آماده است.
اکنون محصول PCR را که برنامه CSGE روی آن اعمال شده را برداشته، به هر میکروتیوب 5 میکرولیتر بافر loading افزوده و چند ثانیه سانتریفیوژ كنيد تا بهخوبی باهم مخلوط شوند. سپس 15 تا 20 میکرولیتر از محتویات میکروتیوب را با سرنگ همیلتون درون چاهکها بريزيد. بهتر است در هر مرحله بارگذاری دو طرف ژل خالی باشد تا در صورت کج شدن مسیر الکتروفورز، محصول به داخل دیوارهها نفوذ نكند. در هر ژل، بهتر است یک کنترل مثبت (DNA heteroduplex) و در صورت امکان یک نشانگر وزن مولكولي هم قرار داده شود. در این مرحله ژل را به مدت 4 ساعت در V 350 الکتروفورز كنيد. پسازاین مدت جریان برق را قطع كرده، ژل از داخل تانک بیرون آورده شده و با احتیاط گیرههای اطراف شیشهها باز میشوند. دو شیشه به نحوی با کاردک از هم جدا میگردند که ژل به یکی از شیشهها متصل باقی بماند. در این مرحله ژل را با احتیاط وارد تانک اتیدیوم بروماید کرده و پس از 3-2 دقیقه با آب مقطر شسته و بر روی دستگاه UV قرار داده و از آن عکسبرداری کنید.
[1] Conformation Sensitive Gel Electrophoresis
نکتههای کلیدی آزمایشگاهی در الکتروفورز هموگلوبین، پروتئین و CSF
مروری بر الایزا خطایابی و رفع ایرادات احتمالی در کار با سیستم الایزا
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام