آزمایشگاه تشخیص پزشکی و قارچشناسی کلینیکی
بخش سوم
دکتر محمد قهری
www.ghahri.ir
شناسایی کپکها
شناسایی کپکها اصولاً بر اساس مشخصات مرفولوژیک آنها انجام میگیرد و شامل ویژگیهای ظاهری کلنی و مرفولوژی میکروسکپی است. رشد قابل مشاهده بر روی محیطهای آگار در مورد زیگومیستها معمولاً در طول 1 تا 5 روز و در مورد اکثر کپکهای شفاف (که هایفی و کونیدیهای آنها به رنگهای روشن است) و برخی از کپکهای سیاه (دیماتیاسئوس که هایفی و کونیدیهای آنها رنگدانه های تیره دارند) و نه همهی آنها نیز در همین حدود است. استفاده از خصوصیات ظاهری و ریختشناسی کلنی کپکها بهتنهایی برای شناسایی آنها کمککننده نیست زیرا منظره کلنی کپکها به نوع محیط کشت و نیز به انواع استرینهای آنها وابسته است (شکلهای شماره 1 الی 11). نما و ظاهر سطح کلنی، توپوگرافی، رنگ، پیگمانتاسیون پشت کلنی، رشد در دمای 37 درجه سانتیگراد و نیازمندیهای تغذیهای به ویتامینهای خاص، همگی خصوصیات مفیدی هستند.
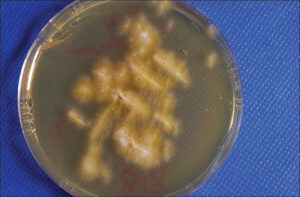
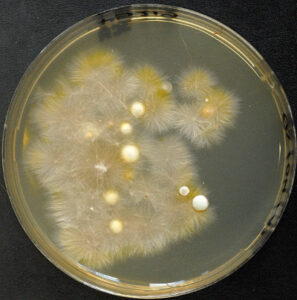
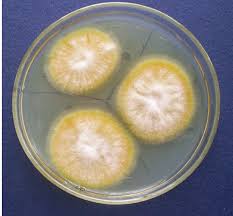
در تصاویر زیر نماهای متفاوتی از ظاهر کلنی در قارچ درماتوفیتی میکروسپوروم کنیس را مشاهده میکنید:
1: کلنیهای میکروسپوروم کنیس بر روی محیط سابورودکستروز آگار
2: استرین دیگری از میکروسپوروم کنیس بر روی محیط سابورودکستروز آگار
3: کلنیهای میکروسپوروم کنیس بر روی محیط سابورودکستروز آگار
4: استرین دیگری از میکروسپوروم کنیس بر روی محیط سابورودکستروز آگار
5: منظره پشت کلنی میکروسپوروم کنیس
6: کلنیهای میکروسپوروم کنیس بر روی محیط مایکوزل آگار
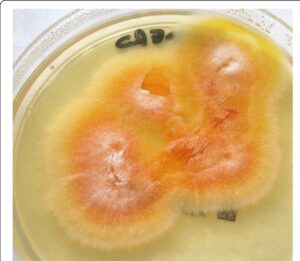
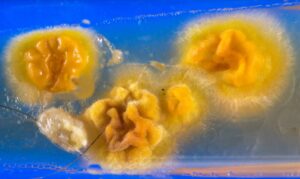
نماهای متفاوتی از ظاهر کلنی در قارچ درماتوفیتی تریکوفیتون سوداننس (Trichophyton soudanense) نیز بهعنوان مثالی دیگر از تنوع شکلی در کلنیهای کپکی در تصاویر زیر مشاهده میشوند:
7: کلنی تریکوفیتون سوداننس بر روی محیط سابورو با سیکلوهگزامید
8: کلنی تریکوفیتون سوداننس بر روی محیط سابورو بدون سیکلوهگزامید
9: کلنیهای مخملی و چینخورده تریکوفیتون سوداننس بر روی محیط سابورو
10: کلنیهای مخملی شکل سفید و زرد تریکوفیتون سوداننس بر روی محیط سابورو
11: کلنیهای مخملی شکل زرد و سفید تریکوفیتون سوداننس بر روی محیط سابورو
شناسایی دقیقتر و قطعیتر اغلب کپکها وابسته به مشاهده و مطالعهی خصوصیات میکروسکپی قارچ مورد نظر است. نمونهای که برای آزمایش میکروسکپی در نظر گرفته میشود باید طوری تهیه شود که ارتباطات بین کونیدیها با هایفی و دستگاه اسپورزائی ازهمگسیخته نشود و یا اینکه آن را به حداقل ممکن برساند. بهترین روش برای رسیدن به این هدف استفاده از تکنیک اسلاید کالچر است.
بررسی و تعیین ملانین دیواره سلولی و دیمورفیسم حرارتی نیز از خصوصیات بااهمیت هستند. پاتوژنهای دیمورفیک را نیز میتوان با استفاده از روشهای ایمنولوژیک و روشهای بر پایهی پروبهای اسید نوکلئیک علاوه بر مرفولوژی و دیمورفیسم حرارتی شناسایی نمود.
روشهای ملکولی برای شناسایی مخمرها و کپکها
استفاده از پروبهای مستقیم اسیدهای نوکلئیک و روشهای ملکولار آمپلیفیکاسیون برای شناسایی مخمرها و کپکها در مقایسه با روشهای فنوتیپیکِ مرسوم، امکان سریعتری را فراهم کردهاند. پروبهای اسیدهای نوکلئیک لیبلشده با مواد شیمی لومینسانس (Accu probe, Gen-probe) برای هدفهای اسید ریبونوکلئیک ریبوزومی قارچی اختصاصی هستند و بهصورت تجارتی برای استفاده در آزمایشگاههای تشخیص طبی در دسترس قرار گرفتهاند. وقتی که نمونهی لیزات ارگانیسمها مورد استفاده قرار میگیرند، پروبها حساسیتی مشابه تست اگزوآنتیژن دارند اما اختصاصیت کمتری نشان میدهند که وابسته به نوع قارچی است که مورد آزمایش قرار گرفته است. پروبها برای کوکسیدیوئیدس ایمیتیس حساسیتی برابر 100 درصد دارند، هرچند که اختصاصیت برای بلاستومایسس درماتیتیدیس و هیستوپلاسما کپسولاتوم اندکی کمتر و برابر با 99 الی 99/7درصد است و مربوط به واکنش متقاطع این دو قارچ بهترتیب با پاراکوکسیدیوئیدس برازیلینسیس و کرایزوسپوریوم است.
روشهای بر پایهی آمپلیفیکاسیون بهویژه برای شناسایی کپکهایی که اسپور تولید نمیکنند (دستگاه زایشی ایجاد نمیکنند) و با روشهای معمولی قابل شناسایی نیستند، بسیار مفید هستند. هدفهای ریبوزومال و نواحی بین فواصل نسخهبرداری داخلی (Internal Transcribed Spacer) برای شناسایی ملکولار تعداد زیادی از قارچها مفید هستند. یک محدودیت مهم در اینجا صحت و کیفیت متنوع پایگاههای اطلاعاتی مربوط به توالیهای موجود است. انتظار میرود با فراهم شدن و در دسترس قرار گرفتن تکنیکهای بهبودیافتهی تعیین توالی، بانکهای اطلاعاتی بزرگتر و قابل اعتمادتر و افزایش سهولت دسترسی به کیتها و نرمافزارها، این تکنولوژی بهصورت یک جانشین رقابتی نسبت به روشهای شناسایی مایکولوژیک کلاسیک برای قارچهای بااهمیت از منظر کلینیکی شود.
روشهای تشخیصی سرولوژیک و روشهای بر پایهی اسیدهای نوکلئیک
هرچند که کشت و هیستوپاتولوژی، راههای اولیه برای تشخیص عفونتهای قارچی هستند، اما نیاز برای روشهای غیر از کشت و بسیار سریعتر ضروری مینماید. تستهایی برای سنجش آنتیبادیها، سنجش سریع آنتیژنهای اختصاصی قارچها، محصولات متابولیک و توالیهای اختصاصیِ گونهای اسید ریبونوکلئیک و اسید دزوکسی نوکلئیک، امکان بالقوهی اطلاعات تشخیصی سریع را فراهم آورده است که به راهنمایی آن میتوان درمان ضد قارچی مناسب و در زمان مناسب را انجام داد.
سنجش آنتیبادی
تستهای سرولوژیک روشی سریع برای تشخیص عفونتهای قارچی و نیز پایش پیشرفت عفونت و پاسخ بیمار به درمان ضد قارچی را بهوسیلهی تعیین تیتر سریال آنتیبادی یا آنتیژن فراهم میکند. اکثر تستهای سرولوژی که معمول هستند بر اساس سنجش میزان آنتیبادی علیه آنتیژنهای اختصاصی قارچی هستند، هرچند که اغلب اوقات این روش سرودیاگنوستیک غیرمؤثر است، زیرا بسیاری از بیماران که در معرض خطر برای عفونتهای مهاجم قارچی قرار میگیرند به علت ایمنوسوپرسیون قادر به ایجاد یک پاسخ اختصاصی آنتیبادی نیستند و علاوه بر این تعیین حضور یک عفونت حاد نوعاً به مقایسهی نوع و مقدار آنتیبادی که در نمونههای سرم در فاز حاد و دورهی نقاهت بیماری حضور دارد، نیازمند است و این مسئله در طول زمان حاد که مداخلات درمانی صورت میگیرد، مفید نیست.
در بین رایجترین و قابل اعتمادترین تستهای سرودیاگنوستیکی که در قارچشناسی استفاده میشود، تستهای آنتیبادی برای هیستوپلاسموز و کوکسیدیوئیدومایکوزیس مورد نظر هستند. تستهای فیکساسیون کمپلمان و ایمیونودیفیوژن در ژل برای تشخیص این عفونتها مفید است. تیترهای فیکساسیون کمپلمان بالاتر از 1/32 از نظر تشخیصی بااهمیت هستند در حالی که تیترهای پائینتر ممکن است نشاندهندهی مراحل ابتدایی عفونت باشند و یا اینکه مربوط به واکنش متقاطع بوده و یا سطح باقیماندهی آنتیبادی مربوط به عفونت قبلی را نشان دهند.
تستهای ایمیونودیفیوژن عموماً حساسیت کمتری نسبت به تستهای فیکساسیون کمپلمان دارند اما میتوانند در شناسایی واکنشهای متقاطع مفید واقع گردند. اگر در یک بیمار به فاصلهی 5 تا 7 روز قبل از انجام تست ایمیونودیفیوژن، تست پوستی هیستوپلاسموز انجام شده باشد، امکان مشاهدهی نتایج مثبت کاذب وجود خواهد داشت. نکتهی دیگر این است که در تستهای ایمیونودیفیوژن و فیکساسیون کمپلمان آنتیبادیهای مختلفی مورد سنجش قرار میگیرند و برای بدست آوردن حداکثر حساسیت تشخیصی هر دو تست باید انجام گیرند.
چندین تکنیک تجاریشدهی الایزا در حال حاضر در دسترس است که آنتیبادیهای ضد کاندیدا را در کاندیدیازیس تهاجمی میسنجند. این کیتها حساسیتی معادل 50 الی 90 درصد و اختصاصیت بین 15 الی 65 درصد را نشان میدهند. یک تکنیک الایزا برای سنجش آنتیبادیهای ضد کاندیدا (آنتی انولاز و آنتیژنهای داخل سیتوپلاسمی) با حساسیت 74%، اختصاصیت 75% و ارزش پیشگوئی مثبت 62% و ارزش پیشگوئی منفی 84% برای تشخیص کاندیدیازیس تهاجمی در افراد دارای سیستم ایمنی سالم در دسترس قرار گرفته شده است. نسبتهای فوق برای بیماران مبتلا به کاندیدیازیس تهاجمی با سیستم ایمنی مختلشده؛ حساسیت 15%، اختصاصیت 60%، ارزش پیشگوئی مثبت 1/7% و ارزش پیشگوئی منفی 93% را نشان داده است. علیرغم ارزش پیشگوئی منفی بالا، ارزشیابی چنین تستی بهویژه در مورد بیماران در معرض خطر بالا، امر مشکلی است.
یک نوع تست آنتیبادی ضد کاندیدایی (Bio-Rad, Redmond, WA) وجود دارد که از یک فرمت الایزا استفاده میکند که در آن آنتیبادیهای ضد مانان موجود در گردش خون را در سرم بیماران مورد سنجش قرار میدهد و حساسیتی برابر 53 درصد اما اختصاصیت معادل 94 درصد دارد. هنگامی که بهطور همزمان در ترکیب با تست آنتیژن مانان بهکار میرود، حساسیت روش به 80 درصد میرسد و اختصاصیت آن معادل 93 درصد میشود. از این نتایج مشخص میشود که تشخیص کاندیدیازیس تهاجمی را نمیتوان تنها بر اساس یک تست آنتیبادی به تنهایی بنا نمود. بکار گرفتن یک استراتژی که در آن منانمی (mannanemia) و نیز آنتیبادیهای ضد مانان مورد آزمایش قرار گیرند، بسیار مفید است؛ علاوه بر این بهنظر میرسد که نمونهگیری منظم (حداقل هفتهای دو مرتبه) برای رسیدن به تشخیص زودرس کاندیدیازیس تهاجمی میتواند حیاتبخش باشد.
- روش انجام تست پوستی
معرفی یک مورد هیستوپلاسموز فعال سیستم اعصاب مرکزی
بیماری با علائم سرگیجه، سردرد و تهوع مورد بررسی قرار میگیرد. یافتههای رادیولوژیکی در CT از ریه علائمی از عفونت گرانولوماتوز قدیمی نشان میدهد. در آزمایش از مایع نخاع، پروتئین بالا، قند نرمال و تعداد 58 گلبول سفید که 86% از آنها از نوع تکهستهای هستند، دیده میشود.
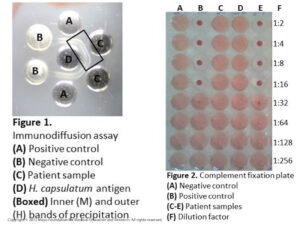
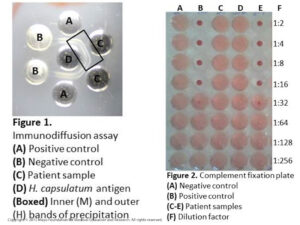
تست ایمیونودیفیوژن سرم و مایع نخاع از نظر هیستوپلاسما مثبت بوده است (شکل شماره 1). تیترهای فیکساسیون کمپلمان در سرم و مایع نخاع برای آنتیژن فاز مخمری بترتیب برابر 1/32 و 1/64 بوده است و این مقدار برای آنتیژن فاز میسلیال بترتیب برابر 1/16 و 1/128 بوده است (شکل شماره 2 قسمت E). نتایج کشت قارچ از مایع نخاع منفی و نیز نتیجه تست آنتیژن هیستوپلاسما در ادرار نیز منفی بوده است.
شکل شماره 1
تست ID در اینجا اختصاصیتی برابر 100% دارد، ولی حساسیت آن نسبت به فیکساسیون کمپلمان کمتر است. در تست ID در هیستوپلاسموز دو باند تشکیل میشود: باند داخلی M و باند خارجی تحت عنوان H، مشاهدهی 2 باند نشاندهندهی عفونت فعال است، درصورتیکه مشاهدهی باند M بهتنهایی ممکن است مربوط به عفونت گذشته باشد و مشاهدهی باند H به تنهایی نادر است و استفادهی کلینیکی مشخصی ندارد (شکل شماره 1).
شکل شماره 2
تشخیص هیستوپلاسموز منتشره بهوسیلهی کشت، PCR، سنجش آنتیژن و/یا سرولوژی فراهم میشود. کشت مایع مغزی نخاعی در 50 درصد موارد مننژیت هیستوپلاسمایی ممکن است مثبت شود. روشهای ملکولی برای سنجش اسید نوکلئیک این قارچ در بیماران دارای حساسیت بین 70 تا 86 درصد است. آزمایش آنتیژن هیستوپلاسما در نمونهی سرم یا ادرار بالاترین حساسیت برای این ارگانیسم را دارد (92 درصد در بیماری منتشره) و آزمایش سریال آنتیژن میتواند برای ارزیابی پاسخ به درمان مورد استفاده قرار گیرد. واکنشهای متقاطع ممکن است با میکوزهای دیمورفیک دیگر مانند بلاستومایکوز حاصل شود. آزمایش آنتیبادی عموماً نسبت به آزمایش آنتیژن در هیستوپلاسموز منتشره از حساسیت کمتری برخوردار است که این مسئله بهویژه در بیمارانی که سیستم ایمنی سرکوبشده دارند بیشتر نمایان است، علاوه بر این در نواحی اندمیک که موارد سرولوژی مثبت (seropositive) در آن بالا است، آزمایشهای سرولوژیک از اختصاصیت کلینیکی محدودی برخوردار است. تستهای سرولوژیک برای آنتیبادیهای ضد هیستوپلاسما کپسولاتوم را میتوان بر روی نمونهی سرم و مایع مغزی نخاعی انجام داد و شامل تستهای ایمیونودیفیوژن (ID) و فیکساسیون کمپلمان(CF) است. تست فیکساسیون کمپلمان حساسیت زیاد اما اختصاصیت کمتری در مقایسه با تست ID دارد که این مسئله لزوم کاربرد هر دو تست را برای تشخیص درست خاطرنشان میسازد. آزمایش فیکساسیون کمپلمان، آنتیبادی توتال علیه اجزای میسلیال و مخمری هیستوپلاسما کپسولاتوم را اندازهگیری میکند. بهطور خلاصه، نمونهی مربوط به بیمار حرارت داده میشود تا کمپلمان غیرفعال شود و سپس با آنتیژن هیستوپلاسما کپسولاتوم، کمپلمان خوکچه هندی و گلبولهای قرمز حساس شدهی گوسفندی انکوبه میشود. اگر آنتیبادیهای ضد هیستوپلاسما کپسولاتوم در نمونهی بیمار وجود داشته باشد، کمپلکس آنتیژن- آنتیبادی به اجزاء کمپلمان باند میشود و از لیز گلبولهای قرمز جلوگیری میکند. اگر آنتیبادیها در نمونهی بیمار وجود نداشته باشند، اجزای کمپلمان بهصورت باندنشده باقی میمانند و لیز گلبولهای قرمز اتفاق میافتد.
References:
1- Clinical Mycology. E. J. Anaissie. 2009. CHURCHILL LIVINGSTONE. Chapter 4:The Laboratory and Clinical mycology.
2- Kauffman C. Histoplasmosis: a Clinical and Laboratory Update. Clin Microbiol Rev. 2007 Jan; 20(1): 115–132.
آزمایشگاه تشخیص پزشکی و قارچشناسی کلینیکی (1)
آزمایشگاه تشخیص پزشکی و قارچشناسی کلینیکی (2)
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام