ارزیابی آزمایشگاهی اختلالات عملکرد پلاکت
اکبر درگلاله1، حسن مروتی2
1: گروه هماتولوژی و طب انتقال خون، دانشگاه علوم پزشکی ایران
2: مرکز تحقیقات واکسن و سرمسازی رازی
زمان انسداد / آنالیزر عملکرد پلاکت (PFA) 100 ® / 200 ®
زمان انسداد[1]، زمان لازم برای تشکیل میخ پلاکتی اولیه و توقف جریان خون در شرایط آزمایشگاهی با استفاده از دستگاههای PFA 100 ® / 200 ®[2] است (کادر 1). زمان بسته شدن نوعی ارزیابی in vitro از عملکرد پلاکت است که میتواند بهعنوان جایگزینی برای آزمایش زمان خونروی (BT) [3]در نظر گرفته شود.
| کادر 1- اساس آزمون زمان انسداد
آنالیزرهای عملکرد پلاکت از دو کارتریج استفاده میکنند که هر کدام دارای یک غشاء با ترکیبی از دو آگونیست پلاکتی هستند: کلاژن/ اپینفرین (Col/Epi) یا کلاژن (ADP (Col/ADP. یک کارتریج سوم حاوی پروستاگلاندین E1 و ADP (Innovance PFA P2Y) نیز ممکن است مورد استفاده قرار گیرد، اما در همه کشورها در دسترس نیست. ®PFA200 مدل ارتقاءیافته ®PFA100 است. ®PFA200 کاربرپسندتر با نرمافزار پیشرفتهتر و قابلیت صفحه لمسی است، اما این مدل در سراسر دنیا در دستـــــرس نیست. اساس هر دو دستــگاه PFA100/200 مشابه است، این دستگاهها امکان ارزیابی عملکرد پلاکت در in vitro در یک سیستم جریان که آسیب عروقی را نیز تقلید میکند، فراهم میکنند. هر کارتریج شامل یک لوله مویینه است که به یک غشای پوشیدهشده با آگونیستهای پلاکتی متصل است. یک روزنه کوچک در مرکز غشا برای تقلید آسیب عروقی وجود دارد. نمونه خون تام سیتراته بیمار با سرعت جریان بالا به داخل لوله مویینه آسپیره میشود. زمانی که پلاکتها با غشاء تماس مییابند، بهواسطه vWF به آگونیست موجود در سطح غشا و کلاژن متصل میشوند. آگونیستهای پوشاننده غشا باعث فعال شدن، چسبندگی و تجمع پلاکتها میشوند که منجر به تشکیل یک میخ پلاکتی میشود که روزنه را مسدود کرده و باعث توقف جریان خون میشود. از زمان آسپیره شدن نمونه بیمار تا انسداد جریان خون بهعنوان زمان انسداد گزارش میشود. آزمایش ابتدا بر روی کارتریج Col/Epi انجام میشود و کارتریج Col/ADP فقط درصورتیکه زمان انسداد با کارتریج Col / Epi طولانی باشد، بهکار خواهد رفت (1, 2). |
دامنه مرجع:
محدوده نرمال برای Col/Epi کمتر از 180 ثانیه و برای Col/ADP کمتر از 120 ثانیه است. در GT، زمان انسداد برای هر دو کارتریج طولانی است.
حساسیت و اختصاصیت:
بهعنوان یک آزمایش غربالگری، زمان انسداد برای تشخیص GT دارای حساسیت خوب حدود 97% است. با این وجود، طولانی بودن زمان انسداد برای تشخیص GT اختصاصی نیست (3).
الزامات نمونه:
نمونه موردنیاز، خون تام جمعآوریشده در غلظت استاندارد از ضد انعقاد سیترات است. نمونه باید تازه باشد و تأخیر بین نمونهبرداری و انجام آزمایش نباید بیش از 4 ساعت باشد.
متغیرهای مداخلهگر:
شمارش پلاکت، هماتوکریت، غلظت سیترات، گروه خون ABO، سطح پلاسمایی vWF و زمان جمعآوری خون، متغیرهایی هستند که ممکن است بر زمان انسداد تأثیر بگذارند. گزارش شده است که شمارش پلاکتی کمتر از L/109×150 و هماتوکریت کمتر از 35% ممکن است زمان انسداد را افزایش دهد (4).
1: مطالعات تجمع پلاکتی
2-1- اگریگومتری عبور نور
اگریگومتری عبور نور (LTA)[4] در اوایل دهه 1960 معرفی شد و بهعنوان روش استاندارد طلایی برای ارزیابی عملکرد پلاکت در اختلالات خونریزیدهنده ارثی و اکتسابی مورد توجه قرار گرفت، همچنین برای نظارت بر اثربخشی درمانهای ضد پلاکتی استفاده میشود. تمام مطالعات تجمع پلاکتی بر اساس توانایی تجمع پلاکتها در پاسخ به آگونیستهای خارجی استوار است. LTA بر اساس تعيين ميزان تغييرات نور پس از افزودن آگونيست (عامل تجمع) به نمونه پلاسماي غني از پلاکت (PRP)[5]، استوار است (کادر 2). پانل پایه پیشنهادشده برای آگونیستهای LTA شامل کلاژن، آدنوزین دی فسفات (ADP)، اپینفرین (EP)، اسید آراشیدونیک (AA)، ریستوستین، یونوفور کلسیم A23187 و پپتید فعالکننده گیرنده ترومبین (TRAP)[6] است، اگرچه سایر آگونیستها نیز ممکن است در شرایط خاصی استفاده شوند (5).
| کادر 2- اساس اگریگومتری عبور نور (LTA)
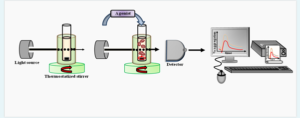
اندازهگیری مقدار عبور نور توسط آنالایزر اگریگومتری پلاکت انجام میشود. در این روش، نمونه PRP در یک کووت یکبار مصرف (انکوبه در دمای 37 درجه سانتیگراد، درحالیکه مدام در حال به هم خوردن است) بین یک منبع نور و یک فتوسل در یک آنالایزر اگریگومتری قرار میگیرد (شکل 1). شکل 1 –نمای کلی از یک اگریگومتر یک کووت حاوی PRP که بهطور مداوم هم زده میشود بین یک منبع نور و یک فتوسل قرار میگیرد. پس از اضافه کردن آگونیست، تغییرات نور عبوری شناسایی شده و بهصورت یک منحنی گزارش میشود
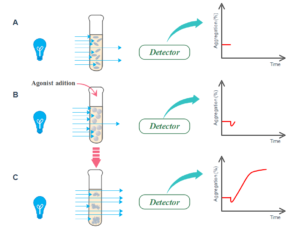
در پاسخ به افزودن آگونیست، شکل پلاکتها ابتدا از دیسکوئید به کروی تغییر میکند و منجر به کاهش موقت در میزان عبور نور میشود. بعد از آنکه پلاکتها تجمع مییابند، کدورت PRP کمتر شده و باعث عبور نور بیشتری میشود. عبور نور توسط یک فتومتر که در مقابل کووت تعبیه شده است، اندازهگیری میشود، سپس انتقال نور به یک منحنی گرافیکی تبدیل میشود و بهصورت درصد تجمع گزارش میشود (2 ,5 ,6) (7 ,8) (شکل 2). شکل 2- اساس اگریگومتری عبور نور A. قبل از افزودن آگونیست،PRP کدر است و اجازه عبور نور کمی را میدهد (عبور پایه) B. اضافه کردن آگونیست منجر به تغییر فوری در شکل پلاکت از دیسکویید به کروی میشود که عبور نور را کمتر کرده و میتواند بهصورت یک کاهش جزئی در منحنی تجمع مشاهده شود. در نهایت، تجمع پلاکتها رخ میدهد که منجر به افزایش در میزان نور عبوری میشود که به شکل منحنی تجمع ترسیم میشود |
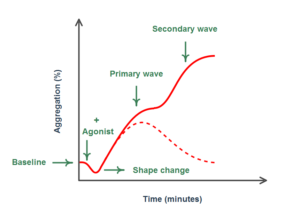
تغییرات منحنی ترسیمشده طی تجمع پلاکتهای نرمال بهصورت تغییر شکل، اولین موج تجمع (موج اولیه)، نقطه عطف و موج ثانویه تجمع مشاهده میشود. هنگامیکه آگونیست اضافه میشود، زنجیره رویدادها شامل تجمع اولیه با فعالسازی پلاکت و به دنبال آن آزاد شدن محتویات گرانولی پلاکت برای کمک به فعال شدن بیشتر و تجمع پلاکتها است. اگر یک دوز ناکافی از آگونیست اضافه شود، پلاکتها بهطور اولیه فعال میشوند که موجب تشکیل موج اولیه میشود. از آنجایی که تحریک به اندازه کافی قوی نیست که پلاکت را به اندازه کافی فعال کند تا محتوای گرانولی آن آزاد شود، موج ثانویه مشاهده نخواهد شد. هنگامی که غلظت آگونیست برای فعال کردن پلاکتها بهمنظور ترشح گرانولی کافی باشد، موج ثانویه بلافاصله پس از موج اولیه ظاهر میشود که مربوط به فعال شدن بیشتر پلاکتها به دلیل آزاد شدن محتویات گرانولی است. هنگامی که غلظت بالایی از یک آگونیست قوی اضافه شود، تنها یک منحنی شامل ادغام هر دو موج اولیه و ثانویه مشاهده خواهد شد؛ چرا که تجمع شدید ناشی از تحریک آگونیست، اثر تحریک اضافی ناشی از ترشح گرانولی را میپوشاند (شکل 3) (5, 9). شیب منحنی و الگوی امواج برای تفسیر مهم هستند و تغییرات آنها اپراتور را برای تحلیل بیشتر هدایت میکند (5).
شکل 3- منحنی تجمع در پاسخ به آگونیستهای قوی که شامل امواج اولیه و ثانویه است
موج اولیه نشاندهنده فعال شدن اولیه پلاکت است که منجر به تجمع اولیه (ابتدایی) پلاکت میشود. اگر آگونیست به اندازه کافی قوی باشد، منجر به ترشح محتوای گرانولهای پلاکتی میشود که پلاکتهای بیشتری را فعال میکند و بدین ترتیب، افزایش تجمع پلاکتها منجر به تشکیل موج دوم میشود. غلظت ضعیف آگونیست منجر به ترشح گرانولها نشده و موج اولیه به سطح پایه برمیگردد (منحنی نقطهچین)
تست اگریگومتری نوری با استفاده از پلاسمای کم پلاکت (PPP) بهعنوان مرجع برای عبور نور 100٪ و PRP برای عبور نور 0٪ انجام میشود. PRP و PPP بهصورت جداگانه به لوله پلاستیکی در دار منتقل شده و تا زمان آنالیز در دمای اتاق نگهداری میشوند.
غلظت پلاکت و اصلاح آن:
با توجه به توصیههای استانداردسازی LTA ارائهشده توسط کمیته فرعی فیزیولوژی پلاکت SSC/ISTH، ارزیابی تعداد پلاکت نمونههای PRP ضروری است. نتایج LTA برای نمونههای PRP با تعداد پلاکتهای کمتر از L/109×150 دقیق نیستند و نتایج غیرطبیعی این نمونهها باید با احتیاط تفسیر شود. بر اساس توصیههای SSC/ISTH، نمونههای PRP بیماران با شمارش پلاکت طبیعی در خون تام نباید با PPP اتولوگ اصلاح شود، زیرا ممکن است واکنش پلاکتی به آگونیستها را تحت تأثیر قرار دهد. با این حال در مورد نمونههای PRP با تعداد پلاکت بیش از L/109×600 اختلاف نظر وجود دارد (10).
غلظت آگونیستها:
این مسئله بهخوبی استاندارد نشده و توافق اجماعی برای غلظت آگونیستهای کاربردی وجود ندارد. این مشکل ممکن است منجر به نتایج متغیری شود که در آزمایشگاههای مختلف قابل مقایسه نیست. غلظتهای توصیهشده توسط کمیته فرعی فیزیولوژی پلاکتی SSC/ISTH برای آگونیستهای LTA در جدول 1 نشان داده شده است (10).
| جدول 1- غلظت توصیهشده آگونیستها برای LTA | |
| غلظت توصیهشده | آگونیست پلاکتی |
| 2 میکرومولار | آدنوزین دی فسفات (ADP) |
| 5 میکرومولار | اپینفرین |
| غلظت کمی که برای القای تجمع پلاکتهای نرمال کافی باشد. | کلاژن |
| 10 میکرومولار | پپتید فعالکننده گیرنده ترومبین (PAR1–AP) |
| 1 میکرومولار | مقلد ترومبوکسان A2 : U46619 |
| 1 میلیمولار | اسید آراشیدونیک |
| 1/2 میلیگرم بر میلیلیتر | ریستوستین |
| توجه: در صورت به دست آمدن نتایج غیرطبیعی (پایین) با غلظتهای ذکرشده، باید از غلظتهای بالاتر استفاده کرد. | |
متغیرهای مداخلهگر:
LTA ممکن است تحت تأثیر بسیاری از متغیرها از جمله شرایط پیش از آزمایش (بهعنوان مثال پلاسمای لیپمیک، همولیز، تعداد پلاکتهای پایین، یا نوع ضد انعقاد)، عوامل حین آزمایش (مانند نوع و غلظت آگونیستها، آمادهسازی PRP) و مهارت و تجربه اپراتور در انجام و تفسیر نتیجه قرار بگیرد. لیپمی و همولیز اولیه نیز ممکن است بر روی کدورت PRP تأثیر بگذارد و نتایج غیرطبیعی را به همراه داشته باشد (8, 10, 11). علاوه بر این، آلودگی نمونه PRP با گلبولهای قرمز و لکوسیتها ممکن است باعث فعال شدن پلاکتها شده و منجر به نتایج غیر قابل تفسیر در الگوهای تجمع شود.
داروها و مکملها:
بیماران باید حداقل به مدت 10 روز قبل از انجام آزمایش از مصرف غذاها، مکملها و داروهایی که ممکن است بهطور قابل برگشت یا غیرقابلبرگشت با عملکرد پلاکتی تداخل داشته باشد، خودداری کنند. داروهای ضد التهاب غیراستروئیدی (NSAIDS)، آسپرین و داروهای ضد پلاکت اختصاصی، نمونههایی از این داروها هستند. ترجیحاً، بیمار از شب ناشتا باشد و همچنین حداقل به مدت 30 دقیقه قبل از نمونهگیری سیگار نکشد.
دما:
دمای پایین (<C˚20) یا دمای بالا (> C˚37) ممکن است پلاکتها را فعال کند و بر کیفیت نتایج تأثیر بگذارد.
ضد انعقاد:
طبق دستورالعمل فعلی، ضد انعقاد مناسب برای LTA، سیترات سدیم 3/2 % و با نسبت 1 قسمت ضد انعقاد به 9 قسمت خون تام است. استفاده از ضد انعقاد نادرست (از جمله EDTA) بهجای سیترات سدیم ممکن است الگوهای تجمعی را تغییر دهد. EDTA میتواند کمپلکسهای αIIbβ3 را از سطح پلاکتها جدا کند و در نتیجه یک الگوی تجمعی مشابه ترومباستنی گلانزمن را تقلید کند. نسبت ضد انعقاد نادرست نیز ممکن است بر الگوهای تجمع تأثیر بگذارد.
LTA یک روش با هزینه بالا، پرزحمت و وقتگیر است و بهطور بالقوه نسبت به خطاهای فنی آسیبپذیر است. این آزمایش همچنین نیاز به حجم زیادی از نمونههای خون دارد که برای نوزادان و کودکان چالش است. این روش همچنین در تجزیه و تحلیل موارد ترومبوسیتوپنی محدودیت دارد. فقدان مواد کنترل کیفی داخلی و خارجی و تفسیر متفاوت نتایج آزمایشگاههای مختلف به علت استانداردسازی ضعیف از دیگر محدودیتهای آزمایش LTA است (9, 10, 12)؛ بنابراین باید تلاش زیادی برای استاندارد کردن این روش اختصاص داده شود. بهعنوان یک آزمایش خط اول و با توجه به اینکه عوامل مختلفی میتواند منجر به اختلال عملکرد پلاکتی شود و نیز به دلیل اثرات متغیرهای متعدد، نتایج LTA باید با روشهای تخصصیتر تأیید شود.
2-2- اگریگومتری چند الکترودی/ اگریگومتری امپدانس خون تام
اگریگومتری چند الکترودی (MEA) روشی برای ارزیابی عملکرد پلاکت بر اساس امپدانس است (کادر 3).
| کادر 3- اساس اگریگومتری چند الکترودی (MEA)
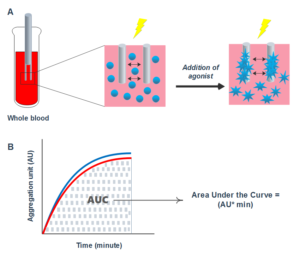
MEA عملکرد پلاکت را با اندازهگیری تغییرات امپدانس الکتریکی به دنبال تجمع پلاکتها بر سطح دو الکترود که درون نمونه قرار میگیرند، بررسی میکند. در اگریگومتری امپدانس، پس از اضافه کردن آگونیست به نمونه خون تام سیتراته، پلاکتها فعال شده و به سطح الکترودها میچسبند (شکل A4). تجمع پلاکتها منجر به افزایش امپدانس الکتریکی شده که به اهم ثبت میشود. نتایج در نهایت تحت عنوان ناحیه زیر منحنی (AUC) (شکل B4) گزارش میشود. علاوه بر این پارامترهایی شامل زمان تأخیری[7]، شیب و حداکثر تجمع نیز میتوانند از منحنی دادهشده، بدست آیند. شکل 4- اساس اگریگومتری چند الکترودی A. الکترود دوقلو در نمونه خون تام قرار میگیرد. افزودن آگونیست منجر به فعال شدن و تجمع پلاکتها در سطح الکترودها میشود که منجر به افزایش امپدانس الکتریکی شده و جریان الکتریکی را کاهش میدهد B. نتایج بهصورت AUC گزارش میشود که بهصورت AU * min محاسبه میشود AU: واحد تجمع |
مزیت MEA ، اندازهگیری عملکرد پلاکت در شرایطی مشابه شرایط فیزیولوژیک است؛ به دو دلیل:
(1) استفاده از خون تام، امکان حضور سایر عناصر مهم خون برای عملکرد پلاکت را فراهم میکند.
(2) چسبندگی پلاکت و تجمع آن در سطح الکترودها شبیه فرآیند چسبندگی و تجمع پلاکتها به عروق آسیبدیده است.
یکی دیگر از مزایای MEA، استانداردسازی بهتر این روش است. پیپتینگ خودکار، معرفها و رقیقکنندههای استانداردشده و آماده برای مصرف و عدم نیاز به آمادهسازی نمونه، MAEرا یک روش سریع و کاربرپسند ساخته است. توانایی اندازهگیری همزمان عملکرد پلاکت در نمونههای مختلف با استفاده از آگونیستهای مختلف یکی دیگر از مزایای MEA است. آنالیزرهای چندگانه عملکرد پلاکت مجهز به پنج کانال، هر کدام با دو جفت الکترود مستقل، امکان تعیین تجمع پلاکتها را بهصورت همزمان و داپلیکیت فراهم میکنند. اندازهگیری هر نمونه بهصورت داپلیکیت، نوعی کنترل کیفی داخلی است که نتایج را قابل اطمینانتر میکند.
تکنیک MEA نیاز به مقادیر کمتری از نمونه دارد و از این رو برای کودکان و همچنین در موارد ترومبوسیتوپنی مناسب است. MEA برای پایش بیماران قلبی- عروقی تحت درمان با ضد پلاکتها برای بررسی واکنشپذیری پلاکت حین درمان مناسب است. با وجود تمام مزایای MEA، در مقایسه با LTA محدودیتهایی دارد؛ بهعنوان مثال،MEA امکان ارزیابی تغییر شکل پلاکتها و امواج اولیه و ثانویه تجمع را فراهم نمیکند. علاوه بر این، ترکیب کردن مطالعه تجمع پلاکت و اندازهگیری آزادسازی ATP در روش MEA امکانپذیر نیست.
منابع:
- Favaloro EJ, Bonar R. An update on quality control for the PFA-100/PFA-200. Platelets. 2018;29(6):622-7.
- Harrison P, Mackie I, Mumford A, Briggs C, Liesner R, Winter M, et al. Guidelines for the laboratory investigation of heritable disorders of platelet function. British journal of haematology. 2011;155(1):30-44.
- Franchini M, Favaloro EJ, Lippi G. Glanzmann thrombasthenia: an update. Clinica Chimica Acta. 2010;411(1-2):1-6.
- Cho Y-U, Jang S, Park C-J, Chi H-S. Variables that affect platelet function analyzer-100 (PFA-100) closure times and establishment of reference intervals in Korean adults. Annals of Clinical & Laboratory Science. 2008;38(3):247-53.
- Paniccia R, Priora R, Liotta AA, Abbate R. Platelet function tests: a comparative review. Vascular health and risk management. 2015;11:133.
- Rand ML, Reddy EC, Israels SJ. Laboratory diagnosis of inherited platelet function disorders. Transfusion and Apheresis Science. 2018.
- Frontroth JP. Light transmission aggregometry. Haemostasis: Springer; 2013. p. 227-40.
- Hvas A-M, Favaloro EJ. Platelet function analyzed by light transmission aggregometry. Hemostasis and Thrombosis: Springer; 2017. p. 321-31.
- Ghasemi B, Dorgalaleh A. 15 Bernard-Soulier Syndrome. Congenital Bleeding Disorders: Diagnosis and Management. 2018;3:357.
- Cattaneo M, Cerletti C, Harrison P, Hayward C, Kenny D, Nugent D, et al. Recommendations for the standardization of light transmission aggregometry: a consensus of the working party from the platelet physiology subcommittee of SSC/ISTH. Journal of Thrombosis and Haemostasis. 2013;11(6):1183-9.
- Chan MV, Warner TD. Standardised optical multichannel (optimul) platelet aggregometry using high-speed shaking and fixed time point readings. Platelets. 2012;23(5):404-8.
[1] Closure time
[2] Platelet function analyzer
[3] Bleeding time
[4] Light transmission aggregometry
[5] platelet-rich plasma
[6] Thrombin receptor-activating peptide
[7] Lag time
پلاسمای غنی از پلاکت (پیآرپی)
پایش آزمایشگاهی مقاومت دارویی به داروهای رایج ضدلختگی در بیماران قلبی و عروقی
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام