بیان قطعات آنتی بادی روی سطح باکتریوفاژها[1]
روشی جدید برای تولید آنتیبادیهای مونوکلونال[2] با منشأ انسانی
صادق دهقانی: دانشجوی دکترای تخصصی بیوتکنولوژی پزشکی دانشگاه علوم پزشکی مشهد
1 مقدمه
تکنیک نمایش فاژی در سال 1985 توسط آقای جرج اسمیت بهعنوان روشی برای بیان پلیپپتیدها بر روی سطح باکتریوفاژهای رشتهای[3] ابداع گردید. از آن زمان به بعد این روش بهعنوان یکی از مؤثرترین راهها برای تولید مقادیر متنوعی از پپتیدها، پروتئینها و آنتیبادیها شناخته شده است.
اساس این روش به این صورت است که توالیهای DNA که از منابع مختلف استخراج شده و سپس توسط تکنیکهای گوناگون در آنها تنوع ایجاد شده است، به درون ژنوم باکتریوفاژ وارد میشوند و سپس این توالیهای واردشده بهصورت پپتیدهای اتصال یافته به یکی از پروتئینهای پوششی فاژ در سطح فاژ بیان میشوند که باعث تولید کتابخانههای فاژی[4] متنوع و در مقادیر زیاد میشود. در ادامه این کتابخانههای فاژی در معرض ماکرومولکولهای هدفی قرار میگیرند که پژوهشگر علاقهمند به شناسایی آنها است. در نهایت فاژهایی که به ماکرومولکولهای موردنظر اتصال پیداکردهاند توسط روشهای بخصوص جدا گردیده و توالی نوکلئوتیدی پپتید یا آنتیبادی بیانشده در سطح آنها برای یافتن ساختارهای اولیهی این پپتیدها یا آنتیبادیها مورد آنالیزهای بعدی قرار میگیرند. دلیل موفقیت این تکنیک این است که در ابتدا کتابخانههای متنوع ساخته شده و سپس لیگاندهای[5] پروتئینی موجود در این کتابخانهها که مختص انواع متفاوتی از ماکرومولکولهای هدف هستند با سرعت، جداسازی و تعیین هویت میشوند.
2 باکتریوفاژهای رشتهای
باکتریوفاژها ویروسهایی هستند که میزبان آنها باکتریها میباشند. باکتریوفاژها بر اساس شکل و نوع اسید نوکلئیک به گروههای مختلفی تقسیمبندی میشوند که یکی از مهمترین آنها باکتریوفاژهای رشتهای میباشند. این فاژها گروهی از فاژهای رشته مانند هستند که میزبانهای آنها باکتریهای گرم منفی دارای پلاسمیدF [6] مانند اشرشیا کلای[7] میباشند. برخی از اعضای این خانواده فاژهای M13 ,fd و f1 هستند. این سه نوع باکتریوفاژ رشتهای نسبت به دیگر فاژها بهطور معمول در تکنیک نمایش فاژی بیشتر مورد استفاده قرار میگیرند. ژنوم اعضای این خانواده از یک DNAی تکرشتهای و حلقوی تشکیلشده است که شامل 11 ژن است که بر اساس عملکرد به سه گروه تقسیم میشوند؛ گروه اول شامل ژنهایی است که پروتئینهای کپسید[8] (پوشش فاژ) را کد میکنند مانند پروتئین شمارهی 3(pIII)، pVI، pVII، pVIII و pIX. گروه دوم ژنهایی هستند که پروتئینهایی را کد میکنند که مسئول تکثیر DNAی فاژ میباشند مانند pII، pV و pX و ژنهای گروه سوم نیز پروتئینهای pI، pIV و pXI که مسئول سرهم کردن قطعات فاژی بوده و تولید یک فاژ بالغ را کد میکنند.
باکتریوفاژهای رشتهای دارای یک چرخهی زندگی غیرلایتیک میباشند، بدینصورت که باکتریهای آلودهشده توسط این فاژها در طی چرخههای زندگی و عفونت فاژی کشته نمیشوند بلکه فاژها بهطور مداوم از این باکتریها آزاد میشوند. ذکر این نکته ضروری است که این چرخهی زندگی از چرخههای زندگی لایتیک و لیزوژنیک که در طی عفونت با دیگر باکتریوفاژها دیده میشود، متفاوت است. در موارد محدودی از فاژهای دیگری مانند لامبدا، T4 و T7 نیز در تکنیک نمایش فاژی استفاده شده است.
3 پروتئینهای پوششی فاژ رشتهای
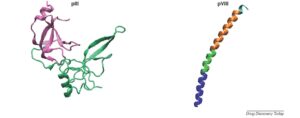
مهمترین پروتئینهای پوششی باکتریوفاژهای رشتهای که در تکنیک نمایش فاژی مورد استفاده قرار میگیرند pIII و pVIII میباشند. pVIII بهعنوان پروتئین پوششی اصلی (major) فاژ رشتهای محصول ژن شمارهی 8 است که تقریباً از 50 اسیدآمینه ساخته شده است و حدود 3000 کپی از آن در هر باکتریوفاژ رشتهای یافت میشود. pIII یکی از پروتئینهای کوچک (minor) پوششی فاژ است که از حدود 406 اسیدآمینه ساخته شده است و در هر فاژ تعداد 3 تا 5 کپی از آن وجود دارد. این پروتئین همچنین مسئولیت شناسایی پیلی باکتری در هنگام اتصال اولیه به باکتری و شروع آلودگی را برعهده دارد. کاربرد pIII در تکنیک نمایش فاژی بهمراتب بیشتر از pVIII است زیرا pVIII برای اینکه کارایی لازم را داشته باشد باید فقط در کنار پپتیدهای کوتاه (6 تا 7 اسیدآمینه) که محتوی اسیدآمینه سیستئین نیز نباشند بیان شود که یکی از دلایل آن تعداد زیاد pVIII و ممانعت فضایی در سطح فاژ میباشد. شکل 1 ساختار این دو پروتئین را نشان میدهد.
شکل 1: ساختار دو پروتئین مهم پوششی یک فاژ رشتهای
4 پارامترهای انتخاب حامل[9] برای تکنیک نمایش فاژی
در مهندسی ژنتیک و کلونینگ[10]، حامل بطور کلی قطعهای از DNA است که برای انتقال یک قطعه DNAی خارجی به داخل یک سلول استفاده میشود. حاملهایی که در تکنیک نمایش فاژی بکاربرده میشوند بر طبق پارامترهای زیر طبقهبندی میشوند.
- نوع پروتئین پوششی مورد استفاده (pIII یا pVIII)
- پپتید یا پروتئین بیانشده به همه یا قسمتی از پروتئین پوششی فاژ اتصال دارد.
- قطعهی DNAی الحاق شده به داخل ژنوم فاژ، توسط ژنوم اصلی فاژ کد میشود یا توسط یک ژنوم دیگر (مانند فاژمید[11]) در داخل سیتوپلاسم باکتری کد میشود.
- فاژمید: پلاسمیدی است که علاوه بر منشأ همانندسازی باکتریایی، دارای منشأ همانندسازی فاژ نیز هست. در ادامه در این مورد توضیح بیشتری داده خواهد شد.
5 کاربردهای تکنیک نمایش فاژی
بطورکلی برخی از کاربردهای تکنیک نمایش فاژی عبارتند از:
- مطالعه تعاملات پروتئین با پروتئین و یا پروتئین با DNA
- شناسایی لیگاندها برای رسپتورهای خاص آنها
- شناسایی مهارکنندههای آنزیمی
- غربالگری بیان DNAهای مکمل (cDNA)
- شناسایی و تعیین نقشهی اپیتوپی[12] آنتیبادیها
- شناسایی پپتیدهایی که اختصاصی یک بافت یا ارگان خاص میباشند.
- تولید ایمونوژنها برای تهیهی واکسنها
- استفاده در کروماتوگرافی میل ترکیبی
- یکی از مهمترین کاربردهای این تکنیک تولید آنتیبادیهای مونوکلونال با منشأ کاملاً انسانی است.
مراحل اصلی تکنیک نمایش فاژی همراه با تولید قطعات آنتیبادی در سطح فاژ در بخشهای بعدی بهصورت مختصر توضیح داده خواهد شد.
6 نمایش فاژی آنتیبادی
6-1 آنتیبادیهای مونوکلونال
این آنتیبادیها قادر به شناسایی یک شاخص آنتیژنی از بین دستهای از آنتیژنها میباشند و به همین دلیل کارایی زیادی در تشخیص و درمان بیماریها دارند. با این وجود آنتیبادیهای مونوکلونال موجود که دارای تمام قطعات یک مولکول کامل آنتیبادی میباشند و توسط تکنیکهای اولیه و مرسوم مانند تکنولوژی سلولهای هیبریدوما تولید میشوند، ممکن است نتوانند به عللی مانند کارایی پایین ورود به بافت موردنظر و یا تجمع در بافتهای غیراختصاصی بهطور مطلوب مورد استفاده قرار گیرند. علاوه بر این چون منشأ آنتیبادیهای مونوکلونالی که تابهحال مجوز سازمان بینالمللی غذا و دارو (FDA) را کسب کردهاند از موش است، استفاده از این آنتیبادیها باعث برخی واکنشهای ایمونولوژیک در بدن افراد میگردد که خود باعث کاهش کارایی درمان میشود. برای حل این مشکلات استفاده از قطعات آنتیبادی کاملاً انسانی و مهندسیشده مانند قطعهی متغیر تک زنجیره[13] (ScFV)، قطعهی اتصال به آنتیژن[14] (Fab)، آنتیبادی دارای یک دومین[15] (SdAb) و دیگر اشکال قطعات آنتیبادی که در شکل 2 نشان داده شده است مورد توجه فراوان قرار گرفته شده است. یکی از مزیتهای این قطعات مهندسی شده اندازهی کوچک آنها (بین 15 تا 20 کیلو دالتون) است که باعث بهبود ویژگیهای فارماکودینامیک و فارماکوکینتیک آنتیبادیهای مونوکلونال تولید شده بهعنوان یک دارو میشود.
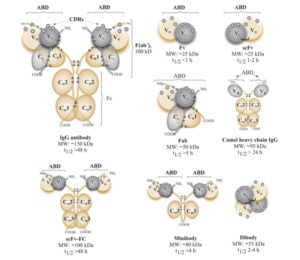
تکنولوژی نمایش فاژی، تولید قطعات آنتیبادی مونوکلونال انسانی را ممکن ساخته است. این تکنیک مهندسی قطعات آنتیبادی مونوکلونال نوترکیب با منشأ انسانی با امکان تعیین ویژگیهای مطلوبی مانند میل ترکیبی، بیان و پایداری را فراهم میسازد. همچنین کتابخانههای آنتیبادی فاژی به منظور تولید قطعات متنوع آنتیبادی و تولید شکل کامل یک آنتیبادی مونوکلونال از این قطعات، تولید آنتیبادیهای چندظرفیتی، کونژوگههای ایمنی[16] مانند ایمونوسایتوکاینها[17]، ایمونوتوکسینها[18] و کونژوگههای آنتیبادی-ایزوتوپ به کار میروند.
6-2 حاملهای نمایش فاژی آنتیبادی
بر اساس پارامترهای بیانشده در قسمت قبلی، حاملهای مورداستفاده برای بیان قطعات آنتیبادی روی سطح فاژ به دو دستهی کلی تقسیم میشوند:
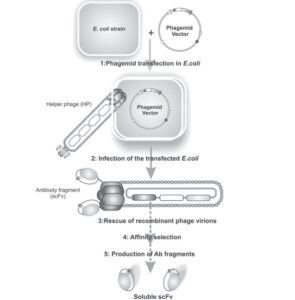
1. حاملهای فاژی: این حاملها شامل کل DNAی فاژ میباشند؛ بدین معنا که این حاملها دارای همهی ژنهای ضروری برای کد کردن و سرهم کردن پروتئینهای پوششی فاژ به همراه قطعهی آنتیبادی مورد نظر میباشند.
2. حاملهای فاژمیدی: این حاملها فقط دارای ژنهای کدکنندهی قطعهی آنتیبادی متصل به یکی از پروتئینهای پوششی فاژ بوده و فاقد ژنهایی است که پروتئینهای مسئول سرهم کردن قطعات فاژی را کد میکنند، به همین دلیل در موارد استفاده از حامل فاژمیدی استفاده از یک فاژ کمکی[19] -که دارای ژنهای کدکنندهی پروتئینهای مسئول سرهم کردن[20] قطعات فاژی که قطعهی آنتیبادی موردنظر نیز به یکی از این قطعات فاژی اتصال دارد- ضروری است.
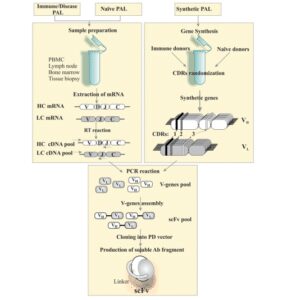
6-3 آمادهسازی کتابخانههای فاژی آنتیبادی
فرآیند نمایش فاژی آنتیبادی با آماده کردن کتابخانههای آنتیبادی آغاز میشود. مراحل تهیهی کتابخانههای آنتیبادی عبارتاند از:
- ابتدا mRNAهای کدکنندهی زنجیرههای سبک و سنگین آنتیبادی از منابع گوناگون مثل لنفوسیتهای خون محیطی و یا بافتهای لنفوئیدی استخراج میشوند.
- این mRNAها با استفاده از تکنیک RT-PCR به [21] cDNA(DNA ی مکمل) تبدیل میشوند. توجه شود که بسته به نوع قطعهی آنتیبادی تولیدی طراحی پرایمر متفاوت میباشد.
- cDNAهای مربوط به قطعات سبک و سنگین آنتیبادی که از مرحلهی قبل بدست آمدهاند با استفاده از تکنیک PCR تکثیر داده میشوند تا مقادیر زیادی از این قطعات کد کنندهی آنتیبادی برای مراحل بعدی فرآیند به دست آید. علاوه بر این توسط تکنیکهای مختلفی در توالی cDNAهای کدکنندهی قطعات آنتیبادی تنوع ایجاد میشود تا تنوع قطعات و درنتیجه گوناگونی در شناسایی انواع مختلف آنتیژن افزایش یابد.
- با توجه به نوع قطعهی آنتیبادی موردنظر که قرار است در سطح فاژ بیان شود، ژنهای تولیدکنندهی قطعات مختلف آنتیبادی توسط قطعات DNAی اتصالدهنده[22] به یکدیگر متصل میشوند؛ به عنوان مثال برای تولید قطعهی ScFV، cDNAی مربوط به ژن کدکنندهی منطقهی متغیر زنجیرهی سنگین (VH) به cDNAی مربوط به ژن کدکنندهی منطقهی متغیر زنجیرهی سبک (VL) توسط یک اتصالدهنده به یکدیگر متصل میشوند.
- cDNAهای مربوط به قطعات آنتیبادی در حامل موردنظر در کنار توالی مربوط به یکی از پروتئینهای پوششی فاژ وارد میشود.
- حامل موردنظر به یک میزبان باکتریایی وارد شده و در این میزبان تکثیر مییابد، درنتیجه قطعهی آنتیبادی موردنظر در کنار پروتئین پوششی فاژ در سطح فاژ ظاهر میشود. در این مرحله قطعات آنتیبادی با توالیهای اسیدآمینهای متفاوت و در مقادیر بسیار زیاد در سطح ذرات فاژ تولید شدهاند که تشکیل یک کتابخانهی فاژی آنتیبادی را میدهند. شکل 3 مراحل ایجاد یک کتابخانه فاژی آنتیبادی و تولید یک قطعهی ScFV را بهصورت شماتیک نشان میدهد. همچنین شکل 4 مراحل اصلی نمایش فاژی آنتیبادی با استفاده از یک حامل فاژمیدی را نشان میدهد.
شکل 3: مراحل ایجاد یک کتابخانه فاژی آنتیبادی و تولید یک قطعهی خاص آنتیبادی
شکل 4: مراحل اصلی تکنیک نمایش فاژی آنتیبادی با استفاده از یک حامل فاژی
6-4 جدا کردن و خالص کردن فاژهای دارای قطعات آنتیبادی خاص
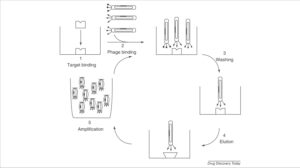
با توجه به اینکه یک کتابخانهی فاژی آنتیبادی دارای ذرات فاژی متعددی است که هرکدام یک قطعهی آنتیبادی با توالی اسیدآمینهای خاص را دارا میباشند، لازم است که فاژهای دارای قطعات آنتیبادی خاص که مکمل آنتیژنهای موردنظر میباشند شناسایی و تخلیص شده و بهصورت جداگانه تکثیر شوند تا بهمرور یک کلون از فاژهای کاملاً خالص که دارای یک قطعه آنتیبادی خاص یک آنتیژن است به دست آید. این کار از طریق یک فرآیند چندمرحلهای به نام Biopanning انجام میشود که شامل 3 تا 5 مرتبه تکرار مراحل زیر است:
- آنتیژنهای هدف موردنظر روی یک سطح مناسب ثابت میشوند. این آنتیژنها میتوانند پروتئینهای خالصشده، پپتیدهای سنتتیک، بافت و یا سلولهای خاصی باشند.
- کتابخانهی فاژی به آنتیژنهای ثابت شده اضافه میشود و اجازه داده میشود تا فاژهای دارای قطعات آنتیبادی خاص به آنتیژن مکمل خود اتصال پیدا کنند.
- شستشوی فاژهای اتصال نیافته و خارج کردن آنها از محیط
- جدا کردن[23] فاژهای اتصال یافته به آنتیژنهای موردنظر
- تکثیر فاژهای دارای قطعهی آنتیبادی متصل شده به آنتیژنهای موردنظر در همان حامل باکتریایی که برای تولید کتابخانههای فاژی استفاده شد و ایجاد کلونهایی که فقط دارای یک نوع خاص قطعهی آنتیبادی هستند. در انتها توالی نوکلئوتیدی کدکنندهی قطعات آنتیبادی خالصشده، توالییابی شده و آنالیز میگردند تا اطلاعات بیشتری در مورد نوع آنتیژنهای شناساییشده توسط این قطعات آنتیبادی به دست آید. مراحل مختلف Biopanning در شکل 5 نشان داده شده است. برای تولید قطعات آنتیبادی محلول که به فاژ متصل نیستند از یک سری تکنیکهای خاص استفاده میشود تا قطعهی خالص آنتیبادی جدا گردد. این قطعات خالص آنتیبادی بعداً برای تولید آنتیبادیهای مونوکلونال با منشأ کاملاً انسانی که دارای تمام قطعات یک مولکول آنتیبادی است بکار میروند.
6-5 دستاوردهای تکنیک نمایش فاژی آنتیبادی
کتابخانههای فاژی آنتیبادی بهطور وسیعی برای انتخاب آنتیبادیهای مونوکلونال علیه انواع آنتیژنهای مختلف توموری بافتی استفاده شدهاند. در حال حاضر فقط تعداد کمی آنتیبادی مونوکلونال حاصل از تکنیک نمایش فاژی در حال استفاده در تشخیص و درمان بیماریها هستند. همچنین تعداد زیادی آنتیبادی مونوکلونال نیز در مراحل مختلف آزمایشات بالینی[24] هستند تا در آینده کاربردهای بالینی آنها اثبات شود. جدول زیر نمونههایی از آنتیبادیهای مونوکلونال تولید شده با روش نمایش فاژی آنتیبادی و کاربرد هرکدام در بدخیمی مربوط به آن را نشان میدهد.
7 نتیجهگیری
تکنیک نمایش فاژی آنتیبادی در حال حاضر به یکی از اصلیترین روشهای تولید آنتیبادیهای مونوکلونال انسانی با هدف تشخیص و درمان تبدیل شده است. تلفیق روشهای نمایش فاژی با تکنولوژیهای در سطح میکرو و نانو منجر به ایجاد روشهای «آزمایشگاه روی چیپ»[25] میشود که باعث انقلابی در روشهای تشخیص و غربالگری با سرعت و کارایی بالاتر خواهد شد. همچنین ترکیب روش نمایش فاژی با روشهایی مانند «توالییابی نسل بعدی»[26] و یا پروتئومیکس[27] ممکن است بهعنوان ابزارهای قدرتمند برای شناسایی پاسخهای سرمی خاص نسبت به آنتیژنها در آیندهای نزدیک شناخته شود.
منابع:
- Aizhi Zhao et al. (2014). Phage antibody display libraries: a powerful antibody discovery platform for immunotherapy. Crit Rev Biotechnol. Early Online: 1–14
- Maryam Hamzeh-Mivehroud et al. (2013). Phage display as a technology delivering on the promise of peptide drug discovey. Drug discovery today.
- Justyna Bazan et al. (2012). Phage display—a powerful technique for immunotherapy. human Vaccines & Immunotherapeutics 8:12, 1817–1828.
- Mohammad Reza Tohidkia et al. (2012). Molecular considerations for development of phag antibody libraries. Journal of Drug Targeting, 2012; 20(3): 195–208
- Christoph M. Hammers et al. (2013). Antibody Phage Display: Technique and Applications. Journal of Investigative Dermatology.
3.filamentous Bacteriophages
- Phage libraries
4.Capsid
1.Single chain variable fragment
2.fragment antigenbinding
3.Single domain antibody
- Immunocytokines
- Immunotoxins
- Assemble
متدهای کونژوگاسیون آنتیبادیها و مصارف درمانی آنتیبادیهای کونژوگه شده
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام