افینیتی پروتئینها و افیبادیها
نازیلا آریایی
دانشجوی دکترای تخصصی ایمونولوژی، مرکز تحقیقات آلرژی دانشگاه علوم پزشکی مشهد
چکیده
بسیاری از پروتئینها بطور طبیعی و بهصورت ذاتی توانایی اتصال اختصاصی داشته که آنها را افینیتی پروتئینهای طبیعی مینامیم و از جمله آنها میتوان به آنتیبادیها اشاره کرد. علیرغم استفاده وسیع از آنتیبادیها در حوزههای مختلف، مشکلات بسیاری در این زمینه وجود دارد که منجر به طراحی و تولید افینیتی پروتئینهای مهندسیشده، گردیده است. متداولترین و پرکاربردترین افینیتی پروتئین مهندسیشده، افیبادی است. ساختار افیبادی مبتنی بر پروتئین A استافیلوکوکی است که B دومین نامیده میشود و پس از تغییراتی در ساختار و افینیتی طبیعی آن، به نام Z دومین تغییر یافته و بهعنوان اسکفلد در ساختار افیبادی مورد استفاده قرار میگیرد. این اسکفلد ساختار تریپل آلفا هلیکسی دارد و در سیستمهای مبتنی بر سلول و یا در کتابخانههای فاژی تولید میگردد. تاکنون افیبادیهای مختلفی طراحی شده که در درمان یا تشخیص، imaging و بیوتکنولوژی به شکلهای مختلف مورد استفاده قرار گرفتهاند.
مقدمه
Affinity proteins اصطلاحی است برای پروتئینهایی که بهواسطه مهندسی پروتئین تولید شده و توانایی اتصال اختصاصی به بیوملکولهای متفاوت و شناسایی آنها را دارا هستند.
در طبیعت افینیتی پروتئینهای بسیاری بهصورت طبیعی وجود دارند که معروفترین آنها آنتیبادیها بوده که در تحقیقات بیولوژیک، بیوتکنولوژی و درمانی کاربردهای بسیاری دارند، ولی استفاده از آنتیبادیها دارای معایبی است که میتوان به تحریک پاسخهای ایمنی میزبان علیه آنتیبادی مورد استفاده، پیچیده و پرهزینه بودن تولید آنتیبادی و کاهش نفوذ بافتی به علت سایز بزرگ این ملکول اشاره کرد.
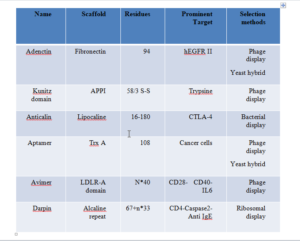
به علت محدودیتهای استفاده از آنتیبادی، محققان ساخت افینیتی پروتئینهای مهندسیشده که مناطق ثابت آنتیبادی در آنها حذف شده را آغاز کردند. برخی از افینیتی پروتئینهای مهندسیشده معروف که طی سالهای اخیر موضوع تحقیق بوده و برخی از آنها در بازار ارائه شده است در جدول شماره 1 لیست شده است.
جدول 1- برخی از افینیتی پروتئینهای مهندسیشده، اسکفلد مورد استفاده در آنها، تعداد آمینواسیدها، مهمترین محصولات و روش اصلی تولید آنها
انواع گوناگونی از اسکفلدها با ریشهی غیرایمنوگلبولینی ایجاد میشوند که یکی از آنها افیبادی نام دارد. افیبادیها از یک دومن پروتئینی 58 اسیدامینهای مشتق از پروتئین A استافیلوکوک (SPA) مشتق شدهاند. SPA متشکل از 5 دومن همولوگ متصلشونده به ایمنوگلبولین است که همگی آنها قدرت اتصال به ناحیه FC آنتیبادیهای مختلف و Fab آنتیبادیهای سابکلاس VH3 انسانی را دارا میباشند. محققان با ایجاد موتاسیون در دومن B و تغییر دو اسیدامینه (گلایسن 29 به آلانین و آلانین 1 به والین) دومن جدیدی بنام دومن Z ایجاد کردند که با افینیتی در حدود 60- 10 نانومولار به FC- IgG1 انسانی وصل شده ولی قدرت اتصالی آن به ناحیه Fab VH3 انسانی نسبت به دومن B کاهش یافته بود. در گام بعدی، ساختار دومن Z با استفاده از NMR spectroscopy بررسی شد و مشخص گردید که این دومن از 3 زنجیر آلفا هلیکس آنتیپارالل تشکیل شده است. در نهایت دومن Z پایهای برای ساخت افیبادیها مورد استفاده قرار گرفت.
خصوصیات افیبادیها
افیبادیها خصوصیاتی مانند دمای ذوب بالا، پایداری زیاد بدون وابستگی به باندهای دیسولفیدی، بزرگ بودن سطح اتصال به هدف تقریباً مشابه با آنتیبادیها، تولید در مقیاس زیاد با استفاده از E.coli، فولدینگ کوتاه و سریع، دارا بودن یک سیستئین جهت نشاندار کردن یا اعمال سایر تغییرات شیمیایی و قابلیت تولید در میزبانهای مختلف را دارا میباشند.
ساخت افیبادی
افیبادیهای مختلف با استفاده از combinatorial library و selection ساخته شده که شامل فرایندهای زیر میباشد:
- ساخت کتابخانه
- Screening افیبادیهایی که به تارگت موردنظر متصل شدهاند.
- Amplification یا تکثیر افیبادیها
- شناسایی دقیق افیبادیهای انتخاب و تکثیر شده
تولید کتابخانههای ملکولی افیبادی با استفاده از combinatorial randomization، 13 اسیدامینه در هلیکس 1 و 2 بوده که در واقع این اسیدامینهها مسئول اتصال دومن Z به FC میباشند.
روشهای تولید افیبادی
1) Cell-dependent display systems
مزیت این روش در استفاده از مواد فلوسیتومتری و Flow cytometry sorting در محله Screening و قدرت افتراق بین افینیتیهای مختلف در مرحله Selection بوده، اما ساخت کتابخانههای بزرگ با این روش مقدور نیست.
2) Cell-free methods
این روش دارای دو مزیت است؛ اول اینکه برای ساخت کتابخانه در این روش، نیاز به مرحلهی ترانسفورمیشن نیست؛ و دوم، توانایی ساخت کتابخانههای بزرگ با این روش وجود دارد.
3) Non-display systems (PCA)
Protein complementation assay، بطور معمول برای واکنش پروتئین– پروتئین بکار میرود. فرق این روش با بقیه روشها در بیان شدن ملکول هدف در سلولی است که حاوی افیبادی مخصوص هدف نیز میباشد، اما محدودیت این روش در عدم کنترل روی غلظت افینیتی پروتئین و تارگت پروتئینی درونسلولی میباشد که باعث نامناسب شدن این تکنیک برای affinity maturation میشود.
Phage display
این تکنیک در گروه Cell-dependent display systems قرار میگیرد و رایجترین تکنیک برای ساخت افیبادی میباشد. در این روش ژن کدکننده پروتئین موردنظر به یکی از ژنهای تولیدکننده پروتئینهای پوششی فاژهایی چون M13 ,T4 ,T7 ,lambda اتصال مییابد که رایجترین این فاژها M13 میباشد و از بین پروتئینهای پوششی آن، ژن پروتئینهای پوششی 3 و 8 (PIII, PVIII) غالباً مورد استفاده قرار میگیرد.
مرحله بعد از ساخت کتابخانه، جداسازی فاژ موردنظر با استفاده از paning میباشد که در این پروسه فاژهای ایجادشده با پروتئینهای هدف که روی solid phase مثل بیدهای پارامگنتیک یا پلیتهای microtiter ثابت شدهاند و یا بهصورت محلول (تارگت بیوتینیله بعد از اتصال به فاژ به سطح حاوی استرپتاویدین متصل میشود) موجود هستند، انکوبه شده و فاژ مدنظر جداسازی، سپس تکثیر شده و با استفاده از سیکوئنسینگ تعیین توالی میگردد. افینیتی افیبادیهایی که تا به امروز تولید شدهاند در حد میکرومولار تا پیکومولار میباشند.
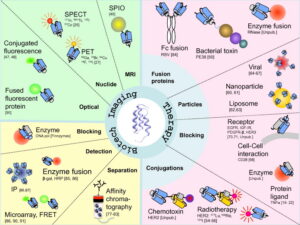
کاربردهای افیبادیها
افیبادیها در بین افینیتی پروتئینهای مهندسیشده بیشترین کاربرد را دارند، برخی از این کاربردها در شکل یک آمده و در ادامه به تفصیل توضیح داده خواهد شد.
تصویر 1- کاربردهای مختلف افیبادی
Imaging
تصویربرداری در تشخیص سریع بیماریهای مختلف از اختلالات استخوانی و توبرکلوزیس ریه تا سرطانهای مختلف نقش بسزایی دارد. یک ماده مناسب برای تصویربرداری باید دارای خصوصیاتی از قبیل اختصاصیت و افینیتی بالا برای هدف، نفوذ بافتی سریع و کلیرنس سریع باقیماندههای آزاد از خون باشد.
روشهای تشخیصی که میتوان از افیبادی بهعنوان یک ماده Imaging استفاده کرد عبارتند از:
CT، MRI،PET ،SPECT ، فلوسیتومتری و … که افیبادی به مواد مختلفی مثل اتمهای رادیواکتیو یا مواد فلورسنت متصل میشود و در این تکنیکها برای تشخیص مورد استفاده قرار میگیرد.
کاربردهای درمانی
1) ایمنوتوکسینها: هیبریدهای پروتئینی هستند که از یک جزء شناساییکننده هدف مثل قطعات آنتیبادی، افیبادی و یک بخش توکسینی تشکیل شدهاند. معروفترین و متداولترین آنها اگزوتوکسین سودوموناس آئروجینوزا است که پس از کوتاه شدن به نام P38 و بهصورت یک افیبادی درمانی مؤثر برای درمان سرطان علیه فاکتور HER2 مورد استفاده قرار گرفته است.
2) لیپوزومها: برای رساندن مقدار زیادی از دارو به یک مکان خاص میتوان آنها را درون یک لیپوزوم قرار داده و به داخل بدن تزریق کرد، اما برای اینکه رسیدن دارو به محل موردنظر بهصورت اختصاصی صورت گیرد روشهای متفاوتی وجود دارد که یکی از آنها استفاده از افیبادی اختصاصی بافت هدف، بهصورت متصل به لیپوزوم میباشد.
3) ذرات ویروسی: ادنوویروسها در درمان سرطان افق وسیعی داشته، اما پاسخ ایمنی بدن به آنها تابحال مانع گسترش آن بهعنوان یک روش رایج در درمان گردیده است. به کمک افیبادیها و ایجاد موتاسیون در ژنهای اتصالی آنها به بافت نرمال، توانایی ویروس برای اتصال به این بافتها حذف شده و در ادامه برای اتصال اختصاصی این ویروسها به بافت هدف، ژن افیبادی اختصاصی برای هدف موردنظر را به ژن پروتئینهای کپسید ویروسی متصل میسازند.
4) کاربرد در بلاکینگ: افیبادیها قادر هستند اهداف مختلفی مثل ملکولهای کواستیمولیتوری (CD28)، رسپتورهای سطح سلولی (CD25، IGFR، EGFR، HER3) و پروتئینهای محلولی چون TNFα را در جهت اهداف درمانی Block سازند.
بطور کلی مزیت استفاده از افیبادی نسبت به آنتیبادی در درمان، هدف قرار دادن ملکولهایی مثل پروتئینهای درونسلولی است که از دسترس آنتیبادیها دور هستند، و از معایب افیبادی میتوان به نیمهعمر کوتاه (30 دقیقه) و حذف سریع این ملکول از طریق کلیه اشاره کرد. اخیراً برای رفع این مشکل، یک دومن متصل شونده به آلبومین را به این ملکول fuse کرده که در نهایت باعث اتصال افیبادی به آلبومین سرم و افزایش نیمهعمر این ملکول میشود.
کاربردهای بیوتکنولوژی
1) افینیتی کروماتوگرافی: افیبادیها بهعنوان لیگانــــدهایی برای تخلیص مواد مختلفی مثل: IgG، Taq polymerase و فاکتور 8 نوترکیب در ستونهای کروماتوگرافی مورد استفاده قرارگرفتهاند.
2) وسترن بلات، الایزا، فلوسایتومتری، کنفوکال میکروسکوپی و ایمنوهیستوشیمی: در این تکنیکها افیبادی جایگزین آنتیبادی تشخیصی برای هدف موردنظر شده است. در این تکنیکها از افیبادی که با ملکولهای رنگی فلورسنس یا غیرفلورسنس نشاندار شده، برای تشخیص تارگت موردنظر استفاده میشود.
3) Protein micro-array: افیبادی بهعنوان capture agent استفاده میشود. استفاده از افیبادی بجای آنتیبادی، باعث بالارفتن حساسیت تست میگردد که به دو دلیل صورت میگیرد:
اول، سایز کوچک افیبادی باعث کاهش اتصالات غیراختصاصی و کاهش Background signal میشود و دوم به علت اندازه افیبادی در مقایسه با آنتیبادی، مقدار بیشتری از این ماده را بهعنوان capture agent میتوان استفاده کرد که در نهایت باعث افزایش حساسیت تست میشود.
4) Fluorescence-based assays: تکنیکهایی مثل فلوسیتومتری و Immunofluorescent confocal microscopy را شامل میشود.
5) Hot Start PCR: در این تکنیک از یک افیبادی اختصاصی DNA پلیمراز استفاده میشود که در حرارت معمولی به DNA پلیمراز متصل شده و فقط بعد از ایجاد یک درجه حرارت خاص از DNA پلیمراز جدا شده و PCR انجام میشود.
منابع:
- Gebauer, M. and A. Skerra (2009). “Engineered protein scaffolds as next-generation antibody therapeutics.” Current opinion in chemical biology 13(3): 245-255.
- Grönwall, C. (2008). Affibody molecules for proteomic and therapeutic applications, Uppsala University.
- Grönwall, C. and S. Ståhl (2009). “Engineered affinity proteins—Generation and applications.” Journal of biotechnology 140(3): 254-269.
- Högbom, M. M. Eklund, et al. (2003). “Structural basis for recognition by an in vitro evolved affibody.” Proceedings of the National Academy of Sciences 100(6): 3191-3196.
- Löfblom, J. J. Feldwisch, et al. (2010). “Affibody molecules: engineered proteins for therapeutic, diagnostic and biotechnological applications.” Febs Letters 584(12): 2670-2680.
- Nygren, P. Å. (2008). “Alternative binding proteins: Affibody binding proteins developed from a small three‐helix bundle scaffold.” Febs Journal 275(11): 2668-2676.
Nanobodies تعریف، تولید و کاربرد در پزشکی
فیوژن پروتئینها با پایه آنتیبادی (Fc-Fusion Proteins)
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام