فیوژن پروتئینها با پایه آنتیبادی (Fc-Fusion Proteins)
کاربردهای درمانی و تشخیصی
دکتر رضا جعفری1، دکتر نعیمه مجیدی ذوالبنین 1
1-مرکز تولید آنتیبادیهای منوکلونال، مرکز تحقیقات ایمونولوژی، دانشگاه علوم پزشکی تبریز
مقدمه
فیوژن پروتئینهای حاوی Fc از دامین Fc ایمونوگلوبین تشکیل شده که به طور مستقیم به پپتید دیگر متصل شدهاند. قسمت پروتئینی میتواند هر مولکول پروتئینی دلخواه باشد، مثلاً لیگاندی که به یک رسپتور سطح سلول متصل شده و آن را فعال میکند یا یک آنتیژن پپتیدی برعلیه یک پاتوژن درگیرکننده و یا یک پروتئین طعمه برای تشخیص پارتنرهای اتصالی مجتمع در یک میکرواری پروتئین باشد. با این وجود، کاربرد غالب پارتنرهای فیوز شده، پتانسیل درمانی داشته و به دامین Fc متصل شدهاند تا خواص مفید بیولوژیک و فارماکولوژیک داشته باشند. مهمترین ویژگی حضور دامین Fc، افزایش چشمگیر نیمه عمر پلاسمائی دارو میباشد که از طریق اتصال با گیرنده FcRn فعالیت درمانی دارو را افزایش میدهد. همچنین وجود دامین Fc موجب تعامل این مولکولها با رسپتورهای FcRn موجود در سطح سلولهای ایمنی میشود که در استفاده از آنها برای درمان انکولوژیک و نیز واکسنها حائز اهمیت است.
از منظر بیوفیزیک، دامین Fc بطور مستقل دچار فولدینگ شده و موجب افزایش قابلیت حل شدن و پایداری مولکول پارتنر میشود ولی از نظر تکنولوژیک، وجود ناحیه Fc موجب خالصسازی مقرون به صرفه از طریق کروماتوگرافی افینیتی پروتئین G/A در طی تولید دارو میشود. در مجموع، اکثر فیوژن پروتئینها بصورت همودایمر بیان شده و امروزه با ایجاد تغییرات بصورت کمپلکسهای حاوی 12 پارتنر فیوز شده، پلیمریزه میشوند. از اینرو، با افزایش اویدیتی دارو بر اهمیت هرچه بیشتر آنها افزوده شده است. بیشترین اهمیت فیوژن پروتئینهای حاوی Fc در زمینه کاربردهای درمانی آن میباشد ولی در ارتباط با واکسنها و میکرواری نقش آنها غیرقابل چشمپوشی است.
1- فیوژن پروتئینهای حاوی Fc با خاصیت درمانی
تا پایان سال 2011 شش داروی فیوژن پروتئین در بازار موجود بودند و چهار نوع در کارآزمائیهای بالینی فاز 3 و تعداد زیادی در مراحل پرهکلینیکال در حال اخذ تأئید از FDA میباشند. از منظر تجاری، فیوژن پروتئینهای حاوی Fc در کنار mAbها در مجموع 43% از محصولات پروتئینی درمانی مورد استفاده را به خود اختصاص دادهاند. اهمیت جهانی فیوژن پروتئین حاوی Fc حتی در برخی از موارد از نظر تجاری بیشتر از آنتیبادیهای مونوکلونال است، به طور مثال فروش سالانه فیوژن پروتئین etanercept در سال 2010 در حدود 7/3 بیلیون دلار بوده در حالیکه فروش سالانه bevacizumab موفقترین آنتیبادی مونوکلونال درمانی در حدود 6/9 بیلیون دلار بوده است.
با چنین موفقیتهایی، فیوژن پروتئینهای حاوی Fc، 20% محصولات با پایه آنتیبادی مورد تأئید FDA را به خود اختصاص میدهد، مثلاً برخی از این فیوژن پروتئینها نقش آنتاگونیستی دارند یا موجب بلوک رسپتور متصل شونده میشوند، etanercept,aflibercept,rinolacept,belatacept,abatacept از این دسته هستند.
برخی نقش آنتاگونیستی دارند و مستقیماً موجب تحریک عملکرد رسپتور میشوند مثلاً alefacept موجب کاهش فعالیت سیستم ایمنی شده درحالیکه romiplostim فعالیت سیستم ایمنی را افزایش میدهد.
1-1 عملکردهای افکتور
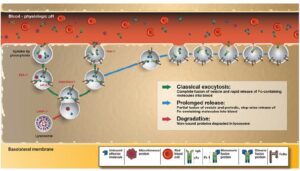
بسیاری از آنتیبادیهای منوکلونال درمانی مانند rituximab, trastuzumab, alemtuzumab از طریق مکانیسمهای ADCC (سایتوتوکسیتی بواسطه آنتیبادی) توسط سلولهای NK، سلولهای توموری را مورد هدف قرار میدهند. این مکانیسم از طریق اتصال IgG1 اختصاصی به FCg3A بر روی NK عمل میکند. این مکانیسمها از طریق سلولهای منوسیت و ماکروفاژ نیز قابل انجام است. در بیمارانی که واریانتهای با افینیتی بالا FCg3A وجود دارد پاسخ به درمان بهتر است.
امروزه با ایجاد تغییرات در توالی آمینواسیدی دامین Fc یا از طریق پیوند N گلیکوزیدی در ناحیه Fc بر پتانسیل درمانی این فیوژن پروتئینها افزودهاند. مکانیسم عملکردی دیگر فیوژن پروتئینها ایجاد آپوپتوز میباشد. یکی دیگر از مکانیسمهای عملکردی آنتیبادیهای مونوکلونال القای سایتوتوکسیسیتی با واسطه کمپلمان (CDC) میباشد ولی سلولهای توموری از طریق تولید پروتئینهای تنظیمی فعالیت CDC آنتیبادیهای مونوکلونال را بطور چشمگیری کاهش میدهند. اکثر فیوژن پروتئینهای دارای Fc فاقد فعالیت CDC هستند که احتمالاً به علت نداشتن ناحیه Fab آنها است.
1-2 کاهش یافتن عملکرد افکتور:
برای برخی از کاربردهای درمانی از فعال شدن کمپلمان FcgR جلوگیری بعمل میآید، مثلاً در خنثی کردن مولکولهای پاتوژن، فعال شدن کمپلمان مطلوب نیست و در این موارد سایتوکاینها و فیوژن پروتئینها مناسبتر میباشند. در حال حاضر، تمام فیوژن پروتئینها مورد استفاده در کلینیک دارای دامین Fc آنتیبادی IgG1 میباشند که میتوانند با افینیتی متوسط تا بالا به FcgRها متصل شوند. با توجه به این نکته، امروزه برای مواردی که حداقل فعالیت افکتور موردنظر میباشد از آنتیبادیهای IgG2 و IgG4 که افینیتی پائینی به رسپتور گاما Fc و رسپتورهای کمپلمان دارند، استفاده میشود. از این دسته آنتیبادیهای مونوکلونال میتوان به denosumab، natalizumab، panitumumab و eculizumab اشاره کرد.
استفاده از دامین Fc آنتیبادیهای IgG2 و IgG4 در فیوژن پروتئینها هنوز در کلینیک استفاده نمیشود، هرچند که نتایج برخی تحقیقات حاکی از نقش مفید درمانی آنها است.در یک مورد، پپتید 1 شبیه گلوکاگون (GLP-1) به IgG2 انسان متصل شده تا از ایمونوژنیتی ناخواسته جلوگیری کند و نشان داده شده است که دارای خواص فارماکولوژیک و درمانی بهتری نسبت به native GLP-1 در مدل موشی دیابت تیپ یک است.
در برخی از موارد برای کاهش عملکرد افکتور یک سیستم افکتور، از فعال شدن خودبخودی یک سیستم افکتور دیگر میتوان بهره برد، مثلاً فعال شدن FceR ماستسلها از طریق فعال شدن خودبخودی رسپتور مهاری FcgR2B کاهش پیدا میکند. از این مکانیسمها میتوان استفاده کرد و از فیوژن پروتئینهای دارای Fc در جهت مهار التهاب و آسم آلرژیک استفاده کرد. امروزه شرکت Bigen-Idec برای درمان آلرژی غذایی شدید اقدام به ساخت و طراحی فیوژن پروتئین دوگانه دارای دامین Fc از IgG1 متصل به دامین Fc از IgE کرده است.
2- بهبود بخشیدن خواص فارماکوکینتیک فیوژنهای دارای Fc
بطورکلی یکی از راههای افزایش اثربخشی فیوژن پروتئینهای حاوی Fc افزایش نیمه عمر پلاسمائی آن میباشد. این کار از طریق اتصال این پروتئینها به گیرنده FcRn صورت میگیرد. محل اتصال IgG به FcRn دامین CH3-CH2 میباشد و موتاسیونهایی که موجب افزایش افینیتی IgG به FcRn در محیط اسیدی (و نه PH خنثی) میشوند، یافته شده است. الحاق چنین موتاسیونهایی به درون mAbهای درمانی (cetuximab و bevacizumab) نه تنها موجب افزایش نیمه عمر آنها در بدن میشود بلکه بطور چشمگیری فعالیت ضدتوموری آنها را افزایش میدهد.
نیمه عمر فیوژن پروتئینهای حاوی Fc معمولاً کمتر از Abهای معمول و دست نخورده است (یک الی دو هفته در مقابل 3 الی 4 هفته) و میتوان انتظار داشت که چنین موتاسیونهایی اثرات بیشتری در افزایش نیمه عمر پلاسمایی فیوژن پروتئینهای حاوی Fc نسبت به آنتیبادیهای مونوکلونال داشته باشد. در برخی موارد اتصال فیوژن پروتئینها به FcRn در تحویل پروتئینهای فعال زیستی (فیوژن پروتئین حاوی Fc و اریتروپوئتین) به سیستم گردش خون یا در برخی موارد دیگر واکسنها دارای اثرات مفید درمانی میباشند.
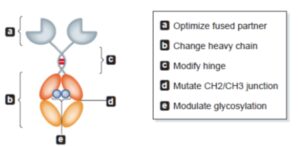
3- بهینهسازی پارتنر اتصالی
درست است که تغییرات در دامین Fc میتواند عملکرد درمانی فیوژن پروتئین را بهبود بخشد ولی باید توجه کرد که ویژگیهای اتصالی پارتنر فیوز شده در فعالیت نهائی فراورده بیولوژیک در کلینیک حائز اهمیت میباشد؛ به عنوان مثال etanercept (فیوژن پروتئین حاوی Fc) و infliximab (آنتیبادی مونوکلونال دست نخورده) هر دو قادر هستند که TNF-a محلول را خنثی کنند ولی فقط infliximab قادر به تحریک پاسخ بالینی در بیماران مبتلا به کرون میباشد، با وجود اینکه هر دو دارو بطور چشمگیری موجب بهبود آرتریت روماتوئید میشوند.
در مقایسهی دو دارو، فقط infliximab قادر است به لنفوسیتهای فعال متصل شده و موجب القای آپوپتوز و فعال کردن کاسپاز 3 شود. این تفاوت در عملکرد احتمالاً به علت تفاوت در افینیتی یا stoichiometry این داروها برای TNF ترانس ممبران است که توسط لنفوسیتهای فعال بیان میشود. از اینرو، شناسایی خواص اتصالی اپتیمال پارتنر اتصالی به رسپتور مورد نظر میتواند مرحله اصلی در توسعه خواص بالینی دارو باشد.
4- پلتفرمهای جدید فیوژن پروتئینهای حاوی Fc برای کاربردهای درمانی
اینکه پروتئین پارتنر بعد از اتصال به Fc خواص بیولوژیکی خود را حفظ میکند یا نه، به فاکتورهای بسیار زیادی وابسته است که مشخص شدن آن برای هر مولکول ضروری است. در برخی موارد برای افزایش اتصال پایدار پارتنر به Fc از پروتئینهای چاپرون استفاده میشود. مثلاً اخیراً چنین کاری را در مورد فیوژن پروتئین TLR4-Fc انجام دادهاند. نگرانی دیگر در مورد فیوژن پروتئینها این است که پروتئین موردنظر چنانچه بصورت فیوژن پروتئینی حاوی Fc با ساختار همودایمریک درآید، آیا با افینیتی کافی به مولکول هدف متصل میشود؟ یک راه برای غلبه بر چنین نگرانی از طریق مهندسی چندین اختصاصیت یا آویدیتی به داخل ساختار فیوژن پروتئین حاوی Fc میباشد.
امروزه استفاده از Fc هترودایمر که حاوی بخشهای آلترناتیو توالیهای CH3 مربوط به IgA و IgG میباشند، در حال گسترش است. اخیراً از همودایمرهای تکراری Fc و به شکل هگزامرهای ستارهای شکل که دارای آویدیتی چندگانه است، برای تولید داروهای غیرایمونولوژیک استفاده میشود که میتواند به 12 مولکول هدف متصل شود.
یکی از بحثهای موجود در مورد آنتیبادیهای پلیمریک مخصوصاً در کاربردهای انکولوژی اندازه بزرگ آنها میباشد که مانع از نفوذ در بافت توموری میشود. با وجود اینکه پلیمرهای طبیعی قدرت نفوذ آهستهتری دارند ولی حتی در صورت تجویز IV و یا IP آنتیبادی IgM دست نخورده به بدن قادر به نفوذ به بافت توموری خواهد بود و امروزه حتی استفاده از کونژوگههای IgM در درمان برخی از تومورها مثل لوسمی سلولهای B که مقادیر زیادی FcqR بیان میکنند، معمول شده است.
نفوذ آهسته و تجمع، خود میتواند یک مزیت برای القای پیام پروآپوپتوتیک قویتر یا سیگنال بقا رسپتورهای سطح سلولی باشد، از اینرو مولکول IgM طبیعی نقش مهمی در کلیرانس سلولهای تغییریافته یا آپوپتوتیک از طریق CDC، مهار التهاب، برداشت پروتئینهای بدتاخورده و تنظیم سلولهای اتوراکتیو B را دارد. همچنین امروزه کونژوگههای دارو-پلیمر بعنوان داروهای نانو در حال پیشرفت است و رهیافتهایی برای افزایش مولتیوالانسی قطعات آنتیبادی درمانی استفاده میشود مانند مینیبادیهای VHH، پروتئینهای ضد HIV با پایه FV تک زنجیرهای یا داربستهای پروتئینی با پایه غیرآنتیبادی. امروزه معتقدند آنتیبادیهای IgE ، IgM و IgA میتوانند جایگزینهای اسکلت IgG در فیوژن پروتئینهای حاوی Fc باشند.
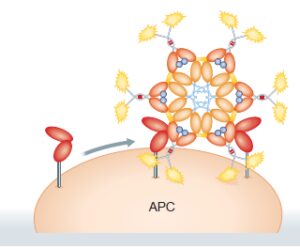
5- فیوژن پروتئینهای حاوی Fc بعنوان واکسن
چون فیوژن پروتئینهای حاوی Fc قادر به اتصال مستقیم به FCRها میباشند، میتوان از آنها به عنوان واکسن استفاده کرد. با وجود اینکه برای استفاده درمانی از این فیوژن پروتئینها تلاش در جهت ارتقا دادن یا مهار کردن اتصال این پروتئینها با دسته خاصی از FCRها میباشد، برای استفاده بعنوان واکسیناسیون تلاش در جهت درک و مشخص کردن نوع FCR هدف موجود بر روی سلولهای عرضه کننده آنتیژن است. از آنجائیکه اکثر سلولهای عرضه کننده آنتیژن فقط FCRهای خاصی را در سطح خود بیان میکنند، دامینهای Fc که به یک یا چند نوع از این رسپتورها متصل میشوند بعنوان حاملهای آنتیژنی مناسب عمل خواهند کرد؛ به عنوان مثال، اکثر زیردستههای سلولهای دندریتیک شامل سلولهای لانگرهانس در پوست (محل عمده تحویل واکسن) رسپتورهای CD16 و CD64 را بیان نمیکنند و لذا فیوژن پروتئینهای حاوی Fc جهت تحویل آنتیژن از طریق FcgRIIA/FcgRIIB عمل میکنند.
از سوی دیگر، برخی یافتهها حاکی از آن است که FcgRهای تحریکی در برخی موارد سیگنالهای مهاری را انتقال میدهند از اینرو استفاده از فیوژن پروتئینهای حاوی Fc بعنوان واکسن نیازمند تبادل بین عملکردهای مهاری و فعال کننده FcgRها میباشد.
اخیراً دو نوع FCRL جدید به نامهای FCRL4 و FCRL5 شناسایی شدهاند که بر روی سطح سلولهای B بالغ بیان شده و رسپتورهای مهاری هستند و به ایمن کمپلکس حاوی IgA و IgG متصل میشوند. توانائی این رسپتورها برای اتصال به آنتیبادیهای کمپلکس در کنار قدرت تنظیم سلول B بیانگر نقش آنها در استفاده بیشتر از فیوژن پروتئینهای حاوی Fc برای مقاصد درمانی و واکسن میباشد. از آنجائیکه IgG1 در مقایسه با IgG3 با کارآئی بهتری به FcgRIIA متصل میشود از IgG1 برای تحویل Ag به سلولهای عرضه کننده در ساختمان فیوژن پروتئینها استفاده میشود. استفاده از دامین Fc مولکول IgG3 از نظر تکنیکی با مشکلاتی همراه است چرا که نسبت به پروتئولیز حساس بوده و نیمه عمر کمتری دارد و موضوع دیگر اینکه وجود آرژینین در موقعیت 435 اکثر آلوتیپهای IgG3 انسانی به طور چشمگیری اثربخشی اتصال به FcRn را کاهش میدهد.
6- کاربردهای غیردرمانی فیوژن پروتئینهای حاوی Fc
از دیگر کاربردهای این پروتئینها میتوان به فلوسایتومتری، ایمونوهیستوشیمی و پروتئین میکرواری اشاره کرد. در چنین مواردی، ناحیه Fc اساساً به عنوان واحدهای مستقل عمل میکند که پروتئینهای مختلف قادر به اتصال به آن بوده و عملکرد خود را حفظ میکنند. در حقیقت، اتصال به دامین Fc موجب افزایش پایداری برخی پروتئینهایی میشود که این پروتئینها جدیداً استخراج شدهاند و در سلولهای پستانداران بیان شده و در جای دیگر قابل تولید نمیباشند. برخی از پروتئینها زمانی که به دامین Fc-IgG1 متصل میشوند عملکرد خود را از دست میدهند. پروتئین Fc-IgG3 دارای ناحیه لولای طویلتری بوده و ممکن است در چنین کاربردهایی استفاده بهتری داشته باشد.
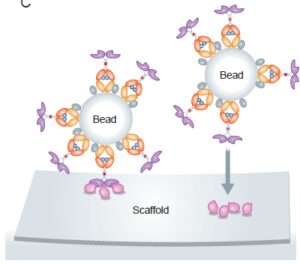
یکی از مزایای این فیوژن پروتئینها در پروتئین میکرواری این است که بسیاری از پروتئینهای متصل شده مختلف میتوانند بطور مستقل به یک سطح جامد متصل شوند، این اتصال از طریق تعامل بین دامین Fc و پروتئین G/A متصل به سطح میباشد. اخیراً در رهیافتهای جدید هدف تعیین تعاملهای پروتئینی با افینیتی کم میباشد. با وجود اینکه تکنیکهای mass spectrometry و yeast-two-hybrid technologies برای بررسی تعاملهای پروتئین-پروتئین بسیار مفید است ولی به علت ناتوانی در تشخیص اتصالات با افینیتی پائین، امروزه از پروتئینهای فیوژن حاوی Fc استفاده میشود. برای افزایش قدرت تشخیص تعاملهای با افینیتی کم از داربستهای کمپلکس مولتیوالانت حاوی فیوژن پروتئینهای دارای Fc نظیر میکروبیدهای پروتئین G/A استفاده میشود.
منابع:
- Adachi T, Harumiya S, Takematsu H, Kozutsumi Y, Wabl M, Fujimoto M,Tedder TF (2011) CD22 serves as a receptor for soluble IgM. Eur J Immunol42: 241-247
- Ammann JU, Jahnke M, Dyson MR, Kaufman J, Trowsdale J (2012) Detection of weak receptor-ligand interactions using IgM and J-chain-based fusion
- Bajtay Z, Csomor E, Sandor N, Erdei A (2006) Expression and role of Fc- and complement-receptors on human dendritic cells. Immunol Lett 104: 46-52
- Bakema JE, van Egmond M (2011a) The human immunoglobulin A Fc receptor FcalphaRI: a multifaceted regulator of mucosal immunity. Mucosal
Immunol 4: 612-624
- Bakema JE, van Egmond M (2011b) Immunoglobulin A: a next generation of therapeutic antibodies? MAbs 3: 352-361
- Baker K, Qiao SW, Kuo TT, Aveson VG, Platzer B, Andersen JT, Sandlie I, Chen Z, de Haar C, Lencer WI, et al (2011) Neonatal Fc receptor for IgG (FcRn) regulates cross-presentation of IgG immune complexes by CD8-CD11b dendritic cells. Proc Natl Acad Sci USA 108: 9927-9932
- Beck A, Reichert JM (2011) Therapeutic Fc-fusion proteins and peptides as successful alternatives to antibodies. MAbs 3: 415-416
- Bitonti AJ, Dumont JA, Low SC, Peters RT, Kropp KE, Palombella VJ, Stattel JM, Lu Y, Tan CA, Song JJ, et al (2004) Pulmonary delivery of an erythropoietin Fc fusion protein in non-human primates through an immunoglobulin transport pathway. Proc Natl Acad Sci USA 101: 9763-9768
- Bruhns P, Iannascoli B, England P, Mancardi DA, Fernandez N, Jorieux S, Daeron M (2009) Specificity and affinity of human Fcgamma receptors
and their polymorphic variants for human IgG subclasses. Blood 113: 3716-3725
- Capon DJ, Chamow SM, Mordenti J,Marsters SA, Gregory T,Mitsuya H, Byrn RA,Lucas C, Wurm FM, Groopman JE, et al (1989) Designing CD4
immunoadhesins for AIDS therapy. Nature 337: 525-531
- Carter PJ (2011) Introduction to current and future protein therapeutics: a protein engineering perspective. Exp Cell Res 317: 1261-1269
- Davis JH, Aperlo C, Li Y, Kurosawa E, Lan Y, Lo KM, Huston JS (2010) SEEDbodies: fusion proteins based on strand-exchange engineered domain
(SEED) CH3 heterodimers in an Fc analogue platform for asymmetric binders or immunofusions and bispecific antibodies. Protein Eng Des Sel 23:
195-202
- Flanagan ML, Arias RS, Hu P, Khawli LA, Epstein AL (2007) Soluble Fc fusion proteins for biomedical research. Methods Mol Biol 378: 33-52
- Huang C (2009) Receptor-Fc fusion therapeutics, traps, and MIMETIBODY technology. Curr Opin Biotechnol 20: 692-699
- Jefferis R (2007) Antibody therapeutics: isotype and glycoform selection. Expert Opin Biol Ther 7: 1401-1413
- Jefferis R (2009) Glycosylation as a strategy to improve antibody-based therapeutics. Nat Rev Drug Discov 8: 226-234
- Lofblom J, Frejd FY, Stahl S (2011) Non-immunoglobulin based protein scaffolds. Curr Opin Biotechnol 22: 843-848
- Nelson AL (2010) Antibody fragments: hope and hype. MAbs 2: 77-83
- Nelson AL, Reichert JM (2009) Development trends for therapeutic antibody fragments. Nat Biotechnol 27: 331-337
- Reichert JM (2011) Antibody-based therapeutics to watch in 2011. MAbs 3:76-99
- Salfeld JG (2007) Isotype selection in antibody engineering. Nat Biotechnol 25:1369-1372
- Sidhu SS, Fellouse FA (2006) Synthetic therapeutic antibodies. Nat Chem Biol2: 682-688
- Strohl WR (2009) Optimization of Fc-mediated effector functions of monoclonal antibodies. Curr Opin Biotechnol 20: 685-691
- Strohl WR, Knight DM (2009) Discovery and development of biopharmaceuticals: current issues. Curr Opin Biotechnol 20: 668-672
- Woof JM, Burton DR (2004) Human antibody-Fc receptor interactions illuminated by crystal structures. Nat Rev Immunol 4: 89-99
- Zalevsky J, Chamberlain AK, Horton HM, Karki S, Leung IW, Sproule TJ, Lazar GA, Roopenian DC, Desjarlais JR (2010) Enhanced antibody half-life
improves in vivo activity. Nat Biotechnol 28: 157-159
https://www.google.com/url?sa=t&rct=j&q=&esrc=s&source=web&cd=&cad=rja&uact=8&ved=2ahUKEwiOyuPwx5z0AhUT7qQKHSAcCTQQFnoECB0QAQ&url=https%3A%2F%2Fbioprocessintl.com%2Fmanufacturing%2Fmonoclonal-antibodies%2Fimmunoglobulin-fc-fusion-proteins-part-1-design-manufacture%2F&usg=AOvVaw31OXWrbVLjBPjl6KRGT2Wy
https://pubmed.ncbi.nlm.nih.gov/28088904/
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام