مقاومتهای آنتیبیوتیکی در آسینتوباکتر بومانی و مروری بر مطالعات انجامشده در ایران
مهدی اکبری ده بالایی۱، شهین نجار پیرایه۲، صیاد بسطامی نژاد۳
1: دانشجوی ph.D گروه باکتریشناسی پزشکی دانشگاه تربیت مدرس
2: دانشیار گروه باکتریشناسی پزشکی دانشگاه تربیت مدرس
3: دانشجوی ph.D گروه پزشکی مولکولی دانشگاه علوم پزشکی همدان
باکتریهای جنس آسینتوباکتر کوکوباسیل های گرم منفی غیر تخمیری، غیر متحرک، کاتالاز مثبت، اکسیداز منفی با محتوای GC38-47% هستند، این باکتریها میکروارگانیسمهایی فرصتطلب میباشند و تا دهه ۱۹۷۰ هر زمان که از نمونههای بالینی جدا میشدند نادیده در نظر گرفته میشدند(1) .
امروزه آسینتوباکتر بومانی به خاطر افزایش عفونتهای ناشی از این باکتری و نیز گسترش جهانی سویههای با مقاومت نسبت به کلاسهای مختلف آنتیبیوتیک بهعنوان یک پاتوژن مهم انسانی شناختهشده است. اکثر عفونتهای ناشی از آسینتوباکتر بومانی عفونتهای بیمارستانی میباشد که اغلب در بخش مراقبتهای ویژه سبب ایجاد عفونت میگردد. این پاتوژن سبب پنومونی، باکتریمی، اندوکاردیت، عفونتهای پوست و بافت نرم، عفونت دستگاه ادراری و مننژیت میگردد. پنومونی شایعترین عفونت بیمارستانی ناشی از این باکتری میباشد، این عفونت اغلب در بیماران بستریشده در بخش مراقبتهای ویژه که بهوسیله ونتیلاتور تنفس میکنند، رخ میدهد. میزان مرگومیر در عفونتهای پنومونی مرتبط با ونتیلاتور ناشی از آسینتوباکتر بومانی بین ۴۰% تا ۷۰% میباشد. آسینتوباکتر بومانی همچنین عامل شایع عفونتهای خون در بخش مراقبتهای ویژه است. منبع شایع عفونتهای خونی ناشی از آسینتوباکتر بومانی دستگاه تنفسی تحتانی و وسایل داخل عروقی است اگرچه عفونت زخم و مجاری ادراری نیز بهعنوان کانون عفونت گزارش شده است (۱). ریسک فاکتورهای مرتبط با کسب آسینتوباکتر بومانی شامل سرکوب سیستم ایمنی، عفونت جریان خون، استفاده از دستگاه تنفس مصنوعی، درمان قبلی آنتیبیوتیک و کلونیزاسیون با ویروسهای مهاجم است. میزان مرگومیر در عفونتهای خون ناشی از آسینتوباکتر بومانی بین ۲۸% تا ۴۳% میباشد. آسینتوباکتر بومانی از عوامل مهم ایجاد عفونتهای سوختگی میباشد، به علت وجود ایزولههای مقام به چندین کلاس مختلف از آنتیبیوتیکها و نفوذ کم بسیاری از آنتیبیوتیکها به محل سوختگی این عفونتها یکی از چالشهای مهم پزشکان برای درمان این بیماران میباشد، اگرچه شیوع آسینتوباکتر بومانی عامل عفونت سوختگی بهاحتمالزیاد متفاوت است و بهطور قابلتوجهی بسته به موقعیت جغرافیایی میباشد. آسینتوباکتر بومانی بهعنوان علت مهم عفونت سوختگی در کارکنان نظامی بهعنوان شایعترین علت عفونت محل سوختگی (۲۲٪) میباشد که ۵۳ درصد از باکتریها مقاومت به چند دارو را نشان دادهاند(2).
جنس آسینتوباکتر امروزه حاوی بیش از ۳۲ گونه مختلف میباشد و گونههای آسینتوباکتر بومانی، گونه ژنومی ۳ و TU ۱۳ بیشترین گونههایی هستند که از نمونههای بالینی جدا میشوند و آسینتوباکتر بومانی گونه غالب میباشد (۱).
میزان جداسازی آسینتوباکتر بومانی از محیطهای طبیعی و بروز آن در جامعه پایین است درحالیکه میزان انتقال آن به بیماران بستری در بیمارستان بالا میباشد و وقوع آن در بیمارستان بهطور مکرر اتفاق میافتد. آسینتوباکتر بومانی نیازهای رشد سادهای دارد و میتواند در محیط خشک زنده بماند (۱).
مقاومت به عوامل آنتیباکتریال در آسینتوباکتر بومانی احتمالاً مهمترین مهارت برای رشد و نمو در محیط بیمارستانی بهعنوان یک پاتوژن نوظهور میباشد. ایزولههای آسینتوباکتر بومانی با مقاومت چندگانه در طول دهه گذشته افزایش یافته است. بیماران مبتلا به عفونتهای آسینتوباکتر بومانی با مقاومت چندگانه میزان مرگومیر بالاتر و طول مدت بستری بیشتری به نسبت بیماران مبتلا به عفونتهای آسینتوباکتر حساس به دارو دارند(3). آسینتوباکتر بومانی دارای طیف گستردهای از مکانیسمهای مقاومت به تمام طبقات آنتیبیوتیکهای موجود و همچنین ظرفیت شگرف برای به دست آوردن عوامل جدید از مقاومت میباشد(4).
مکانیسمهای مقاومت آنتیبیوتیکی در آسینتوباکتر بومانی
طیف گسترده مکانیسمهای مقاومت آنتیبیوتیکی که در آسینتوباکتر بومانی وجود دارد از مهمترین امتیازات این باکتری نسبت به سایر باکتریهای گرم منفی غیر تخمیری است(4)
- مقاومت ژنتیکی به بتالاکتامها
- بتالاکتامازهای ذاتی
آسینتوباکتر بومانی بهطور ذاتی سفالسپوریناز Amp-C را تولید میکند که معمولاً در سطح پایینی بیان میشود و اثر چندانی بر روی سفالسپورینهای وسیعالطیف و کارباپنمها ندارد. قرار گرفتن ISAab1 (متعلق به خانواده IS4) در بالادست ژن blaampC با فراهم نمودن یک پروموتور سبب افزایش بیان آن و درنتیجه مقاومت به سفالسپورینهای وسیعالطیف میشود. آسینتوباکتر بومانی همچنین برخی دیگر از بتالاکتامازهای ذاتی کروموزومی مانند OXA-51 را تولید میکند که جهشهای نقطهای فراوانی در آن توصیف شده است. این آنزیمها در حالت عادی سطح فعالیت پایینی علیه کارباپنمها دارند اما هنگامیکه عناصر الحاقی مانند ISAba1 و ISAba9 در بالادست آنها قرار میگیرند با فراهم کردن پروموتورهای قوی سبب مقاومت آسینتوباکتر بومانی به کارباپنمها میشود(5) .
بتالاکتامازهای اکتسابی با طیف اثر محدود
پنیسیلینازهای با طیف اثر محدود مهار شونده توسط کلاونیک اسید (TEM-1, TEM-2 و CARB-5) و اگزاسیلینازهای مقاوم به کلاونیک اسید (OXA-20, OXA-21) در آسینتوباکتر گزارش شدهاند (6).
- بتالاکتامازهای با طیف اثر گسترده مهار شونده توسط کلاونیک اسید (ESBLs)
اولین ESBL شناساییشده در آسینتوباکتر بومانی PER-1 بود. در بالادست ژن PER-1 عنصر الحاقی ISPa12 قرار دارد درحالیکه در پاییندست این ژن ISPa13 قرار دارد. ISPa12 و ISPa13 باهم در اطراف PER-1 تشکیل Tn1213 را میدهند. ISPa12 با فراهم کردن پروموتور برای PER-1 در بیان ژن PER-1 نقش دارد. ژن PER-7 که سبب القاء مقاومت بیشتری به سفالسپورینهای نسل سوم و منوباکتامها به نسبت PER-1 میشود نیز در آسینتوباکتر بومانی گزارش شده است (7). VEB-1 یک ESBL مهم دیگری که در آسینتوباکتر بومانی است که برای اولین بار در فرانسه گزارش شده است. این ژن در همراهی با اینتگرون کلاس 1 میباشد. ایزولههای آسینتوباکتر بومانی در همراهی با CTX-M-2 در ژاپن و ایالاتمتحده امریکا، CTX-M-43 در بولیوی گزارش شده است. RTG-4 کاربنیسیلینی با ویژگیهای ESBL اولین بار از فرانسه گزارش شد. تفاوت RTG-4 با ESBL ها در هیدرولیز سفپیم و سفپیروم و عدم توانایی هیدرولیز سفتازیدیم یا سفوتاکسیم است (8). بهطورکلی بیان ESBLها در آسینتوباکتر بومانی بهطور قابلتوجهی سبب القاء مقاومت به سفالسپورینهای وسیعالطیف میشود. ژنهای ESBL اغلب با مقاومت به آمینوگلیکوزیدها همراه است. تشخیص ESBLها در آسینتوباکتر بومانی میتواند مشکل باشد چراکه اغلب در همراهی با بیان بیشازحد سفالسپورینازهای ذاتی باشد (8).
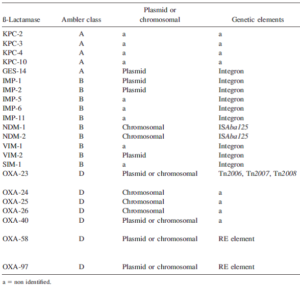
- بتالاکتامازهای اکتسابی هیدرولیز کننده کارباپنمها
کارباپنمها در طی دو دهه گذشته بهعنوان درمان اصلی عفونتهای آسینتوباکتر بومانی بودهاند. بااینحال آسینتوباکتر بومانی با کسب بتالاکتامازهای اکتسابی هیدرولیز کننده کارباپنمها به آنتیبیوتیکها مقاوم گشته است. این کارباپنمازها متعلق به گروه D (اگزاسیلینازها)، گروه B (متالوبتالاکتامازها) و گروه A میباشند(9).
جدول شماره ۱
بتالاکتامازهای اکتسابی هیدرولیز کننده کارباپنمها در آسینتوباکتر بومانی
کلاس D بتالاکتامازهای هیدرولیز کننده کارباپنمها (CHDLs)[1] اغلب سبب مقاومت نسبت به کارباپنمها در آسینتوباکتر بومانی میشوند، هرچند که آنها فقط باعث کاهش حساسیت به کارباپنمها میشوند و فعالیت چندانی در برابر سفالسپورینهای وسیعالطیف ندارند.
اولین CHDL شناساییشده OXA-23 (ARI-1) است. در آسینتوباکتر بومانی OXA-23 بیشترین شیوع را در بین CHDL ها دارد و در سراسر دنیا گزارش شده است(10). blaOXA23 جزئی از ساختار ترانسپوزونهای Tn2006 , Tn2007و Tn2008 است. نکته جالبتوجه این است که مخزن طبیعی blaOXA23 ، آسینتوباکتر رادیورزیستنس است که یکسویه محیطی غیرپاتوژن میباشد.
گروه دوم از CHDLها که هم بهصورت کروموزومی و هم بهصورت پلاسمیدی در آسینتوباکتر بومانی وجود دارد OXA-40 (OXA-24 هم نامیده میشود) OXA-25 و OXA-26 میباشد. OXA-40 دارای انتشار جهانی است اما بخصوص از ایالاتمتحده، اسپانیا و پرتغال گزارش شده است. (11).
سومین گروه از CHDLها که بهصورت پلاسمیدی در آسینتوباکتر بومانی وجود دارد OXA-58 و یک واریانت از آن OXA-97 میباشد. این گروه هم دارای انتشار جهانی میباشد و در همراهی با عناصر الحاقی (و نه ترانسپوزونها) میباشد. عناصر الحاقی نقش مهمی در افزایش بیان این ژنها ایفا میکنند. OXA-58 در سایر گونههای آسینتوباکتر مانند A. junni و گونه ژنومی ۳ و ۱۳TU هم وجود دارد (۱۱).
متالوبتالاکتامازها (MBLs) کارباپنمازهای بسیار قدرتمندی هستند، اگرچه این آنزیمها عمدتاً در سودوموناس حضور دارند اما بهطورکلی ۴ گروه از متالوبتالاکتامازها در آسینتوباکتر بومانی توصیف شدهاند که شامل آنزیمهای SIM-1، IMP-like، VIM-like و NDM-type میباشد. SIM-1، IMP-like و VIM-like در همراهی با اینتگرون کلاس ۱ میباشند. در سالهای اخیر گزارشاتی از ظهور NDM ارائه شده است. ژن NDM بیشتر در خانواده انتروباکتریاسه گزارش شده است. اولین گزارشها NDM-1 در آسینتوباکتر بومانی در هند و آلمان ارائه شده است. NDM-2 برای اولین بار در مصر گزارش شد و در همراهی با ISAba125 بود که این عنصر الحاقی یک پروموتور را برای NDM-2 فراهم میکند. متالوبتالاکتامازها سبب مقاومت سطح بالا به همه بتالاکتامها بهجز آزترونام میشود (12).
درنهایت آنزیمهای بتالاکتاماز هیدرولیز کننده کارباپنمها در آسینتوباکتر بومانی که کارباپنمازهای کلاس A میباشد و شامل آنزیمهای KPC و GES میباشد. GES-14 در همراهی با اینتگرون کلاس ۱ میباشد و میتواند سبب مقاومت به همه بتالاکتامها ازجمله سفالسپورینها، کارباپنمها و آزترونام شود (13).
- مقاومت غیر آنزیماتیک به بتالاکتامها و بهویژه کارباپنمها
مقاومت به کارباپنمها در آسینتوباکتر بومانی ممکن است ناشی از افزایش تعامل بین بتالاکتامازهای وسیعالطیف و سایر مکانیسمهای مقاومت ازجمله از دست دادن پورینها، فعالیت پمپ افلوکس و تغییر در پروتئینهای متصل شونده به پنیسیلین (PBPs) باشد. چندین گزارش در ارتباط با کاهش بیان پورینهای مشخص و افزایش مقاومت آنتیبیوتیکی در آسینتوباکتر بومانی وجود دارد، ازجمله پروتئینهای غشاء خارجی[2] (OMPs) که دارای همولوژی با پورین OmpA انتروباکتریاسه دارد، نقص در این پورینها سبب نفوذ آهسته بتالاکتامها به داخل باکتری میگردد. در آسینتوباکتر بومانی سه پروتئین غشاء خارجی با افزایش مقاومت یا کاهش حساسیت به کارباپنمها همراه هستند که شامل ۱- پروتئین ۳۳-۳۶ کیلو دالتونی ۲- پروتئین ۲۹ کیلو دالتونی که CarO هم نامیده میشود و ۳- پروتئین ۴۳ کیلو دالتونی که با OprD در سودوموناس آئروژینوزا همولوژی دارد. همچنین OmpW در آسینتوباکتر بومانی وجود دارد که کاهش بیان آن با افزایش مقاومت به سفتریاکسون همراه است (14).
مقاومت بهواسطه افلاکس یک فاکتور مشترک در حساسیت آنتیبیوتیکی در باکتریهای گرم منفی است و چندین پمپ افلاکس در آسینتوباکتر بومانی وجود دارد. پمپ AdeABC[3] متعلق به خانواده RND[4]. AdeA کد کننده پروتئین اصلی فیوژن AdeB پروتئین غشاء داخلی و AdeC پروتئین غشاء خارجی است. افزایش بیان این پمپها سبب افزایش مقاومت به سفپیم، سفپیروم و سفوتاکسیم میشود. افزایش بیان پمپ AdeABC و به همراه اگزاسیلینازهای هیدرولیز کننده کارباپنمها میتواند منتج به مقاومت سطح بالا به کارباپنمها شود (15).
- مقاومت ژنتیکی به کینولونها و فلوروکینولونها
اثر کینولونها و فلوروکینولونها وابسته به اتصال به ژیراز باکتریایی (توسط gyrA و gyrB کد میشود) و توپوایزومراز ۴ (توسط parA و parC کد میشود) است. در انتروباکتریاسه موتاسیون در نواحی تعین کننده مقاومت به کینولونها[5] (QRDR) سبب تغییر در حساسیت نسبت به کینولونها و فلوروکینولونها میشود. این تغییرات منجر به کاهش تمایل اتصال کینولون به کمپلکس DNA- ENZYME میشود. جهشهای متعدد در سایتهای هدف کینولونها و فلوروکینولونها در آسینتوباکتر بومانی گزارش شده است (14).
- مقاومت ژنتیکی به آمینوگلیکوزیدها
آنزیمهای متعدد مدیفه کننده آمینوگلیکوزیدها شامل استیلترانسفراز، فسفوترانسفراز و آدنیلترانسفراز میباشد و هر سه گروه مدیفه کننده در آسینتوباکتر بومانی گزارش شده است. ژنهای کد کننده این آنزیمها اغلب در همراهی با اینتگرونهای کلاس ۱ هستند. آنزیم استیلترانسفراز در این باکتری در ارتباط با مقاومت به آمیکاسین میباشد (16).
- مقاومت ژنتیکی به ریفامپیسین
ریفامپیسین با اتصال به اسیدهای آمینه حفاظتشده در سایت فعال RNA پلیمراز باکتریایی و مهار شروع رونویسی عمل میکند. بخش عمده مقاومت به ریفامپیسین ناشی از جهش کروموزومی است که منجر به تغییرات اسیدهای آمینه در سایت فعال میشود. در آسینتوباکتر بومانی مقاومت در برابر ریفامپیسین مربوط به ژن arr-2 میباشد. این ژن کد کننده ریفامپیسین ADP ریبوزیل ترانسفراز که ریفامپیسین را از طریق ریبوزیلاسیون غیرفعال میکند. ژن arr-2 با ژن ESBL bla veb-1 در همراهی با اینتگرونهای کلاس ۱ هستند. همچنین در اینتگرونهای کلاس ۱ ژن arr-2 با ژن ESBL bla per-7 در همراهی هستند (17).
- مقاومت ژنتیکی به سیکلینها
عمل باکتریواستاتیک سیکلینها از طریق اتصال برگشتپذیر با جزء 30s ریبوزومال باکتریایی و مهار ترجمه پروتئین میباشد. مقاومت به تتراسیکلین بهخوبی در آسینتوباکتر بومانی دیده شده است. TetA و TetB از طریق پمپ افلاکس سبب حذف تتراسیکلین از سلول میشود. حفاظت ریبوزومال بهطور وسیعی از طریق TetM نیز ممکن ایجاد شود. گلیکیسیکلینها مشتقات تتراسیکلین هستند که با تغییرات ساختاری فعالیت ضد میکروبی آنها چندین برابر افزایش یافته است. تیگسیکلین اولین داروی تجاری مشتق از گلیکیسیکلینها است که سویههای آسینتوباکتر بومانی با مقاومت چندگانه اغلب به این آنتیبیوتیک حساس میماند. مکانیسمهای شناختهشده مقاومت به تیگسیکلینها شامل افلاکس AdeABC، AdeIJK و AdeFGH میباشد. چندین گزارش در جهان در مورد افزایش مقاومت نسبت به تیگسیکلینها در آسینتوباکتر بومانی ارائه شده است (18).
- مقاومت ژنتیکی به کولیستین و پلیمیکسین
این ترکیبات با اتصال و تخریب شارژ منفی غشاء خارجی باکتریهای گرم منفی عمل مینمایند. مکانیسمهای عمده مقاومت به این آنتیبیوتیکها شامل
۱- کاهش بار منفی پروتئین غشاء خارجی توسط تغیـیر در لیپید A
۲- کلیواژ پروتئولیتیک ترکیبات آنتیبیوتیکی و
۳- خروج دارو توسط پمپ افلاکس در آسینتوباکتر بومانی جهش نقطهای و frameshift در ژنهای pmrA و pmrB سبب افزایش MIC به کولیستسن میگردد. PmrAB یک سیستم دوجزئی است که در درک آهن و PH محیط نقش دارد(19) .
- مقاومت ژنتیکی به سایر کلاسهای آنتیبیوتیکی، ضدعفونیکنندهها و فلزات سنگین
مقاومت به سولفانامیدها در آسینتوباکتر بومانی بسیار شایع میباشد این مقاومت ناشی از sul1 میباشد که در همراهی با اینتگرون کلاس ۱ میباشد. مقاومت به تریمتوپریم و سایر آنتیبیوتیکهای درگیر در سنتز فولات اغلب بهواسطه ژن dfr که بهطور وسیع در باکتریهای گرم منفی وجود دارد میباشد. در آسینتوباکتر بومانی مقاومت به تریمتوپریم همچنین به علت افزایش بیان ژنهای ذاتی افلاکس AdeABC، AdeFGH و AdeM میباشد (4).
کلرامفنیکل که یک آنتیبیوتیک وسیعالطیف میباشد پروتئینسازی را در باکتریها مهار میکند. مقاومت به کلرامفنیکل اغلب بهواسطه ژنهای کد شونده در اینتگرونها مانند cmlA و cat میباشد. نقش پمپهای افلاکس ذاتی بخصوص CarA[6] که بهطور ویژه سبب انتقال کلرامفنیکل به خارج از باکتری میشود در مقاومت به کلرامفنیکل حائز اهمیت است. همچنین AbeM متعلق به خانواده MATE و نیز AbeS متعلق به خانواده SMR نیز در مقاومت به این آنتیبیوتیک مهم هستند (۵).
مقاومت به ماکرولیدها در سویههای آسینتوباکتر ذاتی است اما مقاومت ناشی از پلاسمید بهواسطه Tn1548 نیز گزارش شده است. ژنهای mel و mph که به ترتیب کد کننده پمپ افلاکس و آنزیمهای مدیفه کننده ماکرولیدها هستند نیز در آسینتوباکتر بومانی گزارش شدهاند (۵).
مقاومت به فلزات سنگین، رنگها و مواد ضدعفونیکننده عمدتاً بهواسطه پمپهای افلاکس ذاتی است. تجزیه تحلیل ژنوم آسینتوباکتر بومانی چندین اپرون ژنهای کد کننده پمپهای افلاکس مرتبط با مقاومت به فلزات سنگین را نشان داده است. اپرون کد کننده مقاومت به جیوه بر روی ترانسپوزون Tn21 وجود دارد (۵).
مروری بر مطالعات انجامشده در ایران
در طی یک دهه گذشته با افزایش اهمیت آسینتوباکتر بومانی در عفونتهای بیمارستانی و بخصوص در بخش مراقبتهای ویژه و سوختگی مطالعات فراوانی در نقاط مختلف ایران بر روی این باکتری صورت گرفته است و شیوع بالای مقاومت آنتیبیوتیکی بهخوبی در آسینتوباکتر بومانی نشان داده شده است که در ذیل به برخی از این مطالعات خواهیم پرداخت.
در مطالعهای که در سال ۲۰۱۲ نجار پیرایه و همکاران بر روی ایزولههای آسینتوباکتر بومانی در بخشهای مراقبتهای ویژه بیمارستانهای شهر تهران انجام دادند از ۸۴ ایزوله آسینتوباکتر بومانی موردمطالعه ۵۰ نمونه (۵۹٫۵۲%) مقاوم به ایمیپنم، ۶۵ نمونه (۷۷٫۳۸%) مقاوم به جنتامایسین، ۸۱ نمونه (۹۶٫۴۲%) مقاوم به سیپروفلوکساسین، ۴۴ نمونه (۵۲٫۳۸%) مقاوم به آمیکاسین، ۸۱ نمونه (۹۶٫۴۲%) مقاوم به سفوتاکسیم، ۶۹ نمونه (۸۲٫۱۴%) مقاوم به سفپیم، ۸۱ نمونه (۹۶٫۴۲%) مقاوم به سفتازیدیم، ۷۴ نمونه (۸۸٫۰۹%) مقاوم به مروپنم، ۷۸ نمونه (۹۲٫۸۵%) مقاوم به تری متوپریم – سولفامتوکسازول، ۸۲ نمونه (۹۷٫۶۱%) مقاوم به آزترونام، تمام نمونهها به کولیستین و پلیمیکسین B حساس بودند(20).
در مطالعهای که طاهری کلانی و همکاران در سال ۲۰۰۹ روی ۸۰ ایزوله آسینتوباکتر بومانی از شش بیمارستان شهر تهران صورت گرفت درصد مقاومت به ایمیپنم و مروپنم (۵۲٫۵%)، پیپراسیلین (۷۵%)، پیپراسیلین _ تازوباکتام (۶۸٫۷%) بود، همچنین ۸٫۸% از ایزولهها به تمام آنتیبیوتیکهای درمانی این باکتری ازجمله تیگسیکلین و پلیمیکسین B مقاوم بودند (21).
اکبری و همکاران در سال ۲۰۱۰ مطالعهای بر روی ایزولههای آسینتوباکتر بومانی انجام دادند به مطالعه الگوی مقاومت آنتیبیوتیکی این باکتری پرداختند در این مطالعه بالای ۹۰% از ایزولهها به سفالسپورینها مقاوم بودند همچنین ۶۲% به آمیکاسین و آمپیسیلین _ سولباکتام، ۴۵% به جنتامایسین و ۵۳% به ایمیپنم مقاومت داشتند (22).
بهطورکلی از سال ۲۰۰۱ تا سال ۲۰۱۴، ۸۷ مقاله درزمینه آسینتوباکتر بومانی در ایران منتشر شده است. در این بازه زمانی در فاصله سالهای ۲۰۱۰-۲۰۱۱ با ۱۲ مطالعه در نقاط مختلف ایران بیشترین مطالعه در این سال صورت گرفته است، هرچند این مطالعات از تمامی نقاط ایران انجامشده است اما قسمت اعظم این گزارشها مربوط به مرکز کشور و استان تهران میباشد. میزان مقاومت آنتیبیوتیکی به تعداد زیادی از آنتیبیوتیکها بسیار بالا بوده و این میزان مقاومت به برخی از آنتیبیوتیکها بهطور میانگین بالای ۸۰% بوده است برای مثال میزان مقاومت به سفوتاکسیم، تیکارسیلین، تیکارسیلین کلاولینیک اسید، سفتازیدیم، سفپیم، سفتریاکسون و لئوفلوکساسین در تمام مطالعات بهطور میانگین بالای ۸۰% گزارش شده است، پلیمیکسین و کولیستین مؤثرترین آنتیبیوتیکها در این مطالعات بودهاند از طرفی مقاومت به برخی کلاسهای آنتیبیوتیکی که جزء داروهای اصلی برای درمان عفونتهای ناشی از این باکتری هستند متغیر میباشد بهنحویکه مقاومت به کارباپنمها که از آنتیبیوتیکهای اصلی درمانی عفونتهای ناشی از این باکتری میباشد بین ۲۸% تا ۸۵% گزارش شده است. مقاومت بالا به گروههای مختلف آنتیبیوتیکی مانند بتالاکتامازها، آمینوگلیکوزیدها، کوئینولونها و تتراسیکلینها سبب شده برای پی بردن به منشأ مقاومتها ژنهای مختلف مقاومتی در این مطالعات موردبررسی قرار گیرند. در مورد ژنهای مقاومت به بتالاکتامازها برای پی بردن به مقاومت به کارباپنمها ژنهای اگزاسیلینازها (blaoxa23, blaoxa24, laoxa40, bla oxa51, blaoxa58) و متالوبتالاکتامازها (VIM, IMP) و برای پی بردن به مقاومت به بتالاکتامازها ژنهای
PER – VEB – TEM – SHV – ISAba 25/ampC – ISAba1/ampC موردبررسی قرار گرفتهاند (23). در مورد مقاومت به تتراسیکلینها ژنهای پمپ افلاکس شامل TetA و TetB، در مورد مقاومت به کوئینولونها ژنهای gyrA/parC و در مورد مقاومت به آمینوگلیکوزیدها ژنهای مختلف مقاومت موردبررسی قرار گرفتهاند (23).
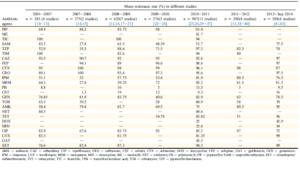
جدول شماره ۲
میانگین مقاومت به آنتیبیوتیکهای مختلف در آسینتوباکتر بومانی در سالهای مختلف در ایران در جدول ذیل آورده شده است (۲۳)
منابع:
- Zarrilli R, Giannouli M, Tomasone F, Triassi M, Tsakris A. Carbapenem resistance in Acinetobacter baumannii: the molecular epidemic features of an emerging problem in health care facilities. The Journal of Infection in Developing Countries. 2009;3(05): 335-41.
- McConnell MJ, Actis L, Pachón J. Acinetobacter baumannii: human infections, factors contributing to pathogenesis and animal models. FEMS microbiology reviews. 2013;37(2):130-55.
- Sunenshine RH, Wright M-O, Maragakis LL, Harris AD, Song X, Hebden J, et al. Multidrug-resistant Acinetobacter infection mortality rate and length of hospitalization. Emerging infectious diseases. 2007;13(1):97.
- Peleg AY, Seifert H, Paterson DL. Acinetobacter baumannii: emergence of a successful pathogen. Clinical microbiology reviews. 2008;21(3):538-82.
- Poirel L, Bonnin RA, Nordmann P. Genetic basis of antibiotic resistance in pathogenic Acinetobacter species. IUBMB life. 2011;63(12):1061-7.
- Poirel L, Corvec S, Rapoport M, Mugnier P, Petroni A, Pasteran F, et al. Identification of the novel narrow-spectrum β-lactamase SCO-1 in Acinetobacter spp. from Argentina. Antimicrobial agents and chemotherapy. 2007;51(6):2179-84.
- Bonnin RA, Potron A, Poirel L, Lecuyer H, Neri R, Nordmann P. PER-7, an extended-spectrum β-lactamase with increased activity toward broad-spectrum cephalosporins in Acinetobacter baumannii. Antimicrobial agents and chemotherapy. 2011;55(5):2424-7.
- Potron A, Poirel L, Croizé J, Chanteperdrix V, Nordmann P. Genetic and Biochemical Characterization of the First Extended-Spectrum CARB-Type ß-Lactamase, RTG-4, from Acinetobacter baumannii. Antimicrobial agents and chemotherapy. 2009;53(7):3010-6.
- Poirel L, Nordmann P. Carbapenem resistance in Acinetobacter baumannii: mechanisms and epidemiology. Clinical Microbiology and Infection. 2006;12(9):826-36.
- Poirel L, Cabanne L, Vahaboglu H, Nordmann P. Genetic environment and expression of the extended-spectrum β-lactamase blaPER-1 gene in gram-negative bacteria. Antimicrobial agents and chemotherapy. 2005;49(5):1708-13.
- Poirel L, Naas T, Nordmann P. Diversity, epidemiology, and genetics of class D β-lactamases. Antimicrobial agents and chemotherapy. 2010;54(1):24-38.
- Karthikeyan K, Thirunarayan M, Krishnan P. Coexistence of blaOXA-23 with blaNDM-1 and armA in clinical isolates of Acinetobacter baumannii from India. Journal of antimicrobial chemotherapy. 2010;65(10):2253-4.
- Bonnin RA, Nordmann P, Potron A, Lecuyer H, Zahar J-R, Poirel L. Carbapenem-hydrolyzing GES-type extended-spectrum β-lactamase in Acinetobacter baumannii. Antimicrobial agents and chemotherapy. 2011;55(1):349-54.
- Vila J, Martí S, Sánchez-Céspedes J. Porins, efflux pumps and multidrug resistance in Acinetobacter baumannii. Journal of antimicrobial chemotherapy. 2007;59(6):1210-5.
- Coyne S, Courvalin P, Périchon B. Efflux-mediated antibiotic resistance in Acinetobacter spp. Antimicrobial agents and chemotherapy. 2011;55(3):947-53.
- Galimand M, Sabtcheva S, Courvalin P, Lambert T. Worldwide disseminated armA aminoglycoside resistance methylase gene is borne by composite transposon Tn1548. Antimicrobial agents and chemotherapy. 2005;49(7):2949-53.
- Fournier P-E, Vallenet D, Barbe V, Audic S, Ogata H, Poirel L, et al. Comparative genomics of multidrug resistance in Acinetobacter baumannii. PLoS genetics. 2006;2(1):e7.
- Perez F, Hujer AM, Hujer KM, Decker BK, Rather PN, Bonomo RA. Global challenge of multidrug-resistant Acinetobacter baumannii. Antimicrobial agents and chemotherapy. 2007;51(10):3471-84.
- Adams MD, Nickel GC, Bajaksouzian S, Lavender H, Murthy AR, Jacobs MR, et al. Resistance to colistin in Acinetobacter baumannii associated with mutations in the PmrAB two-component system. Antimicrobial agents and chemotherapy. 2009;53(9):3628-34.
- Karmostaj A, Peerayeh SN, Salmanian AH. Emergence of Tigecycline Resistant Acinetobacter baumannii From an Inten-sive Care Unit (ICU) in Tehran. Jundishapur J Microbiol. 2013;6(3).
- Morovat T, Bahram F, Mohammad E, Setareh S, Mohamad Mehdi F. Distribution of different carbapenem resistant clones of Acinetobacter baumannii in Tehran hospitals. The new microbiologica. 2009;32(3):265.
- Mahdi A, Mohammad N, Morovat T, Mhammad-Mahdi F, Namam-Ali A, Setareh S, et al. Rapid identification of Iranian Acinetobacter baumannii strains by single PCR assay using BLA oxa-51-like carbapenemase and evaluation of the antimicrobial resistance profiles of the isolates. Acta microbiologica et immunologica Hungarica. 2010;57(2):87-94.
- Moradi J, Hashemi FB, Bahador A. Antibiotic Resistance of Acinetobacter baumannii in Iran: A Systemic Review of the Published Literature. Osong public health and research perspectives. 2015;6(2):79-86.
[1] Carbapenem-hydrolyzing class D b-lactamases
[2] outer membrane proteins
[3] Acinetobacter drug efflux
[4] Resistance-Nodulation-cell Division
[5] Quinolone-Resistance- Determining-Region
[6] Chloramphenicol resistance Acinetobacter
مکانیزمهای مقاومت آنتیبیوتیکی در سودوموناس آئروجینوزا
مقاومتهای دارویی در مایکوباکتریومها و ژنهای مرتبط با آن
مثالهايي از مکانيسمهاي مقاومت به بتالاکتامها
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام