مکانیزمهای مقاومت آنتیبیوتیکی در سودوموناس آئروجینوزا
حسین حضرتی نوین کارشناس علوم آزمایشگاهی دانشگاه علوم پزشکی اردبیل
مقدمه
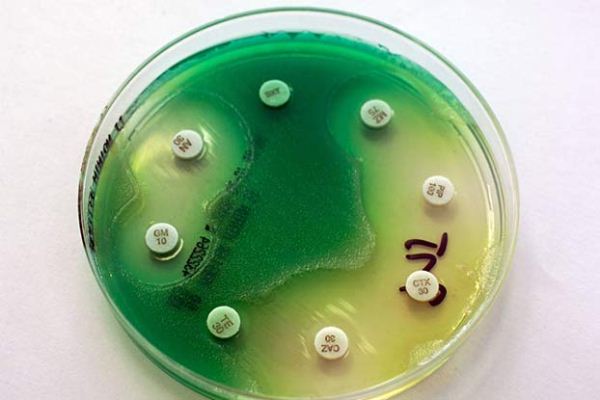
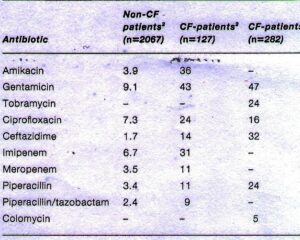
سودوموناس آئروجینوزا از نظر کنترل با آنتیبیوتیکها و ضدعفونی کنندهها یک ارگانیسم مشکلآفرین مشهور است. گزارشات اخیر بر اساس الگوی مقاومت آنتیبیوتیکی سودوموناس آئروجینوزا در انگلستان، مشکل مقاومت آنتیبیوتیکی سویههای ایزوله شده از بیماران مبتلا به CF (Cystic Fibrosis) را در مقایسه با سایر ایزولههای بیمارستانی مطرح ساخته است. جدول زیر میزان مقاومت به آنتیبیوتیکهای مختلف در سودوموناس آئروجینوزا را نشان میدهد.
استفاده وسیع از این آنتیبیوتیکها برای درمان عفونتهای ناشی از سویههای ایزوله شده در بیماران مبتلا به فیبروزکیستیک، فشار انتخابی را برای پیشبرد مقاومت در باکتری ایجاد کرده است.
چرا سودوموناس آئروجینوزا به آنتیبیوتیکها مقاوم است و چطور میتواند بعد از قرار گرفتن در معرض آنتیبیوتیکها مقاومتر شود؟
مقاومت سودوموناس آئروجینوزا به آنتیبیوتیکها در نتیجه ترکیبی از فاکتورهای زیر است:
- این باکتری بعلت نفوذپذیری پایین دیواره سلولیاش به طور ذاتی به عوامل آنتیباکتریال مقاوم است.
- این باکتری ظرفیت ژنتیکی لازم را برای بیان مجموعه وسیعی از مکانیزمهای مقاومت دارا میباشد.
- این باکتری از طریق موتاسیون در ژنهای کروموزومی که تنظیمکننده ژنهای مقاومت هستند، مقاوم میشود.
- این باکتری ژنهای مقاومت مازاد را از سایر ارگانیسمها توسط پلاسمیده، ترانسپوزونها و باکتریوفاژها بدست میآورد.
- علاوه بر فاکتورهای بالا یک خصوصیت سودوموناس آئروجینوزا الگوی رشد آن در ریهها میباشد. تجمعاتی از باکتریها در ریه با لایهای از پلیساکارید آلژینات احاطه میشود. این میکروکولونیها یا بیوفیلمها در برابر ریشهکنی بسیار مقاوم هستند و مکانیزم این مقاومت هنوز روشن نیست.
سودوموناس آئروجینوزا یک ارگانیسم بسیار سازگار است و میتواند روی انواع وسیعی از مواد رشد کند و در پاسخ به شرایط محیطی ویژگیهای خود را تغییر دهد. شناسایی کامل سکانس ژنومی این باکتری با استفاده از تکنیک قدرتمندDNA array برای اثبات بیان ژن میکروبی درInvitro در مورد مکانیزمهای مقاومت آنتیبیوتیکی مورد بحث، جزئیات بیشتری را آشکار ساخته است.
سودوموناس آئروجینوزا یک ژنوم بزرگ با وزن مولکولی 6.26 Mbp (کدکننده برای 5567 ژن) دارد در حالیکه در مقایسه با آن درEscherichia coli k12 ژنوم دارای وزن مولکولی Mbp 1/64 (کدکننده برای 4729 ژن) و درStaphylococcus aureus N135 ژنوم با وزن مولکولی Mbp 2/8 (کدکننده برای 2594 ژن) و در Haemophlus influenzae RDژنوم دارای وزن مولکولی 1.83 Mbp (کدکننده برای 1714 ژن) میباشد. در یک محاسبه تخمینی تعداد ژنهای موردنیاز برای رشد سلولی و تقسیم در یک محیط حداقل دارای نمک، شامل آنزیمهایی هستند که برای انجام متابولیسم سلولی و ساخت پروسههای ساختاری ضروری بوده و حدوداً 1500 ژن میباشند، بنابراین سودوموناس آئروجینوزا در مقایسه با سایر ارگانیسمها توانایی ژنتیکی قابل ملاحظهای را دارا میباشد و این امر ماهیت سازگاری این باکتری را توجیه میکند که شامل توانایی در پیشرفت مقاومت در هر جایی است که آنتیبیوتیکها بطور وسیعی مورد استفاده قرار میگیرند.
مکانیزمهای مقاومت
سه مکانیسم اصلی مقاومت توسط ارگانیسمهای مقاوم به فعالیت عوامل ضدمیکروبی وجود دارد:
جذب محدود شده و افلوکس، غیرفعالسازی دارو و تغییر در اهداف.
مشارکت هریک از این سه مکانیسم مقاومت در مبتلایان به فیبروز کیستیک (CF) مورد بحث قرار گرفته است.
نفوذ آنتیبیوتیکها از طریق دیواره سلولی سودوموناس آئروجینوزا
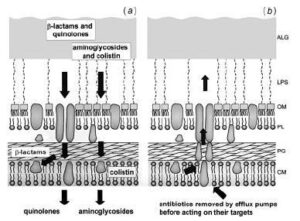
تمام کلاسهای اصلی آنتیبیوتیکهای مورد استفاده برای درمان عفونتهای سودوموناس آئروجینوزا باید برای رسیدن به اهدافشان از دیواره سلولی عبور کنند (شکل 1). آمینوگلیکوزیدها (جنتامایسین، توبرامایسین و آمیکاسین) از طریق اتصال به زیرواحد 30S ریبوزوم سنتز پروتئینها را مهار میکنند. کینولونها (سیپروفلوکساسین) به زیرواحد A از آنزیم DNA gyrase متصل میشوند. بتالاکتامها (پیپراسیلین، سفتازیدیم، ایمیپنم، مروپنم و آزترونام) ترانسپپتیدازهای قرار گرفته در قسمت خارجی غشاء سیتوپلاسمی را مهار میکنند و سرانجام پلیمیکسینها (کولومایسین و کولیستین) به فسفولیپیدهای غشاء پلاسمایی متصل میشوند و فعالیت سدی آن را از بین میبرند.
شکل 1: نمای شماتیک آرایش ترکیبات دیواره سلولی در سودوموناس آئروجینوزا
مقاومت ذاتی باکتری به تمام کلاسهای آنتیبیوتیک در نفوذپذیری پایین دیواره سلولی باکتری خلاصه شده است. کاهش تجمع آنتیبیوتیکها در داخل سلول باکتری معلول محدودیت نفوذپذیری غشاء خارجی و حذف مؤثر ملکولهای آنتیبیوتیک از طریق سیستم پمپهای افلوکس میباشد.
آلژینات به عنوان یک سد: یک خصوصیت ویژه سویههای موجود در مبتلایان به فیبروز کیستیک تولید یک لایه سست همراه با پوشش باکتری از جنس پلیساکارید آنیونیک بنام آلژینات است که سلولهای باکتری را احاطه میکند و آنها را در تجمعات به هم میچسباند. با وجود اینکه آلژینات میتواند به آنتیبیوتیکهای کاتیونیک مثل آمینوگلیکوزیدها متصل شده و نفوذپذیری آنها را محدود کند تأثیر کمی روی حساسیت باکتریهای موکویید به این آنتیبیوتیکها دارد و در عمل نشان داده شده که سویههای موکویید به آمینوگلیکوزیدها حساس میباشند.
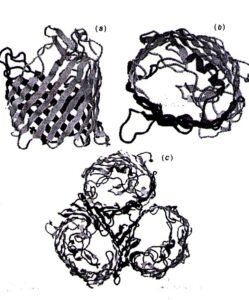
غشاء خارجی به عنوان یک سد: غشاء خارجی باکتری یک سد مهم در برابر نفوذ آنتیبیوتیکها میباشد که این عمل با محدود ساختن سرعت نفوذ مولکولهای کوچک آبدوست و مانع شدن از نفوذ مولکولهای بزرگ میباشد (شکل 1a). آنتیبیوتیکهای کوچک آبدوست مثل بتالاکتامها و کینولونها فقط از طریق کانالهای آب آماده شده بوسیله مولکولهای پورین عبور میکنند. این کانالها مولکولهای بشکهای شکل هستند که در غشاء خارجی میچرخند و معمولاً به صورت تریمر میباشند (شکل 2).
شکل 2: ساختمان عمومی پروتئین پورین در دیواره سلولی سودوموناس آئروجینوزا
سودوموناس آئروجینوزا پورینهای مختلف متعددی تولید میکند:
OprF نوع بزرگی است که در تمام سویهها دیده شده است. با وجود اینکه موتانتهای بدون این پورین گزارش شدهاند، از دست دادن این پورین عامل بزرگ مقاومت آنتیبیوتیکی به حساب نمیآید؛ احتمالاً به این دلیل چنین سویههایی توانایی محدودی در جذب مواد غذایی آبدوست داشتهاند.
OprD یک پورین تخصصیافته است که یک نقش اختصاصی در جذب اسیدهای آمینه دارای بار مثبت مثل لیزین دارد. از دست دادن این پورین همراه با مقاومت به ایمیپنم است زیرا این آنتیبیوتیک برای عبور از غشاء به این پورین نیاز دارد. از دست دادن پورین MIC داروی مذکور را از 2-1 میلیگرم درصد به 32-8 میلیگرم درصد افزایش میدهد و 17% میزان مقاومت به آنتیبیوتیک در طول درمان گزارش شده است. بطور شگفتآوری مروپنم تحتتأثیر از دست دادن oprD قرار نمیگیرد و این امر نشانگر این است که کارباپنمها از غشاء خارجی توسط کانالهای مختلف عبور کردهاند. آمینوگلیکوزیدها و کولیستین از طریق کانالهای پورین از غشاء خارجی عبور نمیکنند و جذب آنها از طریق اتصال به LPS در قســـــــــــــمت خارجی OM (Outer Membrane) انجام میگیرد. این امر سد نفوذپذیری OM را بهم میریزد و به این آنتیبیوتیکها اجازه میدهد تا از طریق سلوال به غشاء پلاسمایی نفوذ کنند، لذا آمینوگلیکوزیدها فعالانه بداخل سلول حمل میشوند، جایی که در سنتز پروتئینها در ریبوزمها تداخل ایجاد میکنند. کولیستین فعالیت باکتریوسایدی خود را از طریق بهم ریختن غشاء پلاسمایی انجام میدهد. مقاومت به آمینوگلیکوزیدها و کولیستین در سویههای آزمایشگاهی در نتیجه بیان بیش از حد پروتئین غشاء خارجی omp H مشاهده شده است کهLPS را از اتصال به این آنتیبیوتیکها محافظت میکند. با این حال این نوع از مقاومت بطور وسیع در سویههای بالینی مشاهده نشده است.
نقش پمپهای افلوکس در مقاومت: سیستمهای افلوکس چنددارویی از سه ترکیب پروتئینی تشکیل شدهاند:
یک پمپ وابسته به انرژی که در غشاء پلاسمایی واقع شده است.
یک پورین غشاء خارجی و یک پروتئین اتصالدهنده که دو ترکیب غشایی مذکور را بهم متصل میکند.
این ترکیب سه قسمتی برای مولکولهای سمی موجود در سیتوپلاسم، غشاء پلاسمایی و پریپلاسم یک سیستم خارجسازی ایجاد میکنند، پس اساساً در پاسخ به مواد شیمیایی ضدمیکروبی پدید نیامدهاند (شکل 1b).ترانسپورترهای پمپ افلوکس مواد را از عرض غشاء پلاسمایی به داخل فضای پریپلاسم پمپ میکنند. یک پروتئین لنگرمانند این فضا را دور میزند و ماده را به کانال غشایی خارجیتر پرتاب میکند، در نهایت سوبسترا به خارج از سلول پمپ میشود.
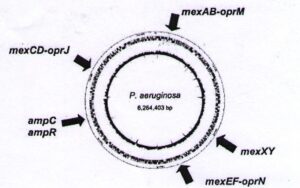
چهار سیستم افلوکس آنتیبیوتیکی مختلف برای سودوموناس آئروجینوزا توصیف شدهاند:
MexAB-oprM mex CD-oprJ
Mex XY-oprM mex EF-opr N10
تمام کلاسهای آنتیبیوتیک به جز پلیمیکسینها به خارجسازی توسط یک یا چند تا از این سیستمهای افلوکس حساس میباشند.
MexAB-oprM: مسئول خارجسازی بتالاکتامها، کینولونها و دامنه وسیعی از ضدعفونی کنندههاست.
Mex XY-oprM: مسئول خارجسازی آمینوگلیکوزیدها و
mex EF-opr N10: مسئول خارج سازی کارباپنمها و کینولونهاست.
ژنهای سیستمهای افلوکس فوق در تمام سویههای سودوموناس آئروجینوزا وجود دارند ولی به میزان بالایی بیان نمیشوند. با این حال بیان بیش از حد آنها از موتاسیون در ژنهای تنظیمی مثل mex R ناشی میشود که بیان ژنهای MexAB-oprM را کنترل میکنند (شکل 3).
شکل 3: جایگاه ژنهای افلوکس و بتالاکتاماز کروموزومی در ژنوم سودوموناس آئروجینوزا
غیرفعالسازی و تغییر آنتیبیوتیکها: تمام سویههای باکتری دارای ژن amp C برای بتالاکتاماز القایی کرموزومی هستند با این حال این القاء شاید برای ایجاد مقاومت در سویههای CF کافی نباشد. بجای آن بیان بیش از حد آنزیم از موتاسیون خودبخودی در ژن تنظیمی ampR ناشی میشود. این امر بویژه در درمان عفونت با سفتازیدیم مشاهده شده است. این آنزیم خارج سلولی احتمالاً از باکتریهای مولد با سطح بالا در ریه بعد از لیز سلولی آزاد میشود که ممکن است مولدهای با سطح پایین را از طریق کاهش غلظت موضعی آنتیبیوتیک بتالاکتام محافظت کند. تولید بالای بتالاکتاماز فوق یک تهدید جدی بر علیه سفالوسپورینها است.
سایر بتالاکتامازهای تولید شده توسط باکتری مثل ESBLها (Extended-spectrum plasmid – mediated enzymes) بر علیه پنیسیلینها و سفالوسپورینها است. استفاده از مهارکنندههای بتالاکتاماز مثل کلاولونیک اسید با تیکارسیلین و تازوباکتام با پیپراسیلین، آنتیبیوتیکها را از اثر تخریبی آنزیمهای با واسطه پلاسمید ولی نه از آسیبampC محافظت میکند. با این وجود آنزیمهای مقاوم به مهارکنندهها هم گزارش شدهاند و این جنبه از خصوصیت باکتریهای جداشده از CF ممکن است تهدیدی برای استفاده مؤثر این آنتیبیوتیکها باشد. کارباپنمازهای اختصاصی در باکتری دو نوع هستند: آنزیمهای با پایه سرین و متالوآنزیمهای کلاس D. گزارشات مربوط به کارباپنمازهای ویژه در سویههای غیرCF نشان داده است که این آنزیمها دارای پتانسیل لازم برای انتقال به سویههایCF بخصوص تحت فشار انتخابی استفاده وسیع از کارباپنمها میباشند.
غیرفعالسازی آمینوگلیکوزیدها از طریق تولید آنزیمهایی روی میدهد که گروههای استیل، فسفات و آدنیلیل را به گروه آمینو و استخلافهای هیدروکسیل در آنتیبیوتیکها انتقال میدهند. پیش از شناسایی این موضوع که آمینوگلیکوزیدها به سیستم افلوکس حساس میباشند غیرفعالسازی مکانیزم عمده مقاومت به این گروه از آنتیبیوتیکها در نظر گرفته میشد. این آنزیمهای تغییردهنده از فاکتورهای سیتوپلاسمی مثل استیل کوآنزیم A یا ATP برای حمل استخلافهای اضافه شده به آمینوگلیکوزیدها استفاده میکنند طوری که این پروژه تغییر در داخل سیتوپلاسم روی میدهد. این آنزیمهای تغییردهنده توسط پلاسمیدها کد میشوند. بنابراین موتاسیون خودبخودی در سلولهای باکتری در طول درمان آنتیبیوتیکی آنطوری که در بتالاکتامازهای کروموزومی دیده میشود به بیان بیش از حد چنین آنزیمهایی منجر نمیشود. کسب این ژنها برای تغییر دادن آنزیمها ممکن است مستلزم انتقال از سویههای مولد پلاسمیدها باشد. با این وجود در درمان روتین عفونتهای سودوموناسی در بیمارانCF با توبرامایسین آئروسل شده، در میزان مقاومت افزایشی حاصل نشده است.
تغییر در اهداف داروها: این نوع از مکانیسم مقاومت از تغییرات موتاسیونی در آنزیمهای هدف داروها روی میدهد. این تغییرات موتاسیونی تأثیری بر اعمال حیاتی این آنزیمها نداشته ولی به مهار انتخابی آنتیبیوتیکهای مؤثر بر روی باکتری میانجامد. در سودوموناس آئروجینوزا از طریق موتاسیون در ژن gyrA که زیرواحد A آنزیم هدف را کد میکند فعالیت کینولونها مهار میشود یا تغییرات در ساختمان ریبوزم 30S فقط حساسیت به استرپتومایسین از گروه آمینوگلیکوزیدها را تحتتأثیر قرار میدهد، یا تغییر در PBPها که در مقاومت به بتالاکتامها دیده شده است ولی مشکل عمدهای در درمان عفونتهای ناشی از باکتری ایجاد نمیکند.
بیوفیلمها و مقاومت: در عفونتهای ریوی در مبتلایان به CF سودوموناس آئروجینوزا به صورت تجمعاتی از سلولها که میکروکولونی نامیده میشوند رشد میکند که با پلیساکارید آلژینات احاطه شدهاند. این شکل از رشد باکتری در سطوح نیز رخ میدهد که بیوفیلم نامیده میشود. خاصیت ویژه تمام بیوفیلمها مقاومت قابلملاحظه آنها در برابر ریشهکنی با درمانهای فیزیکی و شیمیایی مثل آنتیبیوتیکها میباشد. با وجود اینکه این نوع مقاومت مدت زیادی است که شناسایی شده است ولی ماهیت زیستشناختی آن هنوز بطور کامل روشن نشده است. عواملی که ممکن است بطور عمده این نوع از فنوتیپ مقاومت را توضیح دهند شامل تراکم بالای جمعیت باکتریایی و محدودسازی فیزیکی نفوذ آنتیبیوتیکها میباشد. بیوفیلمها دربرگیرنده یک پاسخ استرس معمول در پروژههای متابولیکی کلیدی است که خاموش میشوند و مکانیزمهای محافظتکننده را القا میکنند. واضح است که سلولها در بیوفیلمها شبیه سلولهای پلانکتون آزادزی میتوانند حضور سایر سلولها را حس کنند (Quroum Sensing) و ویژگیهای خود را مطابق با آن تغییر میدهند. سخن آخر اینکه جمعیت سلولهای داخل یک بیوفیلم هتروژن هستند که شامل سلولهای سریعالرشد و کندرشد میباشند. تعدادی از آنها از طریق بیان آنزیمهای غیرفعالسازی و سیستم افلوکس به داروها مقاوم میباشند. سایر سلولها بطور آشکار چنین سیستمهایی را بیان نمیکنند، بنابراین در کل مقاومت به یک میانکنش بین جمعیت کلی سلولها بستگی دارد و درمان آنتیبیوتیکی باید علیه یک جمعیت چندسلولی صورت پذیرد.
سودوموناس آئروجینوزا همیشه مستعد به داشتن مقاومت در برابر درمان آنتیبیوتیکی هست. اندازه بسیار بزرگ ژنوم باکتری و عدم وجود دانش روزمره در مورد بسیاری از ژنهای آن پیشنهاد میکند که موارد مقاومت باکتری هرجایی که درمانهای جدید صورت پذیرد مشاهده خواهد شد.
منبع:
این مقاله ترجمه مقاله زیر است:
Lambert PA: Mechanisms of antibiotic resistance in Pseudomonas aeruginosa. Journal Royal Society of Medicine, 95:22-26, 2002.
مقاله مرتبط: خانواده سودوموناداسه
مکانیسم مقاومت داروئی در باکتریها
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام