معرفی پروتئین سیرتونین 1 (SIRT1) و مولکولهای هدف آن در گسترش سرطان
پریسا ظفری1 ، صادق عباسیان2*
1: دانشجوی کارشناسی ارشد ایمونولوژی پزشکی، دانشکدهی پزشکی، دانشگاه علوم پزشکی کرمانشاه
2: کارشناس ارشد هماتولوژی، ادارهی کل انتقال خون ایلام، سازمان انتقال خون ایران
نویسندهی مسئول: صادق عباسیان
سیرتونینها خانوادهای از داستیلازهای حفاظت شدهی وابسته به +NAD هستند که به عنوان حسگرهای درون سلولی در شناسایی سطح انرژی سلول و تنظیم فرآیندهای متابولیک نقش دارند. خانوادهی سیرتونین دارای 7 عضو میباشد. دو عضو از این خانواده که در تنظیم فرآیندهای متابولیک نقش محوری دارند شامل سیرتونین 1 (SIRT1) و سیرتونین 3 (SIRT3) است که به ترتیب در میتوکندری و هسته حضور دارند. SIRT1 عملکرد داستیلاسیون خود را با جدا کردن گروه استیل از باقیماندهی لیزین پروتئینهای هدف انجام میدهد. این پروتئین در مرگ برنامهریزی شده سلولی، چرخه سلولی، عملکرد میتوکندری، متابولیسم و اعمال متابولیک نیز نقش مهمی دارد (1).
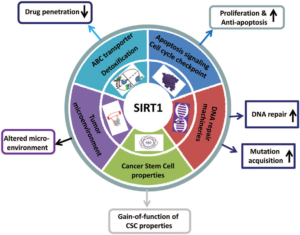
شکل 1- نقشهای متفاوت سیرتونین در سلول
ساختار SIRT1 :
در ساختمان سیرتونین، 2 دومن اختصاصی موجود است :
1- small domain there standard zinc ribbon Motif
2 – domain Rossmonn fold
جایگاه اتصال NAD بین 2 دومن میباشد (2).
توزیع بافتی SIRT1:
سیرتونین در طیف وسیعی از بافتها و ارگانها بیان میشود. این ژن در کبد، پانکراس، قلب، ماهیچه و بافت چربی موش بیان میشود. SIRT1 به طور انحصاری در مغز نیز بیان میشود و در بیماریهای تحلیل روندهی عصبی بیان آن وجود دارد. این پروتئین در مراکز متابولیک مغز مثل هیپوتالاموس و ناحیهی مرکزی مغز نیز بیان میشود. در طول مدت زندگی، SIRT1 در بخشهای هیپوتالاموس مغز کاهش بیان دارد. SIRT1 در سطح بالائی از بافتهای جنینی نیز بیان می شود (3, 4).
توزیع سلولی SIRT1:
توزیع سلول بستگی به تیپ سلولی، وضعیت استرس و واکنشهای مولکولی دارد. آنالیز ایمنوسیتوشیمیایی و آنالیز وسترن بلات، نشاندهندهی این است که SIRT1 عمدتاً در هسته بیان میشود و به مقدار کمتر در سیتوپلاسم وجود دارد (5, 6).
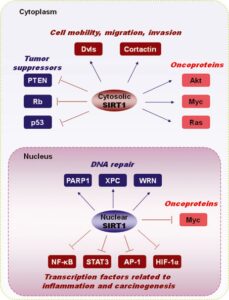
شکل 2- SIRT1 در سیتوپلاسم و هسته دارای نقش های متفاوتی می باشد. در سیتوپلاسم بیشتر به عنوان مهارکننده تومور مطرح می باشد. در حالی که در هسته نقش تعمیر ژنوم را به عهده دارد (7)
مولکولهای هدف SIRT1 :
هدفهای داخل سلولی وسیعی در ارتباط با عملکرد بیولوژیکی، به وسیلهی خاصیت داستیلاسیون میانجیگری میشود. این فعالیت در متابولیسم انرژی، التهاب و تنظیم شکستهایی که در DNA دو رشتهای به وجود میآید نقش دارد (1). این مولکولهای هدف شامل موارد زیر است:
1- هیستونها:
این پروتئینها برای فشردهسازی DNA و کروماتین لازم هستند. افزایش استیلاسیون هیستون از باند شدن هیستون به DNA و فشردهسازی آن جلوگیری میکند. H1 (هیستون یک) در قسمت اسیدآمینه لیزین توسط SIRT1 داستیله میشود. H3(هیستون سه) در لیزینهای 9،14 و 18،H6 (هیستون شش) در لیزینهای 12 و 6 این عمل روی آنها انجام میشود (8).
2- P53 :
این پروتئین در فعالیتهایی مانند چرخه سلولی، تعمیر DNA ، مرگ برنامهریزی شده سلول نقش دارد. P53 نقش مرکزی در عملکردهای وابسته به سیرتونین و در توموزایی ایفا میکند. با این وجود بعضی از مطالعات نشان میدهد که SIRT1 گاهی یک مهارکننده تومور میباشد.
واکنش بین P53 و SIRT1 بر روی تومورزائی بحث برانگیز است (8, 9).
3- پروتئینهای مرتبط باDNA آسیبدیده:
پروتئینهایی که در آسیب به DNA وارد عمل میشوند و هدف SIRT1 قرار میگیرند شامل موارد زیر میباشند:
- KU70: دارای 2 زیر واحد Ku70 و Ku80 میباشد. این 2 زیر واحد نقش کلیدی در هسته سلول به عهده دارند که شامل تعمیر DNA، نگهداری کروموزوم، تنظیم رونویسی و نوترکیبی میباشد. SIRT1 به دلیل واکنشی که با Ku70 دارد از مرگ برنامهریزی شده سلول جلوگیری میکند (10).
- FOXO یا (Forkhead box):جزء خانوادهی فاکتورهای رونویسی است که در مرگ برنامهریزی شده سلولی و چرخهی سلولی نقش دارد. SIRT1 با داستیلاسیون FOXO باعث افزایش انقباضات هسته و فعالیت رونویسی میشود. فعال بودن اعضای خانوادهی FOXO میتواند باعث افزایش مقاومت به استرس اکسیداتیو شود (11).
- P300: یک استیل ترانسفراز میباشد که مسیرهای انتقال پیام فراوانی را تنظیم میکند. این عمل به وسیلهی تسهیل کردن فعالیت رونویسی SIRT1 و با مهار کردن P300 توسط SIRT1 انجام میشود و وابسته به NAD است (12).
- T1p60: یک هیستون استیل ترانسفراز میباشد که با استیله کردن مواردی مثل هیستونها و P53 باعث ارتقاء مرگ برنامهریزی شده سلول میشود. SIRT1 باعث استیلاسیون و غیرفعال کردن TIP60 میشود. این عمل نقش مهم SIRT1 را در کنترل فعالیت استیل ترانسفرازی و اعمال وابسته به هسیتون نشان میدهد (12).
- NF-KB (Naclear- factor- kappa-B): در پروسههایی مثل ایمنی، التهاب و مرگ برنامهریزی شده سلول نقش دارد. SIRT1 با واکنش با زیر واحد NF-KB عملکرد خود را ایفا میکند (1).
تنظیم کنندههای داخلی SIRT1
E2F-1: باعث بیان SIRT1 در سطح رونویسی میشود. داستیلاسیون این پروتئین باعث فعال کردن پروتئینهایی مثل کمک فعالکنندههای رونویسی نیز میشود (13).
P53: پاسخدهی داخلی پروموتور SIRT1 را تنظیم میکند. P53 باعث افزایش سطح رونویسی SIRT1 در بافتهای مختلف میشود. SIRT1 و P53 دارای تنظیم فیدبکی هستند (14).
mir-34: به ´3 UTR در قسمت SIRT1 در سطح mRNA متصل میشود. و باعث جلوگیری از ترجمه SIRT1 و مهار فعالیت داستیلاسیون این پروتئین میشود (1).
AROS (Active regulator of sirtunin): یک پروتئین 142 آمینواسیدی است. مستقیماً سیرتونین را فعال میکند و فعالیت رونویسی وابسته به P53 را تضعیف میکند. کاهش AROS باعث افزایش حساسیت سلول به مرگ برنامهریزی شده داخل سلولی میشود (15).
- Nogueiras R, Habegger KM, Chaudhary N, Finan B, Banks AS, Dietrich MO, et al. Sirtuin 1 and sirtuin 3: physiological modulators of metabolism. Physiological reviews. 2012;92(3):1479-514.
- Frye RA. Phylogenetic classification of prokaryotic and eukaryotic Sir2-like proteins. Biochemical and biophysical research communications. 2000;273(2):793-8.
- Bamps S, Wirtz J, Savory FR, Lake D, Hope IA. The Caenorhabditis elegans sirtuin gene, sir-2.1, is widely expressed and induced upon caloric restriction. Mechanisms of ageing and development. 2009;130(11):762-70.
- Lafontaine-Lacasse M, Richard D, Picard F. Effects of age and gender on Sirt 1 mRNA expressions in the hypothalamus of the mouse. Neuroscience letters. 2010;480(1):1-3.
- Michishita E, Park JY, Burneskis JM, Barrett JC, Horikawa I. Evolutionarily conserved and nonconserved cellular localizations and functions of human SIRT proteins. Molecular biology of the cell. 2005;16(10):4623-35.
- Tanno M, Sakamoto J, Miura T, Shimamoto K, Horio Y. Nucleocytoplasmic shuttling of the NAD+-dependent histone deacetylase SIRT1. Journal of Biological Chemistry. 2007;282(9):6823-32.
- Hoffbrand AV, Catovsky D, Tuddenham EG. Postgraduate haematology: John Wiley & Sons; 2008.
- Kuzmichev A, Margueron R, Vaquero A, Preissner TS, Scher M, Kirmizis A, et al. Composition and histone substrates of polycomb repressive group complexes change during cellular differentiation. Proceedings of the National Academy of Sciences of the United States of America. 2005;102(6):1859-64.
- Liu X, Wang D, Zhao Y, Tu B, Zheng Z, Wang L, et al. Methyltransferase Set7/9 regulates p53 activity by interacting with Sirtuin 1 (SIRT1). Proceedings of the National Academy of Sciences. 2011;108(5):1925-30.
- Jeong J, Juhn K, Lee H, Kim S, Min B, Lee K, et al. SIRT1 promotes DNA repair activity and deacetylation of Ku70. Experimental and Molecular Medicine. 2007;39(1):8.
- Kops GJ, Dansen TB, Polderman PE, Saarloos I, Wirtz KW, Coffer PJ, et al. Forkhead transcription factor FOXO3a protects quiescent cells from oxidative stress. Nature. 2002;419(6904):316-21.
- Bouras T, Fu M, Sauve AA, Wang F, Quong AA, Perkins ND, et al. SIRT1 deacetylation and repression of p300 involves lysine residues 1020/1024 within the cell cycle regulatory domain 1. Journal of Biological Chemistry. 2005;280(11):10264-76.
- Brooks CL, W G. How does SIRT1 affect metabolism, senescence and cancer? Nature Reviews Cancer. 2008;9(2):123-8.
- Ford J, Jiang M, Milner J. Cancer-specific functions of SIRT1 enable human epithelial cancer cell growth and survival. Cancer Research. 2005;65(22):10457-63.
- Kim E-J, Kho J-H, Kang M-R, Um S-J. Active regulator of SIRT1 cooperates with SIRT1 and facilitates suppression of p53 activity. Molecular cell. 2007;28(2):277-90.
microRNAها در هموستاز و ترومبوز
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام