ارزش کلینیکی آزمایشهای بیوشیمیایی تیروئید
مرتضی داودی
PhD بیوشیمی، دانشگاه پیام نور واحد تهران شرق
خلاصه موضوع:
غدۀ تیروئید از مهمترین غدد درونریز در بدن است که هورمونهای تیروئیدی را ترشح مینماید. گرچه عمدهترین شکلی از هورمون که توسط این غده به خون ترشح میشود بهصورت T41 است، صورتهای دیگری از هورمون نیز مانند T32، fT43، fT34 و rT35 و غیره در خون دیده میشود که هر یک با تکنیکهای مختلف آزمایشگاهی قابل اندازهگیری هستند. پارامترهای دیگری نیز در رابطه با تعیین چگونگی کارکرد غدۀ تیروئید در آزمایشگاههـــــــا بهطور معمول اندازهگیری میشوند که شامل TSH6، RU7، Anti Tpo8، Tg9 است و تستهای اختصاصی دیگری هم هستند که کمتر مورد استفاده قرار میگیرند. سؤالی که مطرح میشود این است که برای ارزیابی چگونگی عملکرد غدۀ تیروئید در یک فرد، بهترین تصمیم ممکن در انتخاب پروفایل تستهای آزمایشگاهی چیست؟ جهت پاسخ به این سؤال مرور مختصری در مورد کلیات عوامل ذکرشده در این مورد خواهیم داشت و در نهایت جمعبندی و نتایج بدستآمده مطرح خواهند شد.
کلیدواژهها: T4 ,T3 ,fT4 ,fT3
مقدمه:
با توجه به اینکه منظور از انواع سنجشهای آزمایشگاهی نام برده شده در بالا، دستیابی به مقادیر کمی دقیق از هورمونهای تیروئیدی و تشخیص عملکرد طبیعی و یا اختلال در عمل این غده با تکیه بر این مقادیر است، لذا دو مطلب حائز اهمیت است: اول اینکه یک ترسیم کلی از چگونگی چیدمان این عوامل از منبع ترشح هورمون تا سلولهای هدف در نظر گرفته شود و دوم اینکه کدامیک از پارامترهای اندازهگیری شده از ارزش کلینیکی بیشتری برخوردار است. در این رابطه از توضیحات اضافه در مورد چگونگی عمل هورمونها و تشریح بیماریهایی که در صورت اختلال در عمل این غده ایجاد میشود پرهیز شده است، چرا که این موارد بهطور گسترده در کتب مختلف مربوط شرح داده شده است. در اینجا هدف ارزیابی مقایسهای ارزش پارامترهای اندازهگیری شده بهعنوان راهنما در تشخیص چگونگی عملکرد غدۀ تیروئید است.
1- Tetra Iodothyrosine Or L – Thyroxine
2- Tri Iodothyrosine
3– Free T4
4– Free T3
5– Reverse T3
6 – Thyroid Stimulating Hormone
7 – Resin Uptake
8 – Anti Thyroperoxidase
9 – Thyroglobulin
1– غدۀ تیروئید:
غدۀ تیروئید بزرگترین غدۀ درونریز در انسان است و حدود 20 گرم وزن دارد. از دو لب تشکیل شده که در دو طرف نای قرار گرفته است. غدۀ تیروئید از فولیکولهای بسیار ریزی تشکیل شده که از سلولهای اپیتلیال ساخته شدهاند که منشأ بافتی آنها اپیتلیوم انتهای زبان است. فضای داخل فولیکولها را مادهای پروتئینی بنام کلوئید پر میکند. از سلولهای C غدۀ تیروئید که بهطور پراکنده در بین فولیکولها قرار گرفتهاند و منشأ رویانی آنها با سلولهای اپیتلیال فرق دارد، هورمون کلسیتونین ترشح میشود که پپتیدی است و در متابولیسم کلسیم و استخوانها نقش دارد (1).
در جنین ظرفیت تغلیظ ید و ساخت تیروکسین در غدۀ تیروئید از حدود هفتۀ یازدهم شروع میشود. در این هنگام ید رادیواکتیو که به مادر داده میشود بهزودی در تیروئید جنین انباشته میشود. به نظر نمیرسد که رشد و توسعۀ اولیه تیروئید به TSH وابسته باشد، زیرا ظرفیت سنتز و ترشح TSH از هیپوفیز تا هفتۀ 14 ظاهر نخواهد شد. پس از آن تغییرات سریع در عملکرد هیپوفیز و تیروئید ایجاد خواهد شد. احتمالاً به دلیل بلوغ هیپوتالاموس و افزایش ترشح TRH، غلظت TSH سرم بین هفتههای 18 تا 26 بارداری افزایش خواهد یافت و پس از آن از سطح TSH مادر بالاتر خواهد بود. این سطح بالاتر میتواند بازتاب تنظیم یک نقطۀ بالاتر از فیدبک منفی کنترل ترشح TSH در دوران جنینی نسبت به بلوغ باشد (2).
تیروگلوبولین، گلیکوپروتئینی یددار با وزن مولکولی 660000 دالتون است که 10 – 8% وزن آن را ریشـــــههای گلیکوزیل و 1 – 0/2% وزن آن از ید تشکیل میشود. دارای 5000 اسیدآمینه و حاوی 115 ریشۀ تیروزیل است که میل ترکیبی زیادی برای ید دارند. 70% ید موجود در مولکول تیروگلوبولین بهصورت دو ترکیب غیرفعال منویدوتیروزین1 و دییدوتیروزین2 و 30% ید بهصورت ریشههای فعال ترییدوتیرونین (T3) و تترایدوتیرونین (T4) میباشد. تیروگلوبولین در سلولهای فولیکولها ساخته شده و به فضای داخل فولیکول انتقال مییابد (اندوسیتوز). هورمون محرک تیروئید (TSH) دارای اثر فعالکننده بر روی کلیۀ مراحل بیوسنتز تیروگلوبولین از جمله رونویسی ژن مربوطه میباشد (1 و 3). تیروزین اسیدآمینۀ مهمی است که در ساختمان تیروگلوبولین وجود دارد، به علت دارا بودن حلقۀ بنزنی در گروه اسیدآمینههای آروماتیک قرار میگیرد، حلالیت آن در آب کم است و به آن هیدروکسی فنیل آلانین نیز میگویند زیرا از اکسیداسیون فنیل آلانین حاصل میشود (3).
تیروگلوبولین پروتئین پیشساز هورمونهای تیروئیدی و شکل ذخیرهای آنها در فضای میانی فولیکولها است. این ذخیره با ذخیرۀ پلاسمایی قادر است نیاز بدن به هورمونهای تیروئیدی را برای مدت چند هفته تأمین نماید. در حدود چند دقیقه پس از اثر TSH (یا cAMP) مولکولهای تیروگلوبولین مجدداً از فضای داخل فولیکول بهصورت پینوسیتوز به داخل سلولهای فولیکولی کشانده میشوند و سپس در لیزوزومها تحت اثر آنزیمهای پروتئاز و پپتیداز هیدرولیز شده و اسیدآمینههای یدوتیروزیل آزاد میشوند و هورمونهای T3 و T4 از طریق قاعدۀ سلولهای فولیکولی به خارج فولیکولها ترشح میگردند و مستقیماً وارد جریان خون مویرگهایی که فولیکولها را احاطه کردهاند، میشوند (1 و 3).
1- Mono Iodothyrosine (MIT)
2- Di Iodothyrosine (DIT)
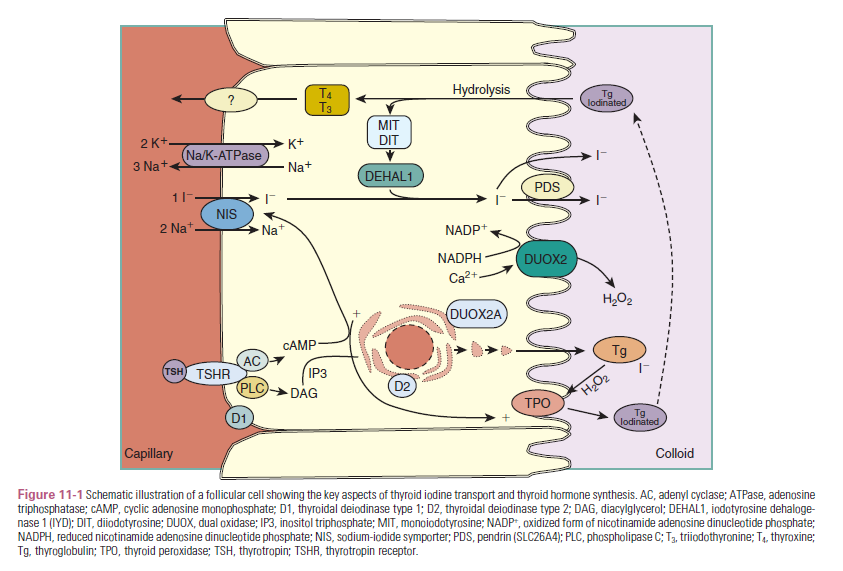
عمل تیروئید تولید مقادیری از هورمون تیروئید است که نیاز بافتهای محیطی را برآورده سازد. این عمل نیازمند جذب ید توسط سیمپورتر سدیم – ید (NIS) است که به کلوئید انتقال مییابد و توسط تیروئید پراکسیداز (TPO) اکسید میشود تا اجازه یابد حدود 110 نانومول در لیتر (85 µg) T4 بسازد که 65 درصد وزنی آن ید است. این عمل نیاز به ساخت حدود 330 کیلودالتون گلیکوپروتئین Tg دارد. تیروزینهای خاصی از همودایمر Tg در مرزهای خاصی از سلولهای تیروئیدی یدینه شده و MIT و DIT تشکیل میشوند (شکل 1). این عمل نیاز به تشکیل پراکسید هیدروژن (H2O2) توسط اکسیداز دوتایی (DUOX1 and 2) و TPO دارد که اکسیداسیون و انتقال آن را به تیروزین انجام میدهند. همچنین TPO جفت شدن دو مولکول DIT و یا یک مولکول DIT با یک مولکول MIT را انجام میدهد که به ترتیب موجب ساخته شدن تیروکسین (T4) و ترییدوتیرونین (T3) میشود که در کلوئید ذخیره شده و هنوز بخشی از مولکول Tg هستند (2).
پینوسیتوز کلوئید ذخیره شده توسط سلولهای غدۀ تیروئید که فولیکولها را احاطه کردهاند، منجر به تشکیل فاگولیزوزوم میشود، قطرات کلوئید که در آن Tg توسط پروتئازهای ویژه هضم میشود تا T4، T3،DIT و MIT بهصورت دراپلت درآیند، در سمت بازال غشاء سلول قرار دارند. T4 و T3 از فاگولیزوزوم به بیرون انتقال مییابد و از غشاء سلولی بازولترال عبور میکند تا از سلول خارج شده و وارد جریان خون شوند، درحالیکه DIT و MIT توسط یدوتیروزین دهیدروژناز (DEHAL1) دیدینه شده تا ید دوباره وارد چرخه ساخت هورمون شود (2).
هورمون تیروئیدی در لیزوزوم از Tg جدا میشود اما انتقال آن به سیتوزول مشخص نیست که چگونه صورت میگیرد و متعاقباً وارد پلاسما میشود. با وجود بیان ترانسپورترهای MCT8 در غدۀ تیروئید (که بعداً خواهیم دید) ممکن است که این انتقالدهندهها در خروج T4 و T3 از فاگولیزوم و یا سلول تیروئید نقش داشته باشند (2).
2– طرز عمل هورمونهای تیروئیدی:
بیشتر انرژی سلول صرف بکار انداختن پمپهای Na+/ K+ATPase میشود و از آنجا که این پمپها در همۀ سلولهای بدن وجود دارند، کلیۀ سلولهای بدن تحت تأثیر هورمونهای تیروئیدی قرار میگیرند و میتوان نتیجه گرفت که نقش اصلی هورمونهای تیروئیدی، افزایش فعالیت این پمپها است و از این طریق، مصرف زیاد ATP منجر به افزایش واکنشهای فسفریلاسیون اکسیداتیو و مصرف بیشتر اکسیژن میگردد (1 و 3).
عمل هورمونهای تیروئیدی در افزایش پروتئینسازی از طریق اثر هورمون در رونویسی ژنهای خاص و سنتز mRNA توجیه میشود. هورمونهای تیروئیدی و گلیکوکورتیکوئیدها در مرحلۀ رونویسی ژن GH (هورمون رشد) اثر دارند و فعالیت آن را افزایش میدهند تا بدین ترتیب هورمون رشد بیشتری تولید گردد. به نظر میرسد که اثر متابولیسمی T3 در پروتئینسازی و رشد بدن از این طریق صورت میگیرد. هورمونهای تیروئیدی از عوامل اصلی تنظیم رشد و نمو در دوران جنینی میباشند و کمبود این هورمونها در دوران جنینی منجر به بروز بیماری کرتینیسم 1 میگردد که با اختلالات مادرزادی و عقبافتادگی ذهنی همراه است (1 و 3).
3– انتقال هورمونهای تیروئیدی در پلاسما:
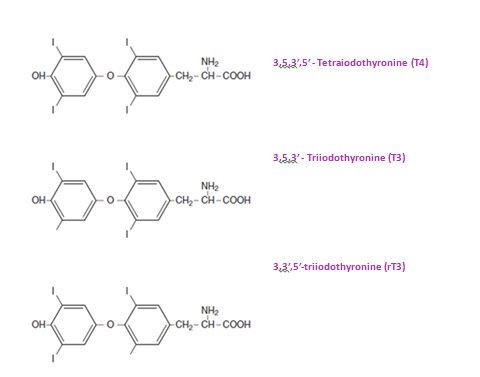
تغییرات متابولیک هورمونهای تیروئیدی در بافتهای محیطی، قدرت و تنظیم اثرات بیولوژیک آنها را مشخص میسازد. شمار گوناگونی از یدوتیروزینها و مشتقات متابولیک آنها در پلاسما وجود دارد. از این میان، T4 از نظر غلظت بیشترین مقدار را دارد و تنها هورمونی است که منحصراً با ترشح مستقیم از غدۀ تیروئید افزایش مییابد. در افراد طبیعی، T3 نیز از تیروئید آزاد میشود اما تقریباً 80% آن از بافــــــــــتهای محیطی و با حذف آنزیمی یک اتم ید از ‘5 در T4 مشتق میشود (حلقۀ بیرونی یا ′5 monodeiodination). یــــــــــــدوتیروزینهای دیگر و مشتــــــقات آنها در بافتهای محیطــــی از T4 و
1– Cretinism
T3 ایجاد میشوند، مانند (reverse T3) triiodothyronine 3 3′,5′ که به میزان کم ایجاد میشود و از نظر متابولیک بیاثر است (شکل 2) (2).
Figure -2 Chemical formulaeof Thyroid Hormones
تقریباً 70- 50% هورمونهای تیروئیدی موجود در بدن در خارج از غدۀ تیروئید و بهصورت ترکیب با پروتئینهای حامل در پلاسما وجود دارند، این پروتئینهای حامل عبارتند از:
1- Thyroxin binding globulin (TBG): گلیکوپروتئینی است با وزن مولکولی 50000 که میل ترکیبی زیادی برای پیوند با T3 و T4 دارد و در هر 100 میلیلیتر پلاسما ظرفیت پیوند با 20 میکروگرم هورمون تیروئید را دارا است. در شرایط طبیعی این گلوبولینها قادرند با تمام هورمونهای T3 و T4 موجود در پلاسما ترکیب شوند، اما بههرحال همواره مقداری جزئی از این هورمونها بهصورت آزاد در پلاسما وجود دارد و کلیۀ اثرات فیزیولوژیکی این هورمونها مربوط به غلظت هورمون آزاد در پلاسما میباشد. انتقال 70% از هورمونهای تیروئیدی به عهدۀ این پروتئین است (4 و 5).
2-Thyroxin binding pre albumin (TBPA): میل ترکیبی این پروتئین حامل (که امروزه به نام trans thyretin شناخته میشود) نسبت به TBG بسیار کمتر و در حدود 1/100 است. این پروتئین وظیفۀ انتقال حدود 20% از هورمونهای تیروئیدی را به عهده دارد (4 و 5).
3- Albumin (Alb): با میل ترکیبی کمتر برای هورمونهای تیروئیدی و انتقالدهندۀ حدود 10% از این هورمونها (4 و 5).
اتصالT4 و T3 به TBG با داروهایی مانند,phenytoin ,salicylate ,salsalate ,furosemide fenclofenac و mitotane مهار میشود. افینیتی این ترکیبات برای TBG بسیار کمتر از یدوتیروزینها است، اما غلظت آنها در پلاسما به اندازۀ کافی بالا هست که با اتصال T4 و T3 رقابت نمایند و میزان هورمون توتال را کاهش دهند، هرچند که میزان fT4 نرمال خواهد ماند (2).
در سرم طبیعی fT4 حدود 0.02% از T4 توتال است (20 pmol/L, 1.5 ng/dL). تقریباً 20 مرتبه افینیتی کمتر TBG برای T3 منجر به بخش بیشتری از T3 بهصورت آزاد میشود (0.3%). بررسی شده است که غلظت هورمون آزاد، مشخصکنندۀ وضعیت متابولیک است و این غلظت است که با مکانیسمهای هموستازی حمایت میشود (2).
4– دیدینازهای شناسایی شده در انسان:
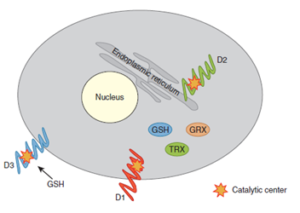
سه نوع دیدیناز به نامهای D1، D2 و D3 در انسان شناسایی شده است که ساختار مشابه دارند. همه همودایمر و پروتئینهای درون غشائی هستند و همه برای کاتالیز موفق نیاز به یک کوفاکتور تیول دارند. هرچند که D1 و D2 هردو T4 را فعال میکنند، اما چندین تفاوت مهم دارند.D1 دیدیناسیون هردوی ‘5 و 5 را در T4 انجام میدهد و به ترتیـــــــــب T3 و rT3 تشکیل میدهــــــــــــند، هرچــــــــــــــــــند که Km برای این واکنشها تقریباً سه برابر بزرگتر از D2 و D3 برای این سوبســـــــــترا است. سوبستراهای ترجیحــــی برای D1،
rT3 (5’ deiodinstion) و T3SO4 (5 deiodination) است. برخلاف D2 و یا D3، D1 توسط PTU(Propyl Thio Uracil) مهار میشود. همچنین تفاوت D1 با D2 در این است که D1 با افزایش هورمونهای تیروئید توسط افزایش رونویسی ژن بهطور قابلملاحظهای افزایش مییابد، درحالیکه mRNAD2 با هورمونهای تیروئید کاهش مییابد. نیمهعمر D2 فقط در حدود 20 تا 30 دقیقه است اما در D1 و D3 بیش از 12 ساعت است. این امر به خاطر یوبیکوئیتنه شدن سریع D2 در پروسهای است که توسط واکنش با سوبسترای خود، T4 و یا T3 انجام میشود. گمان نمیرود D1 و D3 یوبیکوئیتنه شوند (2).
موقعیت درون سلولی D2 نزدیک هسته است و T3ای را که با عمل کاتالیزی خود ایجاد میکند، بهتر در دسترس هسته قرار میدهد. T3 بوجود آمده توسط D2 بهویژه در ورود به هسته و اتصال به رسپتور هورمون مؤثرتر است (شکل 3)، از طرف دیگر D1 در موقعیت غشاء پلاسمایی قرار دارد وT3 بوجود آمده با این آنزیم ترجیحاً وارد منبع پلاسمایی میشود (2).
Figure 3- Predicted topologies of the three iodothyronine deiodinases.The deiodinases are integral membrane proteins that require athiol cofactor for catalytic activity. The type 1 deiodinase (D1) is in theplasma membrane and type 2 (D2) is localized in the endoplasmic reticulum.The active centers of D1 and D2 are in the cytosol and depend onintracellular thiols such as reduced glutathione (GSH), thioredoxin (TRX),and glutaredoxin (GRX) for catalytic activity. The type 3 deiodinase (D3)is also anchored in the plasma membrane but has access to extracellularthiols.
اگر کاهش T4 پلاسما بیشتر از آن باشد که با افزایش فعالیت D2 جبران شود، در هیپوتالاموس و تیروتروفها افزایش TRH و TSH رخ میدهد که تیروئید را تحریک خواهند نمود (2).
D3 مهمترین غیرفعالکنندۀ هورمون تیروئید است که دیدیناسیون حلقۀ داخلی را در هردوی T3 و T4 انجام میدهد. در بالغین D3 در برخی سلولهای بدخیم و تعدادی تومورهای انسانی دیده شده، شامل آستروسیتها، الیگودندروما، گلیوسارکوما، گلیوبلاستوما، ادنومای ترشحکنندههای TSH هیپوفیز، سرطان کولون و کارسینومای سلولهای غشاء پایه است (2).
مشخص شده است که در چندین بافت موش صحرایی، شامل بافتهایی که D1 را بیان میکنند، مانند کلیه و کبد، اغلب T3 هسته از پلاسما مشتق میشود. در بافتهای دارای D2 مانند کورتکس مغز موش صحرایی، هیپوفیز، چربی قهوهای و عضلات اسکلتی، فعالیت D2 بهعنوان منبع T3 درون سلولی است، بطوریکه غلظت T3 درون هسته بیشتر از تبدیل T4 درون سلول میباشد. در این بافتها نیم و یا بیشتر T3 درون سلولی بهطور موضعی از تبدیل T4 درون بافت است. در موش صحرایی، بافتهایی که وابسته به D2 برای T3 هسته هستند، آنهایی هستند که در آنها تهیۀ هورمون تیروئید بهطور مداوم برای وضعیت نمو نرمال (کورتکس مغزی)، تنظیم غدۀ تیروئید (هیپوفیز) و بقاء در هنگام استرس سرما (بافت چربی قهوهای) میباشند. این بافتها همچنین با میزان بالای اشباع رسپتورهای هستهای T3 نسبت به بافتهایی مانند کبد و کلیه که در غلظت طبیعی T3 سرم فقط 50% اشغال میشوند، شناخته میشوند (2).
با افت T4، نیمهعمر پروتئین D2 به دلیل کاهش میزان یوبیکوئیتنه شدن و تجزیۀ پروتئازومی، افزایش مییابد، افزایش فعالیت D2، فشار کاهش T4 سرم را در بافتهای بیانکنندۀ D2 آرام کرده و به هموستازی T3 کمک میکند (2).
حذف ید از رژیم غذایی موجب کاهش سریع غلظت T4 در سرم شده و همزمان افزایش TSH در سرم را بدنبال دارد. جالب اینکه کاهش T3 قابل اندازهگیری رخ نمیدهد، چون عقیده بر این است که افزایش TSH باید بهواسطۀ کاهش تولید T3 درون سلولی از T4 در هیپوفیز، هیپوتالاموس و یا هردو باشد (2).
استروژن موجب افزایش TBG میشود. تجویز استروژن برای زنان پس از یائسگی موجب افزایش 15 تا 20% TSH میشود، در نتیجۀ این افزایش ترشح T4 توتال افزایش مییابد ولی fT4 تغییر ندارد (2).
5– غلظتهای T4 و T3 آزاد:
دقیقترین روش اندازهگیری مستقیم غلظتهای آزاد T4 و T3 سرم با اندازهگیری این هورمونها در دیالیزات و یا سرم اولترافیلتر شده، میسر است. این روش برای پروسههای کلینیکی عملی نیست، بنابراین استراتژیهای جایگزین برای تخمین غلظتهای آزاد هورمون تیروئید، توسعه یافته است. در یک روش سرم با مقادیر هورمون مارکدارشدۀ قابل ردیابی غنی میشود و غلظت ایزوتوپ در دیالیزات و یا محلول اولترافیلتر شده، بهعنوان فراکسیونی از آنچه در سرم غیررقیقشده وجود دارد، بیان میشود. غلظت خالص هورمون آزاد حاصلضرب غلظت توتال هورمون و فراکسیونی است که دیالیز و یا اولترافیلتر شده است. حدود 0.02% از T4 و 0.3% از T3 بهصورت آزاد و یا متصلنشـــــــــــــــــده به پروتئین حامل است. مقادیر طبیعی
fT4 (0.7 to 2.5 ng/dL) و برای fT3 (0.2 to 0.5 ng/dL) است (2).
به دلیل اینکه T4 محصول ترشحی عمدۀ تیروئید است و ارتباط نزدیکتری با TSH سرم دارد، در اغلب مواقع برآورد fT4 برای مشخص کردن تولید و یا ترشح تیروئید لازم بنظر میرسد. شماری از روشها برای اندازهگیری T4 (یا T3) آزاد در سرم تام با متدهای اتوماسیون بهکار گرفته میشود. گرچه بسیاری از تستهای اتوماتیک بیان میکنند که بهطور مستقیم fT4 را اندازهگیری میکنند، اما اینطور نیست و نتایج در سرمها با پروتئینهای اتصالی غیرطبیعی عموماً مطلق نیست، بنابراین بررسیکنندۀ کلینیک بیمار باید در مورد اندازهگیری fT4 که با هر روشی انجام شده و با وضعیت کلینیکی بیمار و TSH همخوانی ندارد، آگاه باشد. در چنین شرایطی متد دیگری برای برآورد fT4 و FT4I بکار میرود و یا اینکه نتایج نادیده گرفته میشود. بهعنوان مثال در حالت بارداری و یا بیماریهای سخت، متدهای اتوماسیون جوابهای غلط پائین میدهند (2).
با وجود عمومیت کارآیی و سودمندی اندازهگیری TSH سرم بهتنهایی بهعنوان ابزار غربالگری شناسایی بیماران با اختلال تیروئید، بیمار نباید فقط با توجه به TSH غیرطبیعی تحت درمان قرار گیرد. اندازهگیری TSH یک واکنش غیرمستقیم به تولید هورمون تیروئید است و بهتنهایی قادر به تشخیص قطعی ویژۀ اختلال در تولید هورمون تیروئید نیست (2).
6– انتقال هورمون تیروئیدی از غشاء:
پیشرفت در زمینۀ اطلاع از نحوه انتقال هورمون تیروئید از غشاء بسیار شگفتآور بوده است؛ قبلاً فرض میشد که انتقال یدوتیروزین از غشاء با انتشار غیرفعال انجام میشود، اما بعدها مشخص شد که جذب و دفع هورمون تیروئید با انتقالدهندههای پروتئینی صورت میگیرد. چندین انتقالدهندۀ هورمون تیروئید شناسایی شده است؛ شامل منوکربوکسیلات ترانسپورترهای 8 و 10 MCT8)، (MCT10 و ارگانیک آنیون ترانسپورتینگ پلیپپتید 1C1(OATP 1C1). MCT8 و MCT10 که در چندین بافت بیان میشوند و انتـــــــقال T3 T4 ,rT3 و T2 را تسهیل میکنند، OATP 1C1 اغلب در مغز بیان میشود و ترجیحاً T4 را انتقال میدهد؛ جایی که T4 به درون آستروسیتها منتقل میشود. نشان داده شده است که نقص در مولکول یک ترانسپورتر منفرد MCT8 موجب رخداد شدید نورولوژیک توسعهیافته میشود.
سندرم Allan-Herndon-Dudley (AHDS) یک وضعیت X – linked است که با عقبافتادگی ذهنی شدید، اختلال در مفصل، اختلال حرکت، هایپوپلازی عضله و پاراپلازی انقباضی همراه با سطح افزایشیافته T3 سرم مشخص میشود. تمام بیماران مورد بررسی با این سندرم، جهشهایی در ژن MCT8 داشتهاند. در این زمینه بیشتر از 70 نوع جهش شناسایی شده است. گرچه نتیجه اغلب جهشها غیرفعال شدن کامل پروتئین MCT8 است، فعالیت نسبی قابلملاحظهای در شماری از جهشهای MCT8 در فنوتیپهای کلینیکی ملایمتر مشاهده شده است. شگفتآور اینکه در موشهای MCT8 – null، با وجود افزایش مشخص T3 هیچ آنورمالی شایع نورولوژیک وجود ندارد، برخلاف یافتههای غیرقابل انتظار در فنوتیپهای شدید یا ضعیف در انسان.
همگام بودن افزایش و کاهش هورمون تیروئید در بافتهای مختلف یک مشخصۀ متمایز این سندرم است. بافتهایی که ترانسپورترهایی غیر از MCT8 را بیان میکنند مانند کبد و کلیه، در پاسخ به میزان بالای T3 در گردش دچار هایپرتیروئید موضعی میشوند، درحالیکه بافتهای وابسته به MCT8 برای ورود هورمون تیروئید به سلولها مانند مغز، هیپوتیروئید هستند. دو انتخاب دارویی، PTU به همراه L – T4 و یک ترکیب وابسته تیروئیدی، دی یدوتایروپروپیونیک اسید (DITPA) که برای ورود به سلول وابسته به MCT8 نیست، برای درمان بسیاری از بیماران دارای جهشهای ژنی MCT8 بکار میرود.
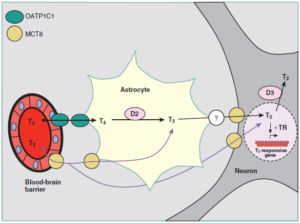
دیگر ترانسپورتر ویژۀ T4، OATP 1C1 (عضوی از خانوادۀ پلیپپتیدهای انتقالدهندۀ آنیونی) که در عروق موئین مغز بیان میشود، گمان میرود که T4 را از سد خونی در مغز عبور میدهد. در مجموع این نتایج پیشنهاد میکند که تهیۀ T3 برای نرونها میتواند طبق طرح نشان داده شده در شکل 4 انجام شود (2).
Figure 4- Potential pathways for entry of T3 into the central nervous system. Thyroid hormones are transported through the blood-brain barrier (OATP) or the blood-CSFbarrier (OATP and MCT8). In the astrocytes and tanycytes, T4 is converted to T3, which then enters the neurons, possibly through MCT8. In the neurons, both T4 and T3 aredegraded by D3. T3 from the tanycytes may reach the portal vessels in the median eminence. Other transporters may be present on the astrocyte or tanycyte membranes. Inmost cases the transport could be bidirectional, although only one direction is shown. The interaction of T3 with the thyroid hormone receptor (TR) bound as a heterodimer withretinoid X receptor to the thyroid hormone–response element, often in the 5′flanking region of a T3-responsive gene, causes either an increase or a decrease in the transcriptionof that gene. This leads to parallel changes in the concentrations of critical proteins, thus producing the thyroid hormone response characteristic of a given cell. CSF, cerebrospinalfluid; D2 and D3, type 2 and type 3 iodothyronine deiodinases; MCT8, the monocarboxylate transporter 8; OATP, organic anion transporting polypeptide; T2, diiodothyronine;T3, triiodothyronine; T4, thyroxine.
انتقال T4 به درون شبکۀ choroidو یا tanycyteها از طریق OATP1C1 انجام میشود که تحت اثر کنترل منفی هورمون تیروئید در مویرگهای مغزی است. در تانیسیتها و یا آستروسیتها، T4 توسط یدوتیروزین دیدیناز تیپ 2 (D2) به T3 تبدیل میشود و احتمالاً از طریق ترانسپورترهای MCT8/MCT10 از سلول خارج میشود، به جایی که در دسترس جذب نورون، باز هم از طریق MCT8 باشد. نورونها، دیدیناز تیپ 3 (D3) را بیان مینمایند که از فعال شدن T4 ممانعت شده و T3 تجزیه میشود (یدوتیروزین دیدیناسیون را ملاحظه نمایید). این موضوع توضیح منطقی ارتباط جهشهای MCT8 را در سندرم ADHD بدست میدهد، گرچه هنوز معلوم نیست که چرا ظهور این وضعیت تا این اندازه در بیماران مبتلا به هایپوتیروئیدیسم مادرزادی و یا کمبود شدید ید متفاوت است (2).
بحث انتقال با توجه به اینکه در بافتهای خاص ترانسپورترهای یدوتیروزین از شماری از خانوادههای پروتئینهای انتقالی مختلف وجود دارد، پیچیدگی بیشتری پیدا میکند. هر یک از اینها شماری عضو با تغییرات کوچک ساختمانی دارند که ویژگی آنها را برای مادۀ هدف تغییر میدهد. بررسی کامل این موضوع مدنظر این بخش نیست و برای اطلاعات بیشتر علاقمندان میتوانند به نشریات تخصصی رجوع نمایند (2).
در اغلب سلولها حدود 90% از T3 داخل سلولی در سیتوزول قرار دارد. استثناء شناخته شده در هیپوفیز است؛ جایی که تقریباً 50% از T3 درون سلولی در هسته ظاهر میشود. مکانیسم اینگونه توزیع هنوز شناخته نشده است، اما تعجبآور نخواهد بود اگر انتقال فعال هورمونهای تیروئیدی در ورود و خروج به هسته و مابین دیگر اندامکهای درون سلول وجود داشته باشد. یک پروتئین متصلشونده به T3 درون سلولی (mu – crystallin) شناسایی شده است که به میزان زیاد در مغز و قلب انسان بیان میشود اما توزیع فراوانی در بافتهای دیگر نیز دارد. این پروتئین و یا پروتئینهای مشابه ممکن است در لوکالیزه کردن سابسلولار هورمون فعال نقش داشته باشند (2).
7– جمعبندی:
با توجه به مطالب ذکرشده، هورمونهای تیروئیدی در غدۀ تیروئید تولید میشوند و از آنجا به درون خون ترشح میشوند و با اتصال به پروتئینهای حامل (و یا بدون اتصال و بهصورت هورمون آزاد) در تمام بافتهای بدن توزیع میشوند. شکلهایی از هورمون که بهطور عمده در گردش خون محیطی وجود دارند T3 و T4 هستند که با توجه به نیاز سلولهای بدن در بافتهای مختلف و از طریق ترانسپورترهای ذکرشده وارد سلول میشوند. بدیهی است که میزان ورود این هورمونها به درون سلولهای مختلف توسط تنظیم فعالیت این ترانسپورترها و بسته به نیاز سلول تعیین میشود که این نیاز خود بهواسطۀ حالتهای فیزیولوژیک که در نقاط مختلف و در زمانهای مختلف با آن مواجه هستند، مشخص میشود. زمانی که یک سلول نیاز به هورمون تیروئید دارد، انتقالدهندههای غشاء سلول این هورمونها را به درون سلول میبرند. در اینجا هورمونهای آزاد بهطور مستقیم از این انتقالدهندهها عبور میکنند و اگر این میزان ورود هورمون جوابگوی نیاز سلول نباشد، بخشی از هورمونهای متصل به پروتئینهای حامل در مویرگهای محیط اطراف سلول نیز از پروتئین حامل جدا شده و وارد سلول میشوند؛ بنابراین نقش پروتئینهای حامل هورمون مانند TBG، ترانستایرتین و آلبومین توزیع متعادل هورمون در نقاط مختلف بدن است و همچنین هورمونهای متصل به این حملکنندهها بهعنوان ذخیرۀ هورمون قابل دسترس سلولها محسوب میشوند.
8– نتایج:
1– با وجود عمومیت کارآیی و سودمندی اندازهگیری TSH سرم بهتنهایی بهعنوان ابزار غربالگری شناسایی بیماران با اختلال تیروئید، بیمار نباید فقط با توجه به TSH غیرطبیعی تحت درمان قرار گیرد. اندازهگیری TSH یک واکنش غیرمستقیم به تهیۀ هورمون تیروئید است و بهتنهایی قادر به تشخیص قطعی ویژۀ اختلال در تولید هورمون تیروئید نیست. برای توضیح بیشتر در این مورد به مقالهای تحت عنوان “نکاتی در مورد کنترل مصرف داروی لووتیروکسین در کمکاری تیروئید” که در نشریۀ ماهنامۀ اخبار آزمایشگاهی شمارۀ 126 تیرماه 93 موجود است، مراجعه فرمایید.
2– در جنین به دلیل بلوغ هیپوتالاموس و افزایش ترشح TRH، غلظت TSH سرم بین هفتههای 18 تا 26 بارداری افزایش خواهد یافت و پس از آن از سطح TSH مادر بالاتر خواهد بود. این سطح بالاتر میتواند بازتاب تنظیم یک نقطۀ بالاتر از فیدبک منفی کنترل ترشح TSH در دوران جنینی نسبت به بلوغ باشد. در اینجا باید در نظر داشت که به دلیل رشد تدریجی جنین و متعاقباً رشد نوزاد، سیکل فیدبک منفی کنترل ترشح TSH نیز بهتدریج کامل میشود و نوزادی که در غربالگری تیروئید مقدار TSH بالا دارد، نباید بهعنوان کمکاری تیروئید تلقی شود و حتماً باید میزان TSH در ارتباط با مقدار T4 توتال تفسیر گردد. اگر صرفاً به دلیل بالا بودن مقدار TSH برای نوزاد داروی لووتیروکسین و یا دیگر داروهای جبرانکنندۀ هورمون تجویز شود، منجر به افزایش میزان هورمون بیش از حد معمول خواهد شد که مطلوب نخواهد بود. در اینجا لازم به ذکر است که میزان TSH در نوزادان از الگوی خاصی پیروی نمیکند و این مقدار بسته به شرایط فیزیولوژیک و ژنتیک هر نوزاد میتواند متفاوت باشد؛ بدین مفهوم که مقدار TSH میتواند در برخی از نوزادان در حد طبیعی باشد و در برخی دیگر افزایش نشان دهد و این موضوع با توجه به تجربیات آزمایشگاهی نیز قابل تأیید است.
3– میدانیم که فعالترین شکل هورمون تیروئید T3 است؛ یعنی T4 ابتدا باید به T3 تبدیل شود تا بتواند اثرات فیزیولوژیک خود را اعمال نماید. بهطور دقیقتر میتوان دیاگرام زیر را برای ایجاد شکل فعال هورمون در نظر گرفت:
T4 → free T4 → free T3 → biological effect
البته در مواردی که free T3 ایجادشده در سلولها مازاد بر احتیاج خود سلول باشد، با ترشح به خون و اتصال به پروتئینهای حامل به نقاط دیگر بدن انتقال خواهد یافت.
در اینجا توجه به این نکته حائز اهمیت است که نیاز فوری یک سلول به هورمون تیروئیدی، نیاز به شکل آزاد هورمون است که بتواند فعالیت بیولوژیک داشته باشد؛ یعنی مقادیر free T4 و free T3 و همچنین تبدیل free T4 به free T3 برای برآورده کردن نیاز سلول مهم هستند و باید همواره در دسترس سلول باشند. همانطور که در توضیحات بالا بهطور گسترده ذکر شد، مکانیسم توزیع و تنظیم انواع مختلف هورمونهای تیروئیدی بهگونهای است که هموستازی و ثبات هورمونهای عامل (یعنی شکلهای آزاد هورمون) را در پی داشته باشد و در این رابطه دیدیم که اغلب، اثر داروهایی مانند phenytoin ,salicylate ,salsalate ,furosemide ,fenclofenac و mitotane که با رقابت در اتصال به TBG موجب کاهش T4 توتال سرم میشوند و یا استروژن که موجب افزایش TBG و در نتیجۀ افزایش ترشح T4 توتال میشود، موجب تغییر در میزان fT4 نخواهند شد.
در حالات مختلف فیزیولوژیک یا بیمارانی که تحت درمان دارویی هستند نیز انتظار تغییرات در مقادیر آزاد هورمونهای تیروئیدی بیمورد است چراکه هموستازی و ثابت نگه داشته شدن هورمونهای عامل و یا به عبارتی هورمونهای آزاد که بهواسطۀ تنظیمات کنترلی سیستمهای مختلف دیکته میشود، از نوسانات شدید هورمونهای آزاد جلوگیری میکند و به همین دلیل در اغلب اندازهگیریهای آزمایشگاهی اندازهگیریهای fT4 و fT3 مقادیری در محدودۀ نرمال تعریفشده بدست میدهد؛ برای مثال میتوان به این موضوع اشاره کرد که در بیماران مبتلا به کمکاری تیروئید مقدار T3 تنها زمانی کمتر از مینیمم میزان نرمال اندازهگیری میشود که میزان T4 توتال بسیار پایینتر از مینیمم مقدار نرمال باشــــــــد (کمتر از 2 μg/dL) که این موضوع نشان میدهد که تنظیمات کنترلی تا حد امکان در جهت تبدیل T4 به fT4 و متعاقباً به T3 عمل میکند و زمانی که منبع اصلی هورمون یعنی T4 بهطور شدید تخلیه شده باشد، به دنبال آن کاهش fT4 و T3 را شاهد خواهیم بود.
4– با توجه به بند 3 که توضیح داده شد، عملاً اندازهگیری fT4 و یا fT3 در توضیح چگونگی عملکرد غدۀ تیروئید نمیتواند کاربردی داشته باشد و همانطور که در متن این نوشته توضیح داده شده، تکنیکهای رایج در اندازهگیری دقیق این پارامترها ناتوان هستند و در اغلب موارد در بررسی وضعیت کلینیکی فرد مورد آزمایش نتایج بدست آمده برای این پارامترها نادیده گرفته میشوند؛ بنابراین انجام این آزمایشها در پروفایل آزمایشهای بررسی تیروئید نمیتواند کمککننده باشد.
5– در بررسی عملکرد تیروئید از طریق تستهای آزمایشگاهی بهطور عمده با دو وضعیت روبرو هستیم؛ کمکاری و یا پرکاری تیروئید. بهطور خلاصه میتوان این دو وضعیت را در چهار گروه به شرح زیر بررسی نمود:
الف: افرادی که سابقۀ بیماری تیروئید ندارند و با علائم کمکاری تیروئید به پزشک مراجعه مینمایند. در مورد این افراد بهترین آزمایشها به ترتیب اولویت شامل TSH و T4 است.
ب: افرادی که مبتلا به کمکاری تیروئید هستند و تحت درمان داروئی قرار دارند. در مورد این افراد بهترین آزمایش T4 است و انجام TSH چندان کاربردی ندارد. در مورد اینگونه افراد همانطور که ذکر شد شرح مفصلی در نشریۀ ماهنامۀ اخبار آزمایشگاهی تحت عنوان “نکاتی در مورد کنترل مصرف داروی لووتیروکسین در کمکاری تیروئید” شمارۀ 126 تیرماه 93 موجود است که مراجعه به این مطلب به علاقمندان توصیه میشود.
ج: افرادی که سابقۀ بیماری تیروئید ندارند و با علائم پرکاری تیروئید به پزشک مراجعه میکنند. در مورد این افراد بهترین آزمایشها به ترتیب اولویت شامل T3، T4 و TSH است. توضیح اینکه T3 بهترین پارامتر جهت تشخیص پرکاری تیروئید است ولی احتمال T4– تیروتوکسیکوزیس نیز نباید نادیده گرفته شود. در برخی موارد نیز میزان T4 در حد طبیعی است و مقدار T3 افزایـــــــش مییـــــــابد که منجــر بــه T3– تیروتوکسیکوزیس میشود. در حالت پرکاری تیروئید که معمولاً TSH سرکوب میشود، باید در نظر داشت که به دلیل مقادیر پائین، حساسیت تکنیکهای مختلف در تفکیک مقادیر بسیار کم، کاهش مییابد.
د– افرادی که مبتلا به پرکاری تیروئید هستند و تحت درمان دارویی قرار دارند. در این افراد نیز بهترین آزمایشهای تیروئیدی که در کنترل میزان دارو میتواند کمککننده باشد، به ترتیب تعیین میزان T3 و T4 است. در این حالت نیز با توجه به اینکه مقدار TSH متأثر از هورمونهای تجویزشده و اگزوژن است، سیکل فیدبک طبیعی از میان رفته و بسته به ژنتیک فرد و اینکه بیماری یک فرد بهواسطۀ اختلال در کدام نقطه از شبکۀ وسیع پروسۀ تولید و توزیع هورمون به وجود آمده است، مقادیر TSH متفاوت خواهد بود و برای تنظیم میزان دارو قابل اتکا نخواهد بود.
در خاتمه بار دیگر توصیه میشود که در غربالگری نوزادان حتیالامکان پارامترهای T4، T3 و TSH هر سه با هم بررسی شوند و همانطور که ذکر شد، به دلیل تکمیل نبودن سیکل فیدبک و سرکوب TSH، تفسیر مقادیر اندازهگیری شده با دانستههای سیستماتیک میتواند گمراهکننده باشد. در مورد نوزادانی که مقادیر TSH بالا دارند، مقادیر T4 و T3 نیز میتواند در محدودۀ بالای نرمال باشد که اگر در این حالت با تکیه بر TSH بالا مبادرت به هورمونتراپی شود، تیروتوکسیکوز ایجاد خواهد شد. البته ناگفته نماند که در برخی از نوزادان نیز چنین حالتهایی دیده نمیشود و مقادیر TSH طبیعی است و با مقادیر هورمونهای تیروئید همخوانی دارد. بههرحال بالانس هورمونهای تیروئیدی و هورمون محرک تیروئید در نوزادان بهتدریج ایجاد خواهد شد و بهتر است برای جلوگیری از صدمات احتمالی، مبنای قضاوت و درمان اختلالات تیروئیدی در نوزادان مقادیر T4 و T3 باشد و از تفسیر TSH بهتنهایی خودداری شود.
منابع:
1– مارتین و. د. میز، آ. پ. رادول و؛ و. گرانر، ک. د.; مروری بر بیوشیمی هارپر، فصل سیوهشتم هورمونهای تیروئیدی، انتشارات جهاد دانشگاهی، 1390.
2– WILLIAMS TEXTBOOK OF ENDOCRINOLOGY, 13th EDITION, (2016), CHAPTER 11 Thyroid Physiology and DiagnosticEvaluation of Patients WithThyroid Disorders.
3– شهبازی، پ. ملکنیا، ن.; بیوشیمی عمومی، بخش هورمونها، هورمونهای غدۀ تیروئید، انتشارات دانشگاه تهران، چاپ بیستوهشتم 1387.
4 – Mc PHERSON R. A. and – PINCUS M. R.; (2007), Henry’s Clinical Diagnosis and Management by Laboratory Methods, 21 EDITION, PP 333 – 341.
5– دیویدسون،; بیوشیمی بالینی، مبحث غدۀ تیروئید، 2007.
تأثیر داروها بر آزمونهای عملکرد تیروئید
نکتههای کلیدی آزمایشگاهی در سنجش هورمونهای تیروئیدی و پرولاکتین
اندازهگیری مقادیر تام هورمونهای تیروئیدی یا مقادیر آزاد این هورمونها؟
مروری بر یافتههای سیتولوژیکی کارسینوم تیروئیدی با تمایز ضعیف و کارسینوم آناپلاستیک
برای دانلود پی دی اف برروی لینک زیر کلیک کنید
ورود / ثبت نام