اثرات نانوساختارهای فلزی بر روی باکتریها
(قسمت دوم)
دکتر رضا میرنژاد (دانشیار دانشگاه) – وهاب پیرانفر (کارشناس ارشد)- محمد عرفانی (کارشناس ارشد)
مکانیسم اثر نانوذرات فلزی بر روی میکروارگانیسمها
با وجود اینکه مکانیسمهای ضدمیکروبی نانوساختارهای فلزی هنوز به طور کامل روشن و واضح نیست، حدس زده میشود که سه مکانیسم زیر نقش اصلی را دارند. این مکانیسمها در بین دانشمندان به صورت گستردهای پذیرفته شدهاند و عبارتند از:
1) جذب یونهای فلزی (انتقال و درونی کردن ذرات) به درون سلول و ایجاد اختلال در مکانیسمهای تولید و مصرف ATP و همانند سازی DNA (مکانیسمهای درون سلولی).
2) تأثیر بر سیستم [1]ROS (گونههای استفاده کننده از اکسیژن فعال) که در تماس با نانوساختارهای فلزی به سیستم اکسیداتیو آنها آسیب وارد میشود.
3) تجمع نانوذرات در غشاء باکتریایی و تخریب آن که باعث از بین رفتن خاصیت نفوذپذیری انتخابی و عملکرد نادرست پمپهای پروتونی میشود.
در شکل 1 به صورت مفهومی میتوانید مکانیسمهایی که اشاره شد را مشاهده کنید. اگرچه پیشرفتهای بزرگی در زمینه پی بردن به مکانیسمهای ضدمیکروبی نانوذرات صورت گرفته است، اما اطلاعات زیادی درباره آن در دسترس نیست. نانوذره نقره بیشترین اطلاعات ما را در این زمینه شامل میشود. البته در سال 2011 نانوذرات تیتانیوم، مس و روی بیشتر مورد مطالعه قرار گرفتهاند. برخی از این مطالعات نشان داده است که عامل فعال یونهای نقره در برهم زدن نیروهای الکترواستاتیک سطح غشاء و همینطور بار منفی آن برای نفوذ، نقش مهمی را ایفا میکنند. با این حال مشخص نیست که این سازگاری در دیگر نانوساختارهای فلزی هم وجود دارد یا نه.
شکل 1: تصویر شماتیک از مکانیسمهای تأثیر نانوذرات و ایجاد خاصیت ضد باکتریایی.
1) جذب یونهای فلزی و کاهش تولید ATP و اختلال در همانندسازی 2) آزادی یونهای فلزی و تولید اکسیژن فعال 3) تجمع نانوذرات و تخریب غشاء باکتریایی
مکانیسمهای تطبیقی برای مقابله با سمیت نانو ذرات
“رشتهای شدن باکتریها [2] باعث تب در کودکان میشود.”
یک مرحله مهم در فیزیولوژی تقسیم سلولی، پارتیشنبندی سلول باکتری است. به دنبال این مرحله، دو سلول دختری از یک سلول والد تولید میشود. این تقسیم سلولی توسط ژن FtsZ (ضروری برای GTPase essential for cytokinesis) کنترل میشود. این ژن باعث ایجاد دیواره درون سلولی[3] شده و یک ساختار حلقه مانند را ایجاد میکند (حلقه Z[4]).
تقسیم سلولی میتواند توسط دسته زیادی از مواد شیمیایی و عوامل فیزیکی محدود شود، از این رو امکان این وجود دارد که دستهای از مواد شیمیایی، رشتهای شدن باکتریها را سبب گردند. این پدیده زمانی اتفاق میافتد که رشد سلول بدون داشتن تقسیم سلولی صورت پذیرد. در حالت معمولی مرحله فیلامنتی باعث وجود آمدن چند کپی از DNA درون سلول میشود که متابولیسم سلولی را عوض خواهد کرد. آسیب به محتوای نوکلئوتیدی و موتاسیون سبب میگردد که در این مرحله با تغییرات مورفولوژیکی، تهیه اجزاء لازم برای تقسیم سلولی دچار اختلال شود.
شرایط پیچیده و مکانیسمهای چند مرحلهای باعث میشود که سلول وارد مرحله تقسیم به حالت فیلامنتی شود. نانوذرات نقره با ابعاد 16 نانومتر میتوانند این مرحله را در استافیلوکوکوس اورئوس مقاوم به متیسیلینATCC 2120 و اشریشیاکلی ATCC 25922 ایجاد کنند. این پدیده میتواند در ارتباط با سیتوکینز و آشفتگی آن در حالت و عملکرد حلقه Z مربوط به ژن FtsZ باشد.
محل استقرار پروتئینهای متصل شونده به پنیسیلین (Penicillin-binding-proteins (PBPs)) در سطح لایه خارجی[5] و در Splitting systems است که میتوانند جدایی سلول و تقسیم آن را کنترل کنند. آنها همچنین میتوانند شکل سلول را نیز کنترل نمایند. PBPها، گروههای مختلفی از ترانسپپتیدازها و کربوکسیپپتیدازها هستند که به صورت مختلف در سنتز دیواره سلولی نقش دارند. در اشریشیاکلی PBP1-b ,PBP-1a باسیل را طویل میسازند، درحالیکه PBP-2 در پایدارکردن شکل باسیلی باکتری نقش دارد. آنتی بیوتیکهای بتالاکتام که به PBP1-b,PBP-1a میچسبند، سبب میشوند که اشریشیاکلی سریعاً لیز شود، درحالیکه آنهایی که ترجیح میدهند به PBP-1 بچسبند، قبل از لیز آن، سبب گرد شدن باکتری میشوند. PBP-3، دیواره میانی اشریشیاکلی را در هنگام تقسیم میسازد و غلظت زیرکشندگی بتالاکتامهایی که به این آنزیم باند میکنند، سبب میشوند که اشریشیاکلی بصورت رشتهای بلند در بیاید. PBP -1 PBP-2 , PBP-3, آنزیمهای دوسر با دو مکان فعال هستند. یک سر آنها، خاصیت ترانسگلیکوزیلاز و سر دیگرشان خاصیت ترانسپپتیداز دارند.PBP-6, PBP-5, PBP-6 D،D -کربوکسیپپتیدازهایی هستند که در طی سنتز دیواره سلولی، آلانین انتهایی را میشکنند و به این ترتیب به آلانین نزدیک به انتها امکان شرکت در واکنش متقاطع را میدهند.
همانطورکه در بالا مشاهده میشود پنیسیلینها و مواد دیگر مانند بتالاکتامها با اتصال به این پروتئینها عملکرد آنها را عوض و یا محدود میکنند. این محدودگری و تعویض کارایی میتواند بر روی عملکرد دیگر PBPsها هم تأثیر گذاشته و باعث ایجاد یک سری اشکالات به صورت آبشاری و در نهایت، منجر به تولید آنزیمهای اشتباه شود. نانومواد با محرکهای اصلی سلولی برای اتصال به این پروتئینها وارد رقابت میشوند، به همین جهت رشتهای شدن یک عمل محافظتی برای بقای سلول محسوب میشود. این مکانیسم در مواقع برخورد با سیستم ایمنی، رقابت و برخورد با مواد سمی داخلی و خارجی نیز توسط سلول باکتری به کار میرود.
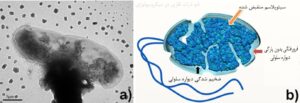
از دیگر راهکارهای سلولی از بین بردن اثر سمی نانوذرات فلزی، نابودی بخش خارجی غشاء و تکهتکه کردن آن است که در اشریشیاکلی مشاهده شده است (شکل 2). در این شکل تجمع مواد در سیتوپلاسم باکتری بدون وجود ساختارهای خارجی مشهود است. این عمل به وسیله تولید پروتئینهای غیر معمول، Microprecipitation، یا حذف کامل غشاء صورت میگیرد. این از بین بردن وابستگی، به سلول اجازه میدهد که بخش زیادی از استرسهای محیطی، سمیت خارجی و دیگر عوامل خطرزا را تحمل کند. این اتفاق البته گاهی با واسطه آسیب به DNA سلولی و فعالیت سیستم ترمیمی SOS نیز رخ میدهد.
شکل 2: a) عکس میکروسکوپ الکترونی از TEM E. coli O157:H7 در مجاورت نانوذرات مس. انقباضات حجم دهنده و سیتوپلاسم نامنظم قابل مشاهده است b) تصویر شماتیک از سلول باکتری، تغییرات مهم در ترکیب پوشش (نازک شدن خفیف و ضخیم شدن دیواره سلولی و خروج سیتوپلاسم نشان داده شده است
[1] Reactive Oxygen Species
[2] Filamentation
[3] Septum
[4] Z-Ring
[5] Outer Membrane
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام