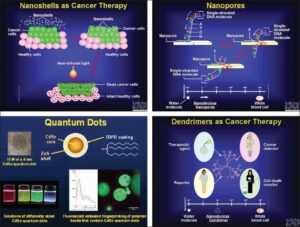
کاربردهای نانوذرات در علوم پزشکی
(بخش دوم)
دکتر رضا میرنژاد (دانشیار دانشگاه)، وهاب پیرانفر (کارشناش ارشد)، الهام زندگانی (کارشناس ارشد)
نانوتکنولوژی، نانوذرات و درمان بیماریهای سرطانی
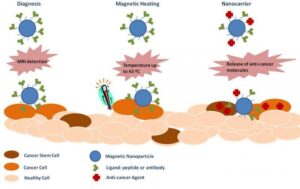
یکی از کاربردهای ذرات مغناطیسی در پزشکی زیستی هدایت داروها به سوی سلولهای بیمار است. کاربرد دیگر این ذرات به نوسان درآوردن سلولهای سرطانی تحت کنترل یک میدان مغناطیسی متغیر است. با این روش سلولهای موردنظر گرم و نابود میشوند. محققان ایتالیایی در تحقیقات خود موفق شدهاند با استفاده از ذرات نانوآهنربا، سلولهای سرطانی را نابود کنند (شکل 1). این تحقیقات نشان میدهد که سلولهای سرطانی میتوانند با قرار گرفتن در دمای 45/5 درجه سانتیگراد به مدت نیم ساعت نابود شوند. ذرات آهنربا برای رسیدن به مقصد از پیش تعیینشده باید در لیپوزمها احاطه شوند. لیپوزمها فضای میکروسکوپی هستند که از 2 لایه لیپیدی تشکیل شدهاند. به این گروه از لیپوزمها که این نانوذرات آهنربا را احاطه میکنند لیپوزمهای آهنربایی گفته میشود. این لیپوزمها که قطر آنها حدوداً 20 نانومتر است میتوانند از موانع سلولی عبور کنند. باید توجه داشت که ابعاد بزرگتر از 20 نانومتر میتوانند به رگهای خونی آسیب برسانند. همچنین ذرات کوچکتر از 20 نانومتر میتوانند توسط ماکروفاژها خورده شوند. ماکروفاژها سلولهایی از بدن هستند که وظیفه حذف اجسام خارجی را دارند. محققان موفق شدند با استفاده از نانوذرات اکسید آهن و یا هیدروکسید آهن کبالت به این خاصیت مغناطیسی دست یابند.
تومورهاي مغزي در برابر درمانهاي معمول مقاوم هستند و سالانه هزاران نفر در اثر ابتلا به اين نوع از سرطان ميميرند. شايد اين نانوفناوري زيستي نوع ديگري از درمان را فراهم نمايد که در آن فقط سلولهاي سرطاني هدفگيری شده و بافتهاي سالم دستنخورده باقي بمانند. اين درمان جديد بر راهکار دوشاخکي استوار است. دياکسيد تيتانيوم يک نانوماده واکنشگر نوري چندکاره است که قابليت اتصال به مولکولهاي زيستي را دارد. اگر اين نانوذرات را به يک پادتن خاص متصل نماييم، ميتوانند سلولهاي سرطاني را به صورت اختصاصي شناسايي کرده و به آنها پيوند يابند. حال اگر نور مرئي متمرکز را به ناحيه موردنظر بتابانيم، نانوذرات با استفاده از اين نور راديکالهاي آزاد اکسيژن را توليد ميکنند که با ميتوکندري سلولهاي سرطاني واکنش ميدهند. ميتوکندري مرکز توليد انرژي سلول محسوب ميشود و تداخل راديکالهاي آزاد اکسيژن در عملکرد زيستشيميايي آن موجب آغاز فرايند مرگ سلولي توسط ميتوکندري ميشود.
اهميت اين کار در توانايي هدفگيري مؤثر و اختصاصي گيرندههاي سطحي بيان شده توسط سلولهاي سرطان مغز با استفاده از نانوذرات نهفته است. در انجام اين کار باید بر محدوديتهاي عمده استفاده از نانوذرات، همچون قابليت انتشار اين عوامل در کل بدن غلبه کرد. در حال حاضر توسعه اين فناوري در مدلهاي پيشباليني تومورهاي مغزي درحال پیشرفت میباشد تا شايد روزي بتوان از اين روش در درمان بيماران استفاده کرد.
ميکروسکوپ فلورسانس اشعه ايکس نشان داد که ميتوان با استفاده از نانوذرات، برجستگيهاي ميکروني سرشار از آکتين تومورها را (که Invadopodia ناميده ميشوند) که امکان حمله سلولهاي سرطاني به سلولهاي سالم اطراف را فراهم ميکنند را مورد حمله قرار داد. تاکنون مطالعات اين روش تنها روي سلولهاي آزمايشگاهي صورت گرفته است، اما در فاز بعدي آزمايش روي حيوانات انجام خواهد شد. نتايج حاصل نشاندهنده کارايي بسيار بالاي اين روش در از بين بردن سلولهاي سرطان مغز است.
براي مطالعه اثر نانوذرات بر مکانيسم سلولها، از واکنش نانوذرات دياکسيد تيتانيوم با پروتئين ميکروتوبول مغز گوسفند استفاده شده است. اين پروتئين شباهت زيادي با نوع انساني آن دارد و غير از مغز در همه بافتهاي بدن يافت ميشود. از سويي ديگر، اين پروتئين نقش زيادي در مکانيسم سلولها داشته و هرگونه اختلال در آن، بهعنوان عاملي مضر براي بدن بهشمار ميآيد.
در یک مطالعه، محققان ابتدا مغز تازه گوسفند را با بافرهاي مخصوص هموژنيزه کرده، سپس در سرما و گرما، اين ماده را، بهصورت متناوب سانتريفوژ و پروتئين موردنظر را از آن استخراج نمودند. در ادامه، اثر نانوذرات را در غلظتهاي مختلف، روي پليمريزاسيون پروتئين دايمر به فيلامنت با روش توربيدومتري در دستگاه اسپکتروسکوپي UV مطالعه نموده و در ادامه، به پژوهش بر روي تشکيل فيلامنتها بهکمک ميکروسکوپ الکتروني پرداخته شد. در پايان، اثر نانوذرات بر ايجاد بريدگي در پروتئين را مورد بررسي قرار دادند. در اين پژوهش، نانوذره، يکبار تحت اشعه UV و بار ديگر بدون اشعه UV قرار گرفت که نتايج حاکي از آن است که نانوذرهاي که تحت UV قرار گرفته است، باعث بريده شدن و از بين رفتن سلولهاي پروتئين نامبرده ميشود.
در نوعی از درمان سرطان که از نانوذرات برای کشتن سلولهای توموری استفاده میکند، اصلاحات زیادی انجام دادند. با این اصلاحات جدید، پایداری نانوذرات بهبود مییابد و امکان نفوذ بیشتر درمان به بافتهای عمیق جهت هدفگیری تومورهای مشکلزا با فراصوت فراهم میشود. اصلاحات صورت گرفته برای نانوذرات به اینصورت انجام شد که نانوذرات را در میسلها کپسوله کردند. این گروه از پلیاتیلن گلایکول، برای پیوندزنی به میسلها جهت پایدارسازی و بهبود زیستسازگاری آنها و اطمینان از خاصیت سیتوتوکسیسیتی (Cytotoxicity) جزئی میسلها استفاده کردند. سیتوتوکسیسیتی پایین مهمترین خاصیت سیستم میسلی است. استفاده از نانوذرات به دام افتاده در میسلها روش جدید و جالبی است.
دی اکسید تیتانیوم یک حساسکننده نوری است که معمولاً با نور قرمز دور فعال میشود و منجر به آزادسازی نمونههای اکسیژنی واکنشی جهت کشتن سلولهای سرطانی میگردد. این درمان قبلاً در بیمارستانها استفاده شده و بعنوان یک درمان فوتودینامیکی شناخته شده است. با این حال، نور قرمز دور نمیتواند بهطور عمیق در بافتهای انسانی نفود کند، به همین خاطر، گروه مذکور به فراصوت تمایل پیدا کرد. فراصوت، مانند نور قرمز دور، غیرمخرب است و هیچ آسیبی به سلولها نمیرساند.
میسلهای شامل دیاکسید تیتانیوم توسط سلولهای معمولی و سالم و نیز سلولهای HeLa (خط سلولی فناناپذیری که در اکثر پژوهشهای سرطانی استفاده میشود) جذب میشوند. هنگامی که این مسیلها در معرض فراصوت قرار گیرند، نانوذرات دیاکسید تیتانیوم شروع به تولید نمونههای اکسیژنی واکنشی میکنند که اصلیترین عامل سیتوتوکسیسیتی در درمان فوتودینامیکی است. این بدین معنی است که با جهتگیری دقیق فراصوت میتوان از این رهیافت برای کاربردهای بالینی در هدفگیری تومورها و از بین بردن آنها با این نمونههای اکسیژنی استفاده کرد. هرچند که باید زیستتوزیع (Environmental distribution) میسلها و ممانعت آنها از رشد تومور با تابشدهی فراصوتی ارزیابی شوند.
سلولهاي سرطاني ميتوانند همانند باکتريها مقاومت خود را در برابر داروها افزايش داده و منجر به بازگشت بيماري سرطان شوند. يکي از راهکارهاي نويدبخش براي غلبه بر مقاومت تومورها در برابر داروهاي مختلف اين است که دو داروي ضدسرطان مختلف را در يک ساختار نانومقياس باهم ترکيب نموده و با اين کار دو ضربه پشت سرهم را به سلولهاي سرطاني مقاوم وارد کنيم. اين کار موجب مرگ اين سلولها ميشود.
در یک آزمایش از نانوذرات سيليکاي متخلخل براي رساندن يک داروي ضدسرطان معمولي و يک مولکول RNA تداخلي درماني کوچک (siRNA) به سلولهاي سرطاني استفاده شد (شکل 2). دوگزوروبيسين (Doxorubicin) که يک داروي ضدسرطان است، با آغاز فرايند مرگ برنامهريزي شده سلولي يا آپوپتوزيس، تومورها را از بين ميبرد و siRNA از توليد پروتئين Bcl-2 جلوگيري ميکند؛ اين پروتئين توسط سلولهاي بدخيم براي متوقف ساختن آپوپتوزيس توليد ميشود. در اين عامل درماني دوگانه ابتدا دوگزوروبيسين را درون حفرات سيليکا بارگذاري کرده و سپس نانوذرات سيليکا را با نانوذرات پليمري کروي ديگري به نام درختسانها روکشدهي کردند. اين نانوذرات روکشدهيشده با درختسانها، محکم به siRNA متصل شده و عامل درماني جديد را به وجود ميآورند. زماني که از اين عامل درماني جديد براي از بين بردن سلولهاي سرطان تخمدانِ مقاوم به داروها استفاده شد، مشاهده گرديد که اثر کشندگي اين عامل درماني جديد نسبت به دوگزوروبيسين آزاد بيش از 130 برابر بالاتر است. بيشترين مقدار اين افزايش فعاليت ضدسرطاني حاصل از حضور siRNA است. همچنين از این آزمایش نتیجهگیری شد که جذب اين نانوذرات به درون سلولهاي سرطاني از طريق اندوسيتوز صورت ميگيرد و دوگزوروبيسين جذب شده در هسته و محيط اطراف آن رها ميشود؛ در نتيجه اين احتمال وجود دارد که اين راهکار درماني قادر به غلبه بر مکانيسم پمپي سلولهاي سرطانیي باشد که توسط اين سلولها براي حذف داروهايي که از طريق انتشار وارد سلول ميشوند، مورد استفاده قرار ميگيرد، بهعلاوه مشاهده گردید که مقدار بسيار کمي از دوگزوروبيسين در خارج از سلول رها ميشود که اين امر منجر به کاهش اثرات جانبي ناشي از درمان با اين دارو ميشود.
داروهای ضدسرطان، منجر به توقف فعالیت سلولهای سرطانی و در نهایت نابودی آنها میشود، ولی متأسفانه روی سلولهای طبیعی بدن تأثیرگذار است، به همین دلیل همه بیماران تحت شیمیدرمانی دچار عوارض جانبی شدیدی میشوند. از این رو دانشمندان در تلاشند تا با استفاده از فناوری نانو، سیستمهای دارورسانی را به گونهای طراحی نمایند که ضمن جلوگیری از آسیب به سلولهای طبیعی، بتوانند به سلولهای هدف حمله نموده و آنها را از بین ببرند.
درحال حاضر نانوذرات حاوی داروی ضدسرطان، با استفاده از پلیمرهای زیست تخریبپذیر مانند PLGA (Poly(lactic-co-glycolic acid))، تهیه شدهاند. برای اینکه نانوذرات، مدت بیشتری در جریان خون باقی مانده و به وسیله سیستم رتیکولواندوتلیال و سلولهای فاگوسیت حذف نشوند، از pegylation استفاده شده است. اتصال مولکوهای پلیاتیلن گلیکول روی سطح نانوذرات، باعث عدم شناسایی آنها به وسیله سلولهای فاگوسیت شده و مدت بیشتری در سیستم گردش خون باقی میمانند و شانس ورود به سلولهای سرطانی افزایش مییابد. برای هدفمندسازی نانوذرات نیز از مولکول folate که سلولهای سرطانی گیرنده بسیار بیشتری از سلولهای طبیعی دارند، استفاده شده است. همچنین مطالعات کشت سلولی با استفاده از ردههای سلولی سرطانی برای نشان دادن کارایی این نانوذرات انجام شده است.
در حال حاضر، مقادیر زیادی از شیمیدرمانی برای درمان اشکال معینی از سرطان موردنیاز است که منجر به اثرات جانبی سمی میشود. این مواد شیمیایی وارد بدن شده و اقدام به تخریب یا تقلیل تومور میکنند، ولی به اندامهای زنده نیز آسیب میزنند و فعالیتهای بدنی را به شدت تحتتأثیر قرار میدهند. اکنون، دانشمندانی از دانشگاه میسوری ثابت کردهاند درمانی که برای سرطان پروستات از نانوذرات رادیواکتیو استفاده میکند، برای استفاده در سگها بیخطر است.
ساندرا آکسیاک- بچتیل، استادیار غدد دانشکده پزشکی دانشگاه میسوری، میگوید که این یک گام بزرگ برای پژوهش نانوذرات است. آکسیاک- بچتیل گفت: «اثبات اینکه نانوذرات طلا برای استفاده در درمان سرطان پروستات سگ بیخطر هستند، قدم بزرگی برای جلب موافقت انجام آزمایشهای پزشکی روی مردان است، سگها بهطور طبیعی مستعد سرطان پروستات مشابه با انسان هستند، بنابراین درمان نانوذرات طلا شانس بزرگی برای اعمال به بیماران انسانی دارد.»
کاتیش کاتی، استاد رادیولوژی و فیزیک در دانشکده پزشکی و کالج علوم و هنر و سایر دانشمندان دانشگاه میسوری، روش بهتری برای هدفگیری تومورهای پروستات با استفاده از نانوذرات رادیواکتیو طلا یافتند. این درمان جدید نیازمند مقادیری از دارو است که هزاران برابر کمتر از شیمیدرمانی بوده و در طول بدن برای وارد آوردن خسارت به نواحی سالم حرکت نمیکنند.
کاتی گفت: «ما نتایج چشمگیری در موشها بدست آوردیم که نشانگر کاهش قابلملاحظه حجم تومور در تزریق نانوذرات رادیواکتیو بود، این یافتهها پایه محکمی تشکیل میدهند و امیدواریم که استفاده از این درمان جدید نانودارویی قابل اعمال به بیماران سرطانی انسانی باشد.»
درمانهای کنونی برای سرطان پروستات در بیمارانی که دارای تومورهای سرطانی تهاجمی باشند، غیرمؤثر است. سرطان پروستات در اکثر اوقات دارای رشد کند بوده و محدود و قابلکنترل است. با این حال، شکلهای تهاجمی این بیماری به سایر قسمتهای بدن منتشر میشود و دومین عامل اصلی مرگهای سرطانی در مردان آمریکا است. دانشمندان دانشگاه میسوری معتقدند که درمان آنها قادر به کاستن تومورهای تهاجمی یا حذف کامل آنها خواهد بود. آکسیاک- بچتیل میگوید که این درمان میتواند در سگها و نیز انسانها بیخطر و مؤثر باشد، زیرا سگ تنها پستانداری است که به طور طبیعی دچار شکل تهاجمی سرطان پروستات میشود. آکسیاک- بچتیل گفت: «توانایی در تست درمان نانوذرات طلا روی سگها خیلی مفید است. از آنجایی که سگها نمیتوانند به ما در مورد احساسشان سخن بگویند، اکثر مواقع بیماری آنها خیلی دیر تشخیص داده میشود، ولی این درمان به ما این امید را میدهد که بتوانیم با تومورهای تهاجمی مبارزه کنیم.»
شکل 2: روشهای مختلف مورد استفاده در درمان سرطان دهان
منابع:
- Prados J, Melguizo C, Ortiz R, Velez C, Alvarez PJ, Arias JL, et al. Doxorubicin-loaded nanoparticles: new advances in breast cancer therapy. Anti-cancer agents in medicinal chemistry. 2012;12(9):1058-70.
- Esposito C, Crema A, Ponzetto A, Murtas G, Carloni G. Multifunctional anti-cancer nano-platforms are moving to clinical trials. Current drug metabolism. 2013;14(5):583-604.
- Jokerst JV, Lobovkina T, Zare RN, Gambhir SS. Nanoparticle PEGylation for imaging and therapy. Nanomedicine (Lond). 2011;6(4):715-28.
- Katsogiannou M, Peng L, Catapano CV, Rocchi P. Active-targeted nanotherapy strategies for prostate cancer. Current cancer drug targets. 2011;11(8):954-65.
- Axiak-Bechtel SM, Upendran A, Lattimer JC, Kelsey J, Cutler CS, Selting KA, et al. Gum arabic-coated radioactive gold nanoparticles cause no short-term local or systemic toxicity in the clinically relevant canine model of prostate cancer. International journal of nanomedicine. 2014;9:5001-11.
- Satyanarayana TSV. Rathika Rai. Nanotechnology: The future. Journal of Interdisciplinary Dentistry.2011;1(2):93-100.
کاربردهای نانوذرات در علوم پزشکی (بخش اول)
نانوذرات مغناطیسی و کاربرد آنها در تحقیقات پروتئومیکس
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام