مروری بر روشهای تشخیصی فاسیولیازیس
نویسندگان: نگار اسدی، پیمان خضری، شهرام خادم وطن
گروه انگلشناسی و قارچشناسی، دانشکده پزشکی، دانشگاه علوم پزشکی ارومیه
فاسيوليازيس، يكي از بیماریهای مهم انگلي مشترک بین انسان و حیوان است كه توسط گونههای فاسيولا در ميزبان ايجاد میشود. میزبانهای نهایی این انگلها بسیاری از پستانداران علفخوار و انسان را شامل میشوند. حلزونهای آب شیرین بهعنوان میزبان واسط در سیر تکاملی این انگلها به شمار میآیند (1).
فاسيولا در حالی که در عفونتهای انساني موجب التهاب و آسيب كبد و مجـاري صـفراوي میشود، در دامها باعث زیانهای اقتصادي فراوان، شامل مرگومیر و كاهش شير، گوشت و پشم میگردد (2).
تقریباً 4 /2 ميليون نفر در جهان به اين انگل مبتلا هستند و 180 ميليون نفر در معرض خطر ابتلا هستند. از نظر گسترش جغرافيايي، در حالی که در قارههاي اروپا، امريكا و اقيانوسيه فقط گونـه فاسـيولا هپاتيكا ديده میشود، در دو قـاره آسـيا و آفريقـا شـامل كشورهاي آسياي جنوب شرقي، ايران، پاكستان و مصـر هر دو گونه فاسيولا هپاتيكا و فاسيولا ژيگانتيكا مشـاهده شده است (3).
محل اصلی استقرار انگل طی مهاجرت کبدی در مجاری صفراوی است. در مراحل انتهایی ممکن است ضایعات دچار عفونت باکتریایی شوند که به سیروز منجر میگردد. موارد اکتوپیک آن در لوزالمعده، قفسه سینه، بافت زیر جلد و مغز مشاهده شده است
براي تشخیص این بیماري میتوان از علائم بالینی، یافتههای آزمایشگاهی، تغییرات فصلی آلودگی، تاریخچه قبلی بیماري و کالبدگشایی استفاده کرد.
تشخیص متداول فاسیولوزیس بر مبنای مشاهده حضور تخم انگل در مدفوع است که در مراحل پیشرفته بیماری پس از بالغ شدن انگل در کبد امکانپذیر میشود که در این مرحله انگل ضایعات زیادی نیز به کبد وارد ساخته و خسارات اقتصادی زیادی را باعث شده است. درصورتیکه با روشهای سرولوژی بتوان بیماری را تشخیص داد، امکان تشخیص بیماری در مراحل اولیه بیماری فراهم میشود و سریعتر میتوان اقدام به درمان نمود و از وارد آمدن خسارات بیشتر جلوگیری میگردد.
روشهای انگلشناسی
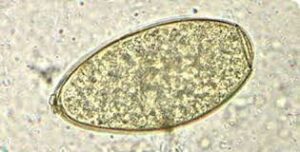
مبنای تشخیصهای انگلشناسی، یافتن تخم فاسیولا در مدفوع است (شکل 1). کرم پس از 4-3 ماه بالغ میشود و تشخیص آزمایشگاهی بر مبنای آزمایش مدفوع، ممکن میگردد. آزمایش مدفوع انواع مختلفی دارد که از آزمایش ساده مدفوع تا انواع روشهای تغلیظ، مانند فلوتاسیون، سدیمانتاسیون و استفاده از لایه سلوفان (کاتو، کاتو کاتس) را شامل میگردد.
شکل 1: نمایی از تخم فاسیولا هپاتیکا در آزمایش مستقیم
روش سدیمانتاسیون بیشتر از فلوتاسیون حساسیت و دقت دارد. مایعات بهکاررفته در فلوتاسیون روی تخم کرم تأثیر نامطلوب دارد. استفاده از انتروتست نیز برای یافتن تخم کرم و تشخیص مناسب است (4).
روش کاتو سریع و ارزان است و تخم کرمهای حاصل از آن قابل استفاده در روشهای بیولوژیک است، اما حساسیت آن برای تشخیص آزمایشگاهی نسبتاً زیاد نیست و یا با روش فرمالین اتر برابری میکند و لذا برای مطالعات اپیدمیولوژیک و علمی کاربرد بهتری دارد (6-5).
در تشخیص فاسیولیازیس با استفاده از متدهای انگلشناسی باید به این نکته اشاره کرد که بلع کبد آلوده و تخم کرم موجود در آن باعث مشاهده تخم کرم در مدفوع میشود که خود نوعی مثبت کاذب محسوب میگردد و قبل از آزمایش مدفوع باید فرد چند روزی رژیم غذایی بدون مصرف جگر داشته باشد (7).
روشهای رادیولوژیک:
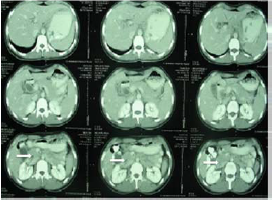
این روشها هرچند به پزشک کمک زیادی برای ارزیابی وضع بیمار میکنند، اما روش تشخیص آزمایشگاهی برای بیماری محسوب نمیشوند. از این میان میتوان رادیوگرافی شکم و سینه و انواع کلانژیوگرافی، Radioisotope liver Scan و Retrograde Cholangiopancreatography (ERCP) را نام برد. در تصاویر سیتیاسکن اشکال کمتراکم دیده میشود که با درمان محو میگردند (شکل 2).
شکل 2: نمایی از CT Scan کبد (فلش منطقه مجرای کلدوک)
روشهای سرولوژیک
از روشهای تشخیص ایمنولوژیک برای شناسایی موارد بیماری، در سرواپیدمیولوژی بیماری و مطالعه موفقیت درمان استفاده میکنند (8).
تستهای سرولوژیک در طول تمام مراحل بیماری و بهخصوص در مرحله حاد و همچنین در سایر شرایطی که کاربرد روشهای بررسی مدفوع با مشکلاتی مواجه است، قابل استفاده میباشند.
در طول چند دهه گذشته با تکامل تکنولوژیهای جدید، تستهای سرولوژیک مختلفی هم در عفونتهای تجربی و هم در انسان، مورد استفاده قرار گرفتهاند.
برای پیگیری سیر درمان موفقیتآمیز، آزمایشات سرولوژی کاربرد خوبی دارند. آنتیبادیهای فاسیولا در مرحله اول بیماری که هنوز تخمها در مدفوع ظاهر نشدهاند، قابل تشخیص میباشند. آنتیبادیهای ضد فاسیولا، دو تا چهار هفته پس از ابتلا به کرم و پنج تا شش هفته قبل از ظاهر شدن تخم کرم قابل شناسایی میباشند.
کاربرد فرآوردههای سوماتیک و دفعی- ترشحی تخلیص شده از کرمهای فاسیولا هپاتیکای بالغ بهعنوان آنتیژن، در تست ELISA بیشترین حساسیت و ویژگی را نشان داده است. بر اساس گزارش سازمان جهانی بهداشت، تستهای سرولوژیک Fas2-ELISA و CL1-ELISA توانایی ردیابی آنتیبــــــادیهای در گردش (circulating IgG) که علیه آنتیژنهایFas2 و CL1 مترشحه از کرمهای بالغ و نوزاد انگلهای فاسیولا تولید شدهاند را دارند.
این روشها قادر به تشخیص عفونت در مراحل حاد و مزمن عفونت و همچنین فاسیولیازیس نابجا میباشند. به نظر میرسد که سطوح آنتیبادیهای در گردش در تستهای ELISA پس از درمان موفق بیماران، احتمالاً برای مدتها بالا باقی میماند و سریعاً سقوط نمیکند، بنابراین، این تستها عفونتهای فعال و غیرفعال را از هم متمایز نمیکنند و در ارزیابی موفقیت پس از درمان نیز چندان مفید نیستند.
این تستها همچنین قادر به تشخیص آنتیژنهای اختصاصی انگلهای فاسیولا در نمونههای سرم و مدفوع افراد آلوده میباشند. از این آنتیژنها میتوان به آنتیژنهای دفعی ترشحی فاسیولا اشاره نمود (10-9).
الف- جستجوی آنتیژن:
از جستجوی آنتیژن ممکن است در سرم خون و یا در سوسپانسیون هموژنیزه مدفوع استفاده گردد (11).
نتایج حاصل از بررسی یافتن آنتیژنهای در گردش (CFAg) و مقایسه آن با نتایج حاصل از یافتن IgG ضد فاسیولا با استفاده از روش الیزا نشان داد یافتن آنتیژن حساسیت بیشتری از روش یافتن آنتیبادی در خون دارد (12).
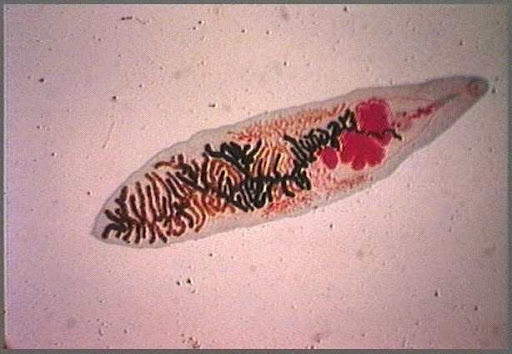
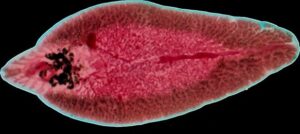
شکل 3: نمایی از کرم بالغ فاسیولا هپاتیکا
ب- جستجوی آنتیبادی:
تقریباً تمام روشهای سرولوژی حساسیت خوبی برای استفاده در تشخیص فاسیولیاریس دارند؛ مثل:
Complement fixation test (CFT)
Immunoflouroscence Assay (IFA)
Counterelectrophoresis (CEP)
Ensym Linked Immuno Surbant Assay (ELISA)
Direct Hemaglutination Test (DAT)
آنتیژنهای بهکاررفته در ELISA و IFA و CEP از آنتیژنهای دفعی ترشحی بهدستآمده از کرمهای بالغ بوده و ویژگی و حساسیت بالایی دارند (11).
ارزیابی ایمنوفلورسانس (IFA)
تست IFA 92 تا 96% حساسیت دارد و برای تشخیص موارد حاد مناسب است اما نه IFA و نه CEP برای تشخیص موارد مزمن بیماری مناسب نیستند. اکثر روشها با شیستوزوماها، آسکاریس، فیلرها و انواع ترماتودها واکنش متقاطع دارند و باید از روشهای جذبی برای افزایش ویژگی آنها استفاده کرد.
روش ELISA
روش بسیار خوب و قابلاعتمادی برای تشخیص در مناطق شایع است و برای انواع فاسیولا قابل استفاده است (11). از معتبرترین روشها جهت تشخیص فاسیولازیس روش ELISA میباشد. در این روش میتوان آنتیبادیهای ضد فاسیولا را دو تا چهار هفته پس از ابتلا به کرم شناسایی نمود. سیستئین پروتئیناز کاتپسین L1، دارای کاربرد خوبی برای استفاده در روش الیزا در تشخیص فاسیولیازیس انسانی است. تیترهای بیشتر از 1/128 در روش ایمونو اسی آنزیمی مثبت تلقی میشود.
حساسیت روش ELISA و FAST بیش از 95% میباشد. درصورتیکه از آنتیژنهای 63، 17 و 12 کیلودالتون استفاده شود حساسیت 100% میباشد. میزان آنتیبادیهای ضد فاسیولا 12- 6 ماه پس از درمان کاهش مییابد.
روش EITB (Enzyme – linked immunoelectroansfer Blot)
تکنیک EITB توانسته است آنتیژنهای پلیپپتید 54 تا 58 کیلو دالتون را در هفته دوم پس از عفونت شناسایی کند. در این روش آنتیژنهای سبکتر با 12 و 8 کیلو دالتون بعد از 12 هفته ناپدید میشوند. در این روش پلیپپتیدهای 54 کیلو دالتون برای تشخیص فاسیولا ژیگانتیکا مناسب گزارش شدهاند (13).
نتیجهگیری:
آزمایشات انگلشناسی معمولاً برای تشخیص یک بیماری، دارای یک روش استاندارد و روشهای فرعی و مختلفی در کنار آن میباشند، اما متأسفانه مطالعات نشان داده که هنوز روش مناسب و دقیقی برای تشخیص فاسیولیازیس وجود ندارد. امروزه نتایج رضایتبخشی در تستهای سرولوژی با استفاده از آنتیژنها بدست آمده، اما هنوز این تستها نیازمند زمینههای بهتر برای ارزیابی و سنجش هستند.
منابع:
- Mas‐Coma S, Valero MA, Bargues MD. Fasciola, lymnaeids and human fascioliasis, with a global overview on disease transmission, epidemiology, evolutionary genetics, molecular epidemiology and control. Advances in parasitology. 2009;69:41-146.
- Rahimi P, Ghavami M, Haniloo A, Nourian A, Biglari A. Identification of Fasciola Species by PCR-RFLP Assay. ZUMS Journal. 2009;16(65):41-8.
- Ashrafi K, Valero M, Panova M, Periago M, Massoud J, Mas-Coma S. Phenotypic analysis of adults of Fasciola hepatica, Fasciola gigantica and intermediate forms from the endemic region of Gilan, Iran. Parasitology International. 2006;55(4):249-60.
- Chen M, Mott K. Progress in assessment of morbidity due to Fasciola hepatica infection: a review of recent literature. Tropical diseases bulletin. 1990;87(4).
- Rhee JK, Baek BK, Lee JH. Fractionation of antigen for ELISA of bovine fascioliasis. Kisaengch’unghak chapchi The Korean journal of parasitology. 1986;24(2):171-6.
- كامبيز فپ، كيهان ا. مقايسه دو روش انگلشناسی (فرمالين-اتر و كاتو) در تشخيص فاسيوليازيس انساني.
- Balows A, Duerden BI, Topley WWC, Wilson SGS. Topley and Wilson’s Microbiology and Microbial Infections: Systematic Bacteriology: Arnold; 1998.
- El-Aziz M, Ghazy A, Effat M. Immunodiagnosis of bovine fasciolosis using Fasciola hepatica excretory-secretory antigens ELISA. Journal of the Egyptian Society of Parasitology. 2001;31(1):327-34.
- Organization WH. The “Neglected” Neglected Worms. Action Against Worms. December 2007, issue 10. 2010.
- Organization WH. Report of the WHO Informal Meeting on use of triclabendazole in fascioliasis control. WHO headquarters, Geneva, Switzerland, 17-18 October 2006. World Health Organization, Geneva http://www who int/neglected_diseases/preventive_chemotherapy/WHO_CDS_ NTD_PCT_2007. 2007;1.
- Dalton J. Fascioliasis. Wallington, UK, CAB International. 1999.
- Massoud J. Present status of human fascioliasis in Iran. Food-borne Trematods World Health Organization, Manila. 1993.
- عطائیان، نوریان، پایکاری، اله ح، عبدالهی، اله س. تعیین آلودگیهای انگلی دستگاه گوارش در مهدهای کودک و دبستانهای زنجان. مجله علمی پژوهشی دانشگاه علوم پزشکی زنجان. 1996;4(16):16-21.
مروری بر آزمایش میکروبیولوژیکی مدفوع
https://www.cdc.gov/dpdx/fascioliasis/index.html
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام