تکنیک SSCP
دکتر مهدی فصیحی رامندی (عضو هیئت علمی دانشگاه علوم پزشکی بقیه ا… (عج))
زهرا کریمی (مرکز تحقیقاتی زیست سلول پژوهان تدبیر)
دکتر رضا میرنژاد (دانشیار دانشگاه)
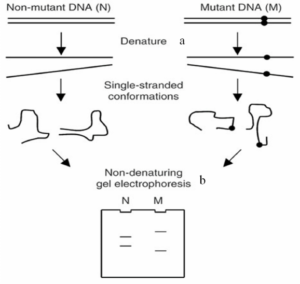
تكنيكSCCP[1] براي اولين بار در سال 1989 توسط orita و همكارانش براي تعيين جهشها و چند شكليها بهكار رفت. عقيده بر اين است كه تعيين موتاسيونهاي نقطهاي توسط اين تكنيك بر اساس تغيير در ساختار DNA تکرشتهای استوار ميباشد. DNAهای تکرشتهای كه داراي يك جهش ژنتيكي باشند نسبت به رشتههاي نرمال روي ژل پلياكريلاميد الگوي حركتي متفاوتي از خود نشان ميدهند (تمام انواع جهشهاي نقطهاي را ميتوان با اين روش تشخيص داد). توالي بازهاي كناري باز جهشیافته، بر روي قدرت تشخيص اين تكنيك تأثیر ميگذارد (شکل 1). يكي از مشكلات اين تكنيك اين است كه بر اساس نوع جهش، نمیتوان الگوي حركت DNA تکرشتهای را پیشبینی نمود. ميزان توانايي اين روش براي تعيين جهشها در مجموع حدود 70% است، ولي ميتوان آن را به 95% هم رساند. بيشترين جاذبه اين تكنيك در سادگي آن است. هنگامي كه DNA تکرشتهای يا دو رشتهای روي يك ژل الكتروفورز ميشوند، حركت قطعه DNA وابسته به اندازه آن ميباشد، اما حركت DNA تکرشتهای علاوه بر اندازه، تابع شكل فضايي نيز هست كه به علت پيوندهاي هيدروژني داخل زنجیرهای در DNA تکرشتهای است، پس به علت اینکه DNA تکرشتهای نمیتواند بهصورت يك خط صاف از ژل عبور كند، حركت آن تابع اندازه و ساختار سوم (شكل فضايي) ميباشد. اگر يك موتاسيون در يك رشته DNA وجود داشته باشد، بر روي اين شكل فضايي تأثیر ميگذارد. بر روي ژل SSCP علاوه بر DNA تکرشتهای DNA دو رشتهاي نيز وجود دارد كه به علت چسبيدن مجدد تك رشتهها ايجاد شده و سريعتر حركت ميكند.
شکل 1: نمای کلی از تکنیک SCCP
متغيرهاي ژل SSCP
متأسفانه شكل فضايي يك قطعه DNA تکرشتهای تابع متغيرهاي ژل نيز هست. حركت يك قطعه DNA تکرشتهای نه تنها تابع شرايط ژل ميباشد، بلكه بين ژلهاي مختلف نيز ممكن است کاملاً تكرارپذير نباشد. يك سري از قطعات DNA كه داراي يك توالي هستند، حركت يكساني دارند، ولی اگر جهشي در آنها رخ دهد حركت آن رشتهها تفاوت ميكند.
حساسيت SSCP وابسته به شرايط زير است:
الف) دماي ژل: در اين تكنيك دماي ژل اهميت اساسي دارد؛ دماي بالا اثر دناتوره كننده دارد و باعث كاهش در ميزان تشكيل ساختار سوم ميشود و اين مسئله سبب كاهش توانايي تكنيك در تعيين جهشها ميشود. معمولاً براي به حداكثر رساندن ميزان تعيين جهشها، بعضي از محققين نمونهها را در دماي 4 درجه سلسیوس الكتروفورز ميكنند. پس بهتر است نمونهها در يك اتاق با دماي 4 درجه سلسیوس الكتروفورز شود. برای این منظور ميتوان از يك دستگاه خنککننده ژل استفاده کرد.
ب) غلظت ماده Cross-linker و اكريلاميد: ژل پلياكريلاميد از پليمريزاسيون اكريلاميد و يك ماده Cross-linker بهوجود ميآيد كه معمولاً N,N/-Methylene bis acrylamide است. اندازه منافذ ژل تحت تأثیر غلظت ژل (T%) و نيز ميزان ماده Cross-linker (C%) ميباشد.
فرمول 1 محاسبه غلظت ژل پلياكريلاميد:
فرمول 2 محاسبه درصد ماده Cross-linker:
معمولاً براي SSCP، C% حدود 2 و T% بين 10-6% بهترين نتيجه را ميدهد، همچنین معمولاً براي SSCP درصد اكريلاميد بيشتر در حدود 6-5% استفاده ميشود، هرچند بعضي گروههای تحقيقاتي ژلهاي تا حدود 10% را نيز بهكار ميبرند.
ج) گليسرول: معمولاً به ژلهاي SSCP گليسرول اضافه ميشود. نشان داده شده است كه درصد گلیسرول بين10-5% توانايي SSCP را در تشخيص جهشها بالا ميبرد. اثر گليسرول را بهعلت داشتن گروههاي –OH ميدانند كه باعث Relaxation قطعات DNA تکرشتهای ميشود.
د) نوع ماتريكس ژل: ژل (Mutation Detection Enhancement) MDE، يك ژل تجاري است كه مزايايي را نسبت به ژل پلياكريلاميد معمولي در نشان دادن تغييرات حركتي كوچك باندها دارا ميباشد. اين ژل بيشتر در Heteroduplex Analysis (HA) بهكار ميرود.
ه ) طول قطعه مورد بررسي: پارامتر كليدي ديگر كه بر ميزان تعيين جهشها توسط اين تكنيك اثر ميگذارد، طول قطعه اسيد نوكلئيكي است كه مورد ارزيابي قرار ميگيرد. عموماً هر چه قطعه مورد نظر بزرگتر باشد، حساسيت اين تكنيك پائينتر ميآيد، اما يك نقطه واضح و مشخص وجود ندارد، بلكه يك كاهش تدريجي در حساسيت تكنيك با افزايش طول قطعه DNA از bp250 به بالا وجود دارد. عموماً 300 باز را حد بالاي طول قطعه در نظر ميگيرند، اما بعضي مقالات و مراجع تا bp450 را هم ذكر كردهاند. همچنين محل بروز موتاسيون نيز در حساسيت شناسايي آن مؤثر است. براي بهدست آوردن طول قطعاتي كه متناسب براي SSCP باشند، ميتوان به گونهاي طراحي كرد كه قطعات حاصل از PCR را زير bp300 بهدست آورد يا اینکه ابتدا يك قطعه بزرگ را تكثير كرده و سپس بهوسیله هضم آنزيمي آن را به قطعات كوچكتر تقسيم نمود.
امروزه پيشرفتهاي زيادي در اين تكنيك به عمل آمده است، بهعنوان مثال از پرايمرهاي نشاندار شده با فلوئورسين براي تكثير استفاده شده و قطعات روي دستگاه Sequencer بهطور اتوماتيك آناليز ميشوند. همچنين اين تكنيك بهصورت Multiplex در تعيين جهشهاي ژنتيكي در چندين ژن از جمله ديستروفين به كار رفته است.
اين تكنيك در تعيين جهش بسياري از بيماريها به كار رفته است، از جمله تعيين جهشهاي ژنتيكي در بيماري تي-ساكس، لوكوس ژن P53، ژن فيبروزیس سيستيك، ژن گيرنده انسولين، ژن گلوكوكيناز، ژنوم ميتوكندري و هموفيلي B.
در مورد حساسيت اين روش عقيده بر اين است كه براي يك قطعه 200-100 بازي بين 95-50% جهشها را ميتوان به دست آورد و با شرايط مختلف اين حساسيت ممكن است به 100% برسد، ولي متأسفانه روشي براي پیشبینی اين شرايط وجود ندارد. در جدول زير مزايا و معايب اين تكنيك آورده شده است:
جدول 1: مزايا و معايب تکنیک SCCP
| مزايا | معايب |
| الف) سادگي و كم بودن مراحل انجام آن
ب)تئوري پيچيدهاي ندارد. ج) به تجهيزات اختصاصي نياز نيست. د) ميتوان بدون نشاندار كردن آن را انجام داد. |
الف) محل جهش ناشناخته باقي ميماند.
ب) محدوديت در اندازه قطعات مورد بررسي وجود دارد. ج) بهشدت وابسته به شرايط آزمايشگاهي است. د) جهشها ممكن است ناشناخته باقي بماند (به علت حساسيت محدود) ه) گاهي تفسير ژلها مشكل میباشد. |
روش كار تکنیک SCCP:
همانطور که در بالا اشاره شد این تکنیک يكي از سادهترين تكنيكهاي غربالگري جهش بوده و به ابزار پيچيدهاي نياز ندارد. در اين روش تحت شرايط ويژهاي اسيد نوكلئيك تکرشتهای، ساختمان ثانويهاي را در محلول تشكيل ميدهد. اين ساختار ثانويه بستگي به تركيب بافرها دارد و ممكن است با تغيير يك نوكلئوتيد عوض شود و اين مسئله باعث تفاوت در الگوی حركت الكتروفورتیک قطعات در شرايط non denaturing روي ژل ميشود. مشاهده شده است كه ساختمان ثانويه توسط RNA بهتر از DNA تشكيل ميشود. همچنين بهوسیله RNA-SSCP قطعات بزرگتري را ميتوان آناليز كرد. براي تأیيد جهشهای شناسایی شده توسط SSCP بايد تعيين توالي نیز انجام شود، زيرا چندشکلیها هم ميتوانند سبب تغييرات حركتي در SSCP شوند.
يكي از مشكلات بزرگ SSCP تجربي بودن آن است. مشكل ديگر اندازه قطعاتي است كه بررسي ميشوند كه در حدود 300-200 باز، بهترين اندازه گزارش شده است. اگرچه اين تكنيك سريع و ساده است، اما حساسيت اين روش در دست افراد مختلف متفاوت بوده و مسائل دخيل در آن بهخوبی شناخته نشده است. گروههاي مختلفي بر روي پارامترهاي مؤثر بر SSCP تحقيق كردهاند.
بهطورکلی پارامترهاي زير ميتوانند بر روي الگوي جدا شدن تكرشتهها تأثیر بگذارند:
1) حرارت
2) افزودن مواد دناتوره كننده به ژل (اوره- فرماميد)
3) افزودن مواد خنثي (neutral)
4) تغيير اندازه منافذ ژل
5) غلظت اكريلاميد
Glavac و Dean با مقايسه تغييرات حركت در تعدادي از جهشها روي ژل اكريلاميد 5% در غلظت C حدود 2/6% به نتايج جالبي رسيدهاند؛ آنها مشاهده كردند كه رشتههاي غني از بازهاي پوريني داراي جهش، تغييرات حركتي بيشتري را نسبت به رشتههاي غني از پيريميدين نشان ميدهند. از سوي ديگر بر روي ژل 7/5% در همان غلظت ماده Cross-linker مشاهده كردند كه تغيير حركت بيشتر در رشتههاي غني از پيريميدين ديده ميشوند. ازآنجاییکه اندازه منافذ ژل تحت تأثیر غلظت اكريلاميد و درصد ماده Cross-linker ميباشد، بهنظر ميرسد كه نه تنها اندازه منافذ، بلكه ساختمان ژل نيز روي حركت DNAهاي تکرشتهای تأثیر ميگذارد. ممكن است استفاده از شيب اندازه منافذ مؤثر باشد.
افزودن 10-5% از تركيبات خنثي به ژل اثرات متفاوتي روي الگوي حركت رشتهها در SSCP دارد. بعضي از اين مواد نظير بوتانل 10% اثري ندارند و بعضي نظير اوره 5% يا فرماميد 5% اثر ناچيزي دارند، اما موادي مانند گليسرول، گلوكز و سوكروز اثرات خوبي روي حركت تکرشتهایها دارند. اين امر نشاندهنده اين است كه اين تركيبات با مكانيسم مشابهي روي ساختمان سنجاقسری در تكرشتهها اثر ميگذارند. اين اثر ممكن است به علت واكنش خفيف گروههاي OH و يا تشكيل باندهاي هيدروژني داخل مولكولي باشد.
در حال حاضر نميتوان تغيير حركتي را كه بهوسیله تغييرات در يك باز ايجاد ميشود پيشبيني نمود. به نظر ميرسد كه در اكثر موارد بازهاي مجاور محل جهش، اثر مهمتری روي تغييرات حركتي DNA تکرشتهای داشته باشند. ميتوان از اين مسئله اینطور نتيجهگيري كرد كه كارايي SSCP تا حد زيادي به توالي مورد آزمايش بستگي دارد و اين ميزان كارايي از يك قطعه DNA به قطعه ديگر متفاوت است.
عامل ديگر، اندازه قطعه DNA مورد نظر است كه هر چه بزرگتر باشد امكان اینکه يك تفاوت باز منجر به القاء تغيير ساختمان و تغییر حرکت روي ژل شود، كمتر ميگردد.
درنهایت بهنظر ميرسد كه مهمترین متغيرهاي مؤثر بر SSCP علاوه بر اندازه قطعه مورد بررسي، غلظت ژل و ماده Cross-linker ميباشد. حساسيت اين روش در ژلهاي با غلظت اكريلاميد بين 10-8% و ماده Cross-linker بين 2/6-1/3% به حداكثر خود ميرسد. تحت اين شرايط ميتوان چندشکلی قطعات بين 200-120 باز را با حداكثر حساسيت به دست آورد. به نظر ميرسد كه يك ژل بهينه براي SSCP در شروع كار، اكريلاميد 8% با ماده Cross-linker 2% كه در 4 درجه سلسیوس الكتروفورز شود، ميباشد.
درنهایت نكتهاي كه در مورد SSCP ميتوان گفت اين است كه با وجودي كه SSCP يك تكنيك با تكنولوژي بالا نيست، اما همچنان شايعترين روش براي بررسي جهشهای ناشناخته میباشد.
تهيه ژل پلياكريلاميد:
مواد و دستگاهها
- پلي اكريلاميد/ بيس اكريلاميد (1/39)
- TBE 10X
- گليسرول
- آب ديونيزه
- آمونيم پرسولفات (APS) 10%(W/V)
- TEMED
- Bind Saline A174
- اسيد استيك 10%
- اتانول 96%
- سيستم كامل الكتروفورز
- Circulator 230 VAC
- NaOH 0.5M
روش كار:
ابتدا شيشههاي الكتروفورز را به مدت يك شب در NaOH 0.5M قرار داده و پس از شستشو با آب مقطر، با الكل 96% تيمار ميشوند. براي چسباندن ژل پلياكريلاميد به شيشه صاف زيرين، محلول زير تهيه شود:
1 ميليليتر اتانول 96%
lµ 250 اسيد استيك 10%
lµ 3/5 Bind Saline
پس از مخلوط كردن، اين محلول را روي شيشه صاف ريخته و در تمام قسمتهاي آن بهطور كامل پخش كنيد.
- پس از قرار دادن Spacerها روي شيشه زيرين، شيشه لبهدار را روي آن قرار داده و با Binder محكم كنيد.
- ژل پلياكريلاميد را بهصورت زير آماده نمایید:
| 2ml | TBE 10X |
| 5-10% | Glycerol |
| 6-10% | Acr/Bis 39/1 |
| lµ400 | APS 10% |
| lµ40 | TEMED |
سپس آب ديونيزه اضافه شده تا حجم محلول به 40 سيسي برسد.
پس از تهيه، تركيب فوق را بهآرامی بين دو لايه شيشه ريخته و شانه را قرار دهيد. بعد از حدود يك ساعت ژل تشكيل ميشود. پس از بستن ژل شيشه را بر روي تانك عمودي قرار داده و به مدت 15 دقيقه براي رسيدن به تعادل حرارتي و الكتريكي pre run شود.
آمادهسازی نمونهها و الكتروفورز:
lµ5 از محصول PCR را با lµ12 از بافر بارگذاري SSCP مخلوط نموده و به مدت 5 دقيقه در حرارت 95 درجه سلسیوس قرار دهيد. سپس بهسرعت نمونه را به درون يخ منتقل نماييد.
تركيب بافر بارگذاري عبارت است از: گزيلن، فرماميد 95%، NaOH 1Mm، برومو فنل بلو %0/05 و سيانول %0/05
نمونهها را درون چاهكهاي تعبيه شده بر روي ژل قرار دهيد و با ولتاژ 1000-800 و در حرارت 4 درجه سلسیوس به مدت 6 ساعت الكتروفورز نماييد.
رنگآميزي نيترات نقره:
براي ارزيابي ژلهاي پلياكريلاميد از رنگ نيترات نقره استفاده ميشود. اين روش معمولاً زمانبر ميباشد. به همين دليل از يك پروتكل سادهتر استفاده ميشود.
مواد مورد نياز رنگآميزي:
اسيد نيتريك 10%
نيترات نقره 0/2%(W/V)+ 0/5ميليليتر فرماميد 37% تازه
NaCO323% (W/V)+ 0/5 ميليليتر فرماميد 37%+0/5 ميليليتر تيوسولفات 2%
اسيد استيك 10%(محلول متوقف كننده)
روش رنگآميزي:
- پس از اتمام الكتروفورز دو شيشه را از هم باز نموده و شيشة حاوي ژل را در سيني قرار دهيد و با آب ديونيزه شستشو دهيد.
- به ژل اسيد نيتريك 1% افزوده و 5 دقيقه بهآرامی تكان دهيد.
- اسيد نيتريك را تخليه و ژل را به مدت 2 دقيقه با آب ديونيزه شستشو دهيد.
- پس از تخليه آب، محلول نيترات نقره را به ژل اضافه نموده و 15 دقيقه در تاريكي تکان دهید (بهمنظور جلوگيري از اكسيداسيون و تیره شدن)
- ژل را با آب شستشو دهيد.
- محلول حاوي NaCO3 را روي ژل ريخته و تا ظاهر شدن باند Shake نماييد.
- پس از ظاهر شدن باندها به ژل اسيد استيك 10% افزوده تا واكنش متوقف شود.
- درنهایت ژل را با آب مقطر شستشو داده و از آن عکس تهیه نمایید.
[1] Single-strand conformation polymorphism
روشهاي شناسايي سریع عوامل میکروبی
برای دانلود پی دی اف برروی لینک زیر کلیک کنید
ورود / ثبت نام