تشخیص سریع عوامل میکروبی با بیوسنسورها
(قسمت دوم)
فاطمه صابری (دانشجوی کارشناسی ارشد بیوتکنولوژی )- دکتر رضا میرنژاد ( استاد تمام دانشگاه)
در مقاله قبلی سعی شد مروری بر ساختار اصلی حسگرها و ویژگیهای یک زیست حسگر مناسب در تشخیص پزشکی داشته باشیم، در این قسمت بطور مختصر مطالبی از چند نوع زیست حسگری که در قسمت قبل نام بردهایم ارائه میکنیم:
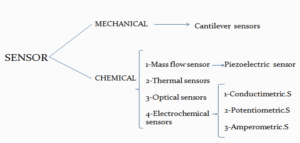
نمودار 1: انواع حسگرها به دو دسته اصلی مکانیکی و شیمیایی تقسیم میشوند.
زیست حسگرهای نانومکانیکی:
اساس حسگری با توجه به وسیله، مولکولهای آنالیت و دقت مورد نیاز متنوع است. بطور کلی حسگرهای شیمیایی اغلب بر مبنای شیوه تبدیل، به چهار زمینه عمده الکتروشیمیایی (Electrochemical)، نوری (Optical)، حساس به گرما (Thermosensitive) و حساس به جرم (Mass Sensitive) طبقه بندی میشوند. پاسخ حسگرهای حساس به جرم، با جرم آنالیت برهمکنش کننده با سطح عنصر حسگر متناسب است. حسگرهای میکروکانتیلور به هیچ برچسبی (Label) جهت پاسخ به حضور مولکول روی سطح زیست حسگر نیاز ندارند. در روشهای بدون برچسب میتوان از نمونههای اصلاح نشده استفاده کرد، در نتیجه امکان قرائت پاسخ در زمان واقعی فراهم میشود. حسگرهای نانومکانیکی حساسیت بالایی در یک ناحیه کوچک (μm1002) در مقایسه با زیست حسگرهای بدون برچسب دیگر نظیر تشدید پلاسمون سطحی (SPR) و ریز ترازوی بلور کوارتز (Quarrtz Crystal Microbalance-QCMB) دارند. زمانی که اتمهای سطح کانتیلور تحت بازآرایی ناشی از جذب سطحی گونههای شیمیایی قرار میگیرند، تغییرات مهمی در فشار روی سطح اتفاق میافتد. این تغییرات کششی یا تراکمی به طبیعت گونه جذب شده بستگی دارد.
میکروکانتیلورها:
میکروکانتیلورها برای میکروزیست حسگرها و نانوزیست حسگرها بسیار امیدبخش هستند و از کانتیلورهای مورد استفاده در میکروسکوپ نیروی اتمی (Atomic Force Microscopy-AFM) مشتق میشوند. کانتیلورها سکوهای فنری در اندازههای نانو و میکرو میباشند و بر مبنای انحراف سکو و یا تغییر فرکانس رزونانسی حاصل از حضور آنالیت در سطح کانتیلور عمل میکنند (شکل1).
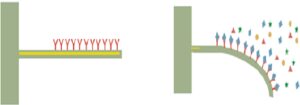
شکل 1: سکوی فنری کانتیلور که با آنتیبادی پوشیده شده است و با اتصال آنتیژن منحرف میشود.
زمانی که یک برهمکنش زیست مولکولی در سطح آنها اتفاق میافتد میکروکانتیلور شناسایی مولکولی، زیست مولکولها را به اشارات نانومکانیکی ترجمه میکند که بطور رایج به یک سیســـــــــــتم قرائت نوری (Optical Readout System) یا پیزورسیستیو (Piezo-Resistive Readout System) بعنوان مبدل نیروی مکانیکی به جریان الکتریکی کوپل میشود. میکروکانتیلور مثال جالبی از همراهی نانوفناوری و زیست فناوری است (شکل2)[1]. حسگرهای مبتنی بر کانتیلور در محیط هوا، خلأ و مایع عمل میکنند [2]. توسعه زیست حسگرهای مجتمع (Integrated) برای آشکار سازی همزمان گونههای مهم زیستی منجر به مفهوم زیست تراشهها (Biochip) شده است که به عنوان بسترهای دارای میکرو آرایههای زیست پذیرندهها (Bioreceptor) تعریف میشوند. زیست تراشههای حاوی نانو و میکروکانتیلورها بعنوان عناصر حسگر به نیروی خارجی، نشاندار کردن (Labling) و مولکولهای فلورسان نیاز ندارند[3]. امروزه طیفی از حسگرهای فیزیکی، شیمیایی و زیستی قرار گرفته روی سکوی کانتیلور مورد مطالعه هستند.
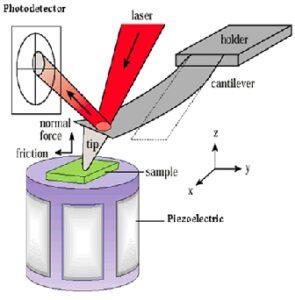
شکل 2: میکروکانتیلور شناسایی مولکولی زیست مولکولها را به اشارات نانومکانیکی ترجمه میکند
آشکار سازی پروتئین
برای تشخیص بیماریهایی مثل سرطان، آشکار سازی پروتئینهای چندگانه علائم بیماری مورد نیاز هستند. پروتئینها مستقیماً با بیماریهای مختلف در ارتباط هستند، بنابراین امکان تشخیص دقیق بیماریها با آشکارسازی پروتئینهای مناسب فراهم میشود. آشکارسازی از طریق تغییرات فشار سطحی اتصالات ویژه آنتیژن– آنتیبادی (Ag-Ab) توسط پاسخ نانومکانیکی مستقیم میکروکانتیلورها صورت گرفته است. یک سنسور مقاومتی پیزو، تغییر مقاومت فیلم با توجه به فشار سطح ناشی از اتصال ویژه زیست مولکولها را اندازه میگیرد. با اتصال آنالیت به پذیرنده، کانتیلور خم شده و مقاومت لایه مقاومتی پیزو تغییر میکند. آنتیژن ویژه پروستات (PSA) و پروتئینهای (CRP( C-reactive که علائم ویژه سرطان پروستات و بیماری قلبی هستند به این روش آشکارسازی شدهاند. آنتیبادیها نسبت به آنتیژنهای خود بسیار اختصاصی عمل میکنند.
صحت نتایج حاصل از این روش و اثبات اختصاصیت پیوند Ag-Ab با آزمایشهای دیگر نظیر فلورسانس تأیید میشود. استفاده از آپتامرها (قطعات اسیدنوکلئیک سنتزی ویژه آنالیت) بعنوان عناصر تشخیص در زیست حسگرها امکان آشکارسازی سریع و آسان پروتئینها را فراهم میکند. خواص ویژه آپتامرها سبب تولید آپتاحسگرهای پایدار، حساس و انتخابگر، با امکان بازتولید و سازگار با وضعیت نمونههای واقعی میشود. آپتامرها در برابر تغییر شکل و دناتوره شدن (Denaturation) مقاوم هستند و میتوانند توسط گروههای عاملی اصلاح شده و مستقیماً روی تراشههای زیستی تثبیت شوند، در نتیجه لایههای پذیرنده بسیار مرتب ایجاد میکنند و قادرند مولکولهای کایرال (Chiral) را تشخیص دهند. آپتامرها بصورت سنتزی بدست میآیند و بسیار خالصاند. همچنین نسبت به گیرندههای دیگر کوچکترند و امکان تثبیت مؤثر در دانسیته بالا را فراهم میکنند، بنابراین تولید، مینیاتوری کردن و تجمیع آپتاحسگرها نسبت به زیست حسگرهای دیگر سادهتر است. آپتامرهای DNA معمولاً به لحاظ شیمیایی پایدار بوده و امکان استفاده مجدد از زیست حسگر وجود دارد. برعکس آپتامرهای RNA توسط اندونوکلئازهایی که در سرم وجود دارند تغییر شکل مییابند، بنابراین زیست حسگرهای برمبنای آپتامرهای RNA فقط برای اندازهگیریهای محدود در محیطهای بیولوژیکی بکار میروند. برای پیشگیری از تغییر شکل آپتامر RNA اصلاح نوکلئوتیدهای پیریمیدین با گروههای آمینو پیشنهاد میشود.
آشکار سازی DNA
الیگونوکلئوتیدهای DNA تک رشته از طریق اتصال سولفور میتوانند روی کانتیلور طلاپوش تثبیت شوند. این اتصال تغییر بزرگی در فشار سطحی از طریق تثبیت ssDNA نشاندار با تیول در تباین با ssDNA غیر اصلاح شده نشان میدهد. همچنین یک لایه حسگر میتواند با استفاده از تک رشته DNA تیوله متصل به بستر طلا ایجاد شود که پیزو مقاومتی داخل این لایه فوراً به افزایش رشته DNA مکمل پاسخ میدهد و نسبت به رشتههای متفاوت انتخابگر است.
اندازهگیری سیگنال به روش حجمی (mass readout):
یکی از روشهای خواندن یا اندازهگیری سیگنال، سنجش تغییراتی است که در لایه تشخیص ایموبولیزه شده ایجاد میشود که در اثر اتصال به مولکول هدف بوجود میآید. در این حالت بیشتر از میکروبالانس کریستال کوارتز (crystal microbalance quartz) استفاده میشود. این دستگاه حساس بوده و میتواند تولید هیبرید (جفت شدگی) را در زمان ایجاد شدن آن گزارش دهد. از محدودیت های روش QMC این است که این روش را نمیتوان در حالتی که نمونه هدف در فاز محلول وجود دارد انجام داد، ولی با پیشرفتهایی در این زمینه یعنی ایجاد روشهای جدید تکثیر و تقویت نمونه شاید بتوان این محدودیت را از بین برد. روش دیگر اندازهگیری حجمی استفاده از کانتیلورهای میکروفابری (Microfabricated cantilevers) میباشد. در این روش افزایش حجم که همراه با هیبریداسیون میباشد بوسیله انحراف اشعه لیزر از سطح کانتیلور تشخیص داده میشود. از مزایای این روش مناسب بودن آن برای توسعه ایجاد شیارهای خطی است و با این روش میتوان اتصالات غیر اختصاصی را تصحیح نمود. از معایب این روش گران بودن و پیچیده بودن ابزار و دستگاه مورد استفاده میباشد.
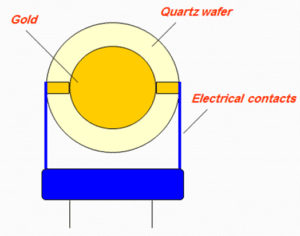
شکل 3: ریز ترازوی بلور کوارتز، میتوان بیورسپتورها را بر روی صفحه طلای این حسگر پوشش داد و آنالیت مورد نظر را شناسایی کرد
اندازهگیری سیگنال به روش الکتروشیمیایی:
روشهای الکتروشیمیایی برای تشخیص DNA بسیار مناسب میباشند، زیرا واکنشهای الکتروشیمیایی مستقیماً ایجاد سیگنال الکترونیکی میکنند و لذا نیازی به دستگاههای مبدل گران قیمت نمیباشد، بعلاوه چون ترتیب بازی ایموبولیزه شده میتواند تنها به یک سری سوبستراهای الکترود محدود شود، عمل نمایاندن (ردیابی) بوسیله یک سری آنالیزهای الکتروشیمیایی ارزان انجام میشود. سنسورهای الکتروشیمیایی جهت انجام تستهای کلینیکی یا محیطی در محل در دست تهیه میباشد. اساس حساسیت سیگنالهای الکتروشیمیایی بر اکسیداسیون مستقیم یا کاتالیزه شدن بازهایDNA همچنین واکنشهای احیا مولکولهای گزارشگر (Reporter molecules) یا آنزیمها میباشد. از روشهای مختلفی برای سنجش سیگنال بطریق الکتروشیمیایی استفاده میگردد.
اساس سنجش سیگنال در روش الکتروشیمی مستقیم DNA بر پایه واکنش اکسیداسیون و احیاDNA در یک الکترود جیوه میباشد، بنابراین مقدارDNA اکسید شده و احیا شده با مقدارDNA ای که با پروب هیبرید میشود تناسب دارد. علاوه بر روشهای قدیم احیای مستقیم DNA امروزه از روشی بنام ولتسنجی جذبی (Voltammetry adsorption stripping) برای اکسیداسیون مستقیمDNA استفاده میشود که روشی بسیار حساس است. در روش الکتروشیمی مستقیم بازهای پورین بوسیله موادی مانند کربن، ایندیومتین اکساید (ITO)، طلا و الکترودهای پوشیده از پلیمر اکسید میشوند. اگرچه روش الکتروشیمی مستقیم روش خیلی حساسی است، ولی کاربرد آن پیچیده میباشد، زیرا برای اکسیداسیون مستقیم DNA ، جریان زمینه با پتانسیل بالایی مورد نیاز است و همچنین روشهای ریاضی و عددی پیشرفتهای لازم است تا بتوان هر سیگنال را اندازهگیری نمود. البته روشهای جدیدی طراحی شدهاند که بوسیله آن بتوان به کمک روشهای فیزیکی تداخلی که در زمینه ایجاد میشود را حذف نمود؛ به عنوان مثال محققین توانستهاند DNA هدف را بوسیله پروبهایی که بر روی ذرات مغناطیسی (Magnetic beads) ثابت شدهاند، ردیابی نمایند. در این روش بعد از اینکه DNA پروب با DNA هدف برخورد کرد، دانههای مغناطیسی در محلول از هم جدا میشوند. DNAهای جمعآوری شده در محلول اسیدی دیپورینه میشوند و نوکلئوزیدهای گوانیندار آزاد جمعآوری شده و بوسیله روش ولتسنجی جذبی آنالیز میشوند. همچنین روش مشابهی با استفاده از اکسیداسیون مستقیم گوانین گزارش شده است که بوسیله آن قادر بودند که یک موتاسیون خاص را در بین قطعات DNAای که بوسیلهPCR تکثیر شده بودند شناسایی کنند. روش دیگر استفاده از پروب اسید نوکلئیک پپتید میباشد که با استفاده از پروبها عمل هیبریداسیون بطور محکمتری انجام شده و میتوان موتاسیون نقطهای را در DNA هدف با این روش تشخیص داد.
در روش الکتروشیمی غیرمستقیم DNA، برای اکسیداسیون DNA از حد واسطهای الکتروشیمیایی استفاده میشود. یک روش اختصاصی بسیار مؤثر استفاده از کمپلکسهای پلی پیریدیل (𝜫)RU و OS(𝜫) میباشد که بوسیله آنها اکسیداسیون الکتروشیمیایی گوانین صورت میگیرد. بوسیله این روش محققین توانستهاند یک ترتیب سه نوکلئوتیدی را ردیابی کنند. این روش به همراه RT-PCR میتواند برای بیان بیش از حد ژنها در نمونههای توموری مورد استفاده قرار بگیرد و دارای حساسیت بالایی میباشد. در همین بازهای آلی که از طریق شیمیایی تغییر کردهاند وارد محصول PCR شده و DNA حاصل به روشهایی شناسایی میگردد. اگرچه این روش بسیار حساس است، ولی اینکه این روش برای تشخیصهای کلینیکی مناسب باشد هنوز کاملاً مشخص نیست. از مزایای این روش غیر پیچیده بودن آن میباشد.
چندین روش تحت بررسی است که بر اساس آن DNA هدف با مولکولهای گزارشگر فعال احیا شده نشاندار میگردند. با استفاده از روشهای فیزیکی میتوان ترتیب بازی نشاندار را تا محدوده 1010 مولکول ردیابی نمود. یک تغییر در این روش شامل سنجش ساندویچ سه جزئی (Three component sandwich assay) میباشد که در این حالت مواد نشاندار احیا شده به یک قطعه DNA سنتزی متصل میشود که در این قطعه DNA به کمپلکس پروب- هدف متصل میشود. به عبارت دیگر مواد نشاندار احیا شده به یک قطعه سنتزی متصل میشود که این قطعه سنتزی به کمپلکس پروب- هدف متصل شده یا آویزان میشود. در این حالت تغییرات انجام شده پروب و ترتیب بازی نشاندار را در کنار هم قرار میدهد (شکل 4).
شکل 4: یکی از موارد استفاده از DNAهای نشاندار استفاده از پروب نشاندار شده با فروسین میباشد که بر روی الکترود طلا قرار گرفته است. با استفاده از این تکنیک میتوان DNA هدف را محصور نموده و بر اثر تماس ایجاد شده تغییری در مولکول فروسین صورت میگیرد که سیگنالی به الکترود طلا میدهد و این سیگنال بصورت جریان فاراد اندازهگیری میشود. با این روش میتوان تغییر در دو باز آلی (موتاسیون) را گزارش نمود.
روش دیگر در این گروه استفاده از نانو ذراتی مانند: PbS،ZnS، CdS است که بر روی آنها قطعهای از DNA سوار شده است. در این روش ابتدا پروب را بر روی ذرات مغناطیسی سوار میکنند و در معرض DNA هدف قرار میدهند، سپس بعد از جدا کردن مغناطیسی ذرات دو مرتبه در معرض نانو ذرات قرار داده که بر روی آنها DNA پروب قرار داده شده است و با DNA هدف واکنش داده میشود و سیگنال مزبور خوانده میشود. حتی در بهبود این روش افرادی قطعاتی از CdS را تهیه کردهاند که قادر به شناسایی فتوالکتروشیمیایی هیبریداسیون DNA میباشد. در طی این عمل ابتدا DNA پروب ایموبولیزه شده و با DNA هدف هیبرید میگردد. سپس این کمپلکس باCdS-DNA هیبرید میشود. در مرحله بعدی کمپلکس CdS-DNA با نانوذرات الیگونوکلئوتیدی و رشته DNA که بصورت پل عمل میکنند واکنش داده و تولید تجمعی از نانوذرات نشاندار میکنند. در معرض قرار دادن این تجمع نانوذرات به نور آبی سبب ایجاد جریان الکتروشیمیایی بین نانوذرات CdS و الکترود طلا میشود.
یکی از مشکلات برای تشخیص بیماریهای عفونی، مقدار کم DNA میباشد که این مشکل را با استفاده از نانوذرات Nanoparticles)) میتوان برطرف نمود. کار به این صورت است که سطحی (الکترود) وجود دارد که بر روی آن DNA پروب قرار گرفته است. نمونه DNA هدف بر روی سطح ریخته میشود. همزمان نانوذرات طلا که بر روی آن DNA پروب قرار گرفته است نیز اضافه میگردد. اگر در نمونه عامل بیماری مورد نظر وجود داشته باشد DNA استخراج شده با DNA پروب هیبرید شده و نانوذرات طلا نیز که مکمل قسمتی از DNA هدف نیز میباشند با آن واکنش میدهد. بر روی کمپلکس، نقره اضافه میشود که در نتیجه اضافه کردن آن ایجاد جریانی شده که قابل اندازهگیری است. همچنین برای بهبود بخشیدن به عمل انتقال سیگنالها مثلاً در موقعی که نمونه DNA کم است میتوان تغییراتی در سطح الکترودها مانند استفاده از صفحات پلیاستری ارزان قیمت ایجاد نمود.
از DNA سنسورهای الکتروشیمیایی میتوان برای سنجش دیگر مولکولها مانند آرسنیک تریاکساید (AS2O3) استفاده نمود. در این روش سیگنال ایجاد شده که بصورت ولتامتریک سنجیده شده و این سنجش بر اساس اکسیداسیون گوانین میباشد در اثر مقدار غلظت و مدت زمان در معرض قرار گرفتن آرسنيک کاهش پيدا میکند (آرسنيک به گوانین صدمه زده و لذا سيگنال کاهش پيدا میکند).
باتشکر از مرکز تحقیقات نانوتکنولوژی دانشکده علوم پایه دانشگاه فردوسی مشهد و ستاد ویژه توسعه فناوری نانو
- 1. Carrascosa LG, Moreno M, A´ lvarez M, Lechuga LM. Nanomechanical biosensors: a new sensing tool. TrAC Trends in Analytical Chemistry, 2006, 25(3):196-206.
- 2. Raiteri R, Grattarola M, Butt HJ,Skladal P. Micromechanical cantilever-based biosensors. Sensors and Actuators B.2001. 79(2-3):115-126.
- 3. Khaled ARA, Vafai K, Yang M, Zhang X, Ozkan CS. Analysis, control and augmentation of microcantilever deflections in bio-sensing systems. Sensors and Actuators B.2003.94(1):103-115.
نانوبیوسنسورها: آیندهای برای تشخیص بیماریها (3)
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام