تازههایی از بروسلاها
دكتر رضا ميرنژاد (استاد تمام دانشگاه)
جنس بروسلا شامل باکتریهای گرم منفی هوازی و فاقد حرکت و عامل بیماری بروسلوزیس است. بیماری بروسلوزیس از لحاظ كلينيكي برای اولین بار توسط مارستون[1] در سال 1859 ميلادي شرح داده شد. گونه مليتنسيس در اواخر 1887 میلادی توسط دیوید بروس[2] پزشک ارتش انگلستان که جهت مطالعه بیماری تب مواج (Undulant fever) به مالت (ملیتا) مأموریت یافته بود، از طحال افرادی که در اثر بیماری فوت شده بودند، جدا شد و به علت شکل كوكوئيدي آن، ميكروكوكوس مليتنسيس ناميده شد. اين باكتري را بعدها بروسلا مليتنسيس ناميدند. ارتش انگلستان از مطالعات بروس حمايت نكرد و او را به تانزانيا فرستاد، بهمحض رسيدن بروس به آفريقاي شرقي، او شروع به مطالعه يك بيماري جديد يعني بيماري خواب كرد و عامل اتيولوژيك آن كه تريپانوزوما بروسي (Trypanosoma brucei) است را شناسایی كرد. آقاي بنهارد بنگ[3] در سال 1895 ارگانيسم متفاوتي را بهعنوان عامل بروسلوزيس در گاوها شرح داد و آن را باسیلوس آبورتوس ناميد. در سال 1898 اولين مورد بروسلوزيس انساني در ايالات متحده آمريكا تشخيص داده شد. در سال 1905 آقاي زاميت[4] شير خام بزها را باعث آلودگي انسان ذكر كرد و در همين سال كميته تب مديترانهاي[5] به رياست ديويد بروس شكل گرفت. باسیلوس سوئیس در سال 1914 از جنين سقطشده خوك جدا شد. تشابه بين بروسلا مليتنسيس و آبورتوس در سال 1918 میلادی توسط اوانس[6] مورد بررسی قرار گرفت و در همان سال نیز آقاي برنارد[7] پي برد كه گاوها مخازن تب مواج هستند.
در سال 1920 به افتخار ديويد بروس نام عمومی بروسلا براي اين ارگانيسم انتخاب شد. كارميشل و برونر[8] (1968) گزارش كردند كه عامل سقط در ميان سگهاي شكاري، باسیلوس کانیس است. در دهههاي بعد، باسیلوس اویس و باسیلوس نئوتومه به ترتيب از گوسفندها و رتهاي جنگلي جداسازي شدند؛ هيچ گزارشي از همراهي اين گونهها با بيماري انساني وجود ندارد. علاوه بر شش گونهي فوق، گونههای جديد بروسلا ستی، بروسلا پینی پدیالیس از پستانداران دریایی و بروسلا میکروتی از والها جداسازي شده است كه در انسان ايجاد بيماري نميكنند. همچنين اخيراً گونهي جديدي به نام اینوپیناتا در همراهي با عفونت انساني شناسايي شده است.
بروسلاها انگلهای اجباری حیوانات، انسانها، برخی از حشرات و کنهها هستند که مشخصاً بهصورت داخل سلولی قرار میگیرند. بیماری ناشی از این باکتریها در انسان که بروسلوزیس (تب مالت، تب مواج و تب مدیترانهای) نام دارد، با یک فاز باکتریمی حاد مشخص میشود که به دنبال آن یک مرحله مزمن ایجاد میشود که میتواند سالهای متمادی طول کشیده و بافتهای زیادی (استخوان و غدد لنفاوی) را درگیر نماید. 12 گونه بروسلا وجود دارد. بروسلا آبورتوس (Brucella abortus) بیشتر در گاوها بیماریزاست؛ بروسلا كانيس (B. canis) سگها؛ بروسلا مليتنسيس (B. melitensis) بز و گوسفند؛ بروسلا نئوتومه (B. neotoma) موشهاي جنگلي؛ بروسلا اويس (B. ovis) گوسفند و بروسلا سوئيس (B. suis) خوك، اسب، جوندگان و گوزن شمالي را آلوده ميكند.
دو گونه جدید از جانداران دریایی ایزوله شدهاند که شامل بروسلا ستی (B. ceti) و بروسلا پینی پدیالیس (B. pinnipedialis) هستند. بروسلا میکروتی (B.microti)، بروسلا پاپیونیس (B. papionis) و بروسـلا وولپیس (B. vulpis) به ترتیب از موش صحرائی، میمون بابون و روباه قرمز ایزوله شدهاند. جدیدترین گونه شناختهشده، بروسلا اینوپیناتا (B.inopinata) است که سبب عفونت در انسان میشود. در ادامه توضیح کوتاهی درباره بعضی از گونهها ارائه میگردد.
1- بروسلا آبورتوس:
بروسلوزیس گاوي بهوسیله این باکتري ایجاد میشود، همچنین سایر گونهها ازجمله انسان را درگیر میکند. بروسلا آبورتوس میتواند بهعنوان یک عامل بیوتروریسم مورد استفاده قرار بگیرد. براي این ارگانیسم تا 9 بیووار گزارش شده است؛ بیووارهاي 9-1 که بیووار 3 از همه شایعتر است. اغلب بیووارهاي بروسلا آبورتوس نیاز به انکوباسیون در حضور 5 تا 10 درصد CO₂ جهت رشد دارند.
2- بروسلا ملیتنسیس:
بروسلا ملیتنسیس عمدهترین مسئول بروسلوزیس در گوسفند و بز، یک بیماري بسیار شایع در خیلی از کشورهاست. عمدتاً سبب سقط، مردهزایی و تولد بچههای ضعیف میشود. این باکتري بسیار زئونتیک بوده و مسئول اکثر موارد بروسلوزیس در انسان و بهعنوان یک سلاح بیولوژیک بالقوه مطرح است. بروسلا ملیتنسیس نسبت به سایر بروسلاها تمایل بیشتري به ایجاد بیماري سیستمیک دارد، با این وجود تنها بالغین را درگیر میکند، حیوانات جوان را میتواند آلوده کند ولی این حیوانات تنها یک ضعف و یا یک پاسخ سرولوژیکی گذرا از خود نشان میدهند. انواع صاف آن ویرولانس بیشتري براي حیوانات آزمایشگاهی، نسبت به بروسلا آبورتوس دارند و ممکن است که سبب عفونتهای کشنده شوند، انواع خشن معمولاً براي هردو، حیوانات آزمایشگاهی و میزبانهای طبیعی بیماریزا هستند. براي این باکتري 3 بیووار گزارش شده است که بیووارهاي 1 و 3 شایعترین آنها هستند.
3- بروسلا سوئیس:
بروسلا سوئیس از جمله قدیمیترین عوامل بررسیشده و استفادهشده بهعنوان یک سلاح بیولوژیک در برنامه بیوتروریسم ایالات متحده آمریکا در سال 1950 بوده است. این باکتري شامل 5 بیووار بوده که بیووارهاي 1 تا 4 آن براي انسان بیماریزا هستند، بروسلا سوئیس داراي تنوع بیشتري از ایزولهها نسبت به سایر گونههای بروسلاست و این ایزولهها اختصاصیت میزبانی وسیعتری دارند.
4- بروسلا کانیس:
از نظر مشخصههای کشت و مرفولوژي به همان صورت است که براي جنس بروسلا شرح داده خواهد شد. هیچ بیوواري براي این باکتري شناسایی نشده است. وارد فاز Smooth نمیشود. کشتهای آن توسط آنتی سرم ضد آنتیژنهای M و A آگلوتینه نمیشوند، اما با آنتیسرم ضد آنتیژن R بروسلا اویس آگلوتینه میشود. از لحاظ فعالیت متابولیکی بسیار شبیه به بیووار 1 بروسلا سوئیس بوده با این تفاوت که اوروکانیک اسید را اکسید میکند. براي سگها پاتوژن است و سبب سقط و مردهزایی در سگهاي باردار میشود. در انسانها نیز بعضی اوقات باعث آلودگی و عفونت میشود.
5- بروسلا اویس:
براي گوسفند پاتوژن بوده ولی در عین حال میتواند بز، گاو، خوك و برخی جوندگان کوچک را آلوده کند. بیوواري براي آن معرفی نشده است. با اینکه گونههای دیگر بروسلا در رنگآمیزی اصلاحشده کوستر، قرمز میشوند، اما این باکتري به رنگ آبی درمیآید. آنتیژنهای سطحی M و A را ندارد، ولی داراي آنتیژن R است؛ مانند بروسلا آبورتوس در ایزولاسیون اولیه به محیط کشت حاوي 5 تا 10 درصد دیاکسید کربن احتیاج دارد.
6- بروسلا نئوتومه:
نام این باکتري از یک موش جونده چوب[9] درختی در غرب آمریکا که ابتدا از آن جدا شده بود اقتباس شده است. براي گاو، گوسفند، بز، خوك و همچنین انسان بیماریزا نیست؛ حتی براي میزبان طبیعی خود نیز بهطور واضح پاتوژن نیست و هیچ بیوواري ندارد.
7- بروسلاهای ستی و پنیپدیالیس:
این باکتریها از پستانداران دریایی ایزوله شدهاند. بیماریزایی آنها براي میزبان طبیعی خود بهروشنی مشخص نشده است، با این حال این ارگانیسمها بهطور بالقوه براي انسان پاتوژن هستند. به دو گونه، بروسلا ستی و بروسلا پنیپدیالیس بر اساس نوع میزبانهای ترجیحی وRFLP انجامشده بر روي لوکوس omp2 تقسیمبندی میشوند. پروفایل پروتئینهای آنها بهطور واضح با گونههای کلاسیک بروسلا تفاوت دارد.
8- بروسلا میکروتی:
در سال 2008 این گونه از جنس بروسلا بهعنوان هشتمین گونه از این جنس توسط Scholz و همکاران معرفی شد. نام این باکتري از موش صحرائی میکروتوس که میزبان طبیعی آن است، اقتباس شده است. برخلاف دیگر گونههای بروسلا، یک ارگانیسم سریعالرشد و از لحاظ بیوشیمیایی بسیار فعال است با فنوتیپی بسیار شبیه به اوچروباکتریوم. این باکتري پاتوژن تصادفی انسان است. براي این باکتري 4 بیووار گزارش شده است.
9- بروسلا اینوپیناتا:
در سال 2010 نهمین گونه بروسلا توسط شولتز و همکارانش به این جنس اضافه شد. خویشاوندي این ارگانیسم با جنس بروسلا بهوسیله الگوي پلیآمین، نمودار لیپیدهاي قطبی، نمودار اسیدهاي چرب، سیستم کینون، مطالعات هیبریداسیون DNA – DNA وPCR اختصاصی توالی الحاقی IS 711 تأئید شده است. باکتري از زخم حاصل از عفونت سینه جداسازي شده بود. از نظر قابلیتهای متابولیکی و فنوتایپی به بروسلا میکروتی شباهت زیادي دارد.
خصوصيات بروسلاها
بروسلاها كوكوباسيلهاي كوچك، غيرمتحرك، هوازی اجباری، غالباً بدون اسپور، بدون كپسول (ولي در موارد نادر كپسول تكامل نيافته در سویههایی كه تازه جدا شده، مشاهده شده است)، ميلهاي شكل با ابعاد 0/7- 0/5 ميكرومتر (عرض) و 1/5 – 0/6 ميكرومتر (طول) كه به بهصورت منفرد و دوتايي از انتهاي يكديگر قرارگرفتهاند و گاه در گروههای كوچك بهصورت زنجيرههاي 4 تا 6 تايي از باکتریها هم ديده ميشوند. آنها با ظاهری شبیه شن (sand) توصیف شدهاند. از منابع طبيعي شكل L-Form باكتري نيز جداسازي شده است. بروسلا گرم منفي و غير اسيد فاست است و در کشتهای كهنه انتهاي باكتري پررنگتر بوده و يا سلول باكتري رنگپذيري نامنظم داشته و بهصورت دوقطبی مشاهده ميشود.
از لحاظ فراساختاري بروسلا مانند ساير گرم منفيها است. در ميكروگراف الكتروني با رنگآمیزی منفي، بروسلا داراي سطحي ناهموار است كه احتمالاً به دلیل حضور ساختارهاي كمپلكس ليپوپليســـــــــاكاريد (LPS) ـ پروتئين، در غشاي خارجي باكتري است. ضخامت غشاي خارجي 9 نانومتر و ضخامت پپتيدوگليكان 3 تا 5 نانومتر است كه نسبت به باكتري اشریشیاکلی داراي پپتيدوگليكان ضخيمتري است. در اين باكتري ناحيه پريپلاسميك وجود دارد و مانند غشاي دروني باكتري حاوي كمپلكسهاي پليريبوزوم است. سيتوپلاسم باكتري حاوي واكوئولهاي كوچك و گرانولهای پليساكاريدي است و مواد كروموزومي باكتري در يك توده قرار گرفته است.
بروسلا داراي دو كروموزوم 1/5و 2/1 مگابازی است. مطالعات تاكنون وجود پلاسميد را در بروسلا نشان نداده است. تاکنون كونژوگاسيون و ترانسفورماسيون، در بروسلاها گزارش نشده است بهاستثنای بيوار 3 بروسلا سوئيس كه يك كروموزوم حلقوي 3/1 مگابازی دارد، محتواي ژنومي ساير اعضاي جنس بروسلا شامل دو كروموزوم حلقوي 2/1 و 1/5 مگابازي است كه هر دو براي بقا و همانندسازي باكتري ضروري هستند. درصد C+G آنها 59-58 است. مطالعههاي انجام گرفته بر اساس هيبريداسيون DNA-DNA نشان از وجود تشابه ژنومي بسيار بالا در بين اعضاي اين جنس دارد، بهطوریکه همساني توالي DNA آنها بيش از 95 درصد است، همچنين نشان داده شده است كه DNA بروسلا 30 درصد مشابه با اكروباكتریوم است.
گرچه سويههاي آزمايشگاهي بروسلا قادر به رشد در محیطهای ساده هستند، ولي اغلب بروسلاها داراي نيازهاي رشد پيچيده بخصوص در جداسازي اوليه از نمونهاي باليني میباشند. بطوركلي عواملي چون اسيدهاي آمينه، تيامين، بيوتين، نيكوتين آميد، یونهای منيزيم، آهن و منگنز براي رشد اين باکتریها ضروري است. با افزودن پانتوتئات و ايزواريترول رشد بسياري از سويهها افزايش مييابد، در واقع تركيب اخير ميتواند بهعنوان منبع انرژي براي بروسلا مليتنسيس و بروسلا سوئيس استفاده گردد. رشد باکتریها در حضور گاز دياكسيد كربن افزايش مييابد، درعینحال وجود اين گاز براي رشد برخي از سويهها مانند گونه بروسلا آبورتوس ضروري است. از عوامل مؤثر فيزيكي در رشد اين باکتریها، حرارت، pH و اسمولاريته است. دماي اپتيمم رشد اين باكتري 37 درجه سلسيوس و pH مناسب رشد 6/6 – 4/7 است و تغييرات pH در شرايط آزمايشگاهي به سمت قليائي و اسيدي باعث مرگ بروسلا ميشود. اسمولاريته مناسب رشد باكتري، 5 درصد تا 15 درصد مولار كلريد سديم است. متابوليسم همه سويههاي بروسلا هوازي است و نياز به اكسيژن دارند و در شرايط بيهوازي قابليت رشد ندارند. متابولسيم قندها در بروسلا از نوع اكسيداتيو است، ولي تحت شرايط خاص از قندها توليد اسيد مينمايند. سويههاي بروسلا كاتالاز مثبت و بيشتر سويهها اكسيداز مثبت هستند. اين باکتریها داراي فعاليت سوپراكسيد ديسموتاز هستند. گلوکز توسط اغلب سويهها متابوليزه ميشود، ولي ايزواريترتيول ترجيحاً توسط بروسلا آبورتوس و بروسلا مليتنسيس و كمتر توسط بروسلا سوئيس و بروسلا اويس متابوليزه ميگردد. این باکتری در بیماران، لاشه حیوانات، حیوانات آلوده و خصوصاً در دستگاه تناسلی و غدد پستان و همچنین شیر و فرآوردههای آن وجود دارد و از طریق شیر و فرآوردههای آن به انسان منتقل میشود.
پاتوژنز و تظاهرات باليني
بروسلا از طريق مخاط تنفسي، گوارشي، ادراري ـ تناسلي، چشم و يا از راه پوست وارد بدن ميشود، سپس در موضع ورود توسط سلولهاي لكوسيت تكهستهاي و چندهستهاي بلعيده ميشود. علاوه بر LPS كه باعث مقاومت در برابر اثر باكتريسيدال سرم و بقاي درون لكوسيتها ميشود؛ ارگانيسم قادر به سركوب انفجار تنفسي است و همچنين با آزاد كردن فاكتورهاي محلول از ادغام فاگوزوم با ليزوزوم جلوگيري ميكند (با اسيدي كردن فاگوزوم علاوه بر جلوگیری از ادغام آن با ليزوزوم از عملكرد آنتيبيوتيكها نيز جلوگيري ميكند). رهاسازي آدنين منوفسفات و گوانين منوفسفات باعث غيرفعال شدن سيستم ميلوپراكسيداز شده و از دگرانولاسيون بيگانهخوارها جلوگيري ميكند. ضمن اینکه باكتري كاتالاز و سوپراكسيد ديسموتاز وابسته به آهن- روي را توليد ميكند كه در بقاء داخل سلولي نقش دارد.
باكتري پس از تكثير در غدد لنفاوي وارد جريان خون شده و باكتريمي ایجادميكند و در نتيجه فاز حاد و تبدار بيماري شروع ميشود. ارگانيسم از خون به سراسر سيستم رتيكولواندوتليال نفوذ ميكند و ممكن است به تعداد زيادي در طحال و كبد يافت شوند. آنها ممكن است ساير اندامها از قبيل: مفاصل، قلب، كليه، سيستم عصبي مركزي و دستگاه تناسلي را نيز درگير كنند (2).
آنتيباديهاي تولیدشده عليه LPS باعث محافظت ناقص در برابر عفونت ميشوند؛ حتي باكتريهاي اپسونيزه شده بهطور مؤثري توسط ماكروفاژها كشته نميشوند. آنتيباديهاي تولیدشده عليه پروتئينهاي سطحي بروسلا نيز در حذف عفونت كارايي كمتري دارند. پاکسازی بروسلاها وابسته به پاسخهاي لنفوسیتهای نوع TH1 است كه با توليد اينترفرون گاما همراه است. اين روند شديداً توسط سلولهاي زندهي بروسلا القاء ميشود. فاکتور نکروزدهنده تومور-α (αTNF-) از فاكتورهای اساسی كشتار داخل سلولي بروسلا است كه توليد آن توسط سلولهاي زنده بروسلا، مهار ميشود. از ديگر سايتوكاينهاي مهم ميتوان به اینترلوکین-1 (IL-1) و اینترلوکین-12 (IL-12) اشاره كرد.
برخلاف ساير گونهها، بروسلا کانیس، بروسلا نئوتومه و بروسلا اویس از اختصاصيت ميزبانی بالاتري برخوردار هستند و خيلي كمتر باعث آلودگي در انسان ميشوند. بهطور كلي بروسلا در تمامي ميزبانهاي خود رشد داخل سلولی دارد و پس از آلوده كردن سيستم رتيكولواندوتليال فازهاي متغير باكتريميك را سبب ميشود. در ميزبانهاي ترجيحي خود قادر به آلوده كردن بافتهاي دستگاه تناسلي و غدد جنسي هستند. مبناي بیماریزایی بروسلا بهطور كامل شناسايي نشده است. واريانتهاي ناصاف گونههايي كه بهطور طبيعي صاف هستند، بیماریزایی بسيار كمتري دارند كه نشان از اين حقيقت دارد كه زنجيرهي O در LPS نقش برجستهاي در بیماریزایی اين ميكروارگانيسم دارد. سويههاي صاف از آپوپتوزیس سلولهاي ميزبان جلوگيري ميكنند كه با فرار از سيستم ايمني باعث بقای داخل سلولي باكتري ميشود. در اين باکتریها جزاير پاتوژنيسيتي و سيستمهاي ترشحي I، II و III وجود ندارد. اعتقاد بر اين است كه سيستم ترشحي تيپ VΙ در اين ارگانيسم در بقا و تكثير داخل سلولي نقش دارد.
بر اساس تظاهرات باليني، بروسلوزیس را به سه شكل حاد، تحت حاد و مزمن، تقسيمبندي ميكنند. این بیماری يك بيماري سيستميك است. در فرم حاد و تحت حاد تظاهرات باليني بيشتر است، ولي در فرم مزمن اين تظاهرات كمتر و گیجکننده بوده که در تشخيص بيماري ايجاد مشكل ميكند.
بيماري حاد يا تحت حاد به دنبال يك دورهي انكوباسيون 6-1 هفتهاي و يا حتي بيشتر ايجاد ميشود. اين دوره وابسته به قدرت بیماریزایی سوش، مقدار تلقيح، مسير عفونت و مقاومت ميزبان متغير است. عفونت با بروسلا ملیتنسیس باعث يك بيماري حاد با شروع ناگهاني ميشود درحالیکه ساير گونهها منجر به يك بيماري تحتحاد با شروع آرام و دورهي انكوباسيون نامعين ميشوند.
بروسلوزیس حاد بهوسیلهی يك تب نوبهاي[10] با دماي بين 38 تا 41 درجه سلسیوس شناسايي ميشود. پس از رسيدن به بالاترين مقدار خود، بهسرعت دما كاهش مييابد كه همراه با عرق فراوان است. در اوايل بيماري اين افزايش و كاهش دما از يك الگوي منظم پيروي ميكند. بيماري همراه با بياشتهايي، ضعف، خستگي شديد و كاهش وزن است و علائمي مانند درد مفاصل، عضلات و سردرد نيز شايع است. حدود دو سوم از بيماران مبتلا به بروسلا ملیتنسیس از تورم كبد[11] و طحال[12] رنج ميبرند و گاهي يك يرقان زودگذر اتفاق ميافتد، درحالیکه يك سوم بيماران مبتلا به بروسلا آبورتوس و سوییس، اسپلنومگالي و تعداد كمتري هپاتومگالي دارند. عود باکتریولوژیک بیماری 3 تا 6 ماه بعد از یک درمان ناپیوسته رخ میدهد و عموماً به پیدایش مقاومت آنتیبیوتیکی مربوط نمیشود. بنابراين تصوير كلينيكي بيماري ميتواند گمراهکننده باشد.
اگر حيوان مبتلا باردار باشد، باكتريمي اغلب منجر به تهاجم به رحم ميشود. در همين زمان، عفونت به غدد لنفاوي و اندامهاي متفاوت از قبيل غدد پستاني و طحال نيز سرايت ميكند. مهمترين علامت در اين مرحلهي اوليهي بيماري سقط است، اما علائم ديگري نيز در پي موضعي شدن ميتواند مشاهده شود (تورم بيضه، اپيديميس، آرتريتديس، التهاب رحم، آماس غدههاي پستان و …). در تعداد زيادي از حيوانات، عفونت بهصورت خودمحدودشونده درآمده و يا در قالب حاملين نهفتهي بدون علامت آن را اشاعه ميدهند. اصولاً عفونت در اواخر بارداري حيوان باعث سقط نميشود. مرحلهي دوم، مزمن شدن عفونت در غدد پستاني و غدد لنفاوي تناسلي با ترشح متناوب ارگانيسم در شير و ترشحات تناسلي است.
ظرفيت اپيدميك شدن بيماري، عدم وجود واكسن انساني، ايمن نبودن سويههاي واكسني و انتقال از طريق آئروسل باعث شده كه اين ارگانيسم در زمرهي بيماريزاي سطح 3 ايمني زيستي طبقهبندي شود، همچنين به دليل ويژگيهاي فوق از اين ميكروارگانيسم در بيوتروريسم استفاده ميگردد.
اپيدميولوژي
بروسلوزیس بيماري حيوانات است و انسان بهطور اتفاقي در اثر تماس با حيوان مبتلا و يا مصرف فرآوردههاي دامي خصوصاً شير و لبنيات آلوده، به آن دچار ميشود. انسان معمولاً در اثر تماس با حيوانات اهلي آلوده مانند گاو، گوسفند، بز، خوك و سگ و يا استفاده از شير، پنير، خامه و ساير لبنيات غير استريل، آلوده ميگردد. عفونت اكتسابي از حيوانات ديگر مانند شتر و حيوانات حيات وحش مانند بوفالو، گوزن شمالي و ياك (غژگاو) نيز گزارش شده است.
تماس از راه پوست زخمي با بروسلا و يا از راه مخاط دهان و چشمي یکی از مسیرهای كسب عفونت در انسان بهشمار میرود كه معمولاً در تماس با حيوان آلوده مانند كمك كردن به وضع حمل حيوان و يا حمل و نقل شير، پنير، كره، خامه، پشم و گوشت آلوده ايجاد ميشود. یک مسير مهم ابتلا در انسان، سيستم گوارشي است كه در اثر مصرف خام و غير استريل شير و فرآوردههاي آن روي ميدهد. حتي مصرف گوشت آلوده كه خوب پخته نشده باشد نيز ميتواند باعث عفونت شود. سومين مسير مهم در عفونتهای انساني، تنفس بروسلا است كه ميتواند در بين كاركنان آزمايشگاه، قصابيها، كاركنان كشتارگاه، كشاورزان، دامداران و كساني كه با پشم حيوانات سروكار دارند ايجاد بیماری نماید. این بیماری در تمام سنین وجود دارد و هر دو جنس زن و مرد نسبت به ابتلا به آن حساسیت مشابهی دارند.
بروسلا اگر در معرض فنل 1% قرار گیرد در مدت 15 دقیقه از بین میرود. باکتری به روش پاستوریزاسیون سریع (حرارت 63 درجه سلسیوس به مدت 10 دقیقه) بهراحتی کشته میشود. بروسلا در محیطهای کشت جامد و غیرقابل نفوذ که بهخوبی درزگیری شده باشند حداقل یک ماه و غالباً بیشتر زنده میماند، همچنین به حالت لیوفیلیزه برای چندین سال پایدار است. این باکتری در شیر خام که در دمای محیط نگهداری شود به علت کاهش pH محیط بهسرعت از بین میرود، گرچه در خامه غیرپاستوریزه تا مدتها میتواند بیماریزایی خود را حفظ نماید، همچنین درصورتیکه پنیر تهیهشده از شیر غیرپاستوریزه در آب نمک نگهداری نشده باشد میتواند یکی از منابع مهم انتشار بیماری در جامعه باشد. در شرایط مطلوب بروسلا ملیتنسیس ممکن است در ادرار به مدت 6 روز، در گردوغبار به مدت 6 هفته، در خاک و آب به مدت 10 هفته و در گوشت به مدت 3 هفته زنده بماند. بروسلا آبورتوس موجود در بافتها، ترشحات و ضایعات بیمار که در دمای نزدیک به انجماد نگهداری شدهاند ممکن است حدود 7 ماه زنده بماند. بهنظر میرسد که مرگ آن در کره و پنیر به علت بالا بودن اسیدیته باشد. البته میتوان باکتری را بهندرت در مدت چند روز از کره و پنیر جدا نمود، تابش اشعه ماوراء بنفش و گاما در دوزهای نرمال باعث کشتن سریع آنها میگردد. اتانول، ایزوپروپانول، یدوفورها، هیپوکلریتها، اتیلن اکسید و فرمالدئید همگی بر روی بروسلا مؤثر هستند. در بررسی دیگر بروسلا آبورتوس در محیطهای مختلفی چون ادرار گاو 4 روز، مدفوع گاو که در محل تاریکی نگهداری میشود 120 روز، جنین سقط شدهای که در هوای سرد نگهداری میشود 75 روز، کود و خاک در دمای 25 درجه سلسیوس 29 روز، کود و خاک در دمای انجماد 2/5 سال، خاک نمناک در حرارت محیط 66 روز، گونی کنف در انبار خنک 30 روز، آب در دمای 25 درجه سلسیوس 10 روز، شیر 10 درجه سلسیوس کمتر از 10 روز، بستنی صفر درجه سلسیوس 30 روز، کره با 8 درجه سلسیوس 142 روز و پنیر به مدت 21 روز زنده مانده است.
بیماری تب مالت پراکندگی وسیع جهانی دارد که علت آن انتشار عفونت در دامهای اهلی و وحشی است. طبق گزارش سازمان بهداشت جهانی، سالیانه حدود صدها هزار نفر انسان مبتلا به تب مالت گزارش میشوند. این بیماری تقريباً در تمام نقاط دنيا ديده ميشود، اما كشورهايي كه عفونتهای انساني در آنها بالا است شامل: ايتاليا، اسپانيا، تركيه، يونان، اسرائيل و فرانسه از اروپا؛ تونس، نيجريه، مصر و ليبي از آفريقا؛ برزيل، آرژانتين، كلمبيا، اكوادور و مكزيك از قاره آمريكا؛ سوريه، لبنان، كويت، عربستان و خصوصاً ايران از آسيا هستند.
تخمین زده میشود که حتی در کشورهای پیشرفته، فقط 4 تا 10 درصد موارد بروسلوزیس تشخیص داده میشود. بسیاری از کشورهای منطقه مدیترانه شرقی جزء مناطق اندمیک بروسلوزیس هستند. در ایران نیز علیرغم سیستم مراقبت بهداشتی خوب، بروسلوزیس هنوز یک بیماری مهم اندمیک محسوب میشود.
اولین بار در سال 1310 وجود تب مالت در ایران توسط انستیتو پاستور تأئید گردید و در سال 1323 بروسلا آبورتوس از گاوداریهای اطراف شهر تهران توسط دکتر کاوه در مؤسسه رازی جدا گردید و به این ترتیب یکی از عوامل سقط جنین گاوها در تهران شناخته شد. در سال 1327 دکتر انتصار اولین مورد بروسلا ملیتنسیس را گزارش نمود. در سال 1337 دکتر تاجبخش و گاتل (دانشجوی فرانسوی) آزمایش ثبوت مکمل و سروآگلوتیناسیون را جهت تشخیص ابتلا به تب مالت روی نمونه سرم از حیوانات مختلف استفاده نمودند. به دلیل مرزهای طولانی کشور و عدم نظارت بر دامها، تعداد زیاد جمعیت عشایری، روشهای سنتی دامداری، عدم نظارت کافی بر تولید و توزیع محصولات لبنی و عدم اجرای منظم واکسیناسیون و تست و کشتار دامها، موارد زیاد بیماری در کشور گزارش شده است. سروتایپ یک بروسلا ملیتنسیس و بیوتایپ سه بروسلا آبورتوس تیپهای بومی و شایع ایران هستند. تب مالت در ایران اکثراً ناشی از گونه ملیتنسیس است. در ایران برای گوساله و گاو از واکسن S19 (تا سال 1383) و RB51(از سال 1382) و برای بره، بزغاله، گوسفند و بز از واکسنRev1 استفاده میشود که این واکسنها توسط سازمان دامپزشکی بهصورت فراگیر و رایگان در سراسر کشور توزیع و تزریق میشوند. همزمان برنامه کشوری تست و کشتار دامها اجرا میگردد.
تب مالت در تمام نقاط کشور پراکنده است ولی وفور آن در مناطق مختلف، یکسان نیست. نشان داده شده است که بین میانگین بروز گزارششده سالیانه تب مالت در هر استان و تراکم جمعیت گوسفند و بز، رابطه آماری مستقیمی وجود دارد. نگاهی به استانهای پرگزارش تب مالت در کشور طی این سالها (چهارمحال بختیاری، لرستان، همدان، کرمانشاه، مرکزی و گیلان) مؤید این موضوع است که بیماری در استانهای غربی و شمال غرب کشور که دارای تراکم جمعیت گوسفند و بز بیشتری هستند، بیشتر گزارش شده است. مطالعات مختلف در دنیا نیز مؤید ارتباط بین آلودگی دامها و انسانها و کاهش خطر بیماری در انسان در اثر واکسیناسیون دامها است. با توجه به اینکه بروسلا آبورتوس را به فراوانی از گاوهای کشور جدا نمودهاند، بعید نیست که مواردی از بروز تب مالت ناشی از گونه آبورتوس در بین افراد گزارش، ولی به علت اشکالات تکنیکی آزمایشگاهی، تشخیص داده نشده و یا به علت خفیف بودن علائم بالینی جلبتوجه ننموده باشد.
بطورکلی و بر اساس یک معیار جهانی، میزان شیوع تب مالت در هر کشوری بستگی بسیار نزدیکی با میزان شیوع بروسلوزیس در دامهای آن کشور دارد که این موضوع ضرورت کنترل بیماری را در جمعیت دامی دوچندان میکند. همچنین لزوم توجه بیشتر به برنامه واکسیناسیون دامها و اطلاعرسانی به مردم برای پرهیز از مصرف لبنیات محلی و غیرپاستوریزه مهم است.
تشخیص آزمایشگاهی:
از زمان كشف بروسلاها بهعنوان عامل بيماري تب مالت، پيشرفتهاي چنداني در روشهای تشخيصي آزمايشگاهي بيماري صورت نگرفته است. هنوز هم روش كشت و روشهای سرولوژيكي بهعنوان روشهای تشخيصي مهم محسوب ميشوند. تصوير كلينيكي غالباً گمراهكننده است و بيماري ممكن است بهصورت عفونتهای معده و روده، دستگاه تنفس و پوست و يا دستگاه عصبي بروز كند. تشخيص احتمالي در زمينههاي مورفولوژي، كشت، صفات سرولوژي و در نظر گرفتن اطلاعات توأم اپيدميولوژي- باليني بنا نهاده شده است. بررسي سيتولوژيك خون در يك فرد مبتلا به بروسلوزيس حاد يا تحتحاد، نشاندهنده لكوپني ملايم با يك لنفوسيتوز نسبي، گاه همراه با يك آنمي ثانويه و ترومبوسيتوپني است. سديمانتاسيون به استثناء موارد حاد معمولاً در حد طبيعي است.
نكته مهم: گونههاي بروسلا بسيار عفونتزا هستند (گونههای بروسلا را جزء طبقه 3 سطح ایمنی طبقهبندی میکنند) و كاركنان آزمايشگاه بايد در کار با نمونههای بیمارانی که مشکوک به بروسلا هستند، خيلي مراقب باشند.
نمونههای ارسالی به آزمایشگاه:
نمونه ارسالي جهت شناسایی بروسلاها در نمونههای انسانی خون، مغز استخوان، مایع مفصلی، آسپیره غدد لنفاوی، مایع نخاعی، ادرار و غیره است.
نمونهي مناسب براي تشخيص بروسلوزیس در حيوانات به نوع حيوان، گونهي بروسلا و تظاهرات باليني بستگي دارد. كشت از نمونههاي آبسه، نطفه، جفت و مايع واژينال در حيوانات تازه سقطشده (قبل از مرگ آنها) بسيار مفيد است. نمونههاي شير از گاوها و گوسفندها براي جداسازي ارگانيسم و بررسيهاي ايمونولوژيكي كاربرد دارد. در سگها، كشت خون به دليل طولاني بودن دورهي باكتريمي براي جداسازی بروسلا کانیس از اهميت خاصي برخوردار است. از سرم حيوانها براي آزمونهاي سرولوژيك استفاده ميشود. در بعضي مواقع لازم است كه پس از مرگ حيوان جداسازي ارگانيسم صورت گيرد؛ كه در اين صورت مناسبترين نمونهها شامل: غدد پستاني فوقاني، سريني داخلي، غدد لنفاوي گلو، پستان گاو و رحم هستند. از خوكچهي هندي براي شناسايي تعداد بسيار كم بروسلا (موجود در بافت حيواني) استفاده ميشود. از كشت خون بهعنوان روش عمومي در تمام حيوانات بهرهگيري ميگردد.
در آزمایشگاههای باليني از روشهای زير جهت شناسایی اين باکتریها استفاده ميگردد:
رنگآمیزی گرم:
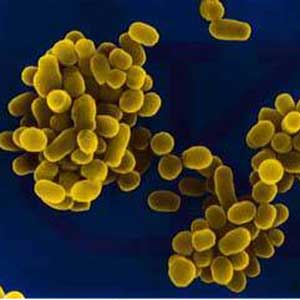
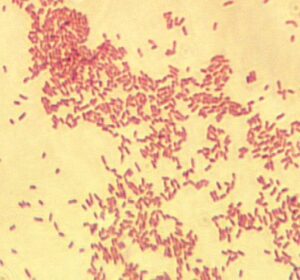
بروسلاها معمولاً بهصورت کوکوباسیل و باسیلهای کوتاه گرم منفی کوچک، منفرد و گاهی جفتی یا زنجیره کوتاه مشاهده ميشوند (شكل 1). بايد توجه داشت كه رنگ فوشین یا سافرانین بجای 30 ثانیه باید 3-1 دقیقه بروي گستره باقي بماند. با روش کوستر، بروسلاها به رنگ قرمز در داخل سلولهای آبی رنگ دیده میشوند. در این روش ابتدا از مخلوط سافرانین (دو قسمت) و پتاس (يك قسمت) که تازه تهیه شده باشد روی لام میریزند و پس از یک دقیقه آن را میشویند. پس از شستن، چند ثانیه اسید سولفوریک یک در هزار روی آن ریخته و مجدداً میشویند و محلول 1% بلودومتیلن روی آن اضافه مینمایند و پس از 30 ثانیه میشویند و سپس خشک كرده و مورد بررسی قرار میدهند.
شكل 1: رنگآميزي گرم بروسلا
کشت:
استاندارد طلايي براي تشخيص بروسلوزيس، كشت خون و نمونههاي ديگري از قبيل آسپيرههاي مغز استخوان و نمونههاي بيوپسي است. احتمال جداسازي بروسلا مليتنسيس و سوئيس نسبت به بروسلا آبورتوس در دورهي حاد بيماري بيشتر است. اگر چندين نمونه در مدت 24 ساعت گرفته شود، احتمال جداسازي افزايش مييابد. با اين وجود، رشد آرام و سخت ارگانيسم و نتايج گمراهکنندهی سيستمهاي تشخيصي بيوشيميايي تجاري باعث محدوديتهايي در كشت و تشخيص فنوتيپي شده است، همچنين قرارگیری بروسلا در گروه 3 عوامل خطرساز باکتریایی محدوديت جدي براي كاركنان آزمايشگاه ايجاد میکند؛ بهعلاوه، بروسلا بهراحتی توسط آئروسل منتقل ميشود و دوز عفونتزايي بسيار پاييني دارد.
رشد بروسلاها بر روی محیطهای معمولی بکندی صورت میگیرد و بیشتر گونهها بر روی بلادآگار و شکلاتآگار و نه روي مكانکی و ساير محیطهای انتريك رشد میکنند، ولي براي رشد مناسب بروسلاها در كشت اوليه، محیطهای جامد و مايع پيشنهاد ميگردند كه عبارتند از: محيط آگاردار حاوي عصاره كبد، نوترينآگار، بلادآگار، تريپتوز آگار، دكستروز پوتيتو، گليسرول پوتيتو، محيط سرم دكستروز آگار، محيط گليسرولآگار، محيط بروسلا براث و آگار، محيط اصلاحشده فارن، محيط كشت كاستاندا، محيط اصلاحشده تايرمارتين به اضافه تركيبات خاص آنتيبيوتيكي كه جهت محيط كشت موردنياز است. افزايش سرم حرارت داده شدة اسب يا خرگوش به محیطهای كشت یادشده بالا سبب سرعت پرورش اين باكتري ميگردد. احتمال جدا كردن بروسلا از خون بيش از 50% نيست چون نياز تغذيهاي اين ارگانيسم بالا و تعداد بسيار كم باكتري موجود در خون و زندگي درون سلول از جمله علل اين واقعيت است. آزمايش كشت خون بيشتر از ساير نمونهها جواب مثبت ميدهد، البته لازم به ذكر است جهت كشت خون نكات متعددي بايد رعايت گردد تا شانس بيشتري براي دستيابي به نتايج بدست آيد. ايدهآلترين زمان نمونهگيري خون هنگامي است كه بيمار در مرحله حاد و تب باشد و اين نمونه براي كشت مناسبتر و اين احتمال بخصوص براي بروسلا مليتنسيس و سوئيس بيشتر است. براي افزايش احتمال جداسازي بروسلا بهتر است نمونهگيري در 3 نوبت و در فواصل زماني متفاوت انجام گيرد.
چندین فاکتور در رشد و تشخیص بروسلا در کشتهای خون مؤثر هستند که باید موردتوجه قرار بگیرند:
1- سطح کم CO2 مهمترین عامل محدودکننده در اکثر محیطهای کشت است.
2- استفاده از سدیم پلیآنتول سولفانات بهعنوان ضد انعقاد، اثرات زیانآوری را بر روی غشای خارجی گونههای بروسلا در بسیاری از سیستمهای کشت خون اعمال میکند، بهطوریکه باعث نفوذ مواد آبدوست به درون باکتری شده و منجر به تأخیر در رشد آن میگردد.
لازم به ذكر است هر يك از نمونههاي باليني مانند مايعات بدن (ادرار، مايع نخاع، خون) و يا بافت بهدستآمده از جراحي يا نكروسكوپي را ميتوان كشت داد. براي كشت خون نيازي به محيط انتخابي نيست، ولي در صورت آلودگي نمونهها بهتر است از اين محيطها استفاده شود. چندين فرمولاسيون براي انتخابي نمودن محيط كشت جهت رشد ضروري است. مفيدترين محيط كشت انتخابي حاوي باسيتراسين، سيكلوهگزاميد، ناليديكسيك اسيد، نيستاتين، پليميكسين B و وانكومايسين در يك محيط پايه سرم دكستروز آگار شرح داده شده است. محيط کشتهای مايع نيز شامل فرمولاسيون مشابه فوق با افزودن آمفوتريسين B و سيكلوسرين هستند كه براي نمونههاي كشت از شير آلوده بكار ميروند. در جدول 1 محیطهای واجد آنتیبیوتیکهای انتخابي براي جداسازي بروسلاها ارائه شده است.
براي اجتناب از كشت باكتري از محيط مايع به جامد ميتوان از محیطهای دو فازي كاستاندا استفاده كرد. در كشت اوليه، بروسلا آبورتوس و بروسلا سوئيس داراي رشد ضعيفي هستند و جهت رشد نیاز به 10–5 درصد Co2 دارند، درحاليكه ساير گونههاي بروسلا قادر به رشد در هواي معمولي هستند. كشت خون از يك تا دو هفته پس از انجام كشت در محيط نگهداري ميشود. براي دادن جواب منفي قطعي كشت بايستي حداقل سه هفته صبر كرد. بايد توجه كرد در محیط آبگوشت ممکن است علیرغم رشد کدورت مشاهده نشود، لذا باید حتی در غیاب کدورت بهطور هفتگی سابکالچر انجام شود. لازم به ذکر است كه محیط دیفازیک مثل کاستاندا نیاز به سابکالچر ندارد.
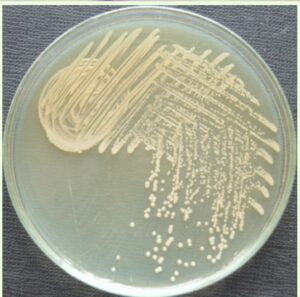
شكل 2: كلنيهاي بروسلا روي محيط كشت بروسلا آگار
بروسلا داراي سه نوع كلني S،R و M است. در محيط كشت آگار مغذي پرگنههاي نوع S پس از 48 ساعت قطري حدود 5 ميليمتر دارند و حاشيه آنها صاف و پرگنهها محدب و نيمهشفاف و داراي سطحي براق هستند (شكل 2). البته پرگنهها پس از 2 تا 3 روز بعد از كشت اوليه بزرگتر، با تحدب بيشتر و داراي رنگ زرد كمرنگ هستند. در زير نور مستقيم كلنيهاي سویههای صاف همانطور که در شکل 2 مشاهده میگردد، به رنگ عسلي شفاف ديده ميشوند، ولي در زير نور منعکسشده بهصورت نيمه شفاف آبيـ خاكستري ديده ميشوند. سویههای غيرصاف كلنيهايي بهاندازه سویههای صاف ايجاد ميكنند، ولي از لحاظ رنگ كلني متغیرند و معمولاً تيرهتر از سویههای صاف با سطحي گرانولار و از رنگ سفيد تا زرد و حتي قهوهاي ديده ميشوند. كلنيهاي صاف، نرمترند و بهراحتی امولسيه ميشوند، ولي كلنيهاي غيرصاف چسبناکتر هستند. بر روي آگار خوندار، هموليز واقعي نميدهند، اما معمولاً رنگ قهوهاي تا سبز در اطراف كلنيها ديده ميشود. كلنيهاي موكوئيدي بروسلا، نيمه شفاف، سبز و يا نارنجي روشن و به حالت لايه لعابي هستند. براي افتراق كلنيهاي صاف و خشن میتوان بر روي پليت محلول آبي 0/05 درصد كريستال ويوله ريخت، بعد از 15 ثانيه، كلنيهاي صاف به رنگ آبي تا سبز و كلنيهاي خشن قرمز تا صورتي ميشوند. كلنيهاي صاف، در محلول نمكي سوسپانسيون ميشوند، ولي كلنيهاي خشن، آگلوتينه ميگردند.
کلني S بیماریزا بوده و ممكن است در نتيجه جهش يا موتاسيون به شكل R (غيربيماريزا) درآيد. موتانهاي خشن بروسلا آبورتوس در انسان، گاو، گوسفند، بز، خوك و خرگوش بيآزارند چون در سرم اين حيوانات موادي وجود دارند كه در آزمايشگاه مانع رشد اشكال خشن (نوع غيربيماريزا R) ميگردند، ولي بر اشكال صاف (نوع بيماريزاي S) ميكروب بيتأثيرند و حيوانات مقاوم R فاقد فاكتورهاي نامبرده فوق هستند. در محيـــــــط in vitro، اسيد آمينه D- آلانين داراي همين خاصيت است. هنگام آماده كردن محیطهای كشت تازه لازم است كه محيط كشت با باكتريهاي بروسلای استاندارد مورد آزمايش قرار گيرند، چون برخي از یونهای جگر حاوي موادي هستند كه از رشد بروسلا ممانعت مينمايند و بهعلاوه بايد مراقب سرمهايي كه جهت تهيه محیطهای كشت بروسلا مورد استفاده قرار ميگيرند، باشیم تا حاوي پادتنهاي ضد بروسلا نباشند. در محیطهای كشت مايعي كه جهت رشد بروسلاها مورد استفاده ميگيرند، كدر شدن محيط كشت بهآرامی صورت ميپذيرد و اين امر با تهنشين شدن رسوبات گرانوله همراه است كه بهمرور در اثر افزايش طول مدت كشت، محيط كشت حالت چسبنده پيدا ميكند. برخي از سويههاي بروسلا تمايل بيشتري به رشد در محيط مايع نسبت به محيط جامد دارند. در اين روش تكنسين آزمايشگر با درصد بالایي در معرض آلودگي است. البته خود اين مدت زمان طولاني عوارضي مانند جهش در ماده وراثتي DNA و از دست رفتن سوش موردنظر و يا آلودگي را به همراه دارد، ضمناً براي تشخيص قطعي باكتري نياز به آزمایشهای بیوشیمیایی، حساسیت به رنگها و استفاده از آنتيسرمهاي اختصاصي ضروري است.
جدول 1- محیطهای واجد آنتيبيوتيكهاي انتخابي براي جداسازي بروسلا
| Concentration of Selective in basal medium |
Selective agent
|
||||
| Peptone Soya broth with 5% horse serum | Serum
Dextrose agar |
5% blood
agar |
Serum
Dextrose agar |
Hartleys Digest agar | |
| 50 | 25 | – | 25 | – |
Bacitracin (units/ml) |
| – | – | 5 | – | 5 | Penicillin (units/ml) |
| 50 | 50 | – | – | – |
Vancomycin (mg/ml) |
| – | – | 10 | – | – | Ristocetin (mg/ml) |
| 5 | 5 | 10 | 4 | Polymyxin B(units/ml) | |
| 5 | 5 | 10 | – | – | Nalidicxic acid(mg/ml) |
| – | – | 1:4000 | – | – | Cetrimide |
| 100 | 100 | 100 | – | – | Nystatin (units/ml) |
| 4 | – | – | 10 | – |
Amphotericin (mg/ml) |
| 100 | 100 | 150 | 100 | 100 |
Cyclohexamide (mg/ml) |
| – | – | – | – | 4 | Gentian violet(mg/ml) |
a Mair (1955) – b Leech et al (1961)- cRvan (1967)- d Farrll(1969)- e Brodie & intoo(1975)
نکات مهم:
– منفی بودن کشتها از نظر بروسلا نشانگر عدم ابتلا به بیماری نیست، چرا که بروسلاها فقط در جریان مرحله بیماری و یا در جریان فعالیت دوباره بیماری از کشتها بهدست میآیند.
– این باکتری روی بلادآگار کلنیهای شبیه استرپتوکوکوس ویريدانس ایجاد میکند و در محیطهای حاوی نمکهای صفراوی، تلوریت و سلنیت قادر به رشد نیست.
– محیطهای مایعی که برای کشت مایکوباکتریوم توبرکلوزیس استفاده میشوند، رشد بعضی از سویههای بروسلا را فراهم میکنند.
روشهای شناسايي رشد سريع از قبيلBactec9204 ، BACT/ALERT و Vital bottle سيستمهاي خودكار مدرن كشت خون هستند كه شناسايي ارگانيسم را در كمتر از 7 روز ميسر كردهاند، اما اين سيستمها نيز بايد با احتياط تفسير شوند، زيرا بعضي از اين سيستمها به اشتباه بروسلا را شناسايي كردهاند. مطالعات نشان داده است كه كشت مغز استخوان بهطور چمشگيري نسبت به كشت خون از حساسيت بالاتري برخوردار است
محيط انتخابي و كشت در حضور رنگ (حساسيت به رنگهای مختلف)
بروسلا در برابر رنگزدایي محلول اسيدي و قليائي مقاومت ميكند و ميتوان از اين مشخصه براي ايجاد روشهای رنگآميزي افتراقي براي بررسي حضور اين باكتري در بافتها و مواد مورد آزمايش بهره جست. براي اولين بار براي افتراق بين بروسلا آبورتوس، مليتنسيس و سوئيس بر پايه حساسيت نسبت به اثر مهاري برخي رنگهای سنتتيك ابداع گرديدند و تا به امروز نيز معتبر هستند. رنگهایی كه در اين روش مورد استفاده قرار ميگيرند عبارتند از: تيونين، فوشين قليائي، متيل ويوله و پيرونين كه تماماً به محيط حاوي سرم دكستروزآگار اضافه ميگردند.
بررسي خصوصیات بیوشیمیایی:
بروسلاها هوازی اجباری هستند و دارای متابولیسم تنفسی بوده و قدرت تخمیری ندارند. کاتالاز مثبت، اکثراً اکسیداز مثبت، اورهآز و نیترات مثبت، VP ,MR و اندل منفی بوده و ژلاتین را ذوب نمیکنند. در جدول زير الگوي فعاليت اكسيداتيو گونههاي بروسلا براي برخي اسيدهاي آمينه و کربوهیدراتها نشان داده شده است.
جدول 2- الگوي فعاليت اكسيداتيو گونههاي بروسلا براي برخي اسيدهاي آمينه و کربوهیدراتها
| Species |
Amino acids
|
|||||
|
B. Ovis |
B.
canis |
B.
neotoma |
B.
suis |
B.
abortus |
B. melitensis |
|
| V | V | V | V | + | + | L.Alanine |
| + | – | + | V | + | + | L.Asparagine |
| + | + | + | V | + | + | L.Glutamate |
| – | + | – | + | – | – | L.Arginine |
| – | + | – | + | – | – | DL.Citrulline |
| – | + | – | V | – | – | L.Lysine |
| – | + | – | + | – | – | DL.Ornithine |
|
Carbohydrate-test
|
||||||
| – | V | + | V | + | – | L.Arabinose |
| – | V | + | V | + | – | D.Galactose |
| – | + | V | + | + | – | D.Ribose |
| – | – | – | – | V | – | D.Xylose |
| – | + | + | + | + | + | D.Glucose |
| – | V | + | + | + | + | Isoerythritol |
تست اورهآز:
بروسلاها به استثناء اویس قادرند اوره را تجزیه نمایند، ولی فعالیت اورهآز در انواع مختلف متفاوت است. بروسلا سوئیس بهسرعت در مدت 15 تا 30 دقیقه، بروسلا آبورتوس در مدت 120 دقیقه و بروسلا ملیتنسیس بهطور متغیر اورهآز مثبت هستند. برای انجام تست، یک لوپ از میکروب را روی محیط اورهآگار برده و درصورتیکه مثبت باشد تغییر رنگ حاصل میشود.
تست تولید H2S:
خاصیت تولید H2S یکی از خصوصیاتی است که برای انواع بروسلاها از یکدیگر مورد استفاده قرار میگیرد. بروسلا اویس، مليتنسيس و کانیس H2S تولید نمیکنند و بروسلا آبورتوس، نئوتومه و سوئیس H2S در مدت حداقل تا 4 روز تولید مینمایند (جدول 3). برای انجام تست بايد کاغذ مرکب خشککن را در محلول استات سرب 10% فرو برده و خشک نمود و سپس آن را پس از کشت میکروب در فاصله دیواره لوله و پنبه دهانه محیط قرار داد. درصورتیکه H2S تولید و متصاعد شود، نوار کاغذ سیاهرنگ میگردد، در غیر این صورت تغییر رنگ نمیدهد. با تعویض کاغذ در هر روز میتوان متوجه شد تا چند روز H2S تولید میشود.
جدول 3: خصوصیات کلیدی افتراق بروسلاها
|
خصوصیات بروسلا |
بیوار | نیاز به co2 | تولید H2S | رشد روی محیطهای حاوی | لیز توسط فاژهای | |||||||
| تیونین | فوشین بازی | Td | Wb | Fi | BK2 | R/C | ||||||
| بیوارهای آبورتوس | 1 | + | + | – | + | L | L | L | L | NL | ||
| 2 | + | + | – | – | L | L | L | L | NL | |||
| 3 | + | + | + | + | L | L | L | L | NL | |||
| 4 | + | + | – | + | L | L | L | L | NL | |||
| 5 | – | – | + | + | L | L | L | L | NL | |||
| 6 | – | – | + | + | L | L | L | L | NL | |||
| 7 | – | + | + | + | L | L | L | L | NL | |||
| بیوارهای ملیتنسيس | 1 | – | – | + | + | NL | NL | NL | L | NL | ||
| 2 | – | – | + | + | NL | NL | NL | L | NL | |||
| 3 | – | – | + | + | NL | NL | NL | L | NL | |||
| بیوار سوئیس | 1 | – | + | + | – | NL | L | L | L | NL | ||
| 2 | – | – | + | – | NL | L | L | L | NL | |||
| 3 | – | – | + | + | NL | L | L | L | NL | |||
| 4 | – | – | + | – | NL | L | L | L | NL | |||
| 5 | – | – | + | – | NL | L | L | L | NL | |||
| کانیس | – | – | + | + | NL | NL | NL | NL | L | |||
| نئوتومه | – | + | – | – | L | L | L | L | NL | |||
| اویس | + | – | + | – | NL | NL | NL | NL | L | |||
L: لیز کردن و NL: لیز نکردن
فاژ Tb یا تیبیلیس (Tibilisi) و BK یا فاز برکلی (Berkeley)، Wb يا Weybridge
– از غلظت رنگ تیونین 50000: 1 یا 100000: 1 و از غلظت فوشین بازی 50000: 1 در محیطها استفاده میگردد.
تستهاي سرولوژی:
به دليل حساسيت پايين كشت (80-70 درصد) نتايج آن هميشه قطعي نيست، ضمن آنكه اگر بيماري بهصورت تحتحاد يا مزمن باشد و يا اينكه دارودرمانی صورت گرفته باشد، اين مقدار حساسيت، پايينتر خواهد بود. تستهاي سرولوژيكي زماني كه نتیجه كشت منفي است، مفيد هستند. بيش از صد سال پيش آقايان رايت و اسميت براي اولين بار، آزمون سرولوژيكي آگلوتيناسيون را براي شناسايي آنتيباديهاي ضد بروسلا مورد استفاده قرار دادند. بيشتر بيماران مبتلا به بروسلوزیس حاد در عرض چند روز اول بيماري، آنتيبادي IgM را توليد ميكنند كه بهسرعت توسط IgG و به مقدار كم IgA، جايگزين ميشود. تيتر آنتيبادي در هفتهي سوم يا چهارم بيماري به بيشترين مقدار خود ميرسد و سپس بهآرامی كاهش مييابد. عموماً در نوع تحتحاد و مزمن بيماري، اين الگو مشاهده نميشود و پاسخ سرولوژيكي همراه با توليد مداوم IgG و بعضاً IgA است. در مورد حیوانات، واکسیناسیون با سویههای صاف (RB51 بروسلا آبورتوس براي واكسيناسيون گاوها و Rev.1 بروسلا ملیتنسیس براي واكسيناسيون بزها و گوسفندها) موجب برانگیخته شدن آنتیبادیهایی میشود که بهشکل پایدار در حیوان باقی مانده و تشخیص بروسلا به روش سرولوژی را دچار اختلال میكند. در سرمهای مثبت، کلاسها و زیرکلاسهای مختلفی از آنتیبادیها (ایزوتایپ) میتوانند وجود داشته باشند. تفاوت آزمونهای مختلف سرولوژی، در توانایی آنها در تشخیص ایزوتایپهای مختلف آنتیبادیها است. بر حسب مرحله بيماري، آزمون خاصي را بايد انجام داد.
سازمان بهداشت جهاني براي تشخيص اين بيماري، پنج آزمايش سرولوژيكي استاندارد زير را توصيه نموده است:
الف) آزمايش رز بنگال (RBT ;Rose Bengal Test)
ب) آزمايش سروآگلوتيناسيون يا رايت (SAT ;Serum Agglutination Test or Wright)
ج) آزمايش 2- مركاپتواتانول- رايت (2ME -Wright Test)
د) آزمايش ثبوت مكمل (CFT ;Complement Fixation Test)
ه) آزمايش آنتيگلبولين يا كومبس- رايت (Antiglobulin or Coombs- Wright)
آزمون رز بنگال يا تست كارد آزمون سريعي است كه براي غربالگري استفاده ميشود، اما نتايج آن هميشه بايد بهوسیلهی تستهاي ديگري مانند SAT و يا كشت خون تأييد شود. در اين آزمايش از يك محلول غليظ از سلولهاي صاف بروسلا بهعنوان آنتيژن استفاده ميشود كه با رز بنگال رنگ شده و در يك بافر اسيدي به صورت محلول درآمده است. مشكل اصلي اين آزمون حساسيت و استانداردسازی آنتيژنهاي مورد استفاده در آن است. به دليل واكنش متقاطع با بعضي از ارگانيسمها، نتايج مثبت كاذب غيرقابل اجتناب است.
SAT آزمونی مفيد براي تشخيص بروسلوزیس انساني است، مخصوصاً اگر با آنتيژنهاي استانداردشده انجام گيرد. آنتيژنهاي مورد استفاده، سلولهاي كامل بروسلا آبورتوس شستهشده در سالين هستند كه به دليل كيفيت مختلف در بستهها نياز به استانداردسازی با تيترهاي مشخص آنتيبادي دارند، اما تاکنون، مشكل تعريف يك تيتر آنتيبادي دال بر عفونت فعال، حلنشده باقي مانده است. بطور كلی، هر فرد پاسخ ايمني ويژهاي در مواجهه با عفونت توليد ميكند كه امكان پيشبيني توليد آنتيبادي در افراد مختلف (كه چرا بعضي از بيماران تيتر بالاتري نسبت به بعضي ديگر در طول بيماري دارند) را بسيار مشكل ميكند. در مناطقي كه بروسلوزیس حيواني شايع است، تيترهاي ارزشمند آنتيبادي بايد بالاتر از ساير مناطق لحاظ شود. در اين شرايط ارزش آزمون SAT بهشدت محدود ميشود. اين آزمون توانايي شناسايي آنتيباديهاي غيرآگلوتينهكننده را ندارد و امكان نتايج منفي كاذب وجود دارد.
آزمون 2ME پس از مثبت شدن آزمون رايت (SAT) انجام ميشود تا كلاس آنتيبادي تشخيص داده شود. در اين آزمون، ملكولهاي IgM سرم از بين ميرود، ولي IgG و IgA به مواد احياكننده (در غلظتي كه استفاده ميشود)، مقاوم هستند. مهمترين كاربرد اين آزمون، تشخيص افتراقي بين بروسلوزيس فعال از غيرفعال و بررسي تأثير آنتيبيوتيك در درمان بيماري است. اين آزمون حساسيت پاييني دارد.
استفاده متداول از آزمون CF به دليل پيچيدگي تكنيكي آن و همچنين موضوع استانداردسازی آن، جز در آزمایشگاههای مجهز، توصيه نميشود. عموماً اين آزمون در روزها و هفتههاي اول بيماري منفي ميشود. واكنشهاي ضدكمپلمان، تغييرپذيري معرفها، سرم هموليزشده و سليقهاي بودن تفسير آزمون در تيترهاي پايين، از محدوديتهاي ديگر اين روش است.
آزمون كومبس- رايت براي تشخيص آنتيباديهاي غيرآگلوتينهكننده و يا مسدودكننده خصوصاً در مرحلهي رجعت بروسلوزیس و يا مرحلهي مزمن بيماري استفاده ميشود. در مرحلهي مزمن و رجعت بيماري، آنتيباديهاي ضد بروسلا كه قدرت آگلوتيناسيون ندارند، در سرم یافت ميشوند. تست کومبس غیرمستقیم در موارد پیچیده بیماری بسیار حساس و اختصاصی است.
آناليز دادهها نشان داده است كه روش ELISA ميتواند جايگزين مناسبي براي آزمونهاي ذکرشده، باشد. بسياري از محققين معتقدند كه ELISA حساسترين روش سرولوژيكي در تشخيص آنتيباديهاي ضد بروسلا است. با اين وجود، شناسايي آنتيبادي به دليل اینکه بعضاً انسان و حيوان آلوده سطح پاييني از آنتيبادي را توليد ميكنند و نيز احتمال واكنش متقاطع آنتيبادي، هميشه رضايتبخش نيست. سنجش بر مبناي Dipstick كه براي اندازهگيري IgM در مرحلهي حاد بيماري استفاده ميشود، با وجود سادگي آزمون؛ همچنان مشكل واكنش متقاطع با ساير ارگانيسمها را دارد.
BPAT[13] و [14]FPA از ديگر آزمايشهايي هستند كه اختصاصيت بالاتري دارند. تفسير تيترهاي پايدار در مقادير كم يا متوسط (تيترهاي 160-20) مشكل است. در بيماراني كه به مدت طولاني در معرض ارگانيسم هستند نميتوان تنها به آزمايش آگلوتيناسيون اكتفا كرد. در چنين افرادي با تيترهاي پايين، بايد آزمونهاي ELISA و يا وسترن بلات نيز انجام گيرد. عدم وجود آنتیبادیها، بروسلوزیس را رد نميكند؛ موارد زيادي از بيماران با كشت خون مثبت وجود دارد كه آزمايش آنتیبادیهای آنها منفي گزارش شده است. بسياري نيز به دليل پديده پروزون انجام بيش از يك آزمايش سرولوژيك را پيشنهاد ميكنند. علاوه بر كاستيهاي ذکرشده در روشهای مختلف سرولوژيك و نياز به انجام توأم چندين آزمون بر روي يك نمونه، اختصاصيت پايين، بزرگترين ايراد تشخيص بروسلوزیس بر مبناي سرولوژي است. تمام آزمونهاي مرسوم سرولوژي بر اساس شناسايي آنتيبادي عليه LPS سوشهاي صاف ((S-LPS پايهگذاري شده است كه اين آنتيباديها در پاسخ به بعضي باكتريهاي ديگر نيز توليد ميشوند. از اين ميان ميتوان به فرانسیسلا تولارنسیس، سروگروه اشریشیا کلی O157:H7، گروه N از سروتیپهای کافمن- وایت سالمونلا، سودوموناس، ویبریو کلرا و یرسینیا انتروکولیتیکا اشاره كرد
نکته مهم: چنانچه تیترهای آگلوتیناسیون بروسلا بشتر از 1:160 باشد نتیجه تست مثبت است، با این حال تیترهای پائینتری با تستهای SAT گزارش میشوند. توصیه شده است که دو تست از تستهای بالا برای تشخیص استفاده گردند تا از اشتباه تشخیصی جلوگیری شود.
تست پوستی بورنه:
هنگامی که عصارة پروتئین بروسلا بهصورت داخل جلدی تزریق شود؛ قرمزی، ادم و سفتی طی 24 ساعت در برخی از افراد آلوده ایجاد میگردد. هرچند كه آزمون پوستی غیرقابلاعتماد است و بندرت مورد استفاده قرار میگیرد، ولي اين تست در مطالعات اپيدميولوژيك استفاده شده و منفي شدن آن موجب حذف بروسلوزيس از تعداد كثيري از حملات مختلف ميگردد. بهکار بردن آزمون پوستی ممکن است باعث افزایش تیترآگلوتینینها شود.
· بیماریزایی تجربي در حيوان: خوكچة هندي در برابر تمام سوشهاي بروسلا حساس است. هيچيك از اين تستها قادر نيستند حيوانات حامل بيماري را از حيواناتي كه جديداً آلوده شدهاند، تفكيك نمايند.
· حساسيت به باكتريوفاژها: فاژهاي مختلف نسبت به سويههاي باکتریایی يك گونه ويژگي نشان ميدهند، از اين خاصيت جهت فاژتايپينگ و براي تعيين جنس و گونه بروسلا استفاده ميشود. اين فاژها را به 5 گروه مجزا تقسيم ميكنند كه در (جدول 3) نشان داده شدهاند.
· روشهای مولكولي: در آزمایشگاههای پیشرفته از تکنیــک مولکولی PCR،PCR-RFLP ، Multiplex PCR، Real time-PCR و غيره برای تشخیص مستقیم بروسلاها در نمونه استفاده میگردد.
اولين گزارش تشخيص بروسلا بر پايه PCR در سال 1990 توسط آقاي Fekete منتشر شد. در اين روش قسمتي از ژنوم باكتري بهطور اختصاصي تكثير داده شد. اختصاصيت، حساسيت بالا و امكان انجام سريعتر آن باعث فراگير شدن آن در عرصه تشخيص مولكولي شده است. تشخيص بروسلا بهوسیله PCR حساستر از كشت است و خطر ابتلاي كاركنان آزمايشگاه نيز در آن كمتر است و حتي قادر به تشخيص ميزان كم باكتري در نمونهها است و مرحله بيماري و دارودرمانی اختلالي در روند آزمايش ايجاد نميكند و نسبت به روشهای سرولوژي از اختصاصيت بالاتري برخوردار است.
با همهي مزيتهايي كه PCR بر كشت و روشهای سرولوژيكي دارد، مشکلات آن قابل اغماض نيست. PCR يك روش وابسته به طول قطعه تكثير يافته است، بهطوریکه هرقدر طول قطعه بيشتر باشد، باند بهتري خواهیم داشت. در PCR نتایج بر اساس الکتروفورز محصولات واکنش در ژل آگارز تعیین میشود كه مستلزم بهکارگیری و تماس مداوم با مواد سمی مثل اتیدیوم بروماید است و اینکه نتیجهای که بر اساس الکتروفورز روی ژل آگارز بهدست میآید از نظر مولکولی قطعی نیست و برای اثبات قطعیت آن بايد هیبریداسیون با پروب اختصاصی به روش ساترن بلات و یا تعیین توالی محصول واکنش PCR انجام گیرد. در عين حال كه انجام اين مراحل وقتگير است، بهرهگيري از آن در آزمایشگاههای تشخيصي نيز امکانپذیر نيست. PCR-ELISA با حذف استفاده از اتيديوم برومايد و استفاده از پروبهاي بيوتينيله شده، گام جديدي در راستاي بهبود اين روش برداشته است. در مقایسه با PCR معمولی، استفاده از پروب اختصاصی برای ردیابی محصول واکنش PCR منجر به حساستر و اختصاصیتر شدن واكنش ميشود.
بخشهای مختلفي از ژنوم بروسلا براي شناسايي اين ارگانيسم در تکنیکهای مولکولی مورد استفاده قرار گرفته است. پس از بهکارگیری ژن كدكنندهي پروتئين غشاي خارجي 43 كيلودالتوني توسط آقاي Fekete (كه تاكنون توالي پرايمرهاي آن منتشر نشده است)، اولين ژن هدفي كه بهطور گسترده مورد استفاده قرار گرفت rRNA 16S بود. اين توالي ژني در Ochrobactrum anthropic نيز به دليل قرابت ژنتيكي نزديك آن با بروسلا، مشاهده ميشود. PCR منطبق بر ناحيهي جداكنندهي داخل ژني 16S-23S rDNA به دليل تنوعش در ميان باکتریها، بيشتر اختصاصي جنس هستند تا ژن 16S و در مواردي امكان سنجش گونهي باكتري نيز امكانپذير است. در سال 1992، bcsp31 (اولين ژن كلونشدهي بروسلا) بهعنوان ژن جديدي براي تشخيص جنس بروسلا مطرح شد و با دارا بودن حساسيت و اختصاصيت بالا مورد تأييد بسياري از محققين قرار گرفت. همولوژي 85 درصدی بين ژنهای omp2a و omp2b باعث شد با يك جفت پرايمر دو الگو در يك باكتري بروسلا داشته باشيم. ديگر ژن متداول مورد استفاده در تشخيص بر اساس PCR عنصر ژنتيكي IS711 است. در هر ژنوم باكتري بروسلا، 35-5 كپي از IS711 پراكنده است. ژن per كه آنزيم perosamine synthetase را كد ميكند، از ديگر ژنهای حفاظتشده در جنس بروسلا است كه از آن در PCR استفاده شده است. ژن gap كدكنندهي آنزيم گليسرآلدئيد 3-فسفات در سال 2010 توسط آقاي Kim در تشخيص بروسلوزیس مورد استفاده و ارزيابي قرار گرفت.
آقاي Breaker و همکارانش یک مجموعه هشتتایی VNTR را شناسایی کردند که در سنجشــــی بنام HOOF-Prints [15] استفاده میشوند. اینها نواحی ژنتیکی هدفی هستند که تنوع درونگونهای بسیار بالایی را نشان میدهند و میتوانند بهطور وسیع جهت آنالیزهاي اپیدمیولوژیکی بروسلوزیس استفاده شوند، هرچند که تعیین هویت ابتدایی باکتري باید با استفاده از PCR و تستهای باکتریولوژیکی انجام گیرد.
Bruce-ladder روشی مبتنی بر PCR است که توانائی افتراق تمام گونههای بروسلا از جمله سویههای واکسن بروسلا آبورتوس RB51، بروسلا آبورتوس B19 و بروسلا ملیتنسیس Rev-1 را دارد. ایـــن روش یک Multiplex PCR با هشت جفت پرایمر است که میتواند در یک مرحله انجام گیرد.
تشخیص افتراقی: بروسلاها را باید از باسیل غیرتخمیری مثل بوردتلا، موراکسلا، کینگلا و اسینتوباکترها افتراق داد.
کلید تشخیصی بروسلاها: کوکوباسیل گرم منفی، کاتالاز و اکسیداز مثبت، غیرهمولیتیک، لاکتوز، گلوکز منفی، هوازی اجباری و اورهآز مثبت. ایجاد آگلوتیناسیون با آنتیسرم ضد بروسلا تشخیص را تأیید مینماید.
درمان و پيشآگهي:
مدیریت درمان بروسلوزیس گاهی بحثبرانگیز است، زیرا درمان طولانیمدت بوده و اغلب بیماران از عود مجدد رنج میبرند. يك مشكل عمده پزشکان، اشكال در تشخيص حصول غلظت مؤثر آنتیبیوتیک در درون سلول است، چرا که در شرايط بدني (In vivo) عوامل ضد ميكروبي كه از قابليت نفوذ درون سلولي خوبي برخوردارند براي محدود كردن و ریشهکنی بروسلوزیس موردنیاز هستند، بنابراين بايد به اين نكته دقت كرد كه علاوه بر اينكه يك ماده ضد ميكروبي بايد در شرايط آزمايشگاهي (In vitro) علیه بروسلا مؤثر باشد، بايد در شرايط بدنی نيز بتواند به درون سلول حاوي بروسلا نفوذ كند. بتالاكتامها فعاليت محدودي بر روي بروسلاها دارند. آمپیسیلین، آموكسيسيلين و بنزيل پنيسيلين بر روي برخي از سويهها اثر مهاري دارند، ولي اكثر سويهها به متيسيلين، نافيسيلين، تيكارسيلين و پيپراسيلین مقاوماند. سفالوسپورينهاي نسل اول و دوم نيز فعاليت محدودي دارند، ولي برخي از سفالوسپورينهاي نسل سوم مانند سفوتاكسيم، سفترياكسون و سفتيزوكسيم داراي MIC (حداقل غلظت مهاري رشد) 0/25تا 2 ميليگرم بر ليتر هستند. MIC براي كلرامفنيكل 2 تا 3 ميليگرم بر ليتر است. رشد اكثر بروسلاها بهوسیله استرپتومايسين، جنتامايسين، كانامايسين، توبرامايسين و آميكاسين در غلظت 1 تا 4 ميليگرم بر ليتر مهار ميشود. حساسيت به تتراسايكلين با MIC حدود 0/1 ميليگرم بر ليتر و براي ريفامپيسين 0/1 تا 2 ميليگرم بر ليتر است. بروسلا عموماً به ناليديكسيك اسيد مقاوم بوده، ولي به فلوروكينولونها و كوتريموكسازول حساس است. به علت دوره طولاني درمان، برای مدیریت مؤثر بروسلوزیس بايد از درمان تركيبي استفاده كرد که معمولاً با تتراسايكلين به مدت 3 هفته بعلاوه استرپتومايسين به مدت 2 هفته صورت میگیرد. در 10 درصد موارد بیمارانی که تحت این نوع درمان قرار میگیرند، عود ديده میشود. روش دیگر این است که بیماران با تركيب استرپتومايسين بعلاوه داكسيسايكلين يا مينوسيكلين درمان ميشوند؛ يا با تركيب داكسيسايكلين بعلاوه ريفامپين به مدت 6 تا 8 هفته يا تركيب سفترياكسون بعلاوه ريفامپين، درمان صورت میگیرد. در مورد این باکتری مقاومت دارویی خیلی کم بهخصوص به ریفامپین، سولفومتوکسازول– تریمتوپریم و تاجیسیکلین، مشاهده شده است.
[1] Marston
[2] Divaid Bruce
[3] Benhard Bang
[4] Zammit
7 Mediterranean Fever Commission
[6] Evans
[8] Carmichael and Bruner
[9] Wood rodent
[10] Intermittent fever
[11] Hepathomegaly
[12] Splenomegaly
[13] Buffered antigen plate agglutination test
[14] Fluorescence polarisation assay
[15] – Hypervariable Octameric Oligonucleotide Finger-Prints
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام