سندرم نقص ایمنی اکتسابی (ایدز)
Acquired Immune Deficiency Syndrome
(AIDS)
دکتر محمدرضا مشایخی (متخصص ژنتیک مولکولی)، شاهین اسعدی (دانشجوی ژنتیک مولکولی)، دکتر علی نظیرزاده (متخصص ژنتیک)، الناز حیدری (دانشجوی کارشناسی ارشد ژنتیک)، محمدحسین علوی (دانشجوی میکروبیولوژی)
نگارنده مسئول: شاهین اسعدی (Geneticist)
سندرم نقص ایمنی اکتسابی (ایدز) در اثر طیفی از عفونتهای ویروسی انسانی که به ویروس HIV مشهور است، حاصل میشود. کسانی که در آزمایش خون آنها، +HIV نمایان شود بیانگر حامل بودن ویروس HIV در سلولهای دفاعی یا گلبولهای سفید هستند؛ اما این بدان معنا نیست که این افراد مبتلا به بیماری ایدز شدهاند، درواقع بین عامل بیماری و خود بیماری فاصلهای وجود دارد که میتواند براساس استعداد افراد، سبک زندگی، رژیم غذایی و شرایط محیطی، این فاصله متغیر باشد؛ به عبارتی ممکن است افراد حامل ویروس HIV حتی تا پایان عمر بسته به شرایط مذکور، بیماری ایدز را بروز ندهند.
زمانی که افراد حامل HIV بیماری ایدز را بروز دهند، بهصورت اولیه ممکن است عفونتی شبیه بیماری آنفلوانزا را نشان دهند. در صورت تکرار این عفونتها، به این بیماران، بیماران مبتلا به عفونت ایدز گفته میشود. این مرحله اغلب با یک عفونت ریوی بهعنوان پنومونی ناشی از پنوموسیستیس شناخته میشود و شامل علائم دیگری مانند کاهش شدید وزن، بروز ضایعات پوستی ناشی از سارکوم کاپوزی و یا دیگر شرایط میباشد.
ویروس HIV عمدتاً از طریق آمیزش جنسی غیرایمن (واژن، سکس مقعد، سکس دهانی، خونی شدن لثهها)، انتقال خون آلوده به ویروس، تزریق زیرجلدی با سوزن آلوده به ویروس، از مادر به فرزند در دوران بارداری از طریق بند ناف و زایمان، یا دوران شیردهی انتقال مییابد. بعضی از مایعات بدن مانند بزاق و اشک، مجرای انتقال ویروس HIV نیستند. از زمان کشف ویروس HIV، بیماری ایدز باعث 36 میلیون مرگومیر تا سال 2012 در سراسر جهان شده است. در سال 2014 حدود 1.2 میلیون مرگومیر که آلوده به HIV بودند، به آمار جانباختگان این بیماری افزوده شده است.
بیماری ایدز، یک بیماری همهگیر در نظر گرفته شده است و شیوع آن در جهان، بیش از پیش رو به افزایش است. تحقیقات ژنتیکی نشان میدهد که ویروس HIV از غرب آفریقا، در اواخر قرن 19 و اوایل قرن 20 گسترش یافته است. ویروس HIV در سال 1984 توسط دو محقق ویروسشناس فرانسوی به نامهای سینوسی و مونتانیر بهعنوان عامل بیماری ایدز کشف گردید.


عکس سمت راست آقای دکتر رابرت گالو و عکس وسط خانم دکتر فرانچیز سینوسی و عکس سمت چپ آقای دکتر لوک آنتونی مونتاگنیئر، کاشفان ویروس HIV برای عامل بیماری ایدز در سالهای 1981-1984. برندگان جایزه نوبل پزشکی در سال 2008 بخاطر کشف ویروس HIV
علائم و نشانههای بالینی سندرم نقص ایمنی اکتسابی (ایدز)
سه مرحله اصلی در عفونت با ویروس HIV وجود دارد:
- عفونت حاد
- زمان تأخیر بالینی
- ایدز
عفونت حاد در سندرم نقص ایمنی اکتسابی (ایدز):
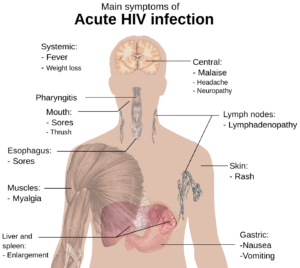
بسیاری از افرادی که حامل ویروس HIV به فرم حاد هستند بیماری شبیه آنفلوانزا یا بیماری دیگری مانند مونونوکلئوز را در 2 تا 4 هفته بعد از تماس با ویروس از خود نشان میدهند. این علائم در 90-40%بیماران که حامل ویروس HIV حاد هستند رخ میدهد و معمولاً شامل تب، لنفادنوپاتی، التهاب گلو، خارش پوست، سردرد و یا زخم دهان و اندام تناسلی میباشد. خارش پوست که در 50-20% بیماران رخ میدهد، خود را بر روی بالاتنه نشان میدهد و معمولاً ماکولوپاپولار کلاسیک میباشد. برخی از افراد نیز عفونتهای فرصتطلب را بروز میدهند. دستگاه گوارش علائمی مانند تهوع، استفراغ یا اسهال را نشان میدهد و همچنین علائم عصبی، مانند پریفرال نروپاتی و یا سندرم گلینبار را نشان میدهد.
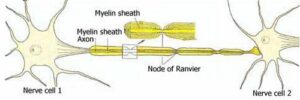
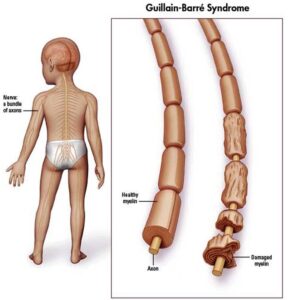
با توجه به ماهیت پنهان ویروس HIV در سلولهای سفید خون، علائم ذکرشده بهسادگی برای تشخیص آلودگی با ویروس HIV در نظر گرفته نمیشود. حتی ممکن است پزشک عمومی، این علائم را با دیگر بیماریهای مشترک اشتباه در نظر بگیرد؛ بنابراین توصیه میشود افرادی که رابطه جنسی مشکوک و غیرایمن داشتهاند در صورت بروز تب با علائم ناشناخته، حتماً جهت آزمایش خون مبنی بر مثبت یا منفی بودن ویروس HIV سریعتر اقدام کنند، چراکه احتمالاً عفونت ایدز در این افراد آغاز شده است.
تأخیر بالینی سندرم نقص ایمنی اکتسابی (ایدز)
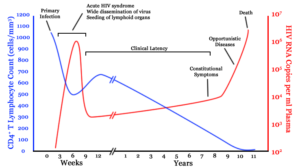
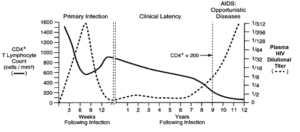
علائم اولیه بیماری ایدز پس از انتقال ویروس در سلول، مرحله نهفتگی یا HIV مزمن نامیده میشود. این مرحله از تاریخ طبیعی عفونت HIV میتواند از 3 تا بیش از 20 سال بسته به شرایط فردی و محیطی جهت القاء بیماری ایدز، متغیر باشد.
این در حالیست که معمولاً، افراد آلوده به ویروس HIV در پایان مرحله تأخیر بالینی علائمی نظیر تب، کاهش وزن، مشکلات گوارشی و دردهای عضلانی را تجربه میکنند. 70-50% از افراد حامل HIV، لنفادنوپاتی ماندگار و پایدار را خواهند داشت و همچنین بزرگ شدن یک گروه از غدد لنفاوی بدون درد برای بیش از 3 تا 6 ماه ایجاد میگردد.
واژه HIV از جمله Human immunodeficiency virus به معنای ویروس نقص ایمنی انسان، مخفف شده است. HIV از خانواده رتروویروسها است که در لغت یونانی رترو به معنای معکوس میباشد.
سندرم نقص ایمنی اکتسابی
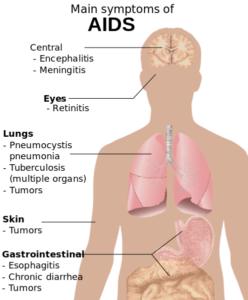
سندرم نقص ایمنی اکتسابی (ایدز)، در رابطه با کاهش سلولهای +CD4 و سلولهای T helper است، به عبارتی اگر تعداد این سلولها کمتر از 200 سلول در هر میکرولیتر از حجم خون باشد، نشاندهنده احتمال آلودگی با ویروس HIV میباشد. در صورت عدم تشخیص بهموقع آلودگی و عدم کنترل و مدیریت این آلودگی، افراد آلوده در کمتر از 10 سال به بیماری ایدز مبتلا خواهند شد. فاکتورهای اولیه هشداردهنده برای وجود بیماری ایدز، در اکثر مبتلایان مشترک است و شامل پنومونی ناشی از پنوموسیستیس (40%)، سوءهاضمه ناشی از سندرم HIV (20%) و کاندیدیاز مری (30%) میباشد.
دیگر علائم شایع در بیماری ایدز شامل عفونتهای دستگاه تنفسی در محدوده زمانی معین (10%) هستند. همچنین عفونتهای فرصتطلب ممکن است توسط، باکتریها، ویروسها، قارچها و انگلها که بهطور معمول توسط سیستم ایمنی بدن کنترل میشود، ایجاد شوند؛ اما اینکه کدام نوع عفونت سریعتر رخ دهد تا حدودی به اکوسیستم فرد آلوده به HIV بستگی دارد. این عفونتها میتوانند هرکدام از سیستم اعضای بدن را تحتتأثیر قرار دهند.
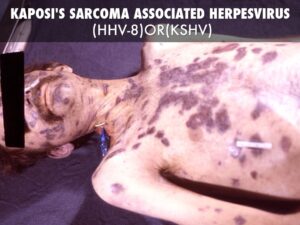
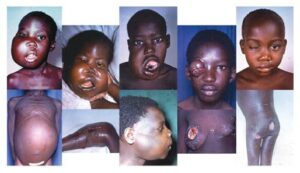
افراد مبتلا به بیماری ایدز، در معرض خطر ابتلا به سرطانهای مختلف ناشی از ویروس از جمله، سارکوم کاپوزی، لنفوم بورکیت، لنفوم اولیه دستگاه عصبی مرکزی و سرطان دهانه رحم قرار دارند. سارکوم کاپوزی شایعترین سرطان در 20-10% از افراد آلوده به HIV رخ میدهد. لنفوم بورکیت و لنفوم اولیه دستگاه عصبی مرکزی، دومین عامل شایع سرطان است که در 4-3% از افراد مبتلا به ایدز رخ میدهد و تقریباً همین سرطانها عامل 16% از مرگومیر افراد مبتلا به ایدز میباشد. این سرطانها با نفوذ هرپسویروسهای 8 انسانی همراه هستند. سرطان دهانه رحم در افراد مبتلا به ایدز، بیشتر به خاطر نفوذ ویروس پاپیلومای انسانی (HPV) رخ میدهد. در افراد مبتلا به ایدز، سرطان ملتحمه چشم نیز شایع است.
تصاویر مربوط به کاپوزی سارکوم و کودکان مبتلا به لنفوم بورکیت
علاوه بر این افراد مبتلا به ایدز، اغلب علائم سیستمیک مانند تب طولانیمدت، تعریق زیاد بخصوص در شب، تورم غدد لنفاوی، لرز عضلات، ضعف و کاهش وزن ناخواسته دارند. اسهال نیز یک نشانه رایج دیگر میباشد، در حال حاضر تقریباً 90% از افراد مبتلا به بیماری ایدز دچار اسهال مکرر هستند.
نقش جنسیت در انتقال ویروس HIV
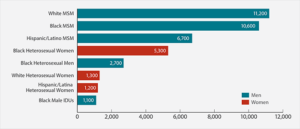
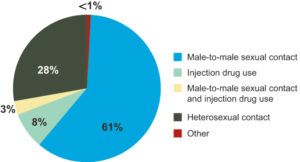
شایعترین حالت انتقال ویروس HIV، مقاربت غیرایمن و مشکوک با جنس مخالف است، بااینحال الگوی انتقال در هر کشور متفاوت است. در ایالات متحده آمریکا تا سال 2009، حدود 64% از موارد آلودگی به ویروس HIV از طریق رابطه جنسی مردان با مردان رخ داده است. این آمار نشان میدهد که انتقال ویروس HIV از طریق مقعدی، بسیار آسانتر و سریعتر از سکس با واژن آلوده، میباشد.
با استناد به اطلاعات بیوانفورماتیک سازمان بهداشت جهانی، خطر انتقال ویروس HIV در کشورهای ضعیف ازنظر اقتصادی و فرهنگی و بهداشتی بهمراتب بیشتر از کشورهای دارای اقتصاد قوی و سیستم بهداشتی مناسب، میباشد. در کشورهای ضعیف اقتصادی، خطر انتقال این ویروس از زن آلوده به مرد سالم در حدود 0/38% برای هر بار فرآیند رابطه جنسی غیرایمن و مشکوک تخمین زده میشود و خطر انتقال ویروس HIV از مرد آلوده به زن سالم، در حدود 0/30% برای هر بار رابطه جنسی غیرایمن و مشکوک میباشد؛ اما در کشورهای دارای اقتصاد قوی، خطر انتقال این ویروس از زن آلوده به مرد سالم تقریباً 0/04% برای هر عمل رابطه جنسی غیرایمن میباشد و خطر انتقال ویروس HIV از مرد آلوده به زن سالم، 0/08% در هر عمل رابطه جنسی غیرایمن تخمین زده میشود.
همانطور که ذکر شد، خطر انتقال ویروس HIV از مقعد بیشتر است و متوسط انتقال آن در ژنتیک جمعیت حدوداً 1/7-1/4% در هر بار عمل رابطه جنسی غیرایمن با جنس مخالف یا مرد به مرد است. خطر انتقال از طریق سکس دهانی تقریباً نزدیک به صفر است اما ناممکن نیست و تابهحال چندین مورد از آلودگی با سکس دهانی نیز گزارش شده است و متوسط انتقال ویروس HIV از طریق مقاربت دهانی تقریباً 0/04-0% است.
البته متوسط انتقال از طریق مقاربت دهانی در کشورهای ضعیف اقتصادی بهمراتب بسیار بیشتر است و میانگین خطر انتقال مقاربت دهانی از زن آلوده به مرد سالم 2/4% است و میانگین خطر انتقال ویروس HIV از مرد آلوده به زن سالم 0/05% برآورد شده است. این آمار بالای انتقال از طریق مقاربت دهانی، به دلیل ضعف اقتصادی و فرهنگی و ضعف سیستم بهداشتی در مردم کشورهای بسیار فقیر میباشد، چراکه زنان و مردان این کشورها نهتنها بهداشت جامعه بلکه بهداشت فردی خودشان را نیز رعایت نمیکنند و همین امر باعث کمبود ویتامین C در این افراد شده که منجر به ضعیف بودن لثه و دندانها میشود و در زمان مقاربت دهانی به دلیل خونریزی لثه در حین سکس دهانی، ویروس HIV نیز بهراحتی قابلانتقال خواهد بود.
مبتلا بودن به انواع عفونتهای مقاربتی مثل سفلیس و زخم تناسلی نیز، میتوانند خطر انتقال ویروس HIV را تشدید کنند. زخم تناسلی خطر انتقال ویروس را 5 برابر افزایش میدهد. سایر عفونتهای مقاربتی مانند، سوزاک، کلامیدیا، تریکومونیازیس، واژینوز باکتریایی نیز، خطر نسبتاً کمتری در انتقال ویروس HIV دارند.
رابطه جنسی همراه با خشونت میتواند خطر انتقال را افزایش دهد. تجاوز جنسی بدون استفاده از پوشش مناسب (کاندوم) حتی در صورت عدم تزریق مایع منی به واژن یا مقعد نیز خطر انتقال را افزایش میدهد.
حالت دوم شایع انتقال ویروس HIV از طریق خون و فرآوردههای خونی میباشد. انتقال از طریق خون یا فرآوردههای خونی میتواند با استفاده از سرنگ مشترک (عمومیت در بین معتادان) در مصرف داروهای وریدی یا مصرف مواد مخدر انجام گیرد. خطر انتقال خون آلوده به عفونتهای مقاربتی با سرنگ مشترک و آلوده، تقریباً 2/4-0/63 در هر بار عمل تزریق مواد مخدر یا داروهای وریدی برآورده شده است. خطر انتقال ویروس HIV از سرنگ آلوده به HIV حدوداً 0/3%(1 در 333) در هر بار عمل تزریق با سرنگ آلوده تخمین زده شده است. خطر آلودگی غشاء محیطی به خون آلوده 0/09% (حدوداً 1 در 1000) برای هر بار عمل استفاده از سرنگ مشترک و آلوده برآورد شده است.
در ایالات متحده آمریکا، معتادان تزریقی تا سال 2009 متوسط 80-12% از آلودهشدگان ویروس HIV را به خود اختصاص داده بودند. ویروس HIV در حدود 93% از طریق خون آلوده منتقل میشود. در کشورهای توسعهیافته خطر انتقال ویروس HIV از طریق فرآوردههای خونی در بیمارستانها و مراکز بانک خون بسیار کمتر است و این به دلیل غربالگری دقیق خون اهداءکننده به مراکز بانک خون است، بهعنوان مثال در کشور انگلستان خطر این نوع انتقال 1 در 5 میلیون گزارش شده است و در ایالات متحده آمریکا خطر این نوع انتقال 1 در 1/5 میلیون گزارش گردیده است.
اما در کشورهای ضعیف اقتصادی خطر این نوع انتقال در مراکز بانک خون و بیمارستانها بسیار بیشتر است و تنها نیمی از انتقالات فرآوردههای خونی بهصورت بهداشتی و مناسب انجام میگیرد. طبق گزارش سازمان بهداشت جهانی، حدود 15% از عفونتهای HIV به دلیل غربالگری نامناسب و انتقال خون و فرآوردههای خونی غیرایمن در کشورهای ضعیف اقتصادی تخمین زده شده است. تزریقات غیربهداشتی در کشورهای جنوب صحرای آفریقا نقش مهمی در انتقال ویروس HIV دارند، بطوریکه در سال 2007 تقریباً 17-12% از عفونتهای خونی به دلیل استفاده مشترک از سرنگ آلوده در این کشورها نسبت داده شد.
استفاده از سوزنهای آلوده به ویروس HIV مثل لوازم خالکوبی، تیغ آرایشگری و سوزنهای سوراخکنی گوش دختران نیز از عوامل انتقال ویروس HIV محسوب میشوند، اما انتقال این ویروس از طریق نیش پشهها حتی پشه آنوفل (عامل انتقال مالاریا) و یا سایر حشرات خونخوار نیز، امکانپذیر نیست.
سومین حالت رایج در انتقال ویروس HIV، انتقال ویروس از مادر آلوده به فرزند در زمان بارداری و همچنین در زمان زایمان و دوران شیردهی میباشد. اگر مادری آلوده به ویروس HIV باشد، به علت اندازه بسیار کوچک جرم ویروسی (نانومتر)، ویروس بهراحتی از جفت عبور کرده و به جنین منتقل میشود، البته این تنها برای ویروس HIV نیست بلکه اکثر اجرام میکروبی اعم از باکتریها، ویروسها، قارچها و انگلها به خاطر اندازه کوچکشان میتوانند بهراحتی از جفت عبور کرده و جنین را آلوده سازند که در پی آلودگی هر جرم میکروبی (پاتوژن) اختلالات و بیماریهای متفاوتی را ایجاد خواهند کرد. خطر انتقال ویروس HIV در دوران جنینی و زایمان، 20% است و در دوران شیردهی خطر انتقال، 35% میباشد.
در سال 2008 انتقال عمودی ویروس HIV در کودکان، حدود 90% را به خود اختصاص داده است. با مدیریت مناسب میتوان خطر انتقال ویروس را به جنین تا 1% کاهش داد که البته رقم بالایی نیست. این مدیریت شامل، استفاده مادر از داروهای آنتیرتروویروس در زمان بارداری و زایمان، زایمان نوزاد با استفاده از جراحی سزارین بجای زایمان فیزیولوژیک، اجتناب از تغذیه با شیر مادر آلوده و تجویز داروهای ضدویروسی برای کاهش و افت عملکرد تکثیر ویروس به نوزاد میباشد. لازم به ذکر است که استفاده از همین داروها، در زمان بارداری یا پس از تولد نوزاد نیز عوارض جانبی در پی خواهد داشت ولی به دلیل تخفیف رنج روانی مادران جهت داشتن فرزندی سالم، این داروها استفاده میشود.
ژنتیک مولکولی ویروس HIV
HIV ویروسی از خانواده رتروویروسها و گروه لنتیویروسها است که به سلولهاى دستگاه ایمنى بدن حمله مىکند. HIV را لوک مونتانیئر و دکتر فرانچیز سینوسی فرانسوی و رابرت گالوی آمریکایی کشف کردند. لنتی به معنای آهستهگستر است.
رتروویروسها (retroviruses) ویروسهایى هستند که ماده ژنتیکی یا ژنوم آنها از RNA تشکیل شده است، بنابراین ویروسهای ایدز براى تکثیر خود به آنزیمى به نام “نسخهبردار معکوس (RT)”، نیازمندند که ژنوم RNA آنها را بهصورت DNA نسخهبردارى کند تا بتواند آن را با کمک آنزیم “اینتگراز” وارد ژنوم سلول میزبان کند و به این ترتیب امکان تکثیر ویروس به وجود مىآید. کلمه Retro به معنای معکوس است و نام این نوع ویروسها هم به همین خاطر است، چرا که معمولاً در سلولها نسخهبردارى از DNA به RNA انجام مىشود. HIV داراى ژنهای مختلفى است که پروتئینهاى ساختمانی آن را رمزبندى مىکنند.
HIV داراى ژنهای عمومى رتروویروسها یعنی، gag، pol و env و نیز ژنهای اختصاصى خودش،tat و rev است. عفونت با HIV با انتشار حاد ویروس در خون آغاز مىشود. پس از این مرحله شمارش ویروسها در خون تا صد برابر کاهش مىیابد. سپس یک دوره نهفتگى بالینى آغاز مىشود. در ابتدا تصور میشد که این دوره یک دوره حقیقى نهفتگى ویروسى است که در آن HIV درون ژنوم میزبان بهصورت غیرفعال قرار مىگیرد. بعدها مشخص شد که یک نوع سلول در بافتهای لنفاوی بدن مثل گرههای لنفاوی به نام سلولهاى دندریتی با ویروس پوشیده شدهاند و بنابراین حتى در مرحلهاى که ویروس در خون دیده نمىشود، میزان آن در بدن بالاست.
HIV با آلوده کردن گروهی از سلولهای دستگاه ایمنی به نام لنفوسیتهای T از نوع +CD4 ، بیماری ایدز را بوجود میآورد. این سلولهای زیرگروهى از گلبولهاى سفید هستند که بهطور طبیعى پاسخ ایمنى به عفونت را تنظیم مىکنند. HIV با استفاده از سلولهای T براى تکثیر خودش در سراسر بدن گسترش مىیابد و در همان زمان باعث کاهش این سلولها مىشود که بدن براى دفاع از خود به آنها نیاز دارد. هنگامیکه میزان سلولهای +T CD4 در فرد آلوده به HIV تا حد معینى سقوط کند، آن فرد به طیفى از بیمارىها مستعد میشود که در حالت معمول، بدن میتواند آنها را کنترل کند. درواقع این عفونتهای فرصتطلب هستند که باعث مرگ فرد مىشوند. دلایل مختلفى وجود دارد که مبارزه با HIV را مشکل مىکند:
اول اینکه HIV یک ویروس دارای RNA است که از آنزیم نسخهبردار معکوس براى تبدیل RNA خودش به DNA استفاده مىکند. این روند باعث مىشود که احتمال بیشترى براى موتاسیون (جهش) در HIV نسبت به ویروسهاى دارای DNA وجود داشته باشد؛ بنابراین امکان ایجاد مقاومت سریع ویروس به درمان وجود دارد.
دوم اینکه، این تصور رایج که HIV یک ویروس کشنده است صحت ندارد. اگر HIV یک ویروس کشنده بود، خودش هم بهزودی از بین میرفت، چرا که فرصت چندانى براى عفونتهاى جدید باقى نمىماند. درواقع HIV سالها در بدن قرنطینه مىماند و از طرق مختلف مانند رابطه جنسى، انتقال خون و انتقال از مادر به نوزاد، دیگران را هم آلوده مىکند.
همانطور که ذکر شد حتى هنگامیکه هیچ ذره ویروسى در خون وجود ندارد ویروس در بدن به حالت نهفته باقى مىماند. پس از سالها ویروس مىتواند فعال شود و از ماشینهاى سلولى براى تکثیر خودش استفاده کند. حتى در سالهاى اخیر این تصور که عفونت مستقیم HIV باعث کاهش یافتن سلولهای +T CD4 مىشود، مورد تردید قرار گرفته است. علت کاهش سلولهاى ایمنى به این امر مربوط مىشود که پروتئین سازنده پوشش HIV به آسانی از ذرات ویروس جدا و به خون وارد مىشود و آن را اشباع مىکند. این پروتئینها مانند چسب، سلولهاى +T CD4 را به هم مىچسبانند، از طرف دیگر دستگاه ایمنى بدن به آنها واکنش نشان مىدهد و باعث مىشود سایر سلولهای ایمنى بدن به سلولهاى +T CD4 خود بدن نیز حمله کنند و آنها را از بین ببرند.
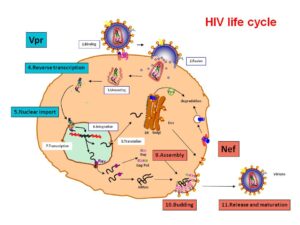
چرخه زندگى HIV
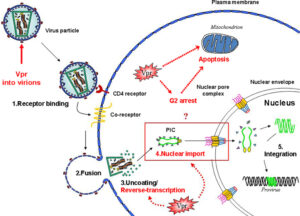
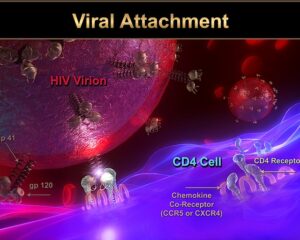
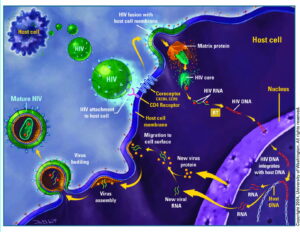
HIV به سلولهای T CD4+که به آنها سلولهای T کمککننده (T helper) هم میگویند و زیرگروهى از گلبولهای سفید هستند که نقش تنظیم پاسخ ایمنى را در بدن دارند، از طریق مولکول گیرنده CXCR4 یا هر دو مولکول گیرنده CXCR4 و CCR5 بسته به مرحله عفونت، متصل مىشوند. در مراحل اولیه عفونت HIV هر دو گیرنده CCR5 و CXCR4 محل اتصال ویروس هستند اما در مراحل انتهایى عفونت که اغلب HIV دچار جهش میشود، تنها به CXCR4 متصل مىشود. هنگامیکه HIV به سلولهای +T CD4 متصل مىشود، یک ساختار ویروسى به نام GP41 به داخل غشاى سلول نفوذ مىکند و RNA ویروس و آنزیمهاى مختلف از جمله نسخهبردار معکوس، اینتگراز و پروتئاز به داخل سلول تزریق مىشوند. مرحله بعدى تولید DNA از روى RNA ویروس با کمک آنزیم نسخهبردار معکوس است.
در صورت موفقیت این عمل،DNA پروویروسى با استفاده از آنزیم اینتگراز وارد DNA سلول میزبان میشود. در این حالت سلول میزبان کاملاً با HIV آلوده شده است اما بهصورت فعال پروتئینهاى ویروس را تولید نمىکند. از این بعد دوره نهفته آغاز میشود که در آن سلولهای آلوده مانند “بمبهایی منفجرنشده” براى مدت طولانى باقى مىمانند. هنگامیکه سلول میزبان تولید پروتئینهاى ویروس را از روى DNA پروویروسى آغاز مىکنند، آنزیم پروتئاز فراهمشده بهوسیله HIV باید آنها را بهصورت پروتئینهاى نوبنیاد HIV سنتز کنند تا با اتصال آنها به هم ذرات ویروسى HIV تشکیل شود. ذرات ویروسى تازهبوجودآمده با جوانه زدن بر روى سطح سلول میزبان از آن خارج مىشوند.
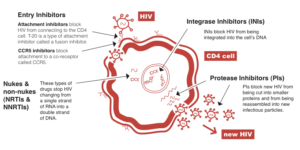
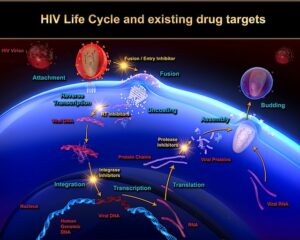
داروهاى ضد رتروویروسی
امروزه بیماران آلوده به HIV را با مجموعهای از داروها که در مراحل مختلف چرخه زندگى ویروس اثر میکنند مورد درمان قرار میدهند. این داروها که به آنها داروهاى ضد رتروویروسى مىگویند شامل گروههای زیر هستند:
- مهارکنندههاى پروتئاز(PIS): این داروها فعالیت آنزیم پروتئاز در ویروس را مهار مىکنند. پروتئاز آنزیم لازم براى ساخته شدن ذرات جدید ویروسى (ویریونها) در مرحله نهایى است.
- مهارکنندههاى آنزیم نسخهبردار معکوس: آنزیم نسخهبردار معکوس براى تکمیل مرحله آلوده شدن سلولها بهوسیله ویروس لازم است و بهوسیله آن است که HIV میتواند از روى RNA خود DNA بسازد.
این داروها به سه دسته تقسیم میشوند:
(a) مهارکنندههای غیرنوکلئوزیدى نسخهبردار معکوس (NNRTTS)
(b) مهارکنندههای آنالوگ نوکلئوزیدى نسخهبردار معکوس (NRTIS یا NARTIS)
(c) مهارکنندههای آنالوگ نوکلئوئیدى نسخهبردار معکوس (NTRTIS یا NTARTIS)
مهارکننده ورود ویروس: این داروها با تعامل مستقیم با گیرندههای ویروس و جلوگیرى از اتصال ویروس به غشاء سلول هدف از ورود آن به سلول جلوگیرى مىکنند.
مشکلات بسیاری در تجویز یک دوره درمانى ضد HIV رخ مىدهد. هر داروى مؤثر داراى عوارض جانبى است که اغلب جدى و گاه تهدیدکننده حیات هستند.
عوارض جانبى شایع در درمان ایدز شامل تهوع و استفراغ شدید، اسهال، آسیب کبدى و نارسایى کبدى و زردى است. هر برنامه درمانى به انجام آزمونهای مکرر خون براى تعیین مداوم کارایى دارو (که بر مبناى تعداد سلولهای T و میزان ویروس در خون سنجیده مىشود) و بررسى کارکرد کبد نیاز دارد.
HIV، یا ویروس نقص ایمنی و دفاع آدمی، ویروسی دارای پوشش، علاوه بر کپسید است که اندازهای برابر با ۱۲۵ نانومتر دارد و برای همانندسازی در گلبولهای سفید دستگاه ایمنی بدن انسان مستقر میشود.
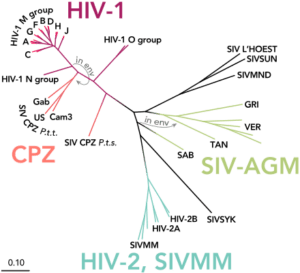
دو نوع عامل اصلی ایدز تاکنون مشخص شده است؛ HIV-1 and HIV-2:
HIV -1 گونهای از ویروسی بود که زودتر شناخته شد (و در ابتدا بهعنوان LAV یا HTLV-III شناخته میشد). این گونهای است که مهاجمتر و واگیرتر است. ازآنجاکه HIV-2 توانایی سرایت کمی دارد، ابتلای به آن عمدتاً محدود به آفریقای غربی است.
نتیجهٔ یک پژوهش علمی عمده و معتبر از سوی گروهی از پژوهشگران دانشگاه آکسفورد انگلستان نشان میدهد که ویروس HIV در روند فرگشتی (تکاملی) خود دچار دگرش و تحول شده و در مقایسه با گذشته از میزان خطر، مرگبار بودن و مسری بودن آن کاسته شده است. بر اساس این مطالعه، ویروس HIV در حال هماهنگی و تطبیق خود با دستگاه ایمنی بدن انسان بوده و درجهٔ خطر آن در حال کاهش است. بر اساس گزارش منتشر شده از این پژوهش، اکنون فاصلهٔ زمانی بین آلودگی به ویروس و بروز بیماری ایدز بیشتر شده است و ممکن است تغییرات تکاملی ایجادشده در ویروسHIV به نتیجهبخشی اقدامات و تلاشها برای مهار همهگیری گسترده و گسترش ابتلا به بیماری ایدز یاری رساند.
به باور برخی ویروسشناسان، امکان دارد در ادامهٔ روند فرگشتی ویروس HIV، درنهایت، این ویروس بیخطر شود. پیامد تلاش دائمی ویروس برای تغییر بهمنظور پنهان ماندن در برابر سامانهٔ ایمنی بدن انسان، کاهش توانایی تکثیر ویروس است. از سوی دیگر، بنا بر یافتههای این پژوهش، داروهای ضدویروس در تضعیف و تحلیل ویروس HIV دارای سهم بودهاند؛ به این شیوه که این داروها که ابتدا به نمونههای قویتر و پرخطرتر حمله کرده و آنها را از بین میبرند، باعث میشوند در فرایند انتخاب طبیعی (در این مورد، صفت مطلوب برای زنده ماندن، ضعیف بودن است چرا که داروها، ویروسهای قویتر و بیماریزاتر را زودتر مورد حمله قرار میدهند)، ویروسهای ضعیفتر و ملایمتر باقی بمانند و تکثیر شوند. البته اکنون، ضعیفترین نمونههای ویروسی هم کاملاً خطرناک هستند.
تشخیص بیماری
بیماری ایدز و HIV با توجه بروز علائم و نشانههای بیمار، از طریق آزمایش و بررسی آن در آزمایشگاه تشخیص داده میشود. آزمایش HIV به همه کسانی که در معرض خطر قرار دارند توصیه میشود که شامل هر فرد مبتلا به هر نوع بیماری آمیزشی است. در بسیاری از مناطق دنیا، یکسوم حاملان HIV زمانی متوجه میشوند که در مرحله پیشرفتهای از این بیماری هستند و AIDS یا نقص شدید دستگاه ایمنی آشکار میشود.
آزمایش HIV
در اکثر افراد دچار HIV، در طول سه تا دوازده هفته پس از بیماری اولیه، یک سری پادتنهای ویژه ایجاد میگردد. تشخیص اولیهی HIV قبل از تولید آنتیبادی با اندازهگیریHIV-RNA یا آنتیژن P24انجام میشود. نتایج مثبت به دست آمده توسط آنتیبادی یا آزمایش واکنش زنجیرهای پلیمراز (PCR)، با PCR و یا با آزمایش آنتیبادی دیگری تأیید میشوند.
آزمایش آنتیبادی در کودکان کمتر از ۱۸ ماه، به دلیل وجود مداوم آنتیبادیهای مادری معمولاً نتیجه درستی نمیدهند؛ بنابراین ابتلا به HIV تنها توسط آزمایش PCR مربوط به HIV RNA یا DNA و یا از طریق آزمایش آنتیبادی P24 قابل تشخیص است. در اکثر نقاط دنیا دسترسی به آزمایش PCR قابلاعتماد وجود ندارد و افراد باید تا زمانی صبر کنند که علائم پیشرفت کند و یا سن کودک بهاندازه کافی باشد و آزمایش آنتیبادی بهدرستی نتیجه دهد. در کشورهای جنوب صحرای آفریقا در بین سالهای ۲۰۰۷ و ۲۰۰۹، بین ۳۰ تا ۷۰ درصد مردم، از وضعیت HIV خودآگاه بودهاند. در سال ۲۰۰۹، بین ۴ تا ۴۲ درصد مردم مورد آزمایش قرار گرفتند. این ارقام نشاندهنده افزایش قابلتوجهی نسبت به ده سال گذشته است.
طبقهبندی آلودگی به HIV
از دو طبقهبندی اصلی برای مرحلهبندی HIV و ایدز استفاده میشود؛ یکی توسط سازمان جهانی بهداشت (WHO) و دیگر توسط مرکز کنترل بیماریها (CDC). برنامه CDC بیشتر در کشورهای توسعهیافته استفاده میشود. ازآنجاکه برنامه WHO احتیاجی به آزمایش ندارد، بیشتر مناسب کشورهای در حال توسعه است که با کمبود لوازم روبرو هستند. علیرغم تفاوتهای که این دو با هم دارند، اما میتوان هردوی آنها را از لحاظ آماری مقایسه نمود.
سازمان بهداشت جهانی برای اولین بار در سال ۱۹۸۶ تعریفی برای ایدز ارائه نمود. از آن زمان به بعد مرحلهبندی WHO برای چندین بار تغییر کرده و گسترش یافت که نسخهٔ اخیر آن در سال ۲۰۰۷ منتشر شده است. ردهبندی مراحل تعیینشده توسط WHO به شرح زیر است:
- ابتلای اولیه به HIV: که یا بدون علامت است و یا همراه با سندرم حاد ویروسی است.
- مرحله ۱: ابتلا به HIV بدون علامت با تعداد سلولهای CD4 بیش از ۵۰۰ در هر میکرولیتر. ممکن است شامل بزرگ شدن گرههای لنفاوی نیز باشد.
- مرحله ۲: علائم خفیف که ممکن است تغییر جزئی غشاء مخاطی و عود عفونت دستگاه تنفسی فوقانی را شامل شود و تعداد سلولهای CD4 کمتر از ۵۰۰ در هر میکرولیتر است.
- مرحله ۳: علائم پیشرفته که ممکن است شامل اسهال مزمن و غیرعادی برای بیش از یک ماه شود، به همراه عفونتهای باکتریایی شدید از جمله سل ریوی و همچنین تعداد سلولهای CD4 کمتر از ۳۵۰ در هر میکرولیتر.
- مرحله ۴ یا ایدز: علائم شدیدی شامل توکسوپلاسموز مغز، کاندیدیاز مری، نای، نایژه یا ششها و سارکوم کاپوزی. تعداد سلولهای CD4 به کمتر از ۲۰۰ در هر میکرولیتر میرسد.
مرکز کنترل و پیشگیری بیماری آمریکا نیز ایجاد یک سیستم طبقهبندی برای HIV ارائه نموده و آخرین بار آن را در سال ۲۰۰۸ بهروزرسانی کرده است. در این که سیستم ابتلا به HIV بر اساس شمارش CD4 و علائم بالینی میباشد، بیماری را در سه مرحله توصیف میکند:
- مرحله ۱: تعداد سلولهای +CD4 بیشتر از ۵۰۰ در هر میکرولیتر بدون هیچ علائمی از ایدز
- مرحله ۲: تعداد سلولهای +CD4 بین ۲۰۰ تا ۵۰۰ در هر میکرولیتر بدون هیچ علائمی از ایدز
- مرحله ۳: تعداد سلولهای +CD4 کمتر از ۵۰۰ در هر میکرولیتر یا وجود علائمی از ایدز
- نامعلوم: اگر اطلاعات کافی برای هر یک از مراحل فوق در دسترس نباشد.
اگر پس از درمان، تعداد سلولهای +CD4 خون به بیش از ۲۰۰ در هر میکرولیتر افزایش یابد و یا بیماری دیگری بهجز ایدز احتمال رود و یا حتی درمان گردد هنوز هم تشخیص اینکه بیماری ایدز بوده نیز پابرجا خواهد بود.
تاریخچه ویروس HIV
کشف ویروس HIV
ایدز اولین بار در سال ۱۹۸۱ در امریکا مشاهده شد. اولین مواردی که مشاهده شد در بین معتادان تزریقی و همچنین همجنسگرایان مرد قرار داشت که به دلیل نامعلومی سیستم دفاعی بدن آنها ضعیف شده بود و علائم بیماری التهاب ریه پنوموسیستیک کارینی (PCP) در آنها مشاهده میشد که این بیماری در افرادی دیده میشود که سیستم دفاعی بدنی ضعیفی دارند. سپس نوعی سرطان پوست نادر با نام کاپوسی سارکوما (KS) در میان مردان همجنسگرای گزارش شد. موارد بیشتری از بیماری PCP و KS مشاهده شد و این زنگ خطری برای مرکز پیشگیری و کنترل بیماری بود و گروهی از طرف این مرکز برای بررسی این واقعه تشکیل شد.
اوایل مرکز کنترل بیماری هنوز نامی رسمی برای این بیماری انتخاب نکرده بود و معمولاً نام این بیماری را با بیماریی که مریض با آن در ارتباط بود بیان میکردند، برای مثال تا قبل از کشف HIV از نام لنفادنوپاتی که بیماری عامل بود استفاده میشد، همچنین اسامی مانند سارکوم کاپوزی یا عفونت فرصتطلب نامهایی بودند که توسط این گروه در سال ۱۹۸۱ استفاده میشده است.
ازآنجاکه این سندرم در هائیتی، همجنسگرایان، بیماران هموفیلی و مصرفکنندگان هروئین ظاهر شده بود، مرکز کنترل بیماری عبارت «بیماری 4H» را ابداع کرد. در مطبوعات از اصطلاح “گرید” که مخفف معادل انگلیسی عبارت نقص ایمنی مرتبط با همجنسگرایی بود، استفاده میشد؛ اما بعداً که معلوم شد که ایدز فقط محدود به جامعه همجنسگرایان نمیشود، این نتیجه گرفته شد که استفاده از اصطلاح گرید گمراهکننده است و واژه ایدز در همایشی در ژوئیه ۱۹۸۲ معرفی شد. از سپتامبر ۱۹۸۲، مرکز کنترل بیماری از واژه ایدز برای نسبت دادن این بیماری استفاده کرد.
در سال ۱۹۸۳، دو گروه تحقیقاتی جداگانه به رهبری رابرت گالو و لوک آنتونی مونتاگنیئر بهطور مستقل اعلام کردند که یک ویروس پسگرد جدید بیماران مبتلا به ایدز را مبتلا کرده و یافتههایشان را در همان شماره از مجله ساینس منتشر کردند. گالو ادعا کرد که ویروسی که همکارانش از یک بیمار مبتلا به ایدز برای تحقیقات جدا کرده بود ازنظر شکل کاملاً مشابه سایر ویروسهای تی- لنفوتروپیک انسانی (HTLV) بوده که گروهش در همان ابتدا جدا کرده بود. گروه گالو نام آن ویروس را HTLV-III گذاشتند. در همان زمان، گروه مونتانیه ویروسی از یک بیمار مبتلا به تورم غدد لنفاوی گردن و ضعف فیزیکی که دو مشخصه از علائم ایدز است، جدا کرده بود.
تناقض در گزارشهای گروه گالو و مونتانیه و همکارانشان نشان میداد که هسته پروتئینهای این ویروس از لحاظ ایمنیشناسی، کاملاً متفاوت از HTLV-I است. گروه مونتانیه اسم ویروسی که جدا کرده بودند را ویروس مرتبط با لنفادنوپاتی (LAV) گذاشتند. ازآنجاکه مشخص شد هردوی این ویروسها یکسان هستند، در سال ۱۹۸۶ LAV و HTLV-III هر دو به HIV تغییر نام دادند.
منشأ
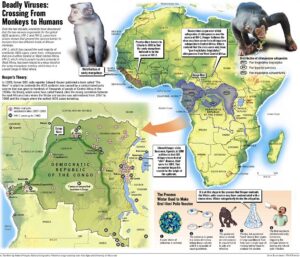
به نظر میرسد که هر دو ویروس HIV-1 و HIV-2 در اصل متعلق به نخستیسانان یا پریماتهای مرکز افریقا بوده و در اوایل قرن بیست به بدن انسان منتقل شدهاند. به نظر میآید که ویروس HIV-1 در اصل متعلق به مناطق جنوبی کامرون و تکاملیافتهٔ ویروس نقص ایمنی میمونی (SIV) که در میان شامپانزههای وحشی شیوع دارد، بوده است.
بعضی از ویروسشناسها معتقدند که این ویروس برای اولین بار، حدود 90 هزار سال قبل یک شکارچی آفریقایی را آلوده ساخته است و از طریق او در میان قبائل آفریقایی گسترش یافته است و امروزه به یک بیماری اپیدمیولوژیکی تبدیل شده است. همچنین ویروس HIV-2 تکاملیافتهٔ ویروس SIV میان گونهای میمون به نام منگابی دودی بوده است که در غرب افریقا (از جنوب سنگال تا غرب ساحل عاج) زندگی میکرده است. پاخ بینیانی مانند میمون شب، نسبت به ویروس HIV-1 مقاوم هستند و این احتمالاً به دلیل یک نوع ژن پیوندی دو گونه مقاوم ویروس در آنها میباشد. به نظر میرسد که HIV-1 حداقل در سه مرحله جهش داشته و به سه گروه از ویروسهای M، N و O جهش یافته است.
مدارکی موجود است که نشان میدهد انسانهایی که در شکار و یا فروش حیوانات دخالت داشتند دچار ویروس SIV شدهاند. اگرچه SIV ویروس ضعیفی است که سیستم دفاعی بدن انسان با آن مقابله میکند و بیش از چند هفته در بدن انسان باقی نمیماند، اما انتقال سریع و متوالی آن بین انسانهای مختلف زمان کافی را به این ویروس برای تبدیل آن به HIV میدهد. علاوه بر این، با توجه به نرخ پایین انتقال فردبهفرد بیماری، SIV فقط میتواند از طریق تعداد زیادی افراد در معرض خطر پخش شود که باور بر این است که تا قبل از قرن بیستم چنین جمعیتی وجود نداشته است.
راههای انتقال پرخطر بسته به زمان انتقال از حیوان به انسان به ویروس این امکان را میدهد که با انسان سازگار شود و در بین جامعه پخش گردد. مطالعات ژنتیکی ویروسی نشان میدهد که اجداد گروه HIV-1 M به سال ۱۹۱۰ برمیگردد. افرادی که مدعی هستند که HIV در این تاریخ شیوع یافته، آن را به ظهور و رشد استعمار و شهرهای مستعمره آفریقایی ارتباط میدهند که منجر به تغییرات اجتماعی شامل بیبندوباری جنسی، گسترش تنفروشی و بیماریهای زخم تناسلی مانند (سفلیس) در شهرهای مستعمره شده است. درحالیکه میزان انتقال HIV در رابطه جنسی واژینال در حالت عادی کم است، اما اگر یکی از طرفین مبتلا به یک بیماری آمیزشی عفونی باشد، احتمال انتقال هم افزایش خواهد یافت.
در اوایل دهه ۱۹۰۰ شهرهای مستعمره به دلیل شیوع بالای تنفروشی و بیماریهای زخم تناسلی معروف بودند و به نظر میرسید که در سال ۱۹۲۸ حدود ۴۵% زنان ساکن کینشاسای شرقی تنفروشی میکردند و در سال ۱۹۳۳ در حدود ۱۵% ساکنان همان شهر به بیماری سفلیس مبتلا شده بودند.
از نگاهی دیگر مشاهده میشود که اعمال خطرناک پزشکی در آفریقا در طول جنگ جهانی دوم، مانند استریل نبودن، استفاده مجدد از سرنگها در واکسنهای عمومی، آنتیبیوتیک و آنتیمالاریا از عواملی بودهاند که باعث پخش ویروس و سازگاری آن با انسانها شده است.
بررسی نمونههای خونی بهجامانده از گذشته نشان میدهد که اولین انسانی که مبتلا به ایدز شده است در سال ۱۹۵۹ در کشور کنگو جان خود را از دست داده است. این نخستین و قدیمیترین مورد مرگ شناخته شده در اثر ابتلا به این بیماری تا به امروز محسوب میشود.
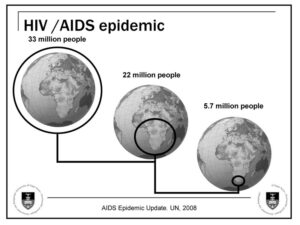
همچنین ممکن است ویروس HIV نخستین بار در سال ۱۹۶۶ به آمریکا گسترش یافته باشد، ولی عمده شیوع HIV مربوط به خارج از صحرای آفریقا و همچنین امریکا میشود و میتوان آن را به فردی ناشناس و مبتلا به ایدز نسبت داد که در کشور هائیتی زندگی میکرده است و با ورود به آمریکا در سال ۱۹۶۹ به آن، شیوع بخشیده است. پس از آن بهسرعت بین گروههای پرخطر (در ابتدا در بین مردان همجنسگرا) پاساژ گردید. در سال ۱۹۷۸ شیوع ویروس HIV-1 در بین مردان همجنسگرای ساکن نیویورک و سانفرانسیسکو، ۵ درصد تخمین زده شد که بیانگر این است که هزاران نفر در کشور مبتلا به ایدز بودهاند. در حال حاضر بیش از 36 میلیون نفر در جهان آلوده به ویروس HIV هستند و هرلحظه بر تعداد آلودهشدگان افزوده میشود.
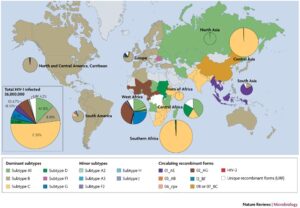
مقایسه بیوانفورماتیک سازمان بهداشت جهانی برای آلودگی با ویروس HIV در سراسر جهان بین سالهای 2013 و 2014
موارد قابلتوجه
در حال حاضر هیچ درمان قطعی برای سندرم نقص ایمنی اکتسابی (ایدز) وجود ندارد، اما راهکارهای مؤثری جهت کاهش تعداد ویروسها و جلوگیری از تکثیر انبوه ویروسی در لکوسیتهای انسان صورت گرفته است. آقای تیموتی براون 56 ساله، نخستین انسانی در تاریخ است که بعد از دریافت پیوند سلولهای بنیادی از یک فرد مقاوم به ویروس ایدز، کاملاً درمان شده است. او بهعنوان نخستین فرد آلوده به HIV که احتمالاً بهصورت قطعی درمان شده است، معرفی شد؛ اما هیچکس دقیقاً مطمئن نیست چه جنبهای از درمان آقای براون به بهبود وی منجر شده است. تیموتی ری براون در سال 1995 در دوران دانشجویی در برلین به ویروس HIV آلوده شد. دوازده سال بعد او برای درمان سرطان خون تحت عمل پیوند مغز استخوان قرار گرفت.
براون برای درمان سرطان، نخست تحت پرتودرمانی قرار گرفت تا سلولهای سرطانی و سلولهای بنیادی مغز استخوان وی که بیماری را به وجود آورده بودند، نابود شوند. وی سپس پیوند مغز استخوان را از یک اهداکننده سالم دریافت کرد تا سلولهای خونی تازه در بدنش تولید شود. پس از این فرآیند درمانی نهتنها سرطان آقای براون بهبود یافت، بلکه میزان ویروس HIV نیز تا حد قابلملاحظهای افت کرد.
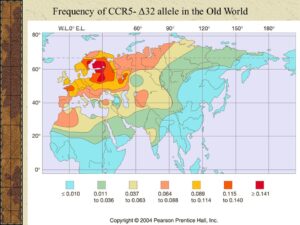
بعد از گذشت ۳۸ ماه، پزشکان نتوانستند اثری از آلودگی به HIV در بدن این فرد پیدا کنند؛ بهعبارتدیگر، همه آزمایشها حاکی از آن بودند که او درمان شده است، اما کسی که پیوند مغزاستخوان را به آقای تیموتی براون اهدا کرده بود، یک جهش یا موتاسیون ژنتیکی داشت که او را به آلودگی با ویروس HIV ایمن میکرد، این جهش، جهش دلتا 32 نام دارد و تنها در یک درصد مردم منطقه شمال اروپا و بیشتر در سوئدیها دیده میشود. این جهش در مردم نژادهای دیگر بسیار کمتر دیده میشود.
در سال ۲۰۰۷، یعنی همان زمانی که پیوند مغز استخوان انجام شد، پزشکان ۷۰ اهداکننده را تا پیش از یافتن موردی که با سلولهای آقای تیموتی براون سازگار باشد، مورد آزمایش قرار داده بودند.
پزشکان بعد از انجام پیوند مغز استخوان در کمال شگفتی متوجه شدند که ویروس HIV آقای براون کاملاً ناپدید شده است. براون حالا بهعنوان مترجم در سانفرانسیسکو زندگی میکند، اما در مقالههای پزشکی در رسانهها، لقب بیمار برلینی گرفته است. این شیوه درمان، بسیار امیدبخش میتواند باشد، چرا که تابهحال تحقیقات بسیار زیادی برای درمان ایدز انجام شده است، داروهای زیادی هم با مکانیسم اثر گوناگون برای ایدز ساخته شده است، اما هیچکدام درمان قطعی بیماری نیستند و تنها میتوانند دوره بدون بیماری را زیاد کنند، از عوارض ایدز بکاهند یا شمار ذرههای ویروسی را در خون کم کنند؛ بنابراین درمانی که طی آن با یک پیوند بشود برای همیشه بیماری را ریشهکن کرد، بسیار هیجانانگیز است.
اما نه! نباید بیشازحد خوشبین شد، چرا که پیششرط این شیوه درمان پیدا کردن اهداکنندههایی است که این جهش ژنتیکی یعنی موتاسیون دلتا 32 را داشته باشند و بهعلاوه مغز استخوانشان با بدن گیرنده پیوند، سازگار باشد؛ اما میتوان بهجای پیوند مغز استخوان، از پیوند سلولهای بندناف استفاده کرد، مزیت این پیوند، نسبت به پیوند مغز استخوان این است که موفقیت پیوند به میزان تطابق کمتری نیاز دارد.
البته باز هم مشکل پیدا کردن افرادی که جهش ژنتیکی را داشته باشند، پابرجا میماند، بر اساس یک برآورد انجامشده، از ۱۷ هزار بندنافی که مورد بررسی قرار گرفتند، تنها ۱۰۲ بند ناف، دارای جهش ژنتیکی بودند، بنابراین ضروری است که به ایجاد یک بانک بندناف فکر کرد. هنوز مشخص نیست که پیوند سلولهای بندناف چقدر پاسخ مثبتی ایجاد کند، اما پژوهشگران بسیار خوشبین هستند. دانشمندان از زمانی که ویروس عامل بیماری ایدز، سه دهه پیش کشف شد، مشغول مطالعه در مورد این بیماری هستند، آنها خیلی زود دریافتند که درصد کوچکی از انسانها بهصورت طبیعی به ایدز مقاوم هستند. پس منطقی بود که با مطالعه روی این افراد، کلید درمان بیماری پیدا شود.
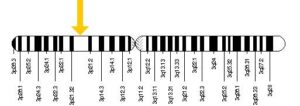
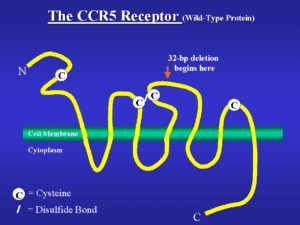
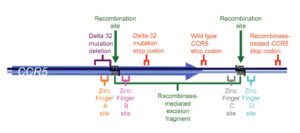
ژنی به نام CCR5 یا C-C chemokine receptor type 5، گیرنده یا receptor خاصی را روی گویچههای سفید کد میکند و ویروس HIV با چسبیدن به همین گیرنده است که به گویچههای سفید میچسبد و باعث نابودی آنها میشود. در افراد مقاوم به ایدز این ژن دچار جهشی به نام دلتا ۳۲ میشود، به این ترتیب دیگر گیرندهای وجود نخواهد داشت تا ویروس بتواند به گویچههای سفید بچسبد این ژن بر روی بازوی کوتاه کروموزوم شماره 3 بهصورت 3p21.31 مستقر است.
کسانی که یک کپی از ژن جهشیافته را دارند، مقاومت نسبی به ایدز دارند، ۱۰ تا ۱۵ درصد کسانی که نژادشان متعلق به شمال اروپا باشد، همین ویژگی را دارا هستند؛ اما آنهایی که دو نسخه از ژن جهشیافته را داشته باشند، یعنی یک ژن جهشیافته را از مادر و دیگری را از پدر خود گرفته باشند، میزان ایمنیشان بسیار بالاست.
نتیجه بررسی دانشمندان نشان داده است که این جهش در قرون وسطی به وقوع پیوسته است، بعضیها گمان میکنند که این جهش در پاسخ به بیماری طاعون یا آبله، ایجاد شده باشد.
البته همانطور که ممکن است به فکر شما هم رسیده باشد، دانشمندان با توجه به گران بودن و مخاطرهآمیز بودن پیوند مغز استخوان، به این فکر هم افتادهاند که با ژندرمانی و ایجاد تغییر در CCR5، بدون نیاز به پیوند، با همین مکانیسم به نتیجه برسند. در یک مورد آنها، بیماری را انتخاب کردند، سلولهای سفیدش را استخراج کردند و در خارج بدن با ژندرمانی باعث تولید پروتئینی شدند که در عملکرد ژن CCR5 ایجاد اختلال میکرد، سپس سلولها را دوباره به بدن بیمار منتقل کردند، آنها ۱۲ هفته به بیمار داروهای ضد ایدز ندادند، در ابتدا شمار ویروس در بدن بیمار بالا رفت، اما بعد از ۱۲ هفته، شمار ذرههای ویروسی کاهش پیدا کرد و شمار گویچههای سفید بالا رفت.
البته همین شیوه درمانی در مورد پنج بیمار دیگر پاسخ نداد، دانشمندان حدس میزنند که علت پاسخ این بیمار بهخصوص که نخواست نامش فاش شود، این است که خودش بهصورت طبیعی با داشتن یک ژن CCR5 جهشیافته ایمنی نسبی به بیماری داشت. بههرحال به نظر میرسد CCR5 یک روزنه امید برای درمان بیماری ایدز باشد، چه با پیوند مغز استخوان یا سلولهای بندناف و چه ژندرمانی با داروهای مختلکننده عملکرد ژن CCR5.
References:
- Sepkowitz KA (June 2001). “AIDS—the first 20 years”. N. Engl. J. Med. 344 (23): 1764–72.
- editors، Alexander Krämer، Mirjam Kretzschmar، Klaus Krickeberg، (2010).
- U.S. Department of Health & Human Services. Dec 2010. Retrieved June 13، 2012.
- Guide for HIV/AIDS Clinical Care. AIDS Education and Training Center Program. Retrieved November 21، 2015.
- Markowitz، edited by William N. Rom ; associate editor، Steven B. (2007).
- Philadelphia: Wolters Kluwer/Lippincott Williams & Wilkins. p. 745.
- Vogel، M; Schwarze-Zander، C; Wasmuth، JC; Spengler، U; Sauerbruch، T; Rockstroh، JK (July 2010).
- Charles B. Hicks، MD (2001). Jacques W. A. J. Reeders & Philip Charles Goodman، ed. Radiology of AIDS. Berlin [u.a.]: Springer. p. 19.
- Blankson، JN (March 2010). “Control of HIV-1 replication in elite suppressors”. Discovery medicine 9 (46): 261–6.
- Walker، BD (Aug–Sep 2007). “Elite control of HIV Infection: implications for vaccines and treatment”. Topics in HIV medicine : a publication of the International AIDS Society، USA 15 (4): 134–6.
- Holmes CB، Losina E، Walensky RP، Yazdanpanah Y، Freedberg KA (2003). “Review of human immunodeficiency virus type 1-related opportunistic infections in sub-Saharan Africa”. Clin. Infect. Dis. 36 (5): 656–662.
- Chu، C; Selwyn، PA (February 15، 2011). “Complications of HIV infection: a systems-based approach”. American family physician 83 (4): 395–406.
- Mittal، R; Rath، S; Vemuganti، GK (Jul 2013). “Ocular surface squamous neoplasia – Review of etio-pathogenesis and an update on clinico-pathological diagnosis.”. Saudi journal of ophthalmology : official journal of the Saudi Ophthalmological Society 27 (3): 177–86.
- Sestak K (July 2005). “Chronic diarrhea and AIDS: insights into studies with non-human primates”. Curr. HIV Res. 3 (3): 199–205.
- Murray ED، Buttner N، Price BH (2012). “Depression and Psychosis in Neurological Practice”. In Bradley WG، Daroff RB، Fenichel GM، Jankovic J. Bradley’s Neurology in Clinical Practice: Expert Consult – Online and Print، 6e (Bradley، Neurology in Clinical Practice e-dition 2v Set) 1 (6th ed.). Philadelphia، PA: Elsevier/Saunders. p. 101.
- Smith DK، Grohskopf LA، Black RJ، Auerbach JD، Veronese F، Struble KA، Cheever L، Johnson M، Paxton LA، Onorato IM، Greenberg AE (21 January 2005). “Antiretroviral postexposure prophylaxis after sexual، injection-drug use، or other nonoccupational exposure to HIV in the United States: recommendations from the U.S. Department of Health and Human Services.”. MMWR. Recommendations and reports : Morbidity and mortality weekly report. Recommendations and reports / Centers for Disease Control 54 (RR-2): 1–20.
- Coovadia H (2004). “Antiretroviral agents—how best to protect infants from HIV and save their mothers from AIDS”. N. Engl. J. Med. 351 (3): 289–292.
- Kripke C (1 August 2007). “Antiretroviral prophylaxis for occupational exposure to HIV.”. American family physician 76 (3): 375–6.
- Dosekun O، Fox J (July 2010). “An overview of the relative risks of different sexual behaviours on HIV transmission.”. Current opinion in HIV and AIDS 5 (4): 291–7.
- Boily MC، Baggaley RF، Wang L، Masse B، White RG، Hayes RJ، Alary M (February 2009). “Heterosexual risk of HIV-1 infection per sexual act: systematic review and meta-analysis of observational studies.”. The Lancet infectious diseases 9 (2): 118–29.
- Kripke، C (August 1، 2007). “Antiretroviral prophylaxis for occupational exposure to HIV”. American family physician 76 (3): 375–6.
- Boily MC، Baggaley RF، Wang L، Masse B، White RG، Hayes RJ، Alary M (February 2009). “Heterosexual risk of HIV-1 infection per sexual act: systematic review and meta-analysis of observational studies”. The Lancet Infectious Diseases 9 (2): 118–129.
- Beyrer، C; Baral، SD; van Griensven، F; Goodreau، SM; Chariyalertsak، S; Wirtz، AL; Brookmeyer، R (Jul 28، 2012). “Global epidemiology of HIV infection in men who have sex with men”. Lancet 380 (9839): 367–77.
- Dosekun، O; Fox، J (July 2010). “An overview of the relative risks of different sexual behaviours on HIV transmission”. Current Opinion in HIV and AIDS 5 (4): 291–7.
- Anderson، J (February 2012). “Women and HIV: motherhood and more”. Current Opinion in Infectious Diseases 25 (1): 58–65.
- Ng، BE; Butler، LM; Horvath، T; Rutherford، GW (March 16، 2011). Butler، Lisa M، ed. “Population-based biomedical sexually transmitted infection control interventions for reducing HIV infection”. Cochrane database of systematic reviews (Online) (3): CD001220.
- Draughon، JE; Sheridan، DJ (2012). “Nonoccupational post exposure prophylaxis following sexual assault in industrialized low-HIV-prevalence countries: a review”. Psychology، health & medicine 17 (2): 235–54.
- Baggaley، RF; Boily، MC; White، RG; Alary، M (April 4، 2006). “Risk of HIV-1 transmission for parenteral exposure and blood transfusion: a systematic review and meta-analysis”. AIDS (London، England) 20 (6): 805–12.
- Centers for Disease Control and Prevention، (CDC) (October 22، 2010). “HIV transmission through transfusion — Missouri and Colorado، 2008.”. MMWR. Morbidity and mortality weekly report 59 (41): 1335–9.
- White، AB; Mirjahangir، JF; Horvath، H; Anglemyer، A; Read، JS (Oct 4، 2014). “Antiretroviral interventions for preventing breast milk transmission of HIV.”. The Cochrane database of systematic reviews 10: CD011323.
- Alimonti JB، Ball TB، Fowke KR (2003). “Mechanisms of CD4+ T lymphocyte cell death in human immunodeficiency virus infection and AIDS”. J. Gen. Virol. 84 (7): 1649–1661.
- Smith، Johanna A.; Daniel، René (Division of Infectious Diseases، Center for Human Virology، Thomas Jefferson University، Philadelphia) (2006). “Following the path of the virus: the exploitation of host DNA repair mechanisms by retroviruses”. ACS Chem Biol 1 (4): 217–26.
- Zhang C، Zhou S، Groppelli E، Pellegrino P، Williams I، Borrow P، Chain BM، Jolly C (2015). “Hybrid Spreading Mechanisms and T Cell Activation Shape the Dynamics of HIV-1 Infection”. PLOS Computational Biology 11 (4): e1004179.
- Jolly C، Kashefi K، Hollinshead M، Sattentau QJ (2004). “HIV-1 cell to cell transfer across an Env-induced، actin-dependent synapse”. Journal of Experimental Medicine 199 (2): 283–293.
- Sigal A، Kim JT، Balazs AB، Dekel E، Mayo A، Milo R، Baltimore D (2011). “Cell-to-cell spread of HIV permits ongoing replication despite antiretroviral therapy”. Nature 477 (7362): 95–98.
- Gilbert، PB; et al. (February 28، 2003). “Comparison of HIV-1 and HIV-2 infectivity from a prospective cohort study in Senegal”. Statistics in Medicine 22 (4): 573–593.
- Piatak، M.، Jr، Saag، M. S.، Yang، L. C.، Clark، S. J.، Kappes، J. C.، Luk، K. C.، Hahn، B. H.، Shaw، G. M. and Lifson، J.D. (1993). “High levels of HIV-1 in plasma during all stages of infection determined by competitive PCR”. Science 259 (5102): 1749–1754.
- Pantaleo G، Demarest JF، Schacker T، Vaccarezza M، Cohen OJ، Daucher M، Graziosi C، Schnittman SS، Quinn TC، Shaw GM، Perrin L، Tambussi G، Lazzarin A، Sekaly RP، Soudeyns H، Corey L، Fauci AS. (1997).
- RC Gallo، PS Sarin، EP Gelmann، M Robert-Guroff، E Richardson، VS Kalyanaraman، D Mann، GD Sidhu، RE Stahl، S Zolla-Pazner، J Leibowitch، and M Popovic (1983). “Isolation of human T-cell leukemia virus in acquired immune deficiency syndrome (AIDS)”. Science 220 (4599): 865–867.
- Barre-Sinoussi، F.; Chermann، J.; Rey، F.; Nugeyre، M.; Chamaret، S.; Gruest، J.; Dauguet، C.; Axler-Blin، C.; Vézinet-Brun، F.; Rouzioux، C.; Rozenbaum، W.; Montagnier، L. (1983). “Isolation of a T-lymphotropic retrovirus from a patient at risk for acquired immune deficiency syndrome (AIDS)”. Science 220 (4599): 868–871.
- Keele، B. F.، van Heuverswyn، F.، Li، Y. Y.، Bailes، E.، Takehisa، J.، Santiago، M. L.، Bibollet-Ruche، F.، Chen، Y.، Wain، L. V.، Liegois، F.، Loul، S.، Mpoudi Ngole، E.، Bienvenue، Y.، Delaporte، E.، Brookfield، J. F. Y.، Sharp، P. M.، Shaw، G. M.، Peeters، M.، and Hahn، B. H. (July 28، 2006).
- Goodier، J.، and Kazazian، H. (2008). “Retrotransposons Revisited: The Restraint and Rehabilitation of Parasites”. Cell 135 (1): 23–35.
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام