بررسی آنتیبادیهای عصبی در بیماران مشکوک به انسفالیت خودایمن
دکتر شاهرخ مستور تهرانی
پیشزمینه: یکی از عواملی که بهطور روزافزون بهعنوان علت انسفالیت شناخته میشود، خودایمنی است و شیوع آن نیز با انسفالیت با اتیولوژی عفونی مشابه است. در طول یک دهه گذشته، فهرست بلندبالایی از بیومارکرهای آنتیبادی کشف شده، وجود داشته است که به شناسایی و تعیین مشخصات انسفالیت خودایمن کمک کرده است. به موازات شتاب گرفتن گذار بیومارکرهای آنتیبادی از محیط تحقیقاتی به آزمایشگاههای بالینی، تقاضا و پیچیدگی آزمایشهای مبتنی بر پنل نیز افزایش یافته است. آزمایشگاههای بالینی بهطور روزافزون درگیر بحثهای مرتبط با کارایی تست و تهیه راهنما در مورد اینکه کدام روش انجام تست بهترین کارایی بالینی را به دنبال دارد، میشوند.
محتوا: در بررسی تشخیصی افراد مشکوک به بیماری عصبی خودایمن، برای تضمین حساسیت و اختصاصیت بالینی بهینه، انجام تست جامع واکنشی مبتنی بر پنل، بر اساس تظاهر فنوتیپی عصبی غالب (بهعنوان مثال انسفالوپاتی)، بهترین راه است. امتیازهای پیشبینیکننده بر اساس بررسیهای تشخیصی بالینی میتوانند در تعیین زمان درخواست انجام تست سودمند واقع شوند. بهجز تعدادی موارد استثنا، در اکثر مواقع انجام تست هم بر روی سرم و هم CSF توصیه میشود. درخواست به موقع و مناسب تست و همچنین تفسیر صحیح آن مستلزم درک متدولوژی تست و کارایی تست آنتیبادی در نمونههای مختلف است.
خلاصه: این مقاله به بررسی ملاحظات مهم در طراحی و انتخاب روشها و پنلهای تست آنتیبادی عصبی میپردازد. افزایش همکاری بین پاتولوژیستها، متخصصان آزمایشگاه و نورولوژیستها باعث بهبود کارایی پنلهای پیچیده تست آنتیبادی عصبی خودایمن خواهد شد.
مقدمه
انسفالیت یک بیماری عصبی غالباً مخرب است که با گسترش سریع زوال شناختی، علائم روانی، نقایص عصبی کانونی و یا تشنج مشخص میشود. اگرچه علت بیماری غالباً به عفونت نسبت داده میشود، اما دادههای اپیدمیولوژیکی اخیر نشان میدهند که انسفالیت میتواند علل خودایمنی نیز داشته باشد که میزان شیوع آن با علل عفونی برابر است. همچنان یک روش تشخیصی دقیق و مناسب برای انسفالیت خودایمن، ضروری است زیرا باعث میشود درمان با ایمونوتراپیهای مؤثر تقویت شود و در عین حال این اطمینان را میدهد که دیگر تشخیصهای احتمالی قابل درمان نادیده گرفته نمیشوند. شناسایی بهتر انسفالیت خودایمن تا حد زیادی با کشف آنتیبادیهای عصبی مرتبط از نظر بالینی محقق شده است که بهعنوان بیومارکرهایی برای خودایمنی عصبی عمل میکنند. با این حال، با افزایش تعداد آنتیبادیهای عصبی، پیچیدگی تستهای تشخیصی آزمایشگاهی در بیماران مشکوک به انسفالیت خودایمن نیز افزایش یافت. در این مقاله، مروری خواهیم داشت بر فرآیند درخواست تست آنتیبادی عصبی، تفاوتهای موجود در روشهای تست آنتیبادی عصبی و تفسیر مؤثر نتایج تست آنتیبادی عصبی در بالین.
تجویز تست آنتیبادی عصبی در بیماران مشکوک به انسفالیت خودایمن
شاخص های زیر انجام تست آنتیبادی عصبی را توصیه میکنند: تست آنتیبادی عصبی برای افراد مشکوک به انسفالیت خودایمن، غالباً برای بیمارانی انجام میشود که اختلال تحت حاد در عملکرد دستگاه عصبی مرکزی با اتیولوژی نامشخص نشان میدهند. بیماران مبتلا به انسفالیت خودایمن ممکن است علائم غالبی مانند انسفالوپاتی، تشنج یا حرکات غیرطبیعی را نشان دهند که بر این اساس پزشک معالج میتواند پنل آنتیبادیهای عصبی مربوط به آن سندرم را درخواست دهد (در ادامه بحث میشود). با این حال، چنین تظاهراتی در نورولوژی شایع بوده و تشخیص افتراقی هر یک از آنها بسیار گسترده است، به همین دلیل امتیازهای پیشبینیکننده توسعه یافتهاند که میتوانند تعیین کنند تست جامع آنتیبادی برای کدام دسته از بیماران میتواند سودمند باشد؛ بهعنوان مثال، صرع یک اختلال عصبی شایع است که شیوع مادامالعمر آن 7/6 به ازای هر ۱۰۰0 نفر است. ممکن است یک آنتیبادی عصبی در یک بیمار غیرمعمول مبتلا به صرع با علت خودایمن یافت شود، اما انجام تست آنتیبادی بر روی همه بیماران مبتلا به صرع بدون قائل شدن هیچ تمایزی، قاعدتاً کمبازده و پرهزینه خواهد بود. امتیاز «شیوع آنتیبادی در صرع و انسفالوپاتی» (APE2) به پیشبینی مثبت بودن آنتیبادی در بیماران مبتلا به صرع کمک میکند، بدین صورت که امتیاز برابر با ۴ یا بیشتر از آن، نشاندهنده حساسیت و اختصاصیت بالینی 98% و 85% برای شناسایی آنتیبادیهای عصبی است که دال بر انسفالیت خودایمن هستند. این امتیاز، ویژگیهایی از تظاهرات بیماران را که تا حد زیادی مطرحکننده خودایمنی عصبی هستند، دربر میگیرد، این موارد عبارتند از: پرودروم (علایم اولیه ) شبیه به بیماری ویروسی، پیشرفت سریع بیماری (۶-۱ هفته)، التهاب مایع مغزی نخاعی (CSF) و یافتههای تصویربرداری مغزی مشعر بر انسفالیت. استفاده از این امتیاز کمک میکند تا بدانیم آیا بررسی آنتیبادیهای عصبی، احتمالاً برای بیمار مبتلا به صرع، سودمند خواهد بود یا خیر. همچنین درخواست تست برای بیمارانی با احتمال اندک خودایمنی عصبی را به حداقل میرساند. این مدل پیشبینیکننده، در بیماران نشاندهنده زوال شناختی اعتبارسنجی شده است. برخی مراکز بیمارستانی، بهکارگیری این مدلها را آغاز کردهاند تا کارایی تست خود را افزایش دهند. توسعه امتیازهای پیشبینیکننده بیشتر برای دیگر سندرمهای عصبی مانند آتاکسی یا نوروپاتی میتواند برای تعیین اینکه کدام بیماران بیشترین بهره را از تست آنتیبادی عصبی خواهند برد، مفید باشد.
استفاده از پنلهای آنتیبادی عصبی
درخواست تست آنتیبادیهای عصبی به صورت یک پنل معمولاً بر یک تست منفرد، ارجحیت دارد؛ زیرا همپوشانی فنوتیپی بین این آنتیبادیها میتواند قابلتوجه باشد؛ بهعنوان مثال، آنتیبادیهای عصبی متعددی در بیماران مبتلا به انسفالیت خودایمن لیمبیک شناسایی شدهاند که فارغ از آنتیبادی مرتبط زمینهای، بیماران غالباً علائم مشابه روانی، اختلالات حافظه و یا بروز تشنج بدون سابقه قبلی را نشان میدهند. تستهای متوالی برای یک آنتیبادی منفرد، همواره باعث تأخیر در تشخیص میشود که خود مشکلاتی را به بار میآورد زیرا درمان زودهنگام سرکوبکننده ایمنی در انسفالیت خودایمن میتواند ریسک تبعات نامطلوب بیماری مانند تشنج دائمی یا اختلال شناختی را کاهش دهد. به این دلیل، بهطور کلی استفاده از پنلهایی که برای تظاهرات عصبی (مانند انسفالوپاتی) طراحی شدهاند و به صورت جامع آنتیبادیهای عصبی مرتبط علیه آنتیژنهای داخل یا خارج سلولی را بررسی میکنند، توصیه میشود. اگرچه باید توجه داشت که تظاهرات عصبی نادری وجود دارند که برای یک آنتیبادی عصبی خاص تا حدودی پاتوگنومیک باشند و بر اساس آنها میتوان تست هدفمند انجام داد. یکی از چنین مواردی، بیمار مشکوک به انسفالیت خودایمنی است که دچار faciobrachial dystonic seizures است.
این وضعیت در صورت و بازو به مدت چند ثانیه تداوم دارد و میتواند صدها بار در یک روز رخ دهد و قویاً مطرحکننده آنتیبادیهای ضد پروتئین ۱ غیرفعال گلیومای غنی از لوسین (LGI1) است. در بیماری با این اختلال حرکتی، انجام تست LGI1-IgG به تنهایی، منطقی است و میتوان با استفاده از معرفهایی که به صورت تجاری در دسترس هستند، این تست را انجام داد. اگرچه در اکثر موارد مشکوک انسفالیت خودایمن آنتیبادی عصبی خاصی را نمیتوان با قطعیت پیشبینی کرد، از این رو استفاده مناسب از پنل آنتیبادی تضمین میکند که بررسیهای جامع و گسترده انجام شده است.
سرم در مقایسه با CSF جهت انجام تست آنتیبادی عصبی
هنگام درخواست تست آنتیبادیهای عصبی، پزشک امکان این را دارد که نمونه سرم، CSF یا هر دو را برای انجام تست به آزمایشگاه ارسال کند. اگرچه جمعآوری سرم نسبت به CSF، کمتر تهاجمی است، اما اغلب بیماران مشکوک به انسفالیت خودایمن، تحت پونکسیون کمری قرار میگیرند تا دیگر مارکرهای التهاب CSF (مانند افزایش شمار گلبولهای سفید CSF و باندهای اولیگوکلونال اختصاصی CSF) بررسی شوند و تشخیصهای دیگر (مانند عفونت ویروسی) رد شود. به این دلیل اغلب هم سرم و هم CSF برای انجام تست در دسترس هستند. آزمایشگاهها باید توجه داشته باشند که اختصاصیت و حساسیت بالینی ممکن است در انواع نمونههای مختلف، بسته به آنتیبادی عصبی موجود متفاوت باشد؛ بهعنوان مثال آنتــــیبادیهای ضد گیرنده N- متیل- D- آسپارتات (NMDAR)، پروتئین اسیدی فیبریلار گلیال (GFAP)، LGI1 و شبه پروتئین وابسته به کانتکتین ۲ (CASPR2)، همگی مرتبط با انسفالیت خودایمن هستند. اما سرم نسبت به CSF برای NMDAR و GFAP حساسیت کمتری دارد و از سوی دیگر CSF نسبت به سرم برای LGI1 و CASPR2 حساسیت کمتری دارد؛ بنابراین هنگامی که چند آنتیبادی عصبی بهعنوان بخشی از یک پنل مورد تست قرار میگیرند، استفاده از سرم و CSF، حساسیت بالینی را به حد بهینه میرساند.
انجام تست هم بر روی سرم و هم CSF همچنین میتواند اختصاصیت بالینی را از طریق هشدار به پزشک در مورد احتمال نتایج مثبت کاذب، به حداکثر برساند. بهطور کلی شناسایی آنتیبادی در CSF نسبت به سرم اختصاصیت بالینی بالاتری دارد. GFAP-IgG بیومارکری برای یک انسفالیت خودایمن است که اغلب با التهاب طناب نخاعی و مننژ همراهی دارد (تحت عنوان مننگوانسفالومیلیت شناخته میشود) و این بیومارکر قویاً مطرحکننده این بیماری هستند. در مطالعهای که شناسایی GAFP-IgG را در سرم و CSF بررسی میکرد، اختصاصیت بالینی مثبت شدن CSF برای مننگوانسفالومیلیت (یا فرم محدودشده آن) بیش از ۹۵% بود، در حالی که اختصاصیت در بیمارانی با مثبت شدن سرم به تنهایی، کمتر از ۱۰% بود؛ بنابراین اگرچه عدم تطابق بین مثبت شدن آنتیبادی سرم و CSF میتواند بازتابی از تفاوت حساسیت بالینی در انواع نمونهها باشد، اما پزشکان باید مثبت شدن آنتیبادی سرم به تنهایی در بیماری با تظاهرات بالینی غیرمعمول را به دیده تردید بنگرند. بهجز اندک موارد استثنا، استفاده از هردو نمونه سرم و CSF برای انجام تست آنتیبادی عصبی در موارد مشکوک به انسفالیت خودایمن توصیه میشود.
متدلوژیهای تست آنتیبادی عصبی برای بیماران مشکوک به انسفالیت خودایمن
بررسیهای جامع در این بیماران باید دربردارنده انجام تست برای آنتیبادیهایی که علاوه بر پروتئینهای عصبی خارجسلولی، پروتئینهای داخل سلولی را نیز هدف قرار میدهند، باشد. آنتیبادیهایی که آنتیژنهای عصبی داخل سلولی را هدف قرار میدهند عموماً پاتوژنیک نیستند، بلکه یک مارکر جایگزین از آسیب به واسطه سلولهای T سایتوتوکسیک هستند. در مقابل، آنتیبادیهایی که به آنتیژنهای خارج سلولی سطح سلول یا آنتیژنهای عصبی سیناپسی متصل میشوند، پاتوژنیک هستند و میتوانند بهطور مستقیم باعث اختلالات نورونی شوند. آنتیبادیهای پاتوژنیک عموماً کونفورماسیون native آنتیژن را میشناسند، در حالی که آنتیبادیهای غیرپاتوژنیک که در بیماریهای ناشی از سلول T غالب هستند، در بیشتر موارد اپیتوپهای غیرساختاری را هدف قرار میدهند که این مسئله بر متدلوژی انتخابشده جهت شناسایی آنتیبادی تأثیر میگذارد.
در مورد اکثر بیومارکرهای آنتیبادی مرتبط به انسفالیت خودایمن، ایزوتایپ ایمونوگلوبولینی موردنظر غالباً ایمونوگلوبین G (IgG) است. تقریباً در تمام متدلوژیهایی که در ادامه بحث میشود، شناسایی این بیومارکرها از طریق استفاده از آنتیهیومن ضد آنتیبادیهای IgG با میل ترکیبی بالا که با آنزیم یا فلوروفور کنژوگه شدهاند، انجام میشود. در بیشتر موارد، آگاهی از زیرکلاس اختصاصی IgG از لحاظ بالینی مهم نیست، با این حال آنتیبادیهای IgG1 بیشترین شیوع را دارند، اما برخی از این بیومارکرهای آنتیبادی به سمت زیرکلاس IgG4 تمایل دارند (مانند LGI1 و CASPR2) و تصور میشود بهجای سایتوتوکسیسیتی به واسطه کمپلمان از طریق مکانیسمهای مسدودکننده باعث بیماری میشوند. شواهدی وجود دارد که استفاده از آنتیبادیهای IgG آنتیهیومن اختصاصی برای یک زیرکلاس میتواند اختصاصیت تست را افزایش دهد. در ادامه ملاحظات متدلوژیکی خاص هنگام انجام تست برای این آنتیبادیهای مختلف در بیماران مشکوک به انسفالیت خودایمن را شرح میدهیم.
آنتیبادیهای ضد آنتیژنهای نورونی داخل سلولی
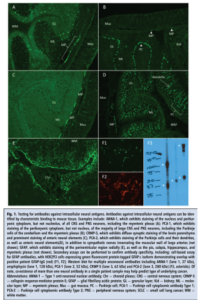
آنتیبادیهای ضد پروتئینهای نورونی داخل سلولی اولین بیومارکرهای کشفشده برای انسفالیت خودایمن بودند. این آنتیبادیها بهطور کلاسیک در بیمارانی با اختلالات عصبی ایجادشده به واسطه ایمنی که توسط بدخیمیهای زمینهای تحریک میشوند، یافت میشوند؛ این بیماریها تحت عنوان سندرم نورولوژیکال پارانئوپلاستیک نامیده میشوند. در این موارد، غالباً تومور، آنتیژنی را بیان میکند که آنتیبادی به آن متصل شده و «آنتیبادی سرطانی- عصبی» نام میگیرد. یکی از اولین آنتیبادیهایی که کشف شد، آنتیبادی نوع ۱ ضد هستهای نورونی (ANNA-1، همچنین anti-Hu نامیده میشود) نام دارد که خانوادهای از پروتئینهای متصلشونده به RNA داخل سلولی را شناسایی میکنند. فنوتایپهای بالینی مرتبط با این آنتیبادی در گروههای بزرگی از بیماران شناسایی شدهاند و عبارتند از انسفالیت لیمبیک، آتاکسی مخچهای، نورونوپاتی حسی و اختلال در حرکات گوارشی. بیشترین شیوع این آنتیبادی در بیماران مبتلا به سرطان ریه سلول کوچک است، بهطوری که در بیش از ۸۰% موارد این بیماری یافت میشود. باید توجه داشت که تعیین اولیه مشخصات بالینی بیماران مبتلا به PNS وابسته به ANNA-1 به شناسایی آنتیبادی با ایمونوفلورسنس غیرمستقیم مبتنی بر بافت (TIIF) بستگی دارد (شکل ۱ را ببینید). با استفاده از TIIF، نمونههای مختلفی از مقطعهای تازه منجمد یا فیکسشده در فرمالین از مغز (مانند کورتکس، هیپوکامپ، گانگلیای قاعدهای، مخچه) موش، رت یا پریماتها و یا بافتهای غیرمغزی (مانند مخاط گوارشی، کلیه) قابل بررسی هستند. سرم یا CSF بیمار بر روی این مقاطع انکوبه میشوند و آنتیبادیهای متصلشده به بافت با استفاده از آنتیبادیهای ثانویه آنتیهیومن فلوروسنت تجاری، شناسایی میشوند. مثبت بودن نمونه با مشاهده زیر میکروسکوپ مشخص میشود؛ به این صورت که وجود یک الگوی رنگآمیزی مشخص، تعیینکننده اختصاصیت یک آنتیبادی معین است. غالباً یک تیتر نهایی (end point) فراهم میشود. با توجه به پیچیدگی این الگوهای رنگآمیزی آنتیبادیها، کیفیت این ارزیابیها به میزان تجربه و مهارت تفسیرکننده بستگی دارد.
در دهههای اخیر، آنتیبادیهای متعدد دیگری در بیماران مبتلا به انسفالیت خودایمن شناسایی شدهاند که آنتیژنهای نورونی داخل سلولی را هدف قرار میدهند. همانند ANNA-1، مقالاتی که این سندرمهای وابسته به آنتیبادی را توصیف میکنند، عموماً متکی بر رنگآمیزی TIIF برای شناسایی آنتیبادی هستند و از یک سنجش ثانویه مانند وسترن بلات (WB) یا لاین بلات (LB) بهعنوان تست تأییدی استفاده میکنند (شکل ۱ را ببینید). آنتیژنهای موردنیاز برای این سنجشها را میتوان از بافت عصبی که در دترجنتها solubilize شده است یا به صورت پروتئین نوترکیب تولید شدهاند، به دست آورد. این پروتئینها عموماً در شرایط دناتوراسیون بر اساس وزن مولکولی جداسازی میشوند (مانند SDS-PAGE)، سپس پروتئینها به یک غشا (مانند نیتروسلولز) انتقال داده میشوند و بعد به صورت نوارهایی بریده میشوند که در نهایت بهعنوان سوبسترا مورد بررسی قرار میگیرند. این نوارها block شده و سپس با سرم یا CSF انکوبه میشوند تا اتوآنتیبادیهای بیمار به آنتیژنها متصل شوند. این اتوآنتیبادیها در بیشتر موارد از طریق آنتیبادی ثانویه آنتیهیومن متصل به آنزیم شناسایی میشوند که یک ارزیابی نیمه کمی از اتوآنتیبادی متصلشده را از طریق مشاهده مستقیم یا چگالیسنجی کامپیوتری فراهم میآورد. استفاده از پروتئینهای بسیار خالص نوترکیب در مقایسه با استفاده از لیزات خام اختصاصیت آنالیتیکال را افزایش میدهد چرا که لیزات خام باعث افزایش رنگآمیزی پسزمینه میشود و احتمال تفسیر نادرست به دلیل مهاجرت پروتئینهای غیرمرتبط را افزایش میدهد. اخیراً، سیستمهای لاین بلات توسعه یافتهاند که خودکار هستند و میتوانند آنالیزهایی با چند آنالیت انجام دهند.
شکل 1
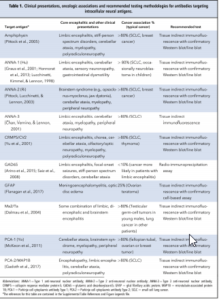
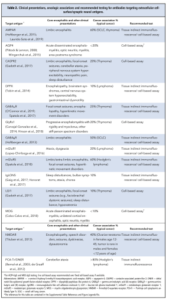
جدول 1
اکثر آزمایشگاههای بزرگ مرجع از TIIF برای غربالگری آنتیبادی ضد آنتیژنهای نورونی داخل سلولی استفاده میکنند و اگر الگوی رنگآمیزی با یک آنتیبادی مشخص سازگار بود، از وسترن بلات یا لاین بلات بهعنوان تأئید استفاده میکنند. کیتهای تجاری لاین بلات برای آنتیبادیهای سرطانی- عصبی در دسترس و برای انجام تست در آزمایشگاههای بالینی مطلوب هستند زیرا بهکارگیری آنها آسانتر است، قابلیت استفاده خودکار آنها بیشتر است و تفسیر آنها نسبت به TIIF مبتنی بر الگو به مهارت کمتری نیاز دارد؛ با این حال، مطالعاتی که به ارزیابی کارایی این متدها بهعنوان ابزارهای غربالگری پرداختهاند، محدود است و همچنان کارایی بالینی آنها در غیاب تست مثبت TIIF مرتبط، برای بسیاری از آنتیبادیهای عصبی باید تأئید شود. مطالعهای بر روی آنتیبادیهای CRMP-5 (همچنین به نام CV2 نیز شناخته میشود) نشان داد که دو کیت لاین بلات تجاری پراستفاده، 7/5% بیمارانی را که با استفاده از TIIF مثبت تشخیص داده میشوند را شناسایی نمیکند که این نشاندهنده حساسیت بالینی پایینتر از حد مطلوب است؛ به علاوه، ارزش پیشبینیکننده مثبت (PPV) یک کیت لاین بلات تجاری برای آنتیبادیهای سرطانی- عصبی، ضعیف (۳۹%) گزارش شده است و اکثر نمونههای لاین بلات مثبت با استفاده از TIIF، منفی گزارش شدند. این یافتهها در کنار یکدیگر، پیشنهاد میکنند که هنگام تست آنتیبادیهای ضد آنتیژنهای نورونی داخل سلولی با استفاده از لاین بلات یا وسترن بلات به تنهایی، باید جانب احتیاط را رعایت کرد و ما توصیه میکنیم در صورت امکان این متدها بهعنوان تست تأییدی پس از مثبت شدن TIIF استفاده شوند. بهطور خاص، یک نتیجه مثبت لاین بلات یا وسترن بلات تنها باید بهعنوان یک وضعیت حساس در بیماری با علائم بالینی غیرمعمول در نظر گرفته شود و تشخیص دیگری به غیر از PNS را باید در نظر داشت.
آنتیبادیهایی که پروتئین داخل سلولی سیناپسی گلوتامیک اسید کربوکسیلاز ۶۵ (GAD65) را هدف قرار میدهند، منحصربهفرد تلقی میشوند زیرا برخلاف دیگر آنتیبادیهای ضد آنتیژنهای نورونی داخل سلولی، آنها بسیار بهندرت با یک سرطان زمینهای ارتباط دارند. آنتیبادیهای ضد GAD65 با بیماری خودایمن سیستمیک همراهی دارند و بهعنوان یک بیومارکر برای دیابت ملیتوس نوع ۱ (T1DM) عمل میکنند، در حالی که آنتیبادیهای سرطانی- عصبی عموماً در بیماران بدون PNS و یا یک سرطان زمینهای یافت نمیشوند، تیترهای پایین آنتیبادیهای ضد GAD65 میتوانند در بیش از ۸۰% افراد سالم حضور داشته باشند. بهطور کلی متدلوژیهای انجام تست GAD65 بر روی ایجاد سنجشهایی متمرکز شدهاند که برای شناسایی T1DM بهینه باشند. این بیماری با آنتیبادیهای ضد GAD65 با تیتر کم همراهی دارد و بنابراین سنجشهای رادیو ایمونوپرسیپیتاسیون (RIPA) بسیار حساسی توسعه یافتهاند که مقادیر اندک آنتیبادیهای ضد GAD65 را شناسایی میکنند. آنتیبادیهای ضد GAD65 با تیتر کم، همبستگی زیادی با بیماریهای نورولوژیک ندارند و بهعنوان یک یافته غیراختصاصی در این وضعیت بالینی در نظر گرفته میشوند. بیمارانی با خودایمنی نورولوژیک GAD65 در ابتدا به وسیله رنگآمیزی در TIIF شناسایی میشوند که با مقادیر RIPA بیش از ۱۰۰۰ برابر حد بالایی مقدار نرمال، همبستگی دارد؛ بنابراین اگرچه استفاده از RIPA برای غربالگری آنتیبادیهای ضد GAD65 در بیماران مشکوک به خودایمنی نورولوژیک، مناسب است، اما پزشکان باید توجه داشته باشند که بعید است در بیمارانی با تظاهرات عصبی، یک تست آنتیبادی GAD65 مثبت در تیتر کم از لحاظ بالینی مرتبط باشد. بسیاری از تستهای آزمایشگاهی تجاری برای آنتیبادیهای ضد GAD65، بهجای RIPA با استفاده از سنجش (الایزا) انجام میشود که معمولاً با واحدهای بینالمللی (IU) دلخواه در هر میلیلیتر گزارش میگردد (مقدار نرمال کمتر از 5 IU/mL). اگرچه همبستگی کمّی اندکی بین مقادیر الایزا و RIPA وجود دارد و بنابراین مقایسه مقادیر بین این دو سنجش توصیه نمیشود.
آنتیبادیهای ضد آنتیژنهای نورونی خارجسلولی
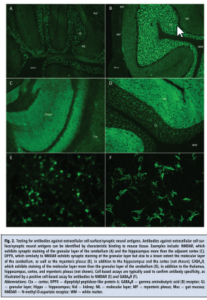
در سال ۲۰۰۸ گروههایی از ۱۰۰ بیمار توصیف شدند که یک سندرم بالینی مجزا شامل اختلالات حافظه، علائم روانی، تشنج، حرکات غیرطبیعی، بیثباتی (instability) اتونومیک، کاهش سطح هوشیاری و هایپوونتیلاسیون را نشان میدادند. بیماران غالباً زنانی در سن باروری بودند و ۵۹% آنان یک تومور، عمدتاً تراتومای تخمدان، داشتند. همه بیماران، آنتیبادیهای ضد دومین خارجسلولی زیرواحد NR1 در NMDAR داشتند که وجود آن با رنگآمیزی TIIF ثابت شد (شکل ۲). در سالهای اخیر در بیماران مبتلا به انسفالیت خودایمن، آنتیبادیهای بسیار زیادی کشف شدهاند که آنتیژنهای خارجسلولی سطح سلول یا آنتیژنهای نورونی سیناپسی را هدف قرار میدهند (جدول ۲). بیشتر آنها الگوی رنگآمیزی TIIF مشخصی دارند و سنجشهای اختصاصی آنتیژن تأییدی برای تأئید اختصاصیت آنتیبادی در دسترس هستند (شکل ۲). شناسایی آنتیبادیهای ضد پروتئینهای عصبی خارجسلولی عموماً نیازمند این است که آنتیژنهای هدف به شکل کنفورماسیون native خود بیان شوند، استفاده از سنجشهایی مانند الایزا یا وسترن بلات/ لاین بلات، به دلیل تغییر کنفورماسیونی آنتیژن طی تولید نوترکیب یا طی انجام فرایندهای فاز جامد، مناسب نیستند، بنابراین رایجترین تستهای تأییدی مورد استفاده، سنجشهای مبتنی بر سلول (CBA) هستند که اتصال آنتیبادی به سلولهای ترنسفکتشدهی بیانکننده آنتیژن به شکل native در سطح سلول را شناسایی میکنند. رایجترین کیتهای تجاری در دسترس، سلولهایی را به کار میگیرند که با سازهای که بیان آنتیژن موردنظر را موجب میشوند، ترنسفکت شده باشند. سلولها در شیشه های کوچک میکروسکوپی رشد داده میشوند و سپس با هدف ذخیرهسازی یا نفوذپذیر ساختن (permeabilization) فیکس میشوند. این سلولهای فیکسشده با سرم یا CSF بیمار انکوبه میشوند. پس از شستشو، آنتیبادی آنتیهیومن فلورسنت تجاری با سلولها انکوبه و سپس برای امتیازبندی (scoring) با میکروسکوپ مشاهده میشود. فرایند فیکس کردن یا شرایط ذخیرهسازی میتواند اثر منفی بر روی آنتیژن داشته باشد که منجر به عملکرد نامطلوب تست خواهد شد. بهعنوان یک گزینه دیگر، فرمتهای سلول زنده که نیازی به فرایند prefixation ندارند در تعداد اندکی از آزمایشگاهها در دسترس هستند. این سنجشها را میتوان به صورت کیفی زیر میکروسکوپ یا به صورت کمی با استفاده از فلوسایتومتری تفسیر کرد. در حالی که سنجشهای مبتنی بر سلول زنده در مقایسه با سنجشهای مبتنی بر سلول فیکسشده، عملکرد بالینی بهتری را نشان میدهند، به لحاظ تکنیکی چالشبرانگیزتر هستند و محدود به تعداد اندکی آزمایشگاه مرجع و مراکز دانشگاهی میباشد.
شکل 2
برخی آزمایشگاههای بالینی ممکن است برای کاهش هزینهها، بهبود زمان انجام کار و به دلیل فقدان تخصص کافی در تفسیر TIIF، تنها از سنجش مبتنی بر سلول بدون TIIF برای غربالگری این آنتیبادیها استفاده کنند که این رویکرد برخی محدودیتها را به دنبال دارد. حساسیت و اختصاصیت بالینی این روش هنگام بررسی جامع آنتیبادیهای عصبی در بیماران مشکوک به انسفالیت خودایمن، در فرایندهای روتین بالینی مورد مطالعه قرار نگرفته است. از آنجایی که در سنجشهای مبتنی بر سلول، بیان آنتیژن موردنظر بالا است، پیشبینی میشود حساسیت بالینی آنها نسبت به TIIF بالاتر باشد. این مسئله بهویژه در مورد آنتیبادیهای LGI1 و CASPR2 صادق است به گونهای که در یک مطالعه نشان داده شد که مثبت شدن رنگآمیزی TIIF در مقایسه با سنجش مبتنی بر سلول، تنها در ۴۵% و ۲۹% (به ترتیب برای LGI1 و CASPR2) بیماران رخ میدهد، با این حال همچنان زمانی که مثبت بودن نتایج آنتیبادی تنها بر اساس سنجش مبتنی بر سلول سرمی گزارش میشود، نگرانیهایی در مورد کاهش اختصاصیت بالینی وجود دارد. در مطالعهای که فنوتایپ بالینی بیماران دارای آنتیبادیهای CASPR2 را گزارش کرده است، تنها کسانی که بر اساس TIIF سرمی و سنجش مبتنی بر سلول در سرم، مثبت بودند برای شرکت در مطالعه انتخاب شدند. در بررسی ۱۰ بیمار که به دلیل مثبت نبودن TIIF سرم، از مطالعه کنار گذاشته شده بودند، تعدادی از آنها فنوتایپ تیپیک آنتیبادیهای CASPR2 مانند انسفالیت لیمبیک را نشان میدادند، اگرچه مشخص شد برخی از بیماران، تشخیص متفاوتی دارند از جمله دو مورد به بیماری کروتزفیلد جاکوب مبتلا بودند. خطاهای احتمالی ناشی از اتکای بیش از حد بر سنجش مبتنی بر سلول سرمی در مطالعه دیگری نیز برجسته شده است؛ این مطالعه نشان داد ۲۳% بیماران دارای نتیجه سنجش سلولی سرمی مثبت برای NMDAR-IgG، به احتمال بسیار کمی دچار سندرم خودایمن هستند. این یافتهها پیشنهاد میکنند که اگر سنجش سلولی سرمی به تنهایی برای تشخیص برخی آنتیبادیهای عصبی (مانند CASPR2 و NMDAR) استفاده شود، احتمال کاهش اختصاصیت بالینی وجود دارد. این مسئله بهویژه در مورد آزمایشگاههای بالینی که فاقد تجربه کافی در خواندن سنجشهای سلولی هستند، صدق میکند، زیرا ممکن است اتصال غیراختصاصی به سلولهای ترنسفکتشده به اشتباه بهعنوان نتیجه مثبت تفسیر شود. استفاده از سلولهای ترنسفکتنشده بهعنوان نمونه کنترل منفی میتوانند در شناسایی این اتصالات غیراختصاصی مفید باشند اما همه آزمایشگاهها این کنترلهای اضافی را به کار نمیگیرند. نتایج مثبت کاذب سنجش سلولی میتواند منجر به تأخیر تشخیص در بیمارانی بشود که تشخیصهای قابل درمان دیگری دارند، مانند عفونت سیستم عصبی مرکزی. در بیمارانی با نتیجه سنجش سلولی مثبت، اما تظاهرات بالینی غیرمعمولی، درخواست بررسی بیشتر سنجش سلولی برای اطمینان از اتصال اختصاصی، همبستگی بین نتایج سرم و CSF و مقایسه با سنجش دوم مانند TIIF (در صورت امکان) توصیه میشود.
جدول 2
برخی اهداف آنتیژنی خارج سلولی از اجزاء گیرندههای مشتمل بر چند زیرواحد یا کمپلکسهای کانالی هستند که در این موارد هدف آنتیژنی اصلی هنوز ناشناخته است. بیان نوترکیب این رسپتورهای چند زیرواحدی به لحاظ تکنیکی چالشبرانگیز است و بنابراین کارایی رویکردهای متدلوژیکی معمول (مانند الایزا، وسترن بلات/ لاین بلات، سنجشهای مبتنی بر سلول) را محدود میسازد. برای غلبه بر این محدودیت، روشهای RIPA ابداع شدهاند که از توکسینهای طبیعی که به کمپلکسهای گیرنده با میل ترکیبی بالا متصل میشوند، استفاده میکنند و از این طریق شناسایی آنتیبادیهایی که گیرندهها یا کانالهای بدون تغییر کنفورماسیونی را هدف قرار میدهند، ممکن میسازند. با بهرهگیری از این RIPAهای مبتنی بر توکسین، اهداف آنتیژنی نورونی (مثل رسپتور یا کانال) بهطور غیرمستقیم با اتصال توکسین نشاندار اختصاصی، نشاندار میشوند. برای به انجام رساندن این عمل، نوروتوکسین (مانند دندروتوکسین) با ید ۱۲۵ (125I) نشاندار میشود و سپس با عصارههای دترنجنت غنی از گیرنده که از بافتهای موردنظر یا ردههای سلولی بیانکننده کمپلکسهای آنتیژنی به صورت طبیعی به دست آمدهاند، انکوبه میشوند، سپس مقادیر مشخص از آنتیژن نشاندار شده با سرم یا CSF انکوبه و در ادامه آنتیبادیهای آنتیهیومن ثانویه به پرسیپیتات اضافه میشود و کمپلکسهای ایمنی با اتصال متقاطع با IgG بیمار و آنتیژن نشاندار شده شکل میگیرد. کمپلکسهای ایجادشده با سانتریفیوژ، رسوب داده میشوند. پس از شستشوی دقیق، فعالیت رادیواکتیو در پرسیپیتات با استفاده از یک گاما کانتر، اندازهگیری میشود. یکی از محدودیتهای RIPAهای مبتنی بر توکسین این است که اختصاصیت تست با این واقعیت که بیماران ممکن است دارای آنتیبادیهایی علیه جزئی از یک کمپلکس باشند که از نظر بالینی مرتبط نیست، کاهش مییابد. در مورد بیماران مبتلا به خودایمنی نورولوژیک و آنتیبادیهای ضد کانال دریچهدار ولتاژی پتاسیم (VGKC)، بهطور متقاعدکنندهای ثابت شده است که تنها یک زیرگروه از پروتئینهای آداپتور مرتبط با زیرواحدهای core، اهداف بالینی معناداری هستند. آنتیبادیهایی که زیرواحد core در VGKC را هدف قرار میدهند با هیچ سندرم نورولوژیک خاصی همبستگی ندارند، در حالی که بیماران دارای آنتیبادیهای ضد پروتئینهای آداپتور مانند LGI1 و CASPR2 با سندرمهای مجزایی همراه هستند. علیرغم اینکه برخی آزمایشگاهها ممکن است آنتیبادیهای ضد VGKC را با استفاده از RIPA بررسی کنند و سپس موارد مثبت را با سنجشهای مبتنی بر سلول برای LGI1 و CASPR2 تست کنند، حساسیت و اختصاصیت این روش کمتر از حد مطلوب است و بهتدریج از الگوریتمهای انجام تست حذف خواهد شد.
آنتیبادیهای ضد آنتیژنهای گلیال در سندرمهای بالینی مجزا: انسفالوپاتیهای منتشر حاد و مننگوانسفالومیلیت
در حالی که آنتیبادیهای ضد آنتیژنهای نورونی ابتدا در بیماران مبتلا به انسفالیت خودایمن شناسایی شدند، آنتیبادیهایی که پروتئینهای گلیال را هدف قرار میدهند اخیراً کشف شدهاند و میتوانند با سندرمهای انسفالیتیک مجزایی همراه باشند. انسفالومیلیت منتشر حاد (ADEM) یک بیماری دمیلینهکننده به واسطه سیستم ایمنی در دستگاه عصبی مرکزی است که بهطور کلاسیک با انسفالوپاتی و علائم نورولوژیک چندکانونی تظاهر میکند. تصویربرداری عصبی عموماً ضایعات دوجانبه، بزرگ و با حدود نامشخص را در ماده سفید مخ نشان میدهد. در طول دهه گذشته، دو آنتیبادی گلیال در ارتباط با ADEM شناسایی شدند: IgG ضد آکواپورین-۴ (AQP4) و IgG ضد گلیکوپروتئین اولیگودندروسیت میلین (MOG). آنتیبادیهای ضد کانال آب آستروسیتی AQP4 اولین بار در بیماری که الگوی رنگآمیزی شاخص در TIIF داشت و به نورومیلیت اپتیکا (NMO)- سندرمی که شامل التهاب عصب بینایی و یا طناب نخاعی میشود- مبتلا بود، شناسایی شد.
اگرچه در ابتدا تصور میشد تصویر مغزی نرمال یک معیار حمایتی کلیدی برای NMO است، اما بعدها مشخص شد تظاهرات شبه ADEM میتواند بهندرت در بیمارانی با خودایمنی ضد AQP4 رخ دهد که منجر به استفاده از یک اصطلاح گستردهتر تحت عنوان «اختلالات طیف نورومیلیت اپتیکا» (NMOSD) و تست کردن آنتیبادیهای AQP4 در مبتلایان به ADEM شد. اولین سنجش تجاری برای تست AQP4-IgG، الایزا بود که مشخص شد اختصاصیت بالینی قابل مقایسه و حساسیت بالینی بهتری نسبت به TIIF دارد. بعدها یک سنجش سلولی فیکسشده تجاری برای AQP4-IgG معرفی شد و یک مقایسه چندمرکزی از سنجشهای AQP4-IgG نشان داد که حساسیت بالینی بیشتری (۶۸%) در مقایسه با الایزا (60%) دارد و اختصاصیت بالینی آن، بالا است (نزدیک به ۱۰۰% برای هر دو تست)؛ به همین دلیل، برای شناسایی آنتیبادیهای AQP4، سنجش سلولی بر الایزا ارجحیت دارد. سنجشهای in-house که IgG متصلشده به سلولهای زنده بیانکننده AQP4 اگزوژن را با دستهبندی سلولی فعالشده با فلورسانــس مبتــنی بر فلوسایتومتری (CBA-FACS) یا بررسی مشاهدهای (CBA-IF) شناسایی میکنند، در مقایسه با سنجش سلولی فیکسشده تجاری، حساسیت بالینی بهبودیافتهای دارند (77-73%)، به علاوه در یک آنالیز دوتایی (paired) بین سرم و CSF، مشخص شده است سرم نسبت به CSF برای شناسایی AQP4-IgG، حساسیت بالینی بیشتری دارد؛ بنابراین اگر تست سنجش سلولی فیکسشده AQP4-IgG در یک بیمار منفی باشد اما شک به ابتلا زیاد باشد، ارسال نمونه سرم به یک آزمایشگاه مرجع که یکی از سنجشهای سلولی زنده که پیشتر ذکر شد را انجام میدهد، میتواند مفید باشد.
برخلاف آنتیبادیهای AQP4 که پس از شناسایی یک الگوی رنگآمیزی خاص در TIIF کشف شدند، موقعیت MOG در سطح خارجی غلاف میلینی باعث شده بود مدتها این تردید وجود داشته باشد که آنتیبادیهایی که MOG را هدف قرار میدهند، میتوانند در بیماریهای دمیلینهکننده دستگاه عصبی مرکزی مانند مالتیپل اسکلروزیس (MS) نقش پاتوگنومیک داشته باشند. مطالعات اولیه بر روی MOG-IgG در MS که از متدهایی مانند الایزا یا وسترن بلات برای شناسایی آنتیبادیهای احتمالی ضد اپیتوپهای پروتئین MOG دناتوره شده، بهطور گیجکنندهای متناقض بودند. با این وجود اثبات شد که اتصال آنتیبادی به MOG با کنفورماسیون native، میتواند یک بیومارکر مفید در بیماران مبتلا به بیماری دمیلینهکننده به واسطه ایمنی غیر MS، بهویژه ADEM باشد. در مطالعات بعدی با استفاده از سنجش مبتنی بر سلول برای شناسایی آنتیبادیهای ضد MOG با کنفورماسیون native، ارتباط بالینی این آنتیبادیها تأئید شد و در حال حاضر انجام تست برای MOG-IgG به وسیله سنجش سلولی در بیماران مبتلا به ADEM توصیه میشود. در حالی که ADEM شایعترین انسفالیت مرتبط با MOG-IgG- بهویژه در میان کودکان- است، اخیراً تظاهرات سربرال دیگری به غیر از ADEM نیز توصیف شدهاند. با توجه به گسترده بودن فنوتایپهای انسفالیـــت مرتبط با MOG-IgG، انتظار میرود انجام تست MOG-IgG در بیماران مشکوک به انسفالیت خودایمن افزایش یابد. همانند AQP4-IgG، بر اساس دادههای فعلی، سرم بهترین نمونه برای انجام تست MOG-IgG است؛ اگرچه موارد سرونگاتیو با MOG-IgG مثبت در نمونه CSF نیز گزارش شده است. سنجش سلولی فیکسشده تجاری برای MOG-IgG در دسترس است و در آزمایشگاههای بالینی متعددی مورد استفاده قرار میگیرد، با این حال، یک مقایسه چندمرکزی نشان داد اختصاصیت سنجش سلولی فیکسشده نسبت به سنجشهای سلولی زنده in-house انجامشده در دو آزمایشگاه مرجع، کمتر است (98/1% در برابر 100- 99/6%). به علاوه، یک مطالعه چندمرکزی دیگر بر روی سنجشهای سلولی MOG-IgG نشان داد که علیرغم همخوانی بسیار عالی سنجشهای سلولی زنده (۹۶%)، تطابق آن با سنجش سلولی فیکسشده کمتر است (۹۰%) و تخمین زده میشود که سنجش سلولی فیکسشده ممکن است ۱۰ تا ۱۵% موارد مثبت را تشخیص ندهد. سنجش سلولی MOG-IgG زنده با توجه به کارایی بالینی بهتر آن، در بیمارانی که مشخصات سندرم دمیلینهکننده مرتبط با MOG-IgG را نشان میدهند، اما نتیجه سنجش سلولی فیکسشده آنها منفی است، باید انجام شود.
برخی از بیماران مبتلا به انسفالیت ممکن است علاوه بر پارانشیم مغز، التهاب دستگاه عصبی مرکزی گستردهتری را نشان بدهند که شامل مننژ و طناب نخاعی شده و به آن مننگوانسفالومیلیت اطلاق میشود. در سال ۲۰۱۶، ۱۶ بیمار مبتلا به مننگوانسفالومیلیت شناسایی شدند که رنگآمیزی رشتهای منحصربهفردی را نشان میدادند که محدود به جمعیت آستروسیتها در TIIF میشد و مشخص گردید که با آنتیبادیهای GFAP-IgG در ارتباط است. مجموعه بزرگ بیماران برای ورود به مطالعه، باید دارای تست GFAP-IgG مثبت هم در TIIF و هم در سنجش سلولی تأییدی میبودند. با استفاده از این روش، مایع مغزی نخاعی، حساسیت بالینی بسیار بیشتری (۹۲%) نسبت به سرم (45%) دارد و بیشتر بیماران GFAP-IgG مثبت که به مننگوانسفالومیلیت مبتلا نبودند، صرفاً در تست سرمی، مثبت شده بودند و این یافتهها در کنار یکدیگر نشان میدهند که مایع مغزی نخاعی، نمونه مطلوب برای انجام تست GFAP-IgG است. در حال حاضر هیچ سنجش سلولی تجاری برای آنتیبادیهای GFAP-IgG در دسترس نیست، اما آزمایشگاههای مرجع با استفاده از سنجشهای سلولی تولیدشده به صورت in-house این تست را ارائه میدهند.
تفسیر تست آنتیبادی عصبی
ارزش پیشبینیکننده تست آنتیبادی عصبی
با توجه به چالشهایی که در شناسایی بیماران در مراحل اولیه بیماری وجود دارد، حساسیت و اختصاصیت بالینی یک تست برای پزشکان و آزمایشگاه از اهمیت بسزایی برخوردار است. ارزش پیشبینیکننده منفی (NPV) به احتمال اینکه یک بیمار با نتیجه منفی، واقعاً مبتلا به بیماری نباشد، اشاره دارد. ارزش پیشبینیکننده مثبت (PPV) به احتمال اینکه بیماری با نتیجه مثبت، واقعاً به بیماری مبتلا باشد، گفته میشود. در حالی که حساسیت و اختصاصیت بالینی، از ویژگیهای ذاتی یک سنجش میباشند اما ارزش پیشبینیکننده تحت تأثیر شیوع بیماری در جمعیت مورد سنجش قرار میگیرد. NPV یک تست، با کاهش شیوع بیماری در جمعیت مورد تست، افزایش مییابد؛ بنابراین NPV تست آنتیبادی عصبی در انسفالیت خودایمن از نادر بودن این بیماری بهره میبرد و به همین دلیل اکثریت نمونههای تستشده واقعاً منفی هستند. نگرانی بیشتری در مورد PPV این تست وجود دارد که با کاهش شیوع بیماری در جمعیت مورد سنجش، کاهش مییابد. پیشرفتهای چشمگیر در کشف آنتیبادیهای عصبی، فنوتیپهای بالینی گزارششده از انسفالیت خودایمن را گسترش داده است. این مسئله به موازات دسترسی بیشتر به تستها، به درخواست مکرر تست آنتیبادی عصبی در بیمارانی با طیف گستردهای از علائم عصبی منجر شده است. یک مطالعه گذشتهنگر بر روی تست آنتیبادی عصبی در یک بازه زمانی یک ساله نشان داد که یک سوم تستهای انجامشده در مؤسسات نویسندگان مقاله، غیرضروری یا بهندرت ضروری بودند و این نشاندهنده احتمال درخواست غیرضروری برای انجام تست است. اجتناب از انجام تست آنتیبادی عصبی در بیمارانی با احتمال بسیار کم مبتلا بودن به انسفالیت خودایمن، بسیار حیاتی است، زیرا اگر تست در جمعیتی با شیوع کم انجام شود، حتی یک تست با اختصاصیت بالینی بسیار خوب هم ممکن است نرخ مثبت کاذب بالایی داشته باشد. درخواست منطقی برای انجام تست با استفاده از مدلهای پیشبینیکننده مانند امتیازدهی APE2 به حفظ PPV بالای تست آنتیبادی عصبی کمک میکند.
تیتر آنتیبادی عصبی و seropositivity پایدار بهعنوان پیشبینیکننده بیماری
در حالی که دوگانه (binary) حضور یا عدم حضور یک آنتیبادی عصبی معمولاً بیشترین ارتباط را با تشخیص انسفالیت خودایمن دارد، بسیاری از آزمایشگاههای بالینی در کنار نتیجه مثبت، تیتر آنتیبادی را نیز گزارش میکنند. بهطور کلی بالا بودن تیتر آنتیبادی با اختصاصیت بالینی افزایشیافته در مقایسه با پایین بودن تیتر آنتیبادی همراهی دارد، اگرچه شدت این همبستگی بین متدها و آنتیبادیهای مختلف متفاوت است. آنتیبادیهای ضد پروتئینهای نورونی داخل سلولی عموماً پاتوژنیک در نظر گرفته نمیشوند و تیترهای آنتیبادی با فعالیت بیماری نورولوژیک، همبستگی مناسبی ندارند. به این دلیل، بررسی و پیگیری تیترهای آنتیبادی برای پایش پاسخ به درمان نورولوژیکال، ضروری نیست. آنتیبادیهای ضد پروتئین داخل سلولی سیناپسی GAD65 تنها در تیترهای بالا با تظاهرات نورولوژیک همراه هستند و در بیمارانی با خودایمنی نورولوژیکال GAD65 اثباتشده، پیگیری تیتر آنتیبادی در طول دوره بیماری موردنیاز نیست.
در مقابل، آنتیبادیهای ضد آنتیژنهای عصبی خارجسلولی، پتانسیل پاتوژنیک دارند و بنابراین منطقاً میتوان گفت تیترهای این آنتیبادیها میتوانند در پیشبینی وضعیت بیماری نقش ایفا کنند. با در نظر داشتن این نکته، یک مطالعه مشاهدهای نشان داد که تیترهای بالاتر NMDAR-IgG در سرم و CSF، با پیامد بالینی ضعیف همراه هستند و افزایش تیتر آنتیبادی در CSF با عود بالینی بیماری همبستگی دارد؛ بنابراین، به لحاظ تئوری، مستند ساختن تیتر NMDAR-IgG در CSF پس از بهبودی میتواند ارزشمند باشد؛ زیرا افزایش در تیتر ممکن است یک مدرک کمکی مبنی بر عود بیماری در آینده باشد. اگرچه به لحاظ عملی، انجام پونکسیون کمری برای جمعآوری CSF در بیمارانی که پیشتر از انسفالیت خودایمن بهبود یافتهاند، معمول نیست و پزشکان عموماً به صورت بالینی علائم عود بیماری را پایش میکنند. این رویکرد با مطالعه گروه ۵۷۷ نفری بیماران مبتلا به انسفالیت ناشی از آنتیبادی NMDAR حمایت میشود که در این مطالعه تصمیمات درمانی بیماران بر اساس علائم بالینی– و نه تیتر آنتیبادی- اتخاذ شده بود و در بیمارانی که به مدت ۲۴ ماه پیگیری شدند، ۸۱% بهبودی مناسبی طی ۲ سال داشتند؛ بنابراین اگرچه تیترهای برخی آنتیبادیهای عصبی ضد آنتیژنهای نورونی خارج سلولی میتواند با فعالیت بیماری همبستگی داشته باشد، اما دادههای آیندهنگر برای تعیین نقش آنها در مدیریت بیماری، موردنیاز است.
مثبت بودن آنتیبادی، مستقل از تیتر آن و فارغ از پیامد بالینی بیماری، عموماً در بیماران مبتلا به انسفالیت خودایمن، پایدار است، به همین دلیل، تکرار تست آنتیبادی عصبی با هدف مستندسازی منفی شدن سرولوژیک آنها در بیماران انسفالیت خودایمن درمانشده عموماً ضرورتی ندارد. یک مورد استثنا، میتواند تکرار تست MOG در بیماران مبتلا به ADEM مرتبط با MOG-IgG باشد. در یک مطالعه کوهورت بر روی ۲۵ بیمار با تشخیص اولیه ADEMA و شناسایی MOG-IgG از طریق CBA-FACS، نرخ عود بیماری در بیمارانی با seropositivity پایدار ۸۸% و در بیمارانی با seropositivity موقت، تنها ۱۲% است؛ بنابراین تکرار تست MOG-IgG برای بررسی seropositivity پایدار در بیماران مبتلا به ADEM میتواند ارزشمند باشد، اگرچه دادههای آیندهنگر برای تعیین نقش وضعیت سرمی MOG-IgG وجود ندارد.
چالشهای پیش رو برای آزمایشگاههای بالینی
با توجه به رشد سریع تقاضا برای تستهای آنتیبادیهای عصبی، رشد پرشتاب کشف بیومارکرهای آنتیبادی جدید و افزایش تعداد آزمایشگاههای ارائهدهنده این تستها، نیاز روزافزون به بهبود و ارزیابی کیفیت آنها در آزمایشگاهها وجود دارد. مهارت آزماییها Proficiency testing تقریباً بهطورمطلق، از ارزیابی عملکرد دیگری استفاده میکند که عموماً تست داخلی کور را به کار میگیرد زیرا محصولات قابل فروش بهطور گسترده در دسترس نیستند. تا به امروز مطالعات مهارت آزمایی محدودی در میان آزمایشگاهها انجام شده است. این مطالعات انجامشده در شناسایی متدلوژیهای گیجکننده یا نشان دادن نیاز به ارتقاء استانداردسازی و کیفیت، مثمر ثمر بودهاند. انجام تست آنتیبادیهای عصبی همچنان بر روی شناسایی الگوی اتصال آنتیبادی بر روی بافت مغز با استفاده از TIIF متمرکز شده است؛ تاکنون استانداردهای مرجع اتوآنتیبادیهای عصبی یا تلاشهای متمرکزی برای استاندارد ساختن متدلوژی تستها در آزمایشگاهها وجود نداشته است. همانند وضعیت فعلی تست آنتیبادی عصبی، متدلوژیهای IIF آنتیبادیهای ضد هستهای (ANA) و نامگذاری الگو، با استانداردسازیهای ضعیف شروع به کار کردند اما با توسعه معرفهای مرجع اتوآنتیبادی، ارتقاء چشمگیری در استانداردسازی متدها، آموزش تفسیر و کیفیت در تست ANA رخ داده است. اتخاذ یک رویکرد مشابه در ارتباط با تست آنتیبادی عصبی میتواند به ارتقاء عملکرد تست بین آزمایشگاهها و در نهایت ارتقاء مدیریت بیمار منجر شود.
نتیجهگیری
در دهههای اخیر، آنتیبادیهای عصبی بهعنوان بیومارکرهای سودمندی در انسفالیت خودایمن شناخته شدند. با شکلگیری سنجشهای تجاری برای شناسایی این آنتیبادیها، آزمایشگاههای بالینی قادر به ارائه تست آنتیبادی هستند. در حالی که دسترسی بیشتر به ارزیابی آنتیبادی عصبی امکان کاهش زمان انجام و تسریع تشخیص بیمار را فراهم ساخته است، در نظر گرفتن پیچیدگیهای این تست قبل از ارائه تست ضروری است. ارزش پنلهای آنتیبادی عصبی تهیهشده برای یک سندرم بالینی، اهمیت سنجشهای متناسب با آنتیبادی عصبی هدف و درک چگونگی بهکارگیری این تست در آزمایشگاه بالینی، همگی به آزمایشگاههای بالینی مرتبط هستند. از همه مهمتر اینکه تست آنتیبادی عصبی باید با توجه به وضعیت بیمار تفسیر شود؛ استفاده از امتیازهای بالینی برای پیشبینی مثبت بودن بیمار به تصمیمگیری برای درخواست تست کمک میکند، در حالی که همبستگی نتیجه مثبت با تظاهرات بیمار در تعیین ارتباط بالینی کمککننده است؛ بنابراین ارتباط نزدیک بین آزمایشگاه بالینی و پزشک تجویزکننده تست برای به انجام تست آنتیبادی عصبی، ضروری است.
Nonstandard Abbreviations: ADEM, acute disseminated encephalomyelitis;
AE, autoimmune encephalitis; ANNA-1, Type 1 antineuronal
nuclear antibody; APE2, Antibody Prevalence in Epilepsy
and Encephalopathy; AQP4, aquaporin-4; CASPR2, contactinassociated
protein-like 2; CBA, cell-based assay; CRMP-5, collapsin
response-mediator protein 5; CSF, cerebrospinal fluid; ELISA,
enzyme-linked immunosorbent assay; GAD65, glutamic acid ecarboxylase
65; GFAP, glial fibrillary acidic protein; IgG, immunoglobulin
G; LB, line blot; LGI1, leucine-rich glioma-inactivated 1
(antibodies); MOG, myelin oligodendrocyte glycoprotein; NMDAR,
N-methyl-D-aspartate receptor; NMO, neuromyelitis optica; NPV,
negative predictive value; PNS, paraneoplastic neurological syndrome;
PPV, positive predictive value; RIPA, radio-immunoprecipitation assay;
T1DM, Type 1 diabetes mellitus; TIIF, tissue-based indirect immunofluorescence; VGKC, voltage gated potassium channel; WB,
Western blot.
برگردان از:
Neural Antibody Testing in Patients with Suspected Autoimmune Encephalitis
Clinical Chemistry 00:0 (2020)
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام