مروری تازه بر باسیلهای گرم منفی
(انتروباکتریاسه- قسمت اول)
دكتر رضا ميرنژاد (استاد دانشگاه)
مقدمه:
انتروباکتریاسهها (Enterobacteriaceae) شایعترین گروه باسیلهای گرم منفی هستند که در آزمایشگاههای کلینیکی کشت داده میشوند. این باکتریها گروه بزرگ و ناهمگوني هستند كه محل زندگي طبيعي آنها روده انسان و حيوانات است و قدرت بیماریزایی در انسان، حیوانات و گیاهان را دارند. اين خانواده از جنسهاي زيادي از جمله
Budvicia, Buttiauxella, Cedecea, Citrobacter, Edwardsiella, Enterobacter, Escherichia, Ewingella, Hafnia, Klebsiella, Kluyvera, Leclercia, Leminorella, Moellerella, Morganella, Obesumbacterium, Pragia, Pantoea, Photorhabdus, Proteus, Providencia, Rahnella, Salmonella, Serratia, Shigella, Tatumella, Trabulsiella, Xenorhabdus, Yersinia, and Yokenella
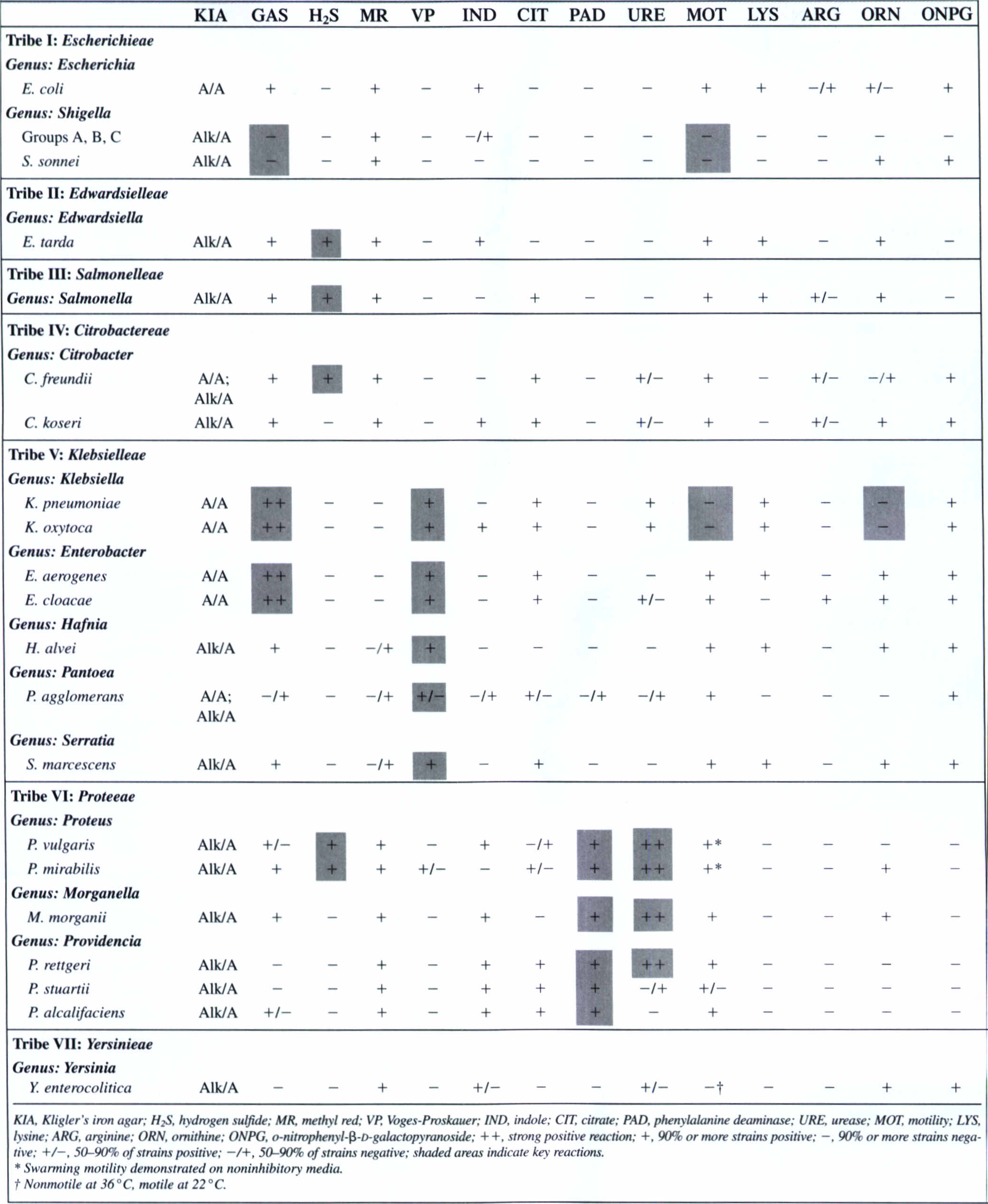
تشکیل شده است که مهمترین آنها اشريشيا، شيگلا، سالمونلا، انتروباكتر، كلبسيلا، سراشيا، پروتئوس، اروينيا، سيتروباكتر، پروويدنشيا، مورگانلا و يرسينيا است که طبق طبقهبندی CDC در تیرههای مختلف قرار میگیرند (جدول 1). بعضي از آنها فرصتطلب هستند و بعضي مانند سالمونلا و شيگلا هميشه براي انسان بيماريزا هستند (جدول 2). اين ارگانيسمها بخش اصلي بيهوازيهاي اختياري موجود در روده بزرگ را تشکیل میدهند. اگرچه در مقايسه با بيهوازيهاي اختياري مانند باكتروئيدسها نسبت كمي را تشكيل ميدهند، ولی آنها در میان شایعترین باکتریهای ایجادکننده بیماری در کنار استافیلوکوکها و استرپتوکوکها قرار دارند. اين باكتريها باسيلهاي گرم منفي بدون اسپور با اندازهای حدود 0/2 تا 0/5میکرومتر پهنا و 2 تا 4 میکرومتر درازا هستند.
اكثر آنها متحرك و داراي فلاژل پريتريش (بهجز tatumella كه فلاژل قطبي دارد)، كاتالاز مثبت (بهجز xenorhabdus و تیپ 1 شیگلا دیسانتری كه منفي است) و اكسيداز منفياند (بهجز پلزیوموناس که اکسیداز مثبت بوده و جدیداً جزو انتروباکتریاسه آ طبقهبندی میگردند). پيلي در اكثر آنها وجود دارد و داراي متابوليسم تنفسي و تخميري هستند. هالوفيليك نيستند، اكثر آنها گلوكز را تخمير نموده و اسيد و گاز بوجود ميآورند (بهجز اروينيا، يرسينيا و شيگلا) و نيترات را به نيتريت تبديل مينمايند (بهجز اروینیا و بعضی یرسینیاها). درصد مولكول G+C در DNA آنها بين 38 تا 60 درصد است و بهاستثناء اروينيا همگي داراي آنتيژن مشترك انتروباكترياسه هستند.
انتروباکتریاسه روی محیطهای کشت معمولی آزمایشگاه رشد میکنند و قدرت تولید اسید از گلوکز را دارند. شکل تیپیک این باکتریها در رشد بر روی محیطهای جامد آزمایشگاهی دیده میشود، اما شکل این باکتریها در نمونههای کلینیکی بسیار متنوع است. در کلبسیلا کپسولها بزرگ و منظم هستند، چیزی که در انتروباکتر کوچکتر بوده و در سایر انواع بندرت دیده میشود.
این باکتریها در خارج از محیط روده مثلاً در زخم، گوش، مایع نخاع و غیره میتوانند بیماریزا تلقی شوند، اما پاتوژنهای رودهای این خانواده به سالمونلا، شیگلا، یرسینیا و بعضی از سوشهای اشریشیا محدود میشوند، لذا در آزمایش مدفوع میبایست صرفاً به دنبال پاتوژنهای مذکور گشت و آنها را تعیین هویت نمود.
در عفونتهای خارج رودهای هم تعیین هویت باکتریهای این خانواده از نظر بالینی (از نظر بررسی اپیدمیولوژیکی و دیگری شیوه درمان بر اساس الگوی مقاومت هر باکتری تا زمانی که آنتیبیوگرام آن مشخص گردد) تا حدی میتواند اهمیت داشته باشد. گرچه معمولاً آنتیبیوگرام زودتر از تعیین هویت مشخص میگردد، ولی باید متذکر شد که الگوی حساسیت دارویی در گونههای مختلف نسبی بوده و با گسترش روزافزون مقاومت دارویی قابل اعتماد نیست، مضافاً بر اینکه الگوهای مذکور در کشور ما مورد مطالعه و بررسی جدی قرار نگرفته و معلوم نیست با کشورهای غربی در تطابق باشد. نکته شایان ذکر این است که باکتریهای این خانواده از تمام عفونتهای کلینیکی بهجز عفونتهای مقاربتی جدا میشوند.
این باکتریها بیماریهایی مانند گاستروانتریت، حصبه، اسهال خونی، سندرم اورمی همولیتیک، سپتیسمی، باکتریمی، اندوکاردیت و غیره را سبب میشوند. در عفونت ادراری مهمترین انتروباکتریاسهها گونههای اشریشا کلی، پروتئوس میرابلیس، کلبسیلا پنومونیه و کلبسیلا اکسیتوکا هستند. مهمترین عامل پنومونی، کلبسیلا پنومونیه بوده و باکتریمی بیشتر توسط اشریشیا کلی، کلبسیلا پنومونیه، گونههای انتروباکتر و پروتئوس میرابلیس رخ میدهد. عفونتهای کسبشده از بیمارستان اغلب توسط سیتروباکتر، انتروباکتر و سراشیا منتقل میگردد. کالیماتوباکتریوم گرانولوماتیس و کلبسیلا گرانولوماتیس دو گونه از خانواده انتروباکتریاسه هستند که از طریق جنسی انتقال مییابند.
جدول 1: تیرهها و جنسهاي خانواده انتروباكترياسه
طايفه I: اشريشيه
اشریشیا
شيگلا
طايفه II: ادواردسيلائه
ادواردسيلا
طايفه III: سالمونلائه
سالمونلا
طايفه IV: سيتروباكتريائه
سيتروباكتر
طايفه V: كلبسيلائه
انتروباكتر
هافنيا
كلبسيلا
پانتوآ
سراشيا
طايفه VI: پروتئه
مورگانلا
پروتئوس
پروويدنشيا
طايفه VII: يرسينيئه
يرسينيا
طايفه VIII: ايروينيه
ايروينيا
الگوی طبقهبندی که در سال 1985 توسط CDC ارائه شده اشریشیا و شیگلا را در یک جنس اشریشیا- شیگلا قرار داده است.
جدول 2: جنس و گونههای خانوادهی انتروباکتریاسه که در انسان قدرت کلونیزاسیون دارند و در ارتباط با بیماری هستند
كشت و شناسايي باكتريهاي رودهاي و خارج رودهای
باكتريهاي فرصتطلب رودهاي اغلب بهصورت فلور نرمال وجود دارند، بنابراين میتوان آنها را از نمونههاي دستگاه گوارش (نظير نمونه مدفوع يا سواب ركتال) جدا كرد كه اهميت زيادي ندارد، البته هنگامي كه ارگانيسمهاي مهاجم رودهاي خصوصاً سالمونلا، شيگلا و يرسينيا در اين نمونهها وجود داشته باشند بهعنوان عامل بيماريزايي محسوب میشوند.
جمعآوري و انتقال نمونه مدفوع
نمونه مدفوع در ظروف پلاستيكي دهانگشاد جمعآوري ميگردد و چنين نمونهاي بايد حداكثر تا يك ساعت مورد آزمايش قرار گيرد (زيرا ميكروارگانيسمهاي پاتوژن به تغيير pH كه در اثر مصرف تركيبات توسط فلور نرمال حاصل ميشود و سایر تغییرات حساساند).
اگر فاصله نمونهبرداري تا كشت نياز به 2 تا 3 ساعت تأخير دارد، بايد نمونه را بر روي محيطهاي ترانسپورت (Transport) مانند Amies ,Stuart ,Cary & blair و Buffered glycerol-saline كشت نمود.
نکته 1: چنانچه فاصلة محل نمونهبرداري تا آزمايشگاه زياد بود، بهتر است از محيط Cary & blair يا بافر فسفات استفاده شود.
نکته 2: براي جداسازي شيگلاها بافر فسفات بهتر از Cary& blair است.
نکته 3: چنانچه بيمار قادر به تهيه نمونه نباشد از روش سواب رکتال که نسبت به برداشت مدفوع به روش معمول ارزش كمتري دارد، استفاده ميشود. هرچند که در اینگونه موارد روش دیگر مانند Proctoscopy كه از درون ركتوم و بالاتر برداشت ميگردد قابلاطمینانتر از روش برداشت از سواب رکتال است.
آزمايش مستقيم مدفوع
ابتدا يك لام مستقيم به طريق قطره مرطوب (Wet mount) تهيه ميگردد و در اين موارد از قسمتهاي بلغـــــمدار (موكوس) و حاوي خون برداشت گرديده و با سرم فيزيولوژي رقيق ميگردد و به آن يك قطره متيلنبلو نيز اضافه مينمايند و همچنين جداگانه يك نمونه را با لوگل رقيق مينمايند. در اینگونه موارد مشاهده گلبولهای سفید (W.B.C)، حضور ارگانيسمهاي پاتوژن را نشان ميدهد (مخصوصاً در مورد شيگلا). از روشهاي ميكروسكوپ فلورسنت با آنتيبادي نشاندار نيز جهت بررسي پاتوژن مدفوعي استفاده ميشود. اگرچه در مورد مسموميت سالمونلايي و بعضي از اشریشیاها محدوديت وجود دارد.
جداسازي پاتوژنهاي رودهاي
سالمونلا و شيگلا در طي مرحله حاد بيماري (سه روز اول) جدا ميگردند، ازاینرو كشت مدفوع بايد در روزهاي اوليه بیماری انجام گيرد. براي كشت مدفوع بايد از قسمتهاي بلغمدار برداشت نموده و بر روي محيطهاي مختلف كشت داده شود (جدول 3). به دليل اینکه باكترهاي كومنسال خيلي سريع رشد ميكنند، ازاینرو از محيطهاي اختصاصي استفاده ميشود تا از رشدشان جلوگيري گردد. حداقل محیطهای لازم جهت کشت روتین مدفوع مکانگی آگار و EMB (جهت ایزوله کردن اولیه تمام گونههای باسیلهای گرم منفی رودهای)، HE و XLD (جهت جداسازی سالمونلاها و شیگلاها) و محیطهای غنی مانند GN یا سلنیت F است. در مورد سلنیت F باید توجه شود که بعد از 12-8 ساعت روی محیط HE سابکالچر گردد. اگرGN استفاده میشود، بایستی بعد از 4 ساعت روی محیط HE ساب کالچر شود.
لازم بذکر است که در بیشتر آزمایشگاههای کلینیکی بهطور روتین روی سلنیتF و GN کشت نمیدهند. بعد از اين مراحل ابتدایی، پليتها بمدت 24 تا 48 ساعت در 37 درجه سلسیوس انكوبه میشوند، سپس از كلني، رنگآميزي گرم شده و در صورت احتياج، براي جداسازي بهصورت استریل كشت داده شده و توسط تعدادي از تستهاي بيوشيميايي تشخيص داده میشوند. تستهاي بيوشيميايي تقریباً هميشه با استفاده از كيتهاي تجارتي موجود براي تشخيص خصوصياتي نظير تخمير كربوهيدرات، تجزيه سيترات، دكربوكسيلاسيون ليزين، اورنيتين و آرژينين، توليد سولفيد هيدروژن، توليد ايندول از تريپتوفان، حركت، تجزيه ارتونيتروفنيل b- D گالاكتوپيرانوزيد (ONPG)، توليد فنيلآلانين دآميناز و فعاليت ووگس– پروسكوئر (توليد استوئين) انجام میشود. امروزه از تکنیکهای پیشرفته مانند تکنیک MaldiTof جهت شناسایی و تشخیص دقیق انتروباکتریاسهها استفاده میکنند.
جداسازي پاتوژنهاي خارج رودهاي
خون، اگزوداي زخم يا ساير نمونههايي كه از محلهايي به غير از دستگاه گوارش جمعآوري میشوند ممكن است داراي ارگانيسمهاي فرصتطلب انتریک باشند كه عامل عفونتهاي انساني میشوند. اين نمونهها بايد بر روي 2 پليت آگار يعني يك بلادآگار و يك مكانگي آگار يا EMB آگار و SS آگار كشت داده شوند. در مرحله بعد با مشاهده باسیلهای گرم منفی، کاتالاز مثبت و اکسیداز منفی با انجام تستهای بیوشیمیایی تشخیص قطعی داده میشود.
نکته 1: امروزه از محیطهای نووبیوسین بریلیانت گرین گلوکز آگار (NBG) و نووبیوسین بریلیانت گرین گلیسرول لاکتوز آگار (NBGL) جهت جداسازی اولیه سالمونلا از مدفوع استفاده میشود.
نکته 2: باكتريهاي لاكـتــوز مثبت، كلني صورتي رنگ و باكتريهاي لاکتوز منفي، كلني بيرنگ ايجاد ميكنند.
نکته 3: باید توجه شود که محيط SS در مواردي از رشد شیگلا جلوگيري ميكند.
نکته 4: ميزان مدفوعی كه به محيط كشت افزوده ميگردد به نسبت یکدهم است.
نکته 5: تمام محیطها پس از 24 ساعت بررسي ميشوند (بهاستثناء بيسموت– سولفیت آگار كه 48 ساعته مورد مطالعه قرار میگیرد).
نكته 6: محيطهاي XLD و هکتون انتریک آگار (HE) حاوي تيوسولفات سديم و سيترات آمونيم فريك هستند و ميتوان روی آنها تولید H2S را بررسي نمود.
نکته 7: CDC توصیه میکند که همه آزمایشگاهها باید نمونههای مدفوع را از نظر حضور شیگا توکسین تیپ I و II که توسط اشریشیا کلی هموراژیک O157 و سایر سروتیپها تولید میشوند، مورد بررسی قرار دهند.
در مورد برخی از باکتریها پس از بررسي مشخصات كلني باكتري رشد نموده بر روي محيطهاي ذکرشده و واكنشهاي ایجادشده، تشخيص احتمالي صورت ميگيرد؛ مثلاً با مشاهده كلنيهاي سبز درخشان بر روي محيط EMB مظنون به E.coli شده و يا ديدن كلنيهاي درشت، موكوئيدی و قوامدار احتمال كلبسيلا بودن را افزايش ميدهد. یرسینیا انتروکولیتیکا روی محیط Cefsulodinirgasan-novobiocin (CIN)کلنی bull’s-eyes با مرکز قرمز رنگ و حاشیه شفاف ایجاد میکند. داشتن حرکت سوارمینگ روی محیط بلاد آگار از ویژگیهای پروتئوسها است. سراشیا مارسیسنس کلنیهای با پیگمانت قرمز تولید میکند.
چنانچه بتوان با تستهاي ذکرشده، باكتري مجهول را تشخيص قطعي داد، تست تعيين حساسيت آنها به آنتیبیوتیکها را بهعمل آورده و جواب آزمايش جهت درمان به پزشك معالج ارسال ميگردد. در غير اين صورت بهوسیله تستهاي سرولوژيكی با استفاده از آنتيسرمهاي پلي و منوكلونال علیه باكتري بدستآمده (در مورد E.coli، شيگلا، سالمونلا…) تشخيص قطعي صورت ميگيرد. همچنین بهوسیله آزمايش بر روي حيوانات حساس، بيماريزايي آنها مسلم ميگردد مانندEIEC و شیگلا.
جدول 3: خصوصيات محيطهاي كشت انتخابي براي انتروباكترياسه
| محیط کشت | عامل باکتریواستاتیک علیه گرم مثبتها | قند محیط | اندیکاتور محیط | تخمیرکنندههای سریع لاکتوز | تخمیرکنندههای آهسته لاکتوز | غیرتخمیرکنندهها | نوع |
| ائوزین متیلنبلو آگار (EMB) | ائوزین Y و متیلنبلو | لاکتوز و سوکروز* | ائوزین Y | کلنیهای سبز-سیاه با جلای فلزی | کلنیهای بنفش در 24 تا 48 ساعت | کلنیهای شفاف | انتخابی (S)، افتراقی (D) |
| هکتون انتریک آگار (HE) | نمکهای صفراوی | لاکتوز، سوکروز و سالیسین | برموتیمول بلو | ممانعت نسبی از رشد؛ نارنجی روشن یا کمرنگ | ممانعت نسبی از رشد؛ نارنجی روشن یا کمرنگ | سبز (شیگلا)، سبز-آبی با مرکز سیاه (سالمونلا) | انتخابی (S)، افتراقی (D) |
| مکانگی آگار (MC) | کریستال ویوله و نمکهای صفراوی | لاکتوز | نوترال رد | کلنیهای قرمز | کلنیهای صورتی با هاله کهربایی. | شفاف بعد از 24 تا 48 ساعت | انتخابی (S)، افتراقی (D) |
| گزیلوز- لیزین دیکربوکسیلاز (XLD) | نمک صفراوی | گزیلوز، لاکتوز و سوکروز | فنل رد | کلنیهای زرد | کلنی زرد | کلنیهای قرمز | انتخابی (S)، افتراقی (D) |
| سالمونلا-شیگلا آگار (SS) | نمک صفراوی | لاکتوز | نوترال رد | کلنیهای قرمز | کلنیهای قرمز | شفاف (شیگلا)؛ شفاف با مرکز سیاه (سالمونلا) | انتخابی (S) |
| بیسموت سولفیت (BS) | برلیانت گرین | گلوکز | بیسموت سولفیت | ** | ** | ** | انتخابی (S) |
* در فرمولاسیون لوینز (levine’s) در محیط EMB تنها لاکتوز وجود دارد.
** سالمونلاهای تولیدکننده H2S کلنیهای سیاه ایجاد میکنند. این یک محیط انتخابی برای جنس سالمونلا است.
بررسی واکنشها
كشت روي محيط كليگلرآيرون آگار (KIA) و يا TSI
هر دو محیط حاوي پـــپتون، كلرورسديم، لاكتوز، گلوكز، يك منبع گوگرد (تيوسولفات سديم)، معرف آهندار (فريك آمونيم سيترات)، معرف فنلرد و آگار هستند. در آنها ميزان لاكتوز ده برابر گلوكز است. برای کشت با آنس استريل، از كلني باكتريهاي مجهول برداشت نموده و ابتدا در قسمت عمق و سپس در سطح شيبدار محیط بهصورت خطوط زيگــــــــــزاك كشت داده میشود. در اين محيطها، تخمير كربوهيدراتهاي گلوكز، لاكتوز، توليد گاز (H2, Co2) و سولفید هيدروژن (H2S) بررسي ميشوند. باكتريهايي كه گلوكز را استفاده مينمايند، اسيد توليد كرده و رنگ محيط را از قرمز به زرد تبديل ميكنند.
چون طي استفاده از گلوكز، اسيد ايجادشده در عمق لوله بيشتر از اسيد ايجادشده در سطح است و بعضی ارگانيسمها از دكربوكسيلاسيون اكسيداتيو، پپتونهاي سطح محيط، تركيبات قليايي ايجاد مينمايند، مقادير كم اسيد ایجادشده در سطح را خنثي نموده، ولی چون قادر به خنثي نمودن مقادير زياد اسيد در عمق لوله نيستند، در نتيجه بعد از انكوباسيون 24 ساعته، رنگ قرمز در سطح و رنگ زرد در ته لوله نمايانگر تخمير گلوكز و عدم تخمير لاكتوز است. باكتريهايي كه علاوه بر گلوكز، لاكتوز را نيز مورد استفاده قرار دهند، مقادير زيادي از اسيد در سطح ايجاد ميكنند كه بهوسیله محصولات قليايي حاصل از پپتونها خنثي نميگردد، در نتيجه سطح و ته لوله هر دو به رنگ زرد باقـــــــي ميماند. توليد گاز (H2, CO2) بهصورت شكاف يا حباب و توليد H2Sبهصورت رسوب سیاهرنگ در ته لوله مشخص ميگردد (شکل 1).
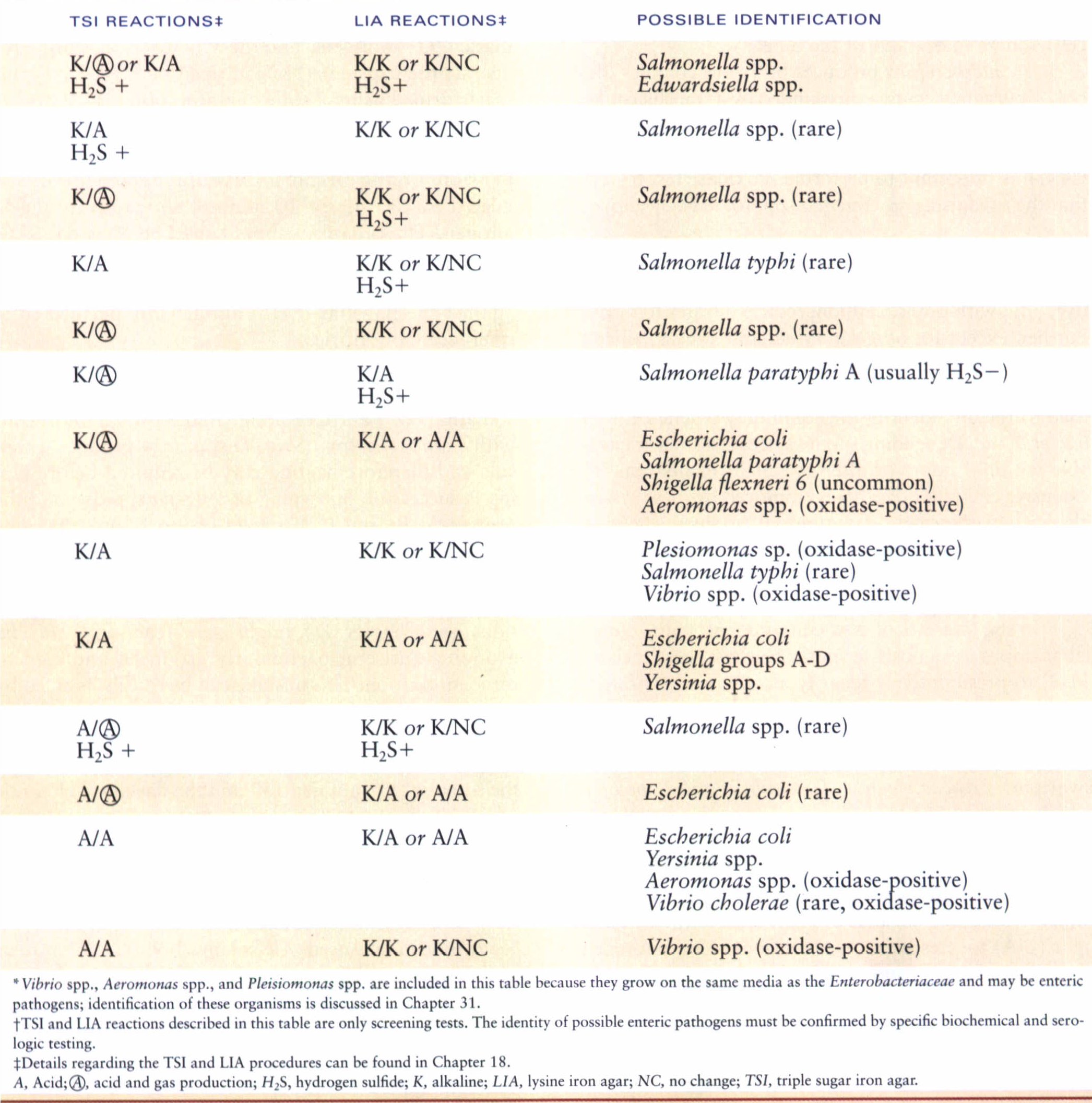
لازم به یادآوری است که محيط TSI علاوه بر دو قند گلوكز و لاكتوز حاوي قند سوكروز است، ازاینرو در مورد باکتریهایی كه قادر به تخمير لاكتوز و سوكروز نیستند واكنش مانند محيط KIA نشان میدهند، در صورتي كه باكتريهايی لاكتوز منفي ولي سوكروز مثبت باشند نتیجه بهصورت كاذب، لاكتوز مثبت نشان ميدهند. در جدول 4 تفسیر مختلف از محیط KIA نشان داده شده است و در جدول 5 واکنشهای ایجادشده روی محیطهای TSI و LIA جهت اسکرین انتروباکتریاسههای بیماریزا در آزمایشگاه بالینی نشان داده شده است.
نکته: برای جلوگیری از مشاهده لاکتوز مثبت کاذب، بهتر است بجای استفاده از محیط TSI از محيط KIA استفاده گردد (بهخصوص در مورد باکتریهای سوکروز مثبت مانند ويبريو و يرسينيا)
جدول 4: تفسير محيط KIA
|
تخمير گلوكز و لاكتوز glucose and lactose fermented |
اسيد در عمق، اسيد در سطح
Acid slant / Acid butt |
زرد، زرد Yellow / Yellow |
|
تخمير گلوكز glucose fermented |
اسيد در عمق، قليا در سطح
Alkaline slant / Acid butt |
زرد، قرمز Red / Yellow |
|
عدم تخمير گلوكز و لاكتوز Glucose and lactose not fermented |
قليا در عمق، قليا در سطح
Alkaline slant / Alkaline butt |
قرمز، قرمز Red / Red |
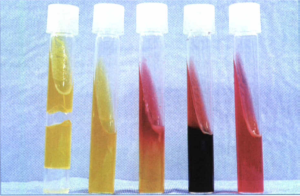
شکل 1: الگوهای واکنشهای مختلف روی محیط KIA
جدول 5: واکنشهای TSI و LIA مورد استفاده جهت اسکرین انتروباکتریاسههای بیماریزا در آزمایشگاه بالینی
آزمايش متيلرد MR))
اين آزمايش اولين بار توسط كلاركclark) ) و لابز (Labs) توصيف شد. براي بررسي اين تست، باكتري موردنظر را در محيط كلارك و لابز (MR-VP) كشت داده و بعد از 48 ساعت به آن به ازای هر يك ميليليتر از محيط، يك قطره معرف تازه متيلرد ميافزايند. چنانچه pH محيط كمتر از 4/4 باشد رنگ قرمز ظاهر ميشود و نشانه مثبت بودن آزمايش (تخمير اسيدي مخلوط) است. درصورتیکهpH بالاتر از 5 باشد، رنگ محيط زرد ميشود که نشانه منفي بودن و احتمالاً واكنش تخمير بوتيلن (الكلي) است. براي بدست آوردن نتيجه بهتر، محيط كشت را براي مدت 5 روز در 30 درجه سلسیوس قرار ميدهند. لازم بهذکر است که محيط MR-VP حاوي قند گلوكز و فسفات است و در راه تخمير اسيدي مخلوط، انواع اسيدهاي لاكتيك، استيك، فرميك، سوكسينيك و الكل اتانول توليد ميشود (شکل 2).
نکته 1: برای تهیه معرف متیلرد، 0/1 گرم متیلرد را در 300 میلیلیتر اتانول 95% حل کرده و سپس حجم آن را با آب مقطر به 500 میلیلیتر برسانید.
نکته 2: از اشریشیا کلی بهعنوان کنترل مثبت و از انتروباکتر آئروژنز بهعنوان کنترل منفی در این تست استفاده میشود.
آزمايش ووگس- پروسكوئر (VP)
این آزمایش اولین بار در سال 1898 توسط ووگس و پروسکوئر توصیف شد. اين واكنش ايجاد استيل متيل كربينول يا استوئين را از گلوكز در محيط نشان ميدهد. بهطورکلی دو راه براي تخمير گلوكز در باكتريها وجود دارد، اول تخمير اسيدي مخلوط بوده كه مقدار زيادي اسيد و كمي اتانول توليد ميشود، دوم تخمير بوتيلن گليكول است كه در آن مقدار ناچيزي از اسيدهاي مختلف توليد ميگردد، ولي مقادير زيادي بوتيلن گليكول و اتانول بوجود ميآيد. براي انجام اين آزمايش، باكتري را در محيط MR-VP (آبگوشت حاوي گلوكز و فسفات) كشت داده و به مدت 48-24 ساعت (چنانچه کشت غلیظ صورت گیرد زمان کوتاه میشود) در حرارت 37-35 درجه سلسیوس قرار داده ميشود.
بعد از اين مدت به ازای هر يك ميليليتر از محيط كشت، 15 قطره محلول الكلي آلفا نفتول (محلول 5 درصد در اتانول 95%) و 10 قطره پتاس (40% در آب) اضافه ميشود. پس از مخلوط نمودن به مدت 15 تا 30 دقيقه در انكوباتور 35 درجه سلسیوس قرار داده میشود تا بروز رنگ صورتی- قرمز در محيط که نشانة مثبت بودن واكنش است، مشاهده گردد. رنگ زرد کمرنگ نشاندهنده منفی بودن واکنش است. كلبسيلا، انتروباكتر و سراشیا، در اين تست مثبتاند (شکل 2).
نکته 1: محيط را قبل از استفاده جهت ريختن معرفها تكان دهيد تا O2 كافي تأمین شود. همچنین ابتدا آلفا نفتول و سپس پتاس و كراتين اضافه شود. با استفاده از كراتين مقدار بيشتري گوانيدين در دسترس قرار ميگيرد و رنگ قرمز در مدت 15- 10 دقيقه ظاهر ميگردد.
نکته 2: معرف آلفا نفتول زمانی که در تاریکی نگهداری شود به مدت 2 هفته قابل استفاده است.
نکته 3: از انتروباکتر آئروژنز بهعنوان کنترل مثبت و از اشریشیا کلی بهعنوان کنترل منفی در این تست استفاده میشود.
آزمایش سیمون سيترات
بعضي از باكتريها قادرند انرژي موردنیاز خود را از راههاي ديگری (بهجز تخمير كربوهيدرات) بدست آورند. سيترات سديم، نمك اسيد سيتريك بوده و باكتريها با استفاده از سيترات بهعنوان يك ماده غذايي و يا تنها منبع كربن، آن را مورد استفاده قرار ميدهند. محيطي كه براي نشان دادن سيترات بكار ميرود، تحت عنوان محيط سيمون سيترات (Koser) است. باکتریهایی كه داراي آنزيمهاي سيتراتاز، سيتراز و سيترات لياز هستند، ميتوانند از سيترات استفاده نمايند. معرف این محیط برموتیمول آبی است که درpH خنثي به رنگ سبز، درpH اسيدي (كمتر از 6) زرد و در pH قليايي (بالاتر از 7/6) آبي رنگ ميشود. برای انجام تست، باکتري را به ميزان كم، ابتدا بر روی این محیط بهصورت سطحي كشت میدهند و سپس به مدت 48 ساعت در حرارت 37-35 درجه سلسیوس قرار داده ميشود. در صورت رشد باکتریها و ایجاد رنگ آبی، واکنش مثبت در نظر گرفته میشود (شکل 2).
نکته 1: لازم به ذکر است که از روی محيطهاي قندي و پروتئيني بر روي محیط سيترات کشت داده نشود، چرا که انتقال تركيبات قند و پروتئين متصل شده به لوپ به محیط سیمون سیترات سبب رشد باكتريها ميگردد.
نکته 2: از انتروباکتر آئروژنز بهعنوان کنترل مثبت و از اشریشیا کلی بهعنوان کنترل منفی در این تست استفاده میشود.
نکته 3: مقدار تلقیح باید بسیار کم باشد چراکه حتی مقدار جزئی از مواد قندی میتواند منجر به واکنش غلط و اشتباه در نتیجه آزمایش گردد. در ضمن درپوش لولهها را نباید محکم بست.
نکته: مجموع چهار تست ذکرشده تحت عنوان IMViC (حرف I اول کلمه ایندول، حرف M از اول کلمه متیلرد، حرف V از اول کلمه ووگس- پروسکوئر و حرف C از کلمه سیترات گرفته شده است و حرف i برای بیان راحت مجموعه اختصار است) نامیده میشود و نتایج تستها برای باكتريهاي مختلف متفاوت است؛ مثلاً در اشریشیا کلی به شکل – – + + و در کلبسیلا به شکل + + – – است (شکل 2).
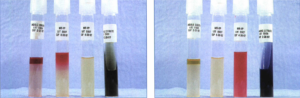
شکل 2: نتایج تست IMViC در اشریشیا کلی (سمت چپ) و کلبسیلا پنومونیه (سمت راست)
آزمایش اورهآز
از محيطهای کشت مايع استوارت ((Stuart,s urea broth و جامد کریستنسن Christensen,s urea agar)) به این منظور استفاده میشود. اوره يك ديآميد بوده و باکتریهایی كه داراي آنزيم اورهآز هستند، ميتوانند اوره را مصرف نموده و توليد آمونياك، دیاکسید کربن و آب نمايند. آمونياك حاصل با تركيبات ديگر به كربنات آمونيم تبديل شده و pH محيط قليايي ميگردد. معـــرف محيط فنلرد است كه در 6/8 = pH نارنجي و در 8/1=pH صورتي سير و بنفش رنگ ميشود.
برای انجام تست، باکتري را به ميزان كم در ابتدا بر روی محیط جامد بهصورت سطحي و یک لوپ داخل محیط مایع كشت میدهند و سپس به مدت 24-18 ساعت در حرارت 35 درجه سلسیوس قرار داده ميشود. در صورت مثبت بودن، کل محیط مایع و سطح محیط جامد قرمز شده و در صورت منفی بودن تست، زنگ محیط زرد باقی میماند. در این تست از گونههای پروتئوس بهعنوان کنترل مثبت و از اشریشیا کلی بهعنوان کنترل منفی استفاده میشود.
نکته مهم: با توجه به اینکه اوره را نمیتوان با اتوکلاو استریل کرد، لذا ابتدا محیط کشت پایه اوره را تهیه و با اتوکلاو سترون نمایید و بعد اوره را با کمک صافی، سترون و به محیط کشت اضافه نمایید.
آزمایش توليد H2S
محیطهایی كه براي بررسی توليد گاز سولفید هیدروژن (H2S) بكار ميروند عبارتند از بیسموت سولفید، سیترات سولفید آگار، LIA (لیزین آیرون آگار)، KIA ,TSIو SIM. تولید H2S همچنين در محيط XLD، HE، SS و با نوار استات سرب ميتواند سنجيده شود. لازم بذکر است که محيط SIM در مقايسه با محيطهای KIA ,TSI حساسيت بيشتري براي سنجش H2S نشان ميدهد (شکل 3). هرچند که حساسیت استات سرب بیشتر از محیط SIM است و اغلب برای مواقعی که میزان تولید H2S کم است (در شناسایی بروسلاها) بکار میرود. مشاهده رنگ سیاه در محیط کشت نشانه تولید گاز H2S است.
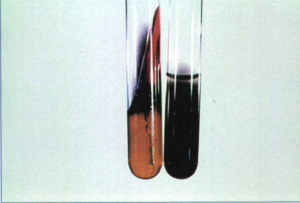
شکل 3: محیط SIM (سمت راست) و KIA (سمت چپ) حساسیت تولید H2S را نشان میدهد
محيط SIM
محيط SIM یک محیط نيمهجامد بوده و كشت باكتري در آن بهصورت عمودي و عمقي صورت ميگيرد. این محيط، علاوه بر نشان دادن حركت و توليد ایندول، تولید H2S را نشان ميدهد. در اين محيط باكتريها مواد مختلف حاوي سولفور را مصرف نموده (پپتون، متيونين، سيستئين و تيوسولفات سديم) و در نتيجه توليد H2S مينمايند كه این گاز تولیدشده با يون فريك ايجاد سولفيت فرو سیاهرنگ مينمايد (شکل 3).
آزمایش ایندول
بعضي از باكتريهاي خانواده انتروباكترياسه نظير اشريشيا كلي كه داراي آنزيم تريپتوفاناز هستند، ميتوانند از اسيد آمينة تريپتوفان گاز ایندول توليد نمايند. براي بررسي قابليت توليد گاز ایندول، باكتري را در محيط داراي تريپتوفان (1%) (آبگوشت تريپتون توصيه شده است) كشت داده و به مدت 24 ساعت در حرارت 37 درجه سلسیوس قرار میدهند، سپس به قسمت سطح لوله محيط کشت چند قطره معرف كواكس (Kovac) يا معرف ارليش– بوهمه (Ehrlich- Boeheme) اضافه مینمایند. در صورت وجود گاز ایندول، 2 دقیقه بعد از اضافه کردن معرف، حلقه قرمز رنگی در سطح محيط تشكيل میشود.
بعد از چند دقیقه اسید کلریدریک موجود در معرف کواکس با پلاستیک کلاهک واکنش میدهد و تغییر رنگ حاصل میکند (زرد رنگ) و یا به رنگ قهوهای مایل به قرمز درمیآید که این واکنش منفی است. از محیطهایی مانند SIM، اورنیتین- موتیلیتی- تریپتوفان (OMT) و ایندول نیترات جهت بررسی تولید ایندول استفاده میشود (شکل 2).
نکته 1: محيط كشتي كه براي آزمايش ایندول بهكار ميرود بايستی فاقد قند (گلوكز) باشد، چراکه قند مزبور از توليد گاز ایندول جلوگیری میکند.
نکته 2: حضور اكسيژن توليد ایندول را تحت تأثیر قرار ميدهد، ازاینرو باكتريهاي بیهوازي اختياري در شرايط هوازي ایندول بيشتري توليد ميكنند.
نکته 3: از اشریشیا کلی بهعنوان کنترل مثبت و از کلبسیلا پنومونیه بهعنوان کنترل منفی در این تست استفاده میشود.
آزمایش دکربوکسیلاز
باكتريها داراي آنزيمهای هستند كه قادرند به گروه كربوكسيل آمينواسيدها حمله نموده و آن را بردارند. محيطهاي اختصاصي حاوی اسيدهاي آمينه اختصاصي ليزيـــن، اورنيتين و آرژينين بهطور معمول براي انتروباكترياسهها مورد استفاده قرار ميگيرند. محيط كشت لیزین آیرون آگار(LIA) حاوي گلوکز، اندیکاتور pH (برموکرزول ارغوانی یا بنفش)، يك اسيد آمينة اختصاصي و همچنين فريك آمونيوم سيترات و تيوسولفات (براي نشان دادن H2S) است. نقش گلوكز در محيط بسيار مهم است، زيرا واكنشهاي دكربوكسيلاسيون توسط آنزيم مربوطه در محيط اسيدي افزايش مييابد (لازم بذکر است که همه انتروباكترياسهها گلوكز مثبت هستند). براي انجام عمل دكربوكسيلاسيون بايد شرايط مختلفي رعايت گردد از جمله: pH اسيدي و شرايط بيهوازي (لولههاي كشت حاوي محيط مايع بوسيلة پارافين استريل پوشانده ميشوند چرا که در حضور اکسیژن جواب مثبت کاذب رخ میدهد).
در صورت دكربوكسيله شدن اسیدآمینه، محصولات آمينـــــي آزاد ميگردند و محيط قليايي ميگــــردد )pH قليایي شده) و رنگ محيط ارغواني باقی ميماند و در صورتی که باكتري فاقد آنزيم مربوطه باشد، با مصرف گلوكز، محيط زرد رنگ ميشود. برای انجام تست، كشت در عمق (بهصورت خطی) و سطح محيط (به شکل زیگزاک) صورت ميگيرد و رنگ بنفش یا ارغواني نشانه دكربوكسيله شدن ليزين است. اين محيط فعاليت دآميناسيون را هم نشان ميدهد كه در صورت دآمينه شدن توسط باكتري محيط به رنگ قرمز مشاهده خواهد شد. بهطورکلی واکنش ایجادشده در محیط لیزین بدین شکل است که با باقی ماندن رنگ بنفش یا ارغوانی، باکتری لیزین مثبت است و چنانچه قسمت عمقی محیط به رنگ زرد درآید لیزین منفی خواهد بود. اگر عمق محیط کشت، قرمز رنگ گردد باکتری لیزین را دآمینه نموده است. توجه شود که نتيجه كشت پس از 4 روز فاقد ارزش است.
لازم بذکر است اگر از محیط LIA برای آزمایش لیزین دکربوکسیلاز استفاده میشود نیازی به اضافه کردن پارافین مایع نیست و تنها پس از تلقیح باکتری در سطح و عمق و بعد از انکوباسیون نتیجه قرائت میگردد. اگر عمق محیط کشت بنفش یا ارغوانی شد جواب مثبت و در صورتی که عمق زردرنگ شد جواب آزمایش لیزین دکربوکسیلاز منفی است.
واكنشهاي دآميناسيون
باكتريهاي جنس پروتئوس، مورگانلا، پروويدنشیا و آنهایي كه داراي آنزيم (ال آمینواسید اكسيداز) هستند، ميتوانند تعدادي از اسیدآمینهها را دآمينه نموده و توليد آلفا- كتواسيد نمايند که نقش مهمي در شناسایی باكتريهاي خانواده انتروباكترياسه ايفاء ميكند. برای بررسی واكنشهاي دآميناسيون، بر روی محيط فنيلآلانين كه بهصورت مورب (slant) تهيه شده، مقدار زيادي باكتري كه از روي محيط جامد برداشت شده به شکل زیگزاک كشت داده (فقط در سطح مورب) و بـــه مدت 24-18 ساعت در حرارت 35 درجه سلسیوس قرار میدهند، سپـس حدود نيم میلیلیتر (5-4 قطره) كلرور فريك 10% روي محيط كشت اضافه میگردد. در صورت مثبت بودن تست، اسيد فنيل پيرويك تولیدشده با معرف كلرور فريك ترکیب شده و ايجاد پيروات فنيل فريك و رنگ سبز میکند.
نکته 1: از محیطهای حاوی عصاره گوشت و پروتئین نباید برای تست فنیلآلانین استفاده کرد، چراکه این محیطها حاوی فنیلآلانین هستند و نتیجه مثبت کاذب بوجود میآورند.
نکته 2: از گونههای پروتئوس بهعنوان کنترل مثبت و از اشریشیا کلی بهعنوان کنترل منفی در این تست استفاده میشود.
جدول 6: خصوصیات افتراقی کلیدی برای مهمترین انتروباکتریاسهها
سیستم API برای تشخیص انتروباکتریاسهها در آزمایشگاه:
سیستم API یک روش استاندارد و اصولی در مقیاس کوچک برای شناسایی انتروباکتریاسهها (تا حد بیوتیپ) و سایر باکتریهای گرم منفی است. این سیستم شامل لولههای کوچکی هستند که بهصورت حفره درون نوارهای API تعبیه شدهاند و حاوی سوبستراهای دهیدراته هستند. به این سوبستراها، سوسپانسیون باکتری اضافه شده و وقتی انکوباسیون انجام میگیرد، باکتری با محتوی لوله واکنش نشان داده و متابولیتهای تولیدی توسط باکتریها تحت تأثیر معرفها قرار میگیرند و تغییر رنگ مشاهده میشود. این تغییرات بعد از 24 تا 48 ساعت انکوباسیون در دمای 37 درجه سلسیوس قابل ارزیابی هستند. در نگهداری نوارها بایستی دقت کرد و آنها را در دمای 2 تا 8 درجه و در تاریکی نگهداری کرد. در صورت مراقبت کافی میتوان نوارها را حداقل تا 10 ماه استفاده کرد. این سیستمها به آسانی 23 تست بیوشیمیایی را در یک مرحله انجام میدهند.
کنترل کیفی در آزمایشگاه میکروب شناسی
نقش و اهميت آزمون استاندارد طلايي كشت در تشخيص بيماري مسري و مهلك سل
https://www.sciencedirect.com/topics/medicine-and-dentistry/enterobacteriaceae
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام