ارتباط تغییرات فلور میکروبی روده با افسردگی
دکتر سيد عليرضا سجادي دانشيار روانپزشکي- مرکز تحقيقات روانپزشکي و علوم رفتاري- بيمارستان ابن سينا- دانشکده پزشکي- دانشگاه علوم پزشکي مشهد- ايران
خلاصه:
اختلال افسردگی اساسی (MDD) Major Depressive Disorder یک مشکل روانی جدی است که افراد بسیاری را مبتلا میکند. در سالهای اخیر شواهد فزایندهای حاکی از آن است که فلور طبیعی روده نقش مهمی در تنظیم اختلالات روانی از جمله اضطراب و افسردگی دارد. در این مقاله به مرور یافتههای اخیر در مورد محور روده- مغز و نیز تعامل و ارتباط آنها میپردازیم. درک بهتر از ارتباط بین فلور روده و افسردگی میتواند راهگشای چشمانداز جدیدی به پاتوژنز، تشخیص بالینی و درمان MDD باشد.
مقدمه
اختلال افسردگی ماژور (MDD) در جامعه امروزی یک اختلال روانی متداول است که در آن افسردگی فراگیر و پایدار مشاهده میگردد که این حالت میتواند بر سلامت خود فرد و خانواده اثر سوء بگذارد.
در یک مطالعه که در سال 2010 در ایالت متحده آمریکا بعمل آمد مشخص شد که MDD در رأس بیماریهای ناتوانکننده است؛ به این معنی که فرد را از انجام شغل و نیز کارهای روزانهاش بازمیدارد. تعداد بیمارانی که به درجات مختلف به MDD دچار هستند از 2/14 میلیون در سال 1990 به 3/05 میلیون در سال 2010 افزایش یافتهاند.
معالوصف شناخت ما از ماهیت و علل افسردگی ناقص و سطحی است.
در این مقاله موضوعات مختلفی همچون علل افسردگی، علائم عمومی آن، شاخصهای تشخیصی محتمل و چشمانداز آینده آن مورد بحث و بررسی قرار میگیرد، اما تمرکز بحث بر روی رابطه نزدیک بین فلور روده و MDD خواهد بود. همچنین در این مقاله به اهمیت تحقیقات آینده در خصوص میکروبها و محور روده- مغز پرداخته خواهد شد.
افسردگی و خصوصیات تشخیصی آن
افسردگی یک بیماری شدید و عالمگیر است که در آن خلقوخوی فرد بهطور قابلتوجه و مستمری افسرده میگردد. اختلال افسردگی شدید یکی از علل مهم خودکشی در سراسر جهان است و حدود 60٪ از افرادی که اقدام به خودکشی میکنند دارای افسردگی یا سایر اختلالات خلقی هستند. افسردگی شامل انواعی از غمگینی مثل افسردهخویی (dysthmia)، افسردگی ملایم و MDD میشود که ممکن است تنها یکبار اتفاق بیفتد و یا اینکه بهطور مکرر تکرار شوند و برخی از آنها با سایر اختلالات روانی همراه باشند.
علت افسردگی تا حدود زیادی همچنان ناشناخته است و هنوز توضیح قاطعی در خصوص آن وجود ندارد اما مسلم است که علت افسردگی یک مجموعه پیچیده است و عوامل احتمالی مؤثر در آن عبارتند از:
- تأثیر تنظیمات نوروهومورال
- عوامل بیولوژیک: توارث و تغییرات تکاملی نقش اساسی دارند و جنسیت و سن هم اثر گذار هستند
- عوامل سایکولوژیک مانند شخصیت فرد که در رأس عوامل است.
- اثرات محیطی- اجتماعی
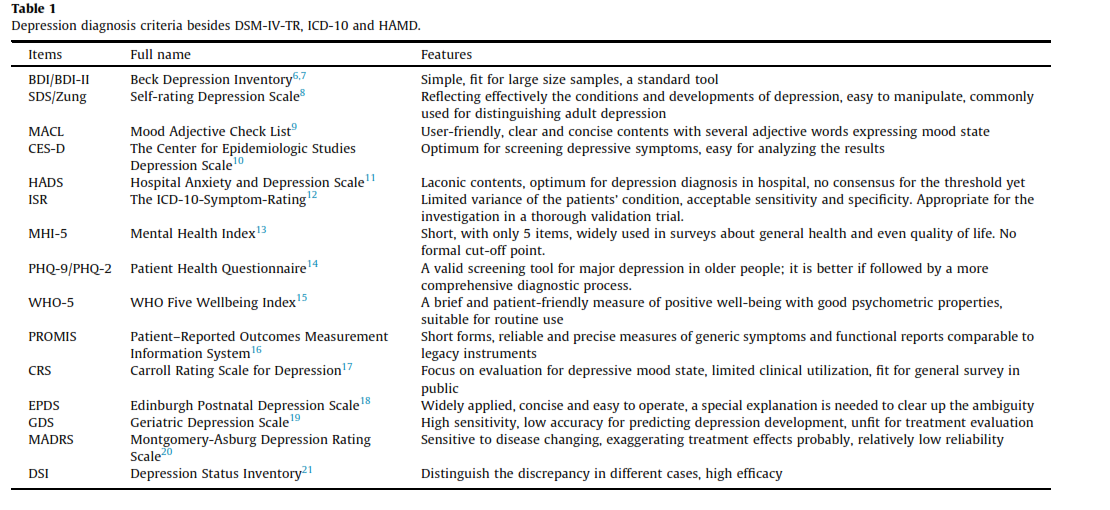
برای تشخیص این بیماری مهم شاخصههای مختلفی پیشنهاد و اعتباربخشی شدهاند.
DSM-IV-IR
مهمترین شاخصههای مورد استفاده برای تشخیص اختلالات افسردگی توسط انجمن روانپزشکان آمریکا ارائه شده و تحت عنوان
Diagnostic and Statistical Manual of Mental Disorders (DSM-IV-TR) است. در این کتابچه سه علامت اصلی جهت تشخیص افسردگی شامل روحیه پایین، عدم لذت anhedonia از مواهب زندگی و کاهش انرژی ذکر شده است. اگر فردی دو تا از این علامتها را داشته باشد میتوان بیماری او را MDD قلمداد نمود.
ICD-10
شاخصههای ICD-10 شامل ده علامت افسردگی است. این علائم عبارتند از: روحیه پایین و اندوه مستمر، از دست دادن اشتیاق و لذت، خستگی یا کمبود انرژی، اختلال خواب، کاهش تمرکز، کاهش اعتمادبهنفس، کاهش یا افزایش اشتها، فکر خودکشی یا اقدام به آن، رفتار هیجانی یا توأم با بیحالی و تنبلی و احساس گناه.
مقیاس افسردگی هامیلتون
مقیاس افسردگی هامیلتون (HAMD) استاندارد طلایی تشخیص اختلالات افسردگی است که بر تغییرات فیزیولوژیک تأکید دارد و انجام آن محتاج افراد مجرب و دورهدیده است.
سایر مقیاسهای افسردگی
شاخصههای دیگری هم در طی مطالعات مختلف پیشنهاد شده است که در جدول 1 میتوانید آنها را ملاحظه نمایند.
ابزارهای متعددی را برای سنجش افسردگی میتوان بهکار گرفت، اما اصول کلی این است که نوع تظاهرات بالینی و آخرین نمود آن را در نظر بگیریم و سپس مطمئن شویم که چه انواعی از افسردگی را بیمار تجربه کرده است. در مرحله بعد باید تشخیص را محرز گردانیم. اگر علائم مختلفی بهطور مکرر اتفاق میافتد تشخیص بیماری را باید اصلاح نمود.
بیومارکرهای فعلی و بیومارکرهای احتمالی در آینده برای تشخیص افسردگی
بیومارکرهای مختلف در روند MDD عملکرد متفاوتی دارند و میتوانند اطلاعاتی را برای تشخیص در اختیار بگذارند. متأسفانه هیچ تست بیولوژیکی وجود ندارد که بهطور مستقیم بتوان با آن MDD را تأیید نمود. در حال حاضر بیومارکرهای متعددی وجود دارند که در تشخیص عینی افسردگی قابل استفاده هستند. همچنین بیومارکرهایی هم هستند که میتوانند نامزد تشخیص افسردگی در آینده باشند.
متیلاسیون DNA و microRNA
در زنانی که مستعد افسردگی پس از زایمان هستند، مقادیر بالای استروژن به هنگام حاملگی باعث تغییراتی در متیلاسیون DNA در ژنها میشود و لذا این بیومارکرها میتوانند در فهم فیزیوپاتولوژی افسردگی پس از زایمان (PPD) گامی به جلو محسوب شوند. محققین دریافتهاند که در این گروه از زنان لوکوس TTC9B با تنظیم رسپتور AMPA که بر حالات روحی فرد اثر میگذارد، مرتبط است.
در سالهای اخیر تلاشهای بسیاری بعمل آمده تا از microRNAها بهعنوان بیومارکر در بیماریهای مختلف همچون سرطان، قلبی عروقی، التهابی و نورودژنراتیو استفاده شود. میکروآرانایهای مختلفی نیز جهت بررسی ارتباط آنها با افسردگی مورد بررسی و آزمایش قرار گرفتهاند.
پارامترهای بیومدیکال خون محیطی
برخی پیشسازهای پروتئینــی و الگوی پپتــــــیدی آنها میتوانند مبنای تشخیص آزمایشگاهی MDD باشند. از میان این پروتئینها میتـــــــــــــوان از آلبومـــــــــــین سرم، apolipoprotein A-I، پروتـــــئین AMBP و
basement membrane –specific heparin sulfate proteoglycan core protein نام برد. اختلالات قبلی HPA-A (مثل استرس مزمن)، مواد مخدر، انتقال سروتونرژیک (بخاطر نارسایی ژنتیک) یا ایمنی ذاتی (التهاب مزمن) هرکدام میتوانند منجر به افسردگی یا صرع گردند.
آسیب دیدن میزان استروئیدهای نرواکتیو در بیماران مبتلا به آلوپسی آندروژنیک که تحت درمان با فیناستراید هستند منجر به بروز علائم افسردگی میگردد. پروتئینها و لیپیدهای متعددی در کارآزماییهای مختلف مورد بررسی قرار گرفتهاند، بعنوان مثال در مبتلایان به MDD میزان کارنیتینها، لیپیدهای اتر و تریپتوفان بهطور محسوسی کاهش یافته ولی LPCs، LPEs و PEs افزایش مییابند.
برخی از مواد دیگری که مورد بررسی قرار گرفتهاند عبارتند از: آپولیپوپروتئین D، آپولیپوپروتئین B، پروتئین اتصال به ویتامین D، سرولوپلاسمین، hornerin، profilin1، malondialdehyde، سوپراکسید دیسمیوتاز، type 3 adenylyl cyclase، Kenurenine pathway itemes، Platelet 5-hydroxytriptamin (5-HT)، lipid peroxidation و برخی کاتیونها مثل روی و منیزیم.
سیتوکاینها و فاکتورهای التهابی
سیتوکاینها توسط سلولها تولید میشوند و میتوانند بر رفتار سایر سلولها (و گاهی خود سلول مولد) اثر بگذارند. تحقیقات حاکی از آن است که فعالیت ایمنی و تولید سیتوکاینها در افسردگی ماژور نقش دارند، اما تعداد مقالات علمی در خصوص نقش سیتوکاینها در افسردگی خیلی زیاد نیست.
سیتوکاینها میتوانند بر متابولیسم سروتونین اثر بگذارند. Vascular Endothelial Growth factor (VEGF) یک میتوژن آنژیوژنیک است که توسط سلولهای اندوتلیال تولید میشود و در حفظ یکپارچگی و تمامیت عروق نقش دارد. GLP-1 یک هورمون اینکرتین است که از سلولهای L در روده و نرونها ترشح میشود. این هورمون نقش اساسی در فعال کردن پاسخهای استرس دارد و نیز نقش عمدهای در تنظیم عملکرد هموستاتیک در سیستم اعصاب مرکزی ایفا میکند.
بسیاری از سیتوکاینها در افراد افسرده در مقایسه با گروه کنترل سالم افزایش مییابند. بعد از درمان افسردگی سطح پلاسمایی هفت سیتوکاین (G-CSF ,IL-10 ,IL-8 ,IL-7 ,1L-6 ,IL-1α و IFN-Y) در مقایسه با سطح پایه کاهش مییابد. کاهش سطوح نرمال سیتوکاینها فقط در افرادی مشاهده میشود که واجد معیارهای بهبودی (recovery) باشند.
الکتروانسفالوگراف (EEG)
در آزمایشهای تصویربرداری، همبستگی مثبتی بین اتصال پایه بتا و کاهش شاخص افسردگی هامیلتون دیده میشود. در MDD افزایش انتقال عملکردی EEG در ناحیه فرونتال مغز دیده میشود. تشدید عدم تقارن EEG آلفا در افراد افسرده با مهار رفتاری و احساسات منفی ارتباط دارد.
میکروبیوتا microbiota و سایر مواد بیولوژیک
به دنبال اختلال افسردگی ماژور همیشه بیماریهای مزمن متعددی همچون سرطان، بیماریهای انسدادی مزمن ریوی COPD و غیره مشاهده میشود. برخی پارامترهای عصبی در بیماری روده تغییر میکنند؛ بهعنوان مثال در بیماران UD فعالیت پلاسمایی DPP-IV کاهش و فعالیت LAP افزایش مییابد. باکتریهای گرم منفی همچون
Hafnia alvei, Pseudomonas aeruginosa, Morganella morganii, Proteus mirabilis, Pseudomonas putida, Citrobacter koseri و Klebsiella pneumonia متعلق به فلور طبیعی روده هستند و به آنها باکتریهای همزیست روده گفته میشود.
فلور روده و افسردگی
میکروبیوتای روده و افسردگی
بلافاصله بعد از تولد، دستگاه گوارش بهوسیله انواع مختلف باکتریها کولونیزه میشود. میکروبیوتای دستگاه گوارش در بزرگسالان مشتمل بر بیش از 1000 گونه و 7000 سویه است. تراکم باکتریها در سراسر لوله گوارش یکنواخت نیست. تعداد باکتریها در کولون از همه مناطق بدن بیشتر است.
ارتباط دوجانبهای بین سیستم گوارش و سیستم اعصاب مرکزی وجود دارد. این ارتباط از طریق اجزای هورمونی شامل محور هیپوتالاموس– هیپوفیز آدرنال، ارتباط آناتومیک چون عصب واگ و مدیاتورهای ایمنی و غیره است. مطالعات سالهای اخیر نشان میدهند که مغز فعالیتهای دستگاه گوارش را تنظیم میکند و میکروبهای دستگاه گوارش هم بر روی مغز اثر دارند. مطالعات بسیاری به این مسئله توجه کردهاند که آیا میتوان از میکروبهای روده بهعنوان بیومارکرهای افسردگی استفاده نمود.
مسیر روده به مغز
فلور انسانی مکانیسمهای متعددی برای تأثیر بر روی میزبان یوکاریوت خود دارد و عموماً این مکانیسمها سودمند بوده و جایگاه آنها را حفظ میکند. در تجاربی همچون درمان با آنتیبیوتیکها و پروبیوتیک، پیوند میکروبهای مدفوع، عفونتهای گوارشی و … تأثیر بالقوه میکروبیوتا بر ارتباط بین روده و مغز در افراد سالم و بیمار مشخص شده است.
پاسخهای التهابی به فلور روده سبب محافظت لایه اپیتلیال از نفوذ میکروبها در مجرای گوارش میگردد. سلولهای دندریتیک روده پس از تعامل با میکروبیوتا تولیدIgA را از لنفوسیتهای B و پلاسماسلها تحریک میکنند، علاوه بر این سلولهای دندریتیک مانند پلی بین مکانیسمهای ایمنی و عصبی عمل مینمایند. عملکرد سلولهای دندریتیک مجاور لوله گوارشی توسط calcitonine – gene – related – peptide تنظیم میشود و از طریق عصب واگ حضور میکروبیوتای کامنسال را به مغز مخابره میکند.
مسیر مغز به روده
محققان بسیاری نشان دادهاند که فشارهای سایکولوژیک در مراحل اولیه زندگی اثر مهمی بر سلامت دستگاه هاضمه در بزرگسالی دارد که درواقع از این طریق میکروبیوم گوارش را تغییر میدهد. شاید در آینده درمان برخی بیماریهای گوارشی از روشها و مواد مرتبط با مغز و روان میسر شود.
استرسهای سایکولوژیک میتواند تعداد و تناسب میکروبها را در روده تغییر دهد. با فرمان سیستم اعصاب مرکزی، سلولهای lamina propria، مولکولهایی را به داخل مجرای گوارشی ترشح میکنند که این مولکولها سبب تنظیم تحرک، نفوذپذیری و ظرفیت ترشحی روده میگردد.
تغییرات فلور روده: استراتژی تحقیقات و چشماندازهای عملی
استراتژیهای تحقیقاتی در مورد تغییرات فلور روده بهعنوان بیومارکر
استراتژیهای تحقیقاتی عملی معطوف به بررسی عمیقتر ارتباط فلور روده با MDDاست. با رشد سریع تکنولوژی مولکولی، آزمایش مؤثر و دقیق فلور روده در آینده وابسته به این تکنولوژی خواهد بود. توالییابی 16S rRNA یک روش سریع و دقیق برای شناسایی و طبقهبندی باکتریهاست که جدیداً عرضه شده است. 16S rRNA اغلب یک خانواده مولتیژن یا اپرونها را تشکیل میدهد که تقریباً در همه باکتریها وجود دارد و عملکرد آن با گذشت زمان تغییر نمیکند. در سالهای اخیر توالییابی 16S rRNA تغییرات و تأثیرات زیادی در طبقهبندی باکتریها ایجاد کرده است. علاوه بر این انتظار میرود که توالییابی rRNA در آینده در آزمایشگاه میکروبشناسی بالینی رواج بیشتری یابد.
وجوه عملی درخصوص تغییرات فلور روده بهعنوان بیومارکر تحقیقات گذشته نشان دادند که ایجاد تغییر در فلور روده کموبیش میتواند بر روی علائم افسردگی تأثیر داشته باشد. برای پایش درمان MDD شاخصهای ذیل را میتوان مدنظر داشت:
1) منابع انرژی و تنظیم رژیم غذایی
تغییر در رژیم غذایی و منابع انرژی میکروبها راه دیگری جهت مقابله با MDD محسوب میگردد. تغییر در میزان انرژی دریافتی میتواند بهطور مستقیم بر روی GALT اثر بگذارد و یا ترکیب میکروبها را عوض کند و یا این کار را از طریق مواد دفعی متابولیک که توسط میکروبها تولید میشود، انجام دهد. ویتامینها میتوانند از راههای مختلف عملکرد میکروبها و GALT را تحت تأثیر قرار دهند.
2) prebiotics ,probiotics و postbiotics
پروبیوتیکها، میکروبهای (باکتری یا مخمر) زندهای هستند که در داخل روده میتوانند به میزبان سود برسانند. پروبیوتیکها میزان افسردگی را بهطور چشمگیری کاهش میدهند و لذا امکان استفاده آنها در پیشگیری از افسردگی قابل توجه و تأمل است. هضم این نوع prebioticها برای میزبان دشوار است اما مسیر متابولیک آنها در روده مفید واقع میشود. به محصولات باکتریایی مانند بوتیراتها postbiotic گفته میشود.
3) آنتیبیوتیکها
استفاده از آنتیبیوتیکها یک استراتژی درمانی دیگر برای بیماریهای روانی محسوب میگردد. آنتیبیوتیکها با کاستن از تعداد باکتریهای مولد اورهآز، مقدار آمونیاک و سایر متابولیتهای نوروتوکسیک را کاهش میدهند، اما پاسخ بیماران مبتلا به MDD به درمان با آنتیبیوتیک برحسب جنس، سن، وضعیت ایمنی، علائم بارز بیماری و مانند آن بسیار متفاوت است، لذا انتخاب درمان مناسب برای پزشک تبدیل به یک چالش میشود.
مانع بزرگ دیگر بر سر راه استفاده از ترکیب میکروفلور روده بهعنوان بیومارکر MDD این است که ترکیب مذکور به عوامل متعدد فیزیولوژیک و پاتولوژیک همچون عوامل ژنتیک، تغذیه، بیماریهای عفونی، تومورها، بیماریهای اندوکرین، داروها و غیره بستگی دارد. الگوی ترکیب و عملکرد برخی از این باکتریها ممکن است در آینده در مرکز توجه مطالعات مربوط به بیومارکر باشد. ما نمیتوانیم از اهمیت این بیومارکرها در تشخیص و پایش درمان MDD صرفنظر کنیم.
نتیجهگیری
ایجاد ابزارهای قوی جهت برآورد و سنجش گوناگونی و عملکرد میکروبهای روده، راه را برای روشن ساختن محور مغز- روده و ارتباط دوسویه آنها هموار خواهد ساخت. شناخت بهتر این ارتباط بهطور یقین نقش میکروبها را در ایجاد افسردگی و احتمال استفاده از آنها را بهعنوان بیومارکر روشن خواهد ساخت.
این مقاله برگردان خلاصه ای است از:
Can gut flora changes be new biomarkers for depression?
P. Lin, Q. Li / Frontiers in Laboratory Medicine 1 (2017) 129–134
بررسی تأثیر امگا-3 بر بیماریهای سرطانی و روانی
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام