مروری تازه بر باسیلهای گرم منفی
(انتروباکتریاسه- قسمت سوم)
دكتر رضا ميرنژاد، استاد تمام دانشگاه
جنس شيگلا (Shigella genera)
عموماً شيگلا (Shigella) به همراه سالمونلا و يرسينيا در دسته پاتوژنهاي لاكتوز منفي قرار میگیرند، ولي با توجه به همولوژي DNA، شيگلا و اشریشیا کلی بسيار به هم نزديكند و بعضي از محققين معتقدند كه شيگلا يك زیرگونهی اشریشیا کلی است. گونههاي شيگلا از اشریشیا کلی بهواسطه عدم تخمير لاكتوز، عدم تحرك، عدم فعاليت دكربوكسيلاسيون لیزین و عدم توليد گاز از تمام كربوهيدراتها قابل شناسايي هستند. گونههاي شيگلا از گونههاي سالمونلا بهواسطه عدم تحرك و عدم توليد گاز H2S متمایز میشوند.
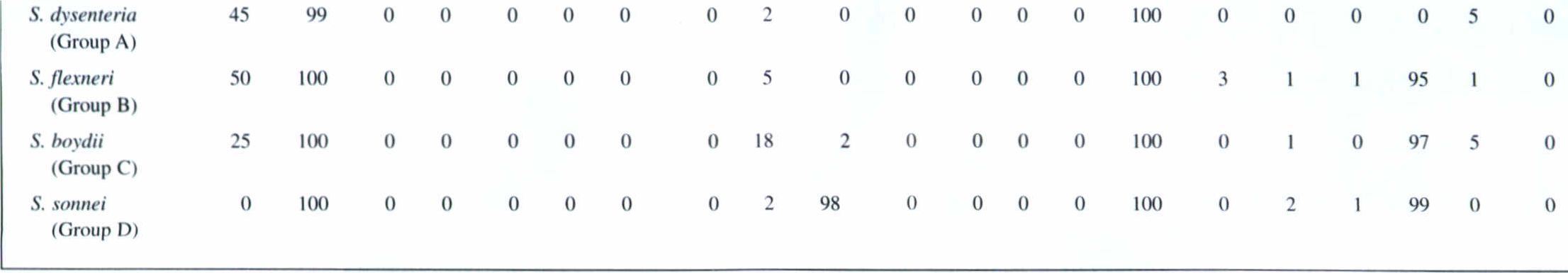
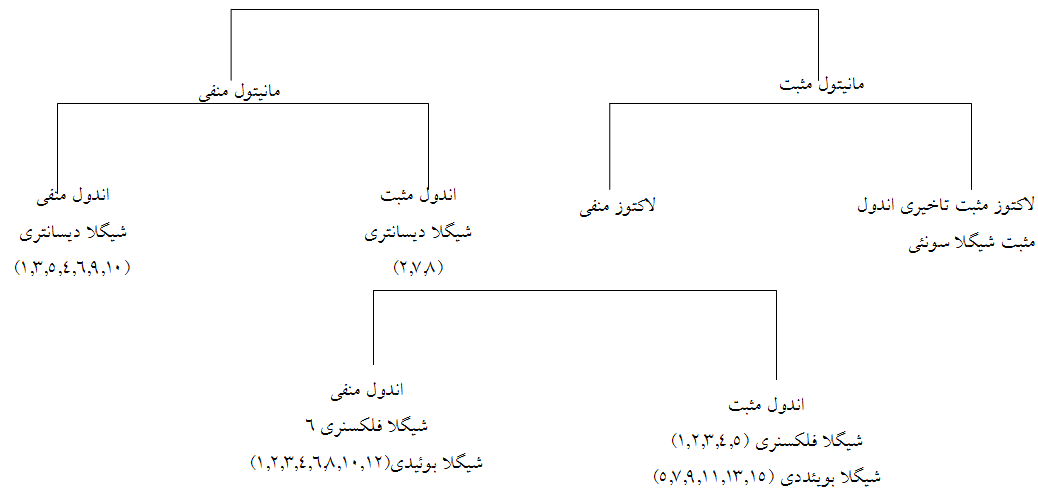
چهار گونه (گروه) در شيگلا تشخيص داده شده است: شيگلا ديسانتريه[1] (گروه A)، شيگلا فلكسنري[2] (گروه B)، شيگلا بوئيدي[3] (گروه C) و شيگلا سونئی[4] (گروه D). در طبقهبندي CDC، سه گونه اول شيگلا چون از نظر بيوشيميايي شبيه میباشند، مجموعۀ شيگلا سروگروپ ABC ناميده میشوند. شيگلا سونئی كه عامل بيشترين عفونتهاي شيگلا در ايالات متحده امريكا و کمترین در کشور ماست، بهراحتی از سه گروه اول تشخيص داده میشود، زيرا برخلاف آنها داراي فعاليت دكربوكسيلاسيون ليزين و بتاگالاكتوزيداز است. شيگلا ديسانتريه كه عامل وخيمترين حالت بيماري است و اغلب از کشورهای در حال توسعه مانند کشور ما ایزوله گشته و ندرتاً در ایالات متحده آمريكا ديده میشود، از ديگر گروهها بهواسطه عدم توانايي تخمير مانيتول و توانايي توليد نوروتوكسين شيگا قابل افتراق است (جدول 1). همچنين گونههاي شيگلا را میتوان توسط اختصاصيت آنتيژنيكی O از يكديگر افتراق داد.
شيگلا يكي از عفونيترين باكتريهاست و خوردن حتي 100 تا 200 ارگانيسم میتواند سبب بيماري شود. اين ID50 پايين، گونههاي شيگلا را در آزمايشگاه، به باكتري خطرناكي تبديل میکند و كاركنان آزمايشگاهها اغلب در هنگام حملونقل نمونههاي حاوي شيگلا آلوده میگردند. بسياري از مواردي كه با شيگلاها آلوده شدهاند كساني بودهاند كه آب و غذاي آلوده به مدفوع انساني را خوردهاند. شيگلاها بيش از 30 روز میتوانند در شير، تخممرغ، پنير يا ميگو زنده بمانند. عموماً پخش عفونت از منبع انساني و توسط پنج f يعني غذا، انگشتان، مدفوع، مگس و اشياء صورت میگیرد كه برخلاف سالمونلا است كه اغلب از حيوان آلوده به انسان منتشر میگردد.
نوزادان و نوجوانان بسيار به شيگلوز حساسند. حدود 60 درصد از نوزادان زير يكسال بعد از مواجهه با شيگلاها دچار ديسانتري میشوند، اما ميزان عفونت بعد از 1 سالگي به 20 درصد كاهش مییابد. بيشتر بيماريها در جهان در كودكان زير 10 سال رخ میدهد. شیوعهای دیسانتری معمولاً در ارتباط با اجتماعات بسته مانند پادگانها، خانوادهها، کشتیهای مسافربری، بیمارستانهای روانی، مراکز مراقبت روزانه کودکان و زندانها است. دیسانتری باسیلی اغلب در طی جنگها به دنبال استقرار موقت در میادین جنگ روی میدهد.
گونههای شيگلا عامل ديسانتري باسيلي هستند و توانايي بيماريزائيشان اصولاً به قدرت تهاجم آنها به مخاط كولون مربوط میشود. قدرت شيگلا ديسانتريه براي ايجاد بيماري به دلیل توانايي توليد نوروتوكسين شيگا از ساير گونهها شديدتر است. محققين، اثرات شيگلا را بر روي سلولهای ميمون، سلولهای كولون و سلولهای غيركولون انساني و بر روي لوپ ايلئال خرگوش مطالعه كردند و با جمعآوری اين اطلاعات تصويري از نحوۀ ايجاد ديسانتري توسط شيگلا ترسيم نمودهاند.
از جمله موارد مؤثر در بیماریزایی باكتري میتوان به موارد زیر اشاره کرد:
توانايي تهاجم شيگلا به سلولهای ميزبان مربوط به پلاسميد 220 کیلودالتون است كه مجموعه پروتئینهایی بنام آنتیژنهای پلاسميدي تهاجم[5] (Ipa) را كد میکنند. بنظر میرسد يكي از اين آنتیژنها يعني IpaD، ادهيسینی است كه به باكتري امكان فاگوسيت شدن را میدهد. رسپتورهاي سلول ميزبان براي IpaD ناشناخته است، اما فقط در يك قطب بازولترال سلولهای انتروسيت بيان میشوند.
زمانی که شيگلا درون فاگوزوم ميزبان است يك هموليزين وابسته به سلول، فاگوزوم را ليز كرده و باكتري درون سيتوپلاسم سلول تكثير مییابد. شيگلا دو ساعت بعد از ورود با اكتين ژلاتينه شده، پوشيده میشود. اين پوشش بهزودی به دنبالهای از اكتين پليمريزه شده تبديل میشود كه در پشت باكتري قرار میگیرد. پليمريزاسيون اكتين توسط يك پروتئين غشاء خارجي 120 کیلودالتونی صورت میگیرد. اين پليمريزاسيون به شيگلا اجازه میدهد كه مستقيماً از يك سلول به سلول ديگر در روندي مشابه حركت داخل سلولي و بين سلولي ليستريا منوسیتوژنز عبور كند.
شيگلا ديسانتريه توليد نوروتوكسين شيگا مینماید. اين سم مشابه سم وروتوكسين1 است كه توسط سويه انتروهموراژيك اشریشیا کلی ترشح میشود و مكانيسم عملش مشابه با سم ریسین[6] كه يك لكتين گياهي است، میباشد. شيگاتوكسين موجب مرگ سلول اپيتليال كولون نمیشود، در حقيقت بنظر میرسد كه تهاجم به سلول، سبب مرگ سلول ميزبان میشود و سلول را سریعتر از سم شيگا میکشد. البته سویهای از شيگلا كه قادر به توليد سم شيگاست، عامل بيماري وخیمتری میشود و ممكن است بخاطر تخريب مویرگهای لامينا پروبريا پرزهای كولون، سبب کولیت ايسكميك و هموراژيك گردد.
توکسین شیگا جزء دستهای از توکسینها است که مکانیسم عمل آن تأثیر بر سنتز پروتئین است. توکسین شیگا دارای یک زیرواحد A (جزء فعال) و چند زیرواحد B (جزء متصلشونده به گیرنده) است. همه اجزاء سم در یک اپرون بیان میشود. زیرواحد B به Gb3 (گلوبوتری آسیل سرامید) متصل میشود و اجازه ورود زیرواحد A را به سلول میدهد. زیرواحد A یک باند N-گلیکـــــوزیدی در 28S rRNA را شکسته و سبب رهاسازی آدنوزین از موقعیت 4324 میشود، در نتیجه EF1 (فاکتور طویلسازی 1) غیرفعال شده و نمیتواند آمینواسیل tRNA را روی ریبوزوم بنشاند. بدین ترتیب مهار سنتز پروتئین موجب مرگ سلولی میگردد.
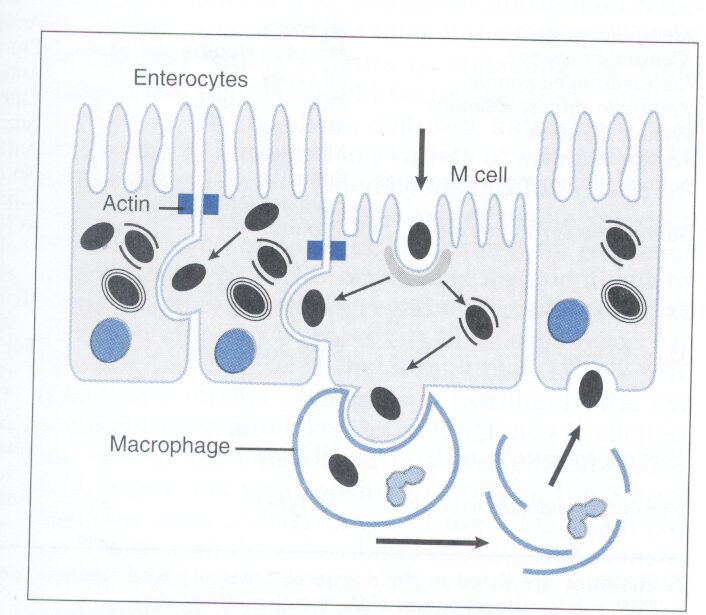
در چرخه عفونت شيگلا در طي روزهاي اول عفونت شيگلا، باكتري ابتدا روده كوچك را بهصورت گذرا آلوده مینماید و اسهال خوني زماني رخ میدهد كه كولون عفوني شده باشد. اين عفونت با عفونت فولیکولهای لنفوئيدي كولون كه غني از سلولهای M و مشابه پلاکهای پير[7] در رودهی كوچك است، آغاز میگردد. شيگلا میچسبد، بهصورت فاگوسيتوز مستقيم بلعيده میشود و از فاگوزوم آزاد میگردد.
باكتري درون سيتوپلاسم سلول، هر 40 دقيقه یکبار تكثير يافته و سلول آلوده را پر مینماید. بنظر میآید باکتریها بهواسطه رشتههای اكتين و در اثر فشار اين رشتهها، بدون اينكه به فضاي خارج سلولي وارد شوند، به جلو هل داده میشوند و مستقيماً از سلولي به سلول ديگر میروند. سپس بعضي از شيگلاها به بافت همبند (لاميناپروبريا) حمله كرده و با تحريك پاسخ ايمني سبب ايجاد زخم در محل تهاجم میشوند. پاسخ ايمني شامل PMNها و غشاء كاذب فيبريني است.
سم شيگا سبب التهاب، از طریق ایجاد ايسكمي و هموراژي میشود. سم شيگايي كه وارد جريان خون شود ممكن است سبب سندرم اورمي هموليتيك گردد. برخلاف سالمونلا، شيگلاها محدود به مخاط و زيرمخاط بوده و ندرتاً ايجاد باكتريمي يا سپسيس میکنند، هرچند امروزه بعضی محققان مطرح نمودند که این باکتریها بهخصوص شیگلا فلکسنری را، از اندامهایی مانند غدد لنفاوی، کبد، طحال و غیره ایزوله کردهاند، همچنین آنها مطرح نمودند که شیگلاها بهخصوص شیگلا فلکسنری سبب وولوواژینیت بدون عفونت ادراری در بالغین شده و این باکتریها بندرت سبب عفونت ادراری در بالغین میگردند.
علائم شيگلوزيس 2 تا 3 روز بعد از مواجهه با شيگلاها آغاز میشود. بيماري با تب ناگهاني، درد شكم و زورپيچ و اسهال همراه است. از دست دادن آب در طول اين دو سه روز ممكن است شديد باشد و زندگي كودكان و ساير افراد ضعيف كه تحمل از دست دادن آب و الكتروليت ندارند را به خطر بياندازد، سپس دلپیچه به همراه كاهش دفعات و حجم مدفوع ظاهر میشود.
شکل 1: تهاجم گونههای شيگلا به اپیتلیوم رودهای و تشكيل آبسههای مخاطي
(برگرفتهشده از Microbiology,T. Stuart Walker)
جدول 1: وجوه تمایز گونهها در جنس شیگلا
تشخیص آزمایشگاهی
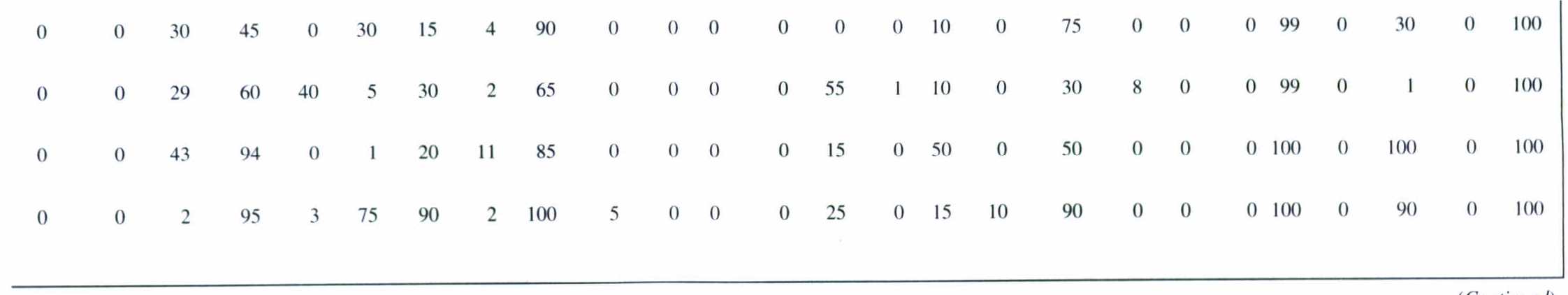
نمونههاي مدفوع، خون، CSF، مایع مفصلی، ضایعات کبدی، غدد لنفاوی، ضایعات واژن و غیره برای شناسایی شیگلاها استفاده میشود. براي تشخيص عامل اسهال خونی میتوان نمونههاي مدفوع را كشت داد. البته بهترين نمونه براي كشت، سواب ركتال از زخمي است كه در طي سيگموئيدوسكوپي بدست میآید. ديسانتري حاصل از شيگلا را بايد از بيماريهاي شبه ديسانتري حاصل از اشریشیا کلی انترواينوازيو، كمپيلوباكتر ژوژني و انگلهاي انتامبا هيستوليتيكا و بالانتيديوم كلی تشخيص داد. سيگموئيدوسكوپي نشان میدهد كه مخاط پرخون و هموراژيك است و حضور زخمهايي كه با غشاء كاذب فيبريني پوشيده شدهاند را آشكار میسازد. مشاهده مخاط، PMN و خون در مدفوع از مشخصههاي ديسانتري است و نشان میدهد كه ديواره روده مورد تهاجم قرار گرفته است. بعد از کشت نمونهها با بررسی تستهای بیوشیمیایی، جنس و گونههای شیگلا را تأئید قطعی میکنیم. در جدول زیر واکنشهای بیوشیمیایی گونههای مختلف جنس شیگلا جهت بررسی نهائی آنها نشان داده شده است.
جدول 2: واکنشهای بیوشیمیایی گونههای مختلف جنس شیگلا
در ضمن با کمک فلوچارت زیر میتوان با توجه بهخصوصیات بیوشیمیایی نظیر مانیتول، لاکتوز و اندول بهآسانی انواع شیگلاها را مورد شناسایی قرار داد.
ایجاد اسید از گلوکز
البته جهت سهولت در کار پس از شناسایی جنس شیگلا میتوان از روشهای سرولوژیک آگلوتیناسیون بهوسیله آنتیسرم اختصاصی شیگلا دیسانتری کمک گرفت و بهسهولت گونه شیگلا دیسانتری را شناسایی و تأیید نمود. ضمناً از آنجایی که در بعضی از انواع شیگلا مشابه با سالمونلاها آنتیژن K وجود دارد، در هنگام آگلوتیناسیون صفحهای با آنتی سرم O چنانچه آگلوتیناسیون بوجود نیاید، توصیه میشود که شیرابهای از باکتری را در محلول سرم فیزیولوژی بمدت 30 تا 60 دقیقه در حرارت 100 درجه سلسیوس جوشانده و مجدداً با همان آنتی سرم آزمایش تکرار گردد.
تشخیص سم شیگا
با توجه به اینکه شناسایی ایزولههای تولیدکننده شیگاتوکسین و خود سم در نمونههای بالینی بسیار مهم است، در ادامه به روشهای شناسایی آن اشاره میگردد.
بهطور کلی تشخیص سم شیگا بر سه محور استوار است:
الف- شناسایی سم شیگاتوکسین Stx
ب- جداسازی و شناسایی ژن تولیدکننده شیگاتوکسین
ج- جداسازی و شناسایی باکتریهای تولیدکننده شیگاتوکسین
الف– شناسایی سم شیگاتوکسین (Stx)
برای این منظور معمولاً از روشهای زیر استفاده میگردد که در ذیل به آنها اشاره میگردد.
1- سنجش سیتوتوکسیسیته سم با استفاده از کشت سلول
(Tissue culture cytotoxicity Assay):
در این روش توکسین Stx بر روی محیط کشت سلولی اثر داده میشود و با مشاهده اثرات سیتوپاتیک میتوان سم را شناسایی نمود. لازم به ذکر است که بهتر است جهت کشت سلولی از سلولهای کلیه میمون سبز آفریقای یا ورو (vero) بهجای سلولهای هلا (Hela) استفاده شود. به این دلیل که سلولهای ورو واجد گیرندههای سطحی Gb3 و Gb4 بوده و بهوسیله آنها قادر به شناسایی stx2e که فقط به Gb4 متصل میشود، هستیم ولی سلولهای هلا بدلیل فقدان گیرنده Gb4 در این زمینه از حساسیت کمتری برخوردار هستند.
بدیهی است که این روش دارای حساسیت بسیار بالایی است، ولی بدلیل استفاده از محیط کشت سلولی و روشهای مبتنی بر آن در آزمایشگاههای معمولی استفاده از این روش قابل دسترس نیست و از طرفی نیاز به محیطی بسیار ایزوله و استریل و همچنین دقت بالایی دارد.
2- روش الیزا
در این روش که از کیت الیزا و روشهای مبتنی بر کمپلکس آنتیژن- آنتیبادی استفاده میگردد، آنتیژن یا stx به آنتیبادی اختصاصی خود متصل شده و با ایجاد کمپلکس رنگی توسط دستگاه فوتومتر مخصوص که همان دستگاه الیزا ریدر است قابل شناسایی و تیتر است.
بدیهی است که این روش از نظر حساسیت از روش کشت سلولی پایینتر است، اما از نظر اختصاصیت اتصال به آنتیبادی منوکلونال و از طرفی در دسترس بودن، قابلیت تیتراسیون و عدم نیاز به محیط کاملاً استریل و ایزوله نسبت به روش کشت سلولی ارجحیت دارد.
3- روش رسوبی و ایمونودیفیوژن:
کمپلکسهای اختصاصی آنتیژن- آنتیبادی و واکنش متقاطع بهواسطه روشهای رسوبی در ژل شناسایی میشوند. در این روش آنتیبادی در غلظتهای معین همراه و مخلوط با ژل ساخته میشود. با حفر چاهکهای متعدد و تزریق موارد مشکوک به سم شیگا در هر چاهک و انکوبه کردن بمدت چند ساعت میتوان خط رسوبی سم شیگا و آنتیبادی اختصاصی آن را در اطراف چاهکهایی که از نظر وجود سم مثبت بودهاند را مشاهده نمود. این روش درواقع یک متد مشابه به الیزا بوده ولی با مکانیسم سادهتر انجام میگیرد. برای اندازهگیری میزان کمّی سم میتوان از غلظتهای استاندارد توکسین بهصورت سریالی استفاده نمود و پس از رسم منحنی استاندارد، غلظت سم مجهول را مشخص نمود.
ب- جداسازی و شناسایی ژن تولیدکننده شیگاتوکسین
دومین راه شناسایی سم شیگا استفاده از روشهای مولکولی و تشخیص ژن کدکننده توکسین در باکتری است. همانطور که در گذشته نیز اشاره گردید، ژنهای کدکننده شیگاتوکسین در شیگلا دیسانتری روی کروموزوم قرار دارند، درحالیکه در باکتری EHEC ژنهای کدکننده توکسین روی ژنوم باکتریوفاژ مستقر هستند، بدین منظور میتوان از روشهای متعددی استفاده نمود که در ادامه به برخی از آنها اشاره میگردد.
1- نشانگرهای (پروبهای) ژنتیکی:
نشانگرهای DNA همانند آنتیبادیها ابزار حساس و اختصاصی برای ردیابی و تعیین توالی اسید نوکلئوئیک کدکننده توکسین شیگا در نمونههای بالینی هستند. بهواسطه حساسیت و ویژگی روش DNA پروب میتوان گونههای تولیدکننده سم و ژنهای کدکننده توکسین را ردیابی نمود.
DNA پروب به شیوه شیمیایی سنتز شده یا بهواسطه کلون نمودن قطعات ژنومی توکسین شیگا در داخل ناقلین باکتریایی یا هر وکتور مناسب دیگر تهیه میگردند، سپس این پروبها با یک ماده رادیواکتیو نظیر P32 یا S35 یا مواد فلورسانس نشاندار میگردند. پس از ذوب نمودن (جدا نمودن رشتهها توسط حرارت)، DNA نمونه توسط مواد شیمیایی یا پروب به آن اضافه شده و اجازه هیبرید شدن داده میشود، توالیهای یکسان یا بسیار یکسان با یکدیگر هیبرید شده و بدین ترتیب میتوان ژنهای تولیدکننده و کدکننده شیگاتوکسین را ردیابی نمود و کمیت آنها را تعیین کرد. اندازهگیری و یا مشاهده میزان ساطع شدن مواد رادیواکتیو یا فلورسانس با میکروسکوپ ایمنوفلورسانس غیرمستقیم و یا با متد EIA میسر میگردد.
2- استفاده از روشهای مختلف PCR
با استفاده از واکنش زنجیره پلیمراز (PCR) یک کپی از DNA ژن کدکننده توکسین شیگا را میلیونها برابر تکثیر میکنیم و سپس توسط متد ژل الکتروفورز و رنگآمیزی توسط رنگهایی که با اسید نوکلئوئیک متصل میشوند قادر به شناسایی این ژنها میشویم. این روش یکی از جدیدترین روشهای تجزیه و تحلیل ژنتیکی محسوب میگردد.
3- استفاده از روش PCR-ELISA
در سالهای اخیر روشهای مختلف PCR، روشهای بالقوهای برای بهبود سرعت و حساسیت تشخیص گونههای مختلف شیگلا در نمونههای مختلف شیگلا در نمونههای مختلف فراهم کردهاند. روش مرسوم برای شناسایی و بررسی محصولات PCR، استفاده از ژل الکتروفورز و رنگآمیزی با اتیدیوم بروماید (Ethidium bromide) و دورگهسازی (Hybridization) است که علاوه بر زمانبر بودن، از مواد سمی مانند اتیدیوم بروماید نیز در این روش استفاده میشود. روش PCR-ELISA یک جایگزین مناسب برای مواد یادشده فوق است و سرعت و حساسیت قابلقبولی را در تشخیص مقادیر اندک توالیهای اختصاصی ژنهای بیماریزا فراهم میآورد. در این روش از ماده دیگوکسیژنین (Digoxigenin) استفاده میشود.
این ماده یک عصاره استروئیدی است که از گیاه puporea بدست میآید. دیگوکسیژنین روش تشخیص مناسب و غیر رادیواکتیوی را برای تشخیص محصولات PCR در قالب پلیتهای میکروتیتر(Micro titer Plates) ایجاد کرده است. در این روش آغازگر (Primer) به همراه دیگوکسیژنین در واکنش PCR بهکار میرود که منجر به ورود این ترکیبات به ساختار PCR میشود. محصولات تولیدشده در ظرفهای پوشیده از استرپتواویدین (Sterptoavidin) ریخته شده که بر اساس تمایل شدید اویدین (Avidin) و بیوتین (Biotin) به سطح ظرف میچسبند. در نهایت قطعه تکثیریافته حاوی دیگوکسیژنین با کمک آنتیبادی ضد دیگوکسیژنین کونژوگه (Conjugated) با آنزیم پراکسیداز (Proxidase) شناسایی میشود و درنهایت با الیزا ریدر نتایج خوانده میشود.
محاسن روش PCR-ELISA:
1- همانطورکه در بالا اشاره شد محدودیتهای موجود و معایب روشهای دیگر از جمله PCR را ندارد.
2- روش اختصاصی و سریع بوده و میتواند مدیریت کیفیت محصولات غذایی را در مقایسه با روشهای باکتریشناسی بهبود بخشد.
3- از ویژگی دیگر این روش تشخیصی میتوان به امکان آنالیز همزمان تعداد زیاد نمونهها با استفاده از میکروپلیتهای 96 خانهای اشاره کرد که بهخصوص در زمان شیوع همهگیری بسیار کاربرد دارد.
4- استفاده از روش Real Time PCR:
بدیهی است میتوان جهت شناسایی دقیقتر و سریعتر و همچنین شناسایی ژن کدکننده توکسین بهصورت کمّی از روش PCR کمّی استفاده نمود. در این روش برخلاف روش PCR معمولی که یک روشEnd point است و پس از اتمام سیکلها اندازهگیری و شناسایی روی ژل الکتروفورز انجام میگیرد، تکثیر در هر لحظه از زمان صورت میگیرد. در ضمن در این روش نیازی به ژل نیز وجود ندارد.
در روش Real Time نیازمند 1000 برابر کمتر از ژن توکسین برای شناسایی هستیم، در نتیجه قدرت شناسایی فوقالعاده بالا میرود. این روش اختصاصیتر، حساستر و تکرار پذیرتر است.
این روش که نیاز به دانش بسیار بالایی دارد مبتنی بر استفاده از پروبهای مخصوصی است که در سمت 5َ آن یک ماده فلورسانس رنگزا و در سمت 3َ آن یک ماده خاموشگر قرار گرفته است. وقتی ماده گزارشگر (فلورسانس) و اطفاکننده (خاموشگر) در مجاورت هم قرار بگیرند، اثر یکدیگر را خنثی میکنند. پس از تکثیر رشتهها همانند همان روشی که در PCR معمولی صورت میگیرد، ماده گزارشگر آزاد شده و میزان تشعشع آن توسط یک دوربین فوقالعاده حساس و دقیق دریافت میگردد و در نهایت این اطلاعات به قسمت آنالیزکننده دستگاه که یک کامپیوتر است منتقل شده و نمودارهای تکثیر رسم و آنالیز میگردند، از این رو محصول در PCR معمولی در آخرین فاز یعنی فاز پلاتو صورت میگیرد، ولی درReal Time منحنی محصول در فاز رشد بررسی میگردد. میزان خطا بسیار کم شده و دقت افزایش مییابد.
ج– جداسازی و شناسایی باکتریهای تولیدکننده شیگاتوکسین
باکتریهای غیر از شیگلاها که تولیدکننده سم شیگا هستند تیپهای مختلفی از انتروهموراژيك اشریشیا کلی میباشند. در این مقاله و مقاله گذشته به روشهای جداسازی و شناسایی آنها اشاره شد.
درمان و پیشگیری:
درمان شیگلوز تأمین آب و الکترولیت است. در موارد خفیفتر تجویز آنتیبیوتیک لازم نیست، ولی در موارد شدیدتر سیپروفلوکسازین داروی انتخابی است. از آنجایی که مقاومت چند دارویی در این باکتری شایع بوده و توسط پلاسمید انتقال مییابد، باید سنجش حساسیت آنتیبیوتیکها صورت گیرد. آمپیسیلین، تتراسایکلین، تریمتوپریم، سولفامتاکسازول و کلرامفنیکل مهارکننده شیگلا هستند. این آنتیبیوتیکها میتوانند حملات حاد بالینی دیسانتری را متوقف نموده و از طول مدت علائم بیماری بکاهند، ولی ممکن است نتوانند ارگانیسم را از رودهها ریشهکن کنند. مصرف داروهای ضد پریستالتیسم و اوپیوئیدها در شیگلوز ممنوع است زیرا باعث طولانی شدن تب، اسهال و تداوم دوره دفع ارگانیسم میشود. در بالغین اغلب بدون درمان آنتیبیوتیکی بهبودی بوجود میآید، اما باید بهطور کافی جایگزینی مایعات در آنها صورت گیرد. عوامل ضد اسهالی به دلیل احتمال طولانی شدن دوره بیماری نباید تجویز شود.
از آنجایی که انسان میزبان شناختهشده اصلی برای شیگلا است و این باکتری فقط در انسان ایجاد بیماری میکند و هیچ واکسنی علیه این بیماری در دسترس نیست، در نتیجه اقدامات پیشگیری بر چرخه انتقالی و حذف ارگانیسم از مخزن باید تمرکز پیدا کند. این اقدامات شامل کنترل بهداشتی آب، غذا، شیر، تخلیه صحیح فاضلاب و کنترل حشرات است. ناقلهای انسانی باید شناسایی و درمان شوند و تعداد دفعات شستن دست با صابون افزایش یابد و مادران شیرده بهجای استفاده از شیرخشک که با آب آلوده تهیه میشود، تشویق به استفاده از شیر خود برای تغذیه کودک خود شوند.
[1]Sh. dysenteriae
[2]Sh. flexeneri
[3]Sh. boydii
[4]Sh. sonnei
[5] -Invasion plasmid antigens
[6]– Ricin
[7] -Peyer’s patches
برخي از ويژگيهاي ایمنی شناختی سمهاي Botox
https://www.cdc.gov/shigella/index.html
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام