اصول بهینه تولید ویژه مراکز انتقال خون
راهنمای سازمان جهانی بهداشت
WHO Guidelines on Good Manufacturing Practices (GMP) for Blood Establishments
(قسمت هشتم)
علیاصغر صفری فرد
نویسنده و مدرس GMP, HSE, Cleanroom
خون و فرآوردههای خون
فرآوردههای خون ممکن است با استفاده از روش شرح دادهشده در بخش 2-4-9 تهیه گردد، البته توالی و نوع روشهای مورد استفاده در تولید فرآوردههای خون ممکن است از یک محصول با محصول دیگر متفاوت باشد.
فرآیند جمعآوری بر روی کیفیت اجزای خون تأثیر حیاتی دارند. اقداماتی نظیر روش تمیز و ضدعفونی کردن دست، استفاده از سیستمهای جمعآوری استریل و بستهبندی و نیز کنترلهای میکروبیولوژیکی مناسب باید اجرایی گردد. محدودههای زمانی باید برای فرآوری فرآوردههای خون تعریف شده باشند.
توصیهها در مورد آمادهسازی و تضمین کیفیت فرآوردههای خون بهطور مبسوط وجود دارد، برای مثال به راهنمای منتشرشده توسط کمیسیون اروپا رجوع کنید.
Guide to the preparation, use and quality assurance of blood components.
در بخشهای بعدی، مثالهایی از مهمترین فرآوردههای خون شرح داده شده است. در مواردی که الزامات نهاد نظارت ملی وجود دارد، باید از آنها پیروی نمود. خصوصیات تعدادی از فرآوردهها در زیر شرح داده شده است:
خون کامل
خون کامل برای ترانسفوزیون، خونی است که از اهداکنندهای که ارزیابی شده و از نظر معیارهای مرکز انتقال خون و نهاد نظارت ملی پذیرفته گردیده، گرفته شده است. خون کامل در کیسههای استریل، عاری از مواد تبزا و حاوی ضد انعقاد مناسب گرفته میشود. خون کامل ممکن است بدون عملیات فرآوری بعدی مورد استفاده قرار بگیرد. در برخی موارد، خون کامل برای تزریق ممکن است بعد از کاهش لکوسیتی مصرف شود.
دمای ذخیرهسازی خون کامل برای ترانسفوزیون باید مابین دمای 1 درجه سانتیگراد و 6 درجه سانتیگراد یا در یک دامنه دمایی دقیقتر که توسط نهاد نظارت ملی تعریف شده است، باشد. زمان نگهداری بستگی به محلول ضد انعقاد یا مواد نگهدارنده مورد استفاده دارد.
کنترل کیفیت دورهای باید بر روی فرآورده نهایی انجام شود تا اطمینان دهد که فرآیند تولید، ثابت و پایدار است.
حداقل، پارامترهای حیاتی زیر باید در حین ارزیابیهای کنترل کیفیت چک شوند:
- حجم
- هموگلوبین یا هماتوکریت
- همولیز در پایان زمان نگهداری
استفاده اصلی از خون کامل بهعنوان ماده منبع برای تولید فرآوردههای خون است. فرآیندهای حملونقل و مراحل تولید بعدی باید طوری صورت گیرد تا تعداد فرآوردههای خون که ممکن است از یک واحد خون کامل اهدایی تولید شود را افزایش دهد. بعد از جمعآوری، خون کامل باید در درجه حرارت کنترلشده مناسب برای تولید فرآوردههای موردنظر نگهداری شود و تا حد ممکن هر چه زودتر به مرکز تولید تحویل گردد.
اگر خون کامل در مرکزی بهجز مرکز فرآوری جمعآوری شده است، سیستم حملونقل معتبرسازیشده باید اطمینان دهد که دمای صحیح در طول فرآیندهای کاری حفظ شده و فرآورده در عرض 24 ساعت تحویل گردیده است. زمان مابین جمعآوری و مراحل فرآوری بعدی بستگی به نوع فرآورده دارد، اما نباید بیش از 24 ساعت طول بکشد.
همچنین خون کامل ممکن است برای کاهش محتوای گلبولهای سفید قبل از انجام مراحل فرآوری بعدی، فیلتر گردد.
فرآوردههای خون باید بهوسیله روش معتبرسازیشده که اختصاصات از قبل تعریفشده محصول را پوشش میدهند، تولید شوند.
گلبولهای قرمز تغلیظشده
فرآورده گلبولهای قرمز تغلیظشده بهوسیله سانتریفیوژ و خارج کردن پلاسما با یا بدون بافی کوت، بسته به پارامترهای سانتریفیوژ کردن، تهیه میگردد. متعاقب اضافه کردن بعدی یک مایع مغذی مناسب، گلبولهای قرمز باید هر چه زودتر تا حد امکان در دمای 1 درجه سانتیگراد تا 6 درجه سانتیگراد نگهداری شوند. بهطور جایگزین، گلبول قرمز تغلیظشده ممکن است با استفاده از سیستم آفرزیس تهیه و همانند روش قبلی در 1 درجه سانتیگراد تا 6 درجه سانتیگراد نگهداری شود. واحدهای گلبول قرمز که دمای آنها بعد از رسیدن به محل نگهداری به 10 درجه سانتیگراد افزایش یافته است، باید معدوم شوند. واحدهای گلبول قرمز تغلیظشده ممکن است بدون انجام عملیات فرآوری بعدی مورد استفاده قرار گیرند.
برای تهیه گلبولهای قرمز تغلیظشده که گلبولهای سفید آنها کاهش داده شده است، هم فیلتراسیون خون کامل میتواند قبل از جداسازی بهکار رود و هم فیلتراسیون بعدی گلبول قرمز تغلیظشده انجام شود. یک روند کاری معتبرسازیشدهی کامل باید برای مشخص کردن وضعیتهای مطلوب برای استفاده از متد کاهش لکوسیتی اجرایی گردد.
گلبولهای قرمز تغلیظشده باید تحت همان شرایط نگهداری خون کامل، نگهداری شوند. زمان نگهداری بستگی به محلول ضد انعقاد/ نگهدارنده مورد استفاده دارد.
برای تهیه فرآوردههای گلبول قرمز اختصاصی، روشهای بعدی آمادهسازی همانند اشعه دادن یا شستشو بهکار میرود و بستگی به اندیکاسیون و موارد مصرف بالینی دارد.
کنترلهای کیفی دورهای باید بر روی فرآورده نهایی انجام گیرد تا اطمینان دهد که فرآیند تولید پایدار است.
پارامترهای مورد ارزیابی بستگی به نوع فرآورده گلبول قرمز تغلیظشده دارد.
حداقل، پارامترهای مهم زیر باید در حین ارزیابیهای کنترل کیفی مورد بررسی قرار گیرند:
- حجم
- هموگلوبین یا هماتوکریت
- همولیز در پایان زمان نگهداری
- گلبولهای سفید باقیمانده، در صورتی که فرآیند کاهش لکوسیتی انجام گرفته است.
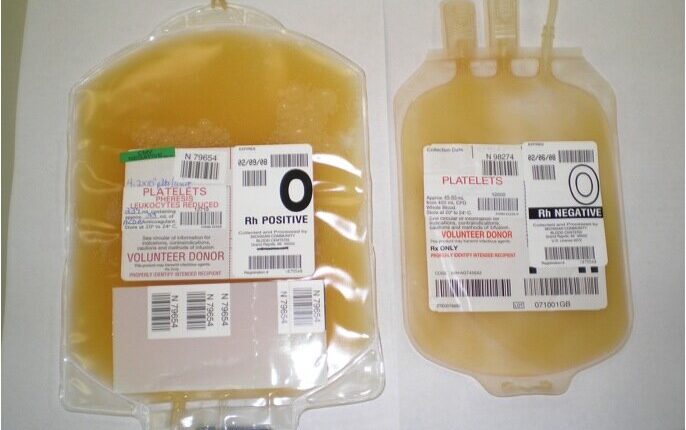
پلاکت تغلیظشده
فرآورده پلاکتی تغلیظشده یا از خون کامل جدا میشود و یا بهوسیله روش آفرزیس تهیه میگردد.
بعد از جمعآوری خون کامل، میتوان آن را در وضعیتهایی که سازگار با تهیه پلاسما است در دمای بین 20 درجه سانتیگراد تا 24 درجه سانتیگراد، معتبرسازیشده با پیروی از توصیههای نهاد نظارت ملی یا بینالمللی نگهداری نمود. واحد خون کامل سانتریفیوژ میشود، بهطوریکه تعداد مناسب و مطلوب پلاکت در پلاسما (پلاسمای غنی از پلاکت یاPRP ) باقی بماند، سپس با سانتریفیوژ دور تند فرآوردهی PRP بهدستآمده، واحدهای پلاکتی تغلیظشده تهیه میگردد و مجدداً به حالت سوسپانسیون درمیآید.
اگر خون کامل سانتریفیوژ شود بهطوریکه پلاکتهای خون بهطور اولیه رسوب کنند و در لایه بافیکوت باقی بمانند، لایه بافیکوت جدا میشود و برای تهیه پلاکت تغلیظشده تحت فرآوری قرار میگیرد. یک بافیکوت تکی یا مجموعهای از بافیکوتها در پلاسما با محلول مغذی مناسب رقیق میشود و سپس پلاکتها بهوسیله سانتریفیوژ مجدد تغلیظ میگردند. شمارش پلاکتی در هر واحد، بستگی به متد آمادهسازی دارد. شمارش لکوسیتی باقیمانده برحسب پارامترهای سانتریفیوژ کردن متفاوت است.
واحدهای پلاکتی تغلیظشده (حاصل از خون کامل و آفرزیس) باید در وضعیتهایی که حیات و فعالیتهای انعقادی پلاکتها را در حد مطلوب تضمین میکند، نگهداری شوند. دمای نگهداری باید بین 20 درجه سانتیگراد تا 24 درجه سانتیگراد باشد. چرخش آرام و مداوم پلاکتها در حین نگهداری باید کافی باشد تا دستیابی پلاکتها به اکسیژن تضمین گردد (اما باید تا حد امکان آرام باشد). زمان نگهداری پلاکتها باید مطابق با قوانین ملی توصیهشده توسط نهاد نظارت ملی تعریف شده باشد. در نبود اقدامات تکمیلی، این زمان نباید بهطور طبیعی بیشتر از پنج روز باشد.
در موارد خاص، فرآوردههای پلاکتی تغلیظشده کاهش حجم یافته، شستهشده یا اشعهدیده میتواند برای اهداف درمانی خاص تهیه گردد.
برای اطمینان از اینکه روند تولید مناسب است، کنترل کیفیت دورهای باید بر روی فرآورده نهایی انجام شود.
حداقل، پارامترهای حیاتی زیر باید در حین ارزیابیهای کنترل کیفی چک شوند:
- حجم
- شمارش پلاکتی
- باقیمانده گلبولهای سفید، اگر فرآیند کاهش گلبولهای سفید انجام شده است.
- PH، اندازهگیری در پایان طول عمر نگهداری توصیهشده
پلاسما برای ترانسفوزیون و پلاسما برای پالایش
پلاسما برای ترانسفوزیون از خون کامل و یا از پلاسمای جمعآوریشده به روش آفرزیس تهیه میشود و در طی دوره زمانی تعریفشده منجمد میگردد، دمایی که باید بهطور کافی فاکتورهای انعقادی ناپایدار مخصوصاً محتوی فاکتور VIII انعقادی را در وضعیت فعال سازگار با استفاده موردنظر از پلاسما، نگهداری میکند. محتوی فاکتور VIII انعقادی هم بهعنوان نشانگر کیفی و هم برای اطمینان از کارایی کرایوپرسیپیتیت مهم و حیاتی است .
اگر پلاسما از یک واحد خون کامل که در دمای 4 درجه سانتیگراد نگهداری شده است، جدا میشود، سانتریفیوژ کردن باید ترجیحاً در طی هشت ساعت بعد از خونگیری صورت گیرد.
اگر خون کامل بهسرعت به دمای 20 درجه تا 24 درجه سانتیگراد رسانده شود و بعد از جمعآوری در این دمای پایدار نگهداری گردد، جداسازی میتواند طی 18 تا 20 ساعت انجام شود زیرا دیده شده است در چنین وضعیتی فاکتور VIII انعقادی محافظت میشود.
اگر پلاسما بهوسیله آفرزیس جمعآوری شود، فرآیند انجماد باید هر چه زودتر آغاز گردد که این زمان بهطور مطلوب نباید بعد از 6 ساعت پس از انجام فرآیند آفرزیس باشد. باید به الزامات نهاد نظارت ملی در مورد محدودههای زمانی فرآوری، با توجه به محلول ضد انعقاد مصرفی و وسایل مورد استفاده و نیز محصولی که باید تولید شود، توجه نمود.
فرآیند انجماد باید معتبرسازی شده باشد و در یک سیستم که اجازه فریز کردن کامل را میدهد، مطابق با دمای مرکزی (core) از قبل تعریفشده و در یک زمان از قبل تعریفشده صورت گیرد.
پایداری فرآورده، وابسته به دمای نگهداری است. دمای نگهداری و طول عمر قفسهای بستگی به استفاده موردنظر از محصول دارد.
برای نگهداری و ذخیرهسازی طولانی مدت (بیشتر از یک سال) دمای نگهداری مطلوب، منفی 25 درجه سانتیگراد یا سردتر است.
برای اطمینان از اینکه فرآیند تولید پایدار است، کنترل کیفی دورهای باید بر روی فرآورده نهایی انجام شود.
حداقل، پارامترهای حیاتی زیر باید در حین ارزیابی کنترل کیفی چک شوند:
- حجم
- فعالیت فاکتور VIII انعقادی (بهویژه اگر پلاسما برای درمان کمبود فاکتور VIII انعقادی بهکار میرود)
- گلبولهای سفید باقیمانده، اگر فرآیند کاهش لکوسیتی انجام شده است.
- نشتی
- تغییرات چشمی
غیرفعالسازی ویروسی و یا قرنطینه پلاسما برای ترانسفوزیون در برخی کشورها اعمال میگردد. اطلاعات تکمیلی در مورد غیرفعالسازی ویروسی در راهنماهای سازمان جهانی بهداشت WHO و سایر انتشارات قابل دسترس است.
WHO guidelines on viral inactivation and removal procedures intended to assure the viral safety of human blood plasma products.
پلاسما برای ترانسفوزیون بهعنوان ماده منبع برای تولید فرآوردههای پالایششونده، بهویژه فرآورده فاکتور VIII تغلیظ شده و یا سایر فاکتورهای ناپایدار مناسب است. پلاسمای تهیهشده توسط سایر روشها باید اختصاصات پلاسمای مراکز پالایشکننده، الزامات فارماکوپه و نهاد نظارت ملی را پوشش دهد. اطلاعات تکمیلی در مورد تولید پلاسما برای پالایش در راهنماهای سازمان جهانی بهداشت WHO و سایر انتشارات قابل دسترس است.
WHO recommendations for the production, control and regulation of human plasma for fractionation.
کرایو پرسیپیتیت و پلاسمای فاقد کرایو
کرایو پرسیپیتیت، جزء کرایوگلوبولین پلاسما است و حاوی مقادیر زیادی از فاکتور VIII انعقادی، فاکتور فونویلبراند، فیبرینوژن، فاکتور XIII انعقادی و فیبرونکتین موجود در پلاسما است. کرایو پرسیپیتیت از پلاسمای منجمد تازه که به روشی از پایداری فاکتور VIII محافظت میکند، تهیه میشود. به پلاسما اجازه داده میشود که با قرار گرفتن در دمای 2 تا 6 درجه سانتیگراد در طول شب یا بهوسیله تکنیک ذوب سریع، ذوب گردد. پس از ذوب شدن، بهوسیله سانتریفیوژ کردن در دور بالا، پلاسمای فاقد کرایو که در بخش رویی قرار گرفته است و جزء کرایو پرسیپیتیت که در زیر قرار گرفته است، جدا میشوند. پلاسمای فاقد کرایو پرسیپیتیت به کیسه جانبی منتقل میگردد. هر دو فرآورده، مجدداً تا رسیدن به دمای مرکزی مناسب منجمد میشوند.
پایداری در حین نگهداری بستگی به دمای نگهداری دارد. دمای نگهداری و طول عمر قفسهای بستگی به نحوه مصرف فرآورده موردنظر دارد. برای نگهداری طولانی مدت (برای دو سال یا بیشتر) دمای مطلوب نگهداری منفی 25 درجه سانتیگراد یا سردتر است.
برای اطمینان از اینکه فرآیند تولید ثابت است، کنترل کیفی دورهای باید بر روی فرآورده نهایی انجام شود.
حداقل، پارامترهای حیاتی زیر باید در حین ارزیابیهای کنترل کیفی کرایوپرسیپیتیت چک شوند:
- حجم
- فعالیت فاکتور VIII انعقادی
- فیبرینوژن قابل انعقاد
- فعالیت فاکتور فونویلبراند (در صورت مصرف)
غیرفعالسازی ویروسی و یا قرنطینه کردن در برخی کشورها انجام میشود.
تحت شرایط خاص، استفاده از فرآوردههای مخلوط کوچک کرایوپرسیپیتیت (بهوسیله مخلوط کردن واحدهای کرایوپرسیپیتیت که از یک اهداکننده تهیه میشود) ممکن است مطلوب باشد.
تستهای آزمایشگاهی
تستهای غربالگری برای نشانگرهای بیماریهای عفونی
آزمایشهای موردنیاز
تستهای زیر که توسط تمام مراکز نظارتی اجباری هستند، مرتبط با تولید فرآوردههای خون هستند و باید بر روی هر مورد خون اهدایی بهصورت تکی انجام شوند:
- تست تأئیدشده برای آنتیژن سطحی هپاتیت B (HBsAg)
- تست تأئیدشده برای anti-HIV1/ HIV2
- تست تأئیدشده برای anti- HCV
پاسخ هر سه آزمایش باید منفی باشد. خونهای اهدایی که بهطور اولیه واکنش میدهند باید با همان روش، دوباره تست شوند. محصولات تهیهشده از خونهایی که در تست دوم واکنش دادهاند، نباید برای مصرف درمانی مورد استفاده قرار بگیرند و باید بهطور صحیح معدوم گردند، مگر اینکه برای اهداف غیر درمانی یا تحقیقاتی مصرف شوند. یک نمونه از خون اهداشده باید توسط تست تأئیدی ارزیابی شود. اگر تست تأئیدی مثبت شد باید سیستمی برای اطلاع به اهداکننده و مشاوره با وی وجود داشته باشد. توصیه شده است که الگوریتمهای ملی برای بررسی و تحلیل موارد ناسازگار و یا بینابینی یا نتایج تأئیدنشده ایجاد و مورد استفاده قرار بگیرند.
در برخی کشورها تستهای سرولوژیک دیگری نیز موردنیاز است؛ برای مثال تست anti-HBc ممکن است برای خونهای کامل اهدایی به منظور کاهش خطر تماس گیرنده با HBV توسط خون یا فرآوردههای خون آلوده، انجام شود. با توجه به وضعیت اپیدمیولوژیک در یک ناحیه یا کشور یا تواتر خون اهدایی، انجام تستهای دیگر برای سایر عوامل یا نشانگرهای عفونی همانند anti-HTLV I/II، anti-T.cruzi یا ویروس نیل غربی (WVN) ممکن است توسط نهاد نظارت ملی لازم باشد. در برخی کشورها علاوه بر آزمایش برای نشانگرهای ایمونوشیمیکال- سرولوژیکال بیماریهای عفونی، انجام تست NAT بر روی خونهای اهدایی جهت جستجوی ژنومهای ویروسی برای افزایش احتمال شناسایی اهداکنندههای آلوده صورت میگیرد.
در حین دوره طبیعی عفونت، ویرومی معمولاً بهطور مشخص در یک نقطه زمانی خاص، زودتر از زمانی که مارکرهای ایمونوشیمیکال (آنتیبادیها) را بتوان در سرم آلوده مشخص کرد، رخ میدهد، بنابراین عفونت ممکن است 50 یا 60 روز قبل از تغییر سرمی (برای مثال برای HCV ) رخ داده باشد. آزمایش برای بررسی حضور اسید نوکلئیک ممکن است برای ویروسهایی همانند HCV، HBV، HIV، HAV و WNV (در جایی که شرایط آن باشد) و یا پارو ویروس B19 انجام شود، همچنین کاربرد این فنآوری ممکن است به سایر میکروبهای قابل انتقال گسترش یابد. آزمایش NAT مخصوصاً به محیط آزمایشگاهی پیشرفته و مجهز، تجهیزات اختصاصی و کارکنان آزمایشگاهی ماهر و آموزشدیده نیاز دارد. به دلیل خطر بیش از حد معمول نتایج مثبت کاذب به علت وقوع پدیده carry over (انتقال اتفاقی ناخواسته DNA تکثیریافته به نمونههای اهداکننده سالم)، دقت در روند کاری و حمل و نقل اجباری است.
برخلاف آزمایش نشانگرهای سرولوژیکی نمونههای تکتک خون افراد، تست NAT ممکن است با اقداماتی نظیر مخلوط کردن چند نمونه و تبدیل آن بهصورت یک نمونه واحد انجام شود که به آن mini-pool میگویند. به هر حال این امر نیازمند سیستم کامل معتبرسازی شدهی برچسب زدن و شناسایی نمونهها، فرآیند مخلوط کردن معتبرسازی شده و الگوریتم معتبرسازی شده برای بررسی و تحلیل نتایج تکتک خونهای اهدایی است؛ بنابراین یک سیستم پشتیبانی اختصاصی ممکن است به منظور جمعآوری و برچسبزنی مناسب موردنیاز باشد که نهتنها در آزمایشگاه بلکه در مراکز انتقال خون هم ایجاد شود. ردیابی پیوسته نمونهها در تمام طول فرآیند از اهداکننده، حین مخلوط کردن، آزمایش و آزاد کردن خونهای اهدایی ممکن است یک نیاز چالشزا باشد.
باید یک سیستم در کشور یا ناحیه برای تأئید سیستمهای آزمایش همانند یک سیستم تأئید رسمی توسط نهاد نظارت ملی یا یک آزمایشگاه تعیینشده که برای این کار انتخاب گردیده است، وجود داشته باشد. حساسیت حداقل موردنیاز تستها برای آنتیژنها و یا آنتیبادیهای مختلف یا اسید نوکلئیک باید توسط نهاد نظارت ملی تعریف شده باشد.
مدیریت نمونهها و اطلاعات
به منظور پوشش دادن همه تستهای مورد لزوم (مانند گروهبندی ABO، نشانگرهای ویروسی و تست NAT) نمونههای متعددی ممکن است از یک اهداکننده گرفته شود. دستورالعملهای استاندارد اجرایی مکتوب که بهطور واضح فرآیندهای جمعآوری، حمل و نقل و برچسب زدن نمونههای اهداکننده (برای مثال خون کامل، سرم، ضد انعقاد، لولهها و بقیه) را شرح دهد و آن که فرآیند نمونهبرداری از مواد برای آنالیز (چگونه و توسط چه کسی باید انجام شود، حمل و نقل نمونه و شمارش نمونهها) را توضیح دهد، باید وجود داشته باشد. همه فعالیتهای غربالگری، مدیریت نمونههای اهداکننده، نمونهبرداری، تحلیل و پردازش اطلاعات باید از آزمایشهای تشخیصی بیماران جدا باشد.
برچسب زدن نمونه در مرکز جمعآوری و شناسایی در حین همه مراحل کاری بعدی، حیاتی است و باید در همه زمانها تحت کنترل باشد. هر مرحله از مراحل کاری باید شرح داده شود که شامل وضعیت مدیریت نمونه قبل از آزمایش (برای مثال سانتریفیوژ کردن)، نگهداری و حمل و نقل (طول زمان حمل و نقل، دما، نوع ظرف و نگهداری بعد از آزمایش) است.
تست سرولوژیکی باید بر روی نمونههایی که بهطور مستقیم از لوله اصلی به دستگاه آنالیزور منتقل شدهاند صورت گیرد.
نمونههای ثانویه تهیهشده از نمونه اصلی ممکن است برای انجام تست NAT بر روی مجموعههای مخلوطشده کوچک (mini-pool) مورد استفاده قرار گیرند.
باید نکات عملی زیر به منظور اطمینان از ردیابی و یکپارچگی نمونهها و اطلاعات مورد توجه باشند:
- در هنگام تحویل گرفتن نمونهها در آزمایشگاه، شناسایی نمونههای مثبت با نمونههایی که احتمال عفونت دارد باید بهطور دقیق مشخص شده باشد. شرایط کار با نمونه از جهت مطابقت با الزامات توصیهشده کارخانه تولیدکننده کیت آزمایشگاه، باید چک شود.
- نمونههای تقسیمشده برای آنالیز، از نمونه اصلی اهداکننده باید ترجیحاً بهوسیله تجهیزات نمونهبرداری خودکار تهیه شود.
- برای شناسایی دقیق همه موارد (اهدا، نمونه اهداکننده، نمونههای تقسیمشده کوچک و غیره) استفاده از سیستم بارکد توصیه میشود؛ بنابراین با شروع اهدا، بارکدها باید برای فرآیند برچسب زدن مورد استفاده قرار گیرند. در موارد نقص سیستم بارکدخوان و یا پردازندههای اطلاعات، باید یک سیستم مناسب برای وارد کردن دستی اطلاعات و ردیابی آنها در طول تمام روند کاری تا آزادسازی خونهای اهداشده برای ترانسفوزیون در دسترس باشد. مدیریت دستی اطلاعات باید شامل وارد کردن مستقل و دوباره اطلاعات به داخل پایگاه دادهها، ساختار و فرمت اطلاعات شامل چک الگوریتم دیجیتال یا یک تست خودکار برای شناسایی دو سری از اطلاعات باشد.
- تجهیزات پیپت کردن نمونهها و دستگاهها باید قبل از استفاده روتین، معتبرسازی گردد و باید گزارشهای مراحل معتبرسازی در دسترس باشند.
- کالیبراسیون تجهیزات پیپت کردن نمونهها باید بهطور دورهای انجام و مستند گردد.
فرآیندهای آزمایش و بعد از آزمایش
آزمایش اجزای خون باید مطابق با توصیههای شرکت تولیدکننده معرفها و کیتهای آزمایش انجام شود. تغییرات در دستورالعملهای تولیدکننده یا معرفها برای تستهای غربالگری اهداکننده باید معتبرسازی شوند. در جایی که موردنیاز است، قبل از اینکه متد بهینهسازیشده برای آزادسازی یک فرآورده خون مورد استفاده قرار گیرد، باید تأئید قبلی نهاد نظارت ملی کسب گردد. معرفهای آزمایشگاهی موردنظر برای استفاده طولانیمدت باید دارای برچسب حاوی اطلاعات تاریخ آمادهسازی، تاریخ انقضاء، شرایط اختصاصی نگهداری و امضاء کسی که آنها را تهیه کرده است، باشد. باید از دستورالعملها برای استفاده و نگهداری پیروی نمود.
الگوریتم غربالگری باید بهطور دقیق و مکتوب (برای مثال دستورالعملهای اجرایی استاندارد) برای حلوفصل نمونههایی که در آزمایش اولیه واکنش دادهاند و مراحل حل اختلافات در نتایج بعد از آزمایش دوباره، تهیه شده باشد. تمام اقدامات انجامشده باید اطمینان دهند که خون و فرآوردههای خون که در تست غربالگری برای نشانگرهای بیماریهای عفونی دوباره واکنش دادهاند از مصرف بالینی و درمانی خارج میشوند. مواردی که در تست تکراری پاسخ میدهند در یک محل نگهداری جداگانه و از قبل پیشبینیشده، باید دور از تمام فرآوردههای خون نگهداری شوند. برای پیشگیری از ورود مجدد ناخواسته چنین مواردی به چرخه انتقال خون، آنها باید معدوم شوند.
الگوریتمهای آزمایش باید جزئیات تست تأئیدی مناسب را شرح دهند.
در مورد نتایج واکنش داده در تستهای مجدد، باید از دستورالعملهای زیر که بهطور واضح تعریف شدهاند پیروی نمود که شامل این موارد هستند:
- اطلاعرسانی و معافیت اهداکننده
- معدومسازی خون اهداشده و فرآوردههای تهیه شده از آن
- ردیابی و معدومسازی فرآوردههایی که هنوز تاریخ انقضاء آنها به سر نرسیده است.
اگر فرآوردهها از چنین اهداکنندهای برای مراحل بعدی تولید ارسال شده است، برای ارزیابی ایمنی فرآوردههای تولیدشده و اینکه آیا فراخوانی موردنیاز است، باید فرآیندی وجود داشته باشد.
همچنین باید فرآیند کاری برای شروع لوکبکهای اهداکننده و یا گیرنده تعریف شده باشد. لوکبکها باید طوری طراحی شوند که زنجیره ترانسفوزیون اهداکننده- خون (یا فرآورده خون)- گیرنده بتواند بهصراحت امکان بازسازی داشته باشد. فرآیندها باید شامل اقدامات اطلاعرسانی و مشاوره باشند.
نکات عملی زیر باید به منظور اطمینان از اینکه تجهیزات مورد استفاده برای تست ویروسشناسی بهطور مناسب کار میکنند، مورد توجه قرار گیرند:
- باید مکانیسمی برای اطمینان از شناسایی نمونه مثبت و لینک به اهداکننده وجود داشته باشد. متد ترجیهی، لولههای نمونه واجد بارکد است.
- بهطور ایدهآل، به منظور کاهش خطر خطاهای انسانی و برای اطمینان از ردیابی کامل فرآیند آزمایش، علاوه بر معرف و نمونهها، فرآیندهای آزمایش باید خودکار باشند.
- اگر اضافه کردن معرفها و نمونهها یا آمادهسازی پلیتهای آزمایش بهصورت دستی انجام میشود، مستندات کامل هر مرحله باید نگهداری شود و از شناسایی پلیت آزمایش و جایگاه چاهکی که در آن نمونه واکنش داده است، اطمینان حاصل شود.
تفسیر شمارش کامل سلولهای خونی در بیماریهای سیستمیک- راهنمایی برای پزشکان
راهنمای تهیه دستورالعملهای اجرایی استاندارد (SOP) برای آزمایشگاه خون شناسی4
اصول بهینه تولید ویژه مراکز انتقال خون (7)
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام