روشهای عملی در Real-Time PCR
قسمت 4
نویسندگان:
شهرام شجاع (دانشجوی کارشناسی ارشد)
دکتر رضا میرنژاد (باکتریولوژیست- استادیار دانشگاه)
در سه قسمت گذشته تعاریف، کلیات، متدهای گوناگون، اصطــــــــــــلاحات متداول و روشهای عملی در Real-Time PCR ارائه گردید، در این مبحث سعی شده تا به صورت کاملاً عملی انجام تست و تفسیر نتایج و همچنین نکاتی در مورد تنظیم Baseline و Threshold Line آورده شود.
راهاندازي يك پليت به روش Absolute Quantitation در دستگاه ABI7500
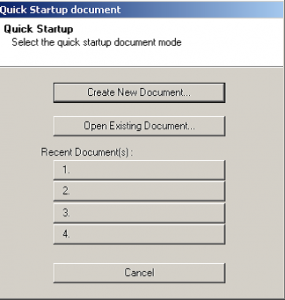
- ابتدا از منوي start بر روي نرم افزار برنامه كليك كنيد تا پنجره Quick start document باز گردد. (شکل 1)
شکل 1: باز کردن منوی Start
- سپس در همين پنجره بر روي باكس Create New Document كليك کرده تا پنــــجره New Document Wizard باز شود.
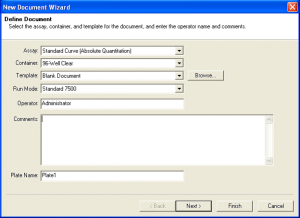
- سپس در پنجره New Document Wizard از قسمت Assay نـــــــــــــــــــوع آزمون (Absolute Quantitation) را انتخاب كنيد. در قسمت Comment ميتوانيد هرگونه ياداشتي كه داشته باشيد را مرقوم نمائید.
- در قسمت Plate Name براي آزمون خود يك نام انتخاب و سپس Next را كليك كنيد. (شکل2)
شکل 2: انتخاب نام و نوع آزمون
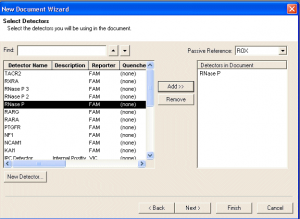
- در پنجره New Document Wizard جديدي كه باز ميشود، در قسـمت باكس Reference dye رنگ مرجع مورد استفاده در آزمون خود را انتخاب كنيد. بر روي Detector مورد نظرتان را هايلايت كرده و كلمه Add را كليك كنيد تا Detector مورد نظرتان براي آزمون انتخاب گردد. چنانچه Detector مورد نظر وجود ندارد براي ايجاد Detector جديد به قسمت بعد رفته و در پايان اين مرحله كلمه Next را كليك نماييد. (شکل 3)
شکل 3: نحوه انتخاب Detector
- در پنجره New Document Wizard جديدي كه باز ميشود براي هر چاهک آزمون نوع Detector و وظيفه آن را میتوان انتخاب کرد.
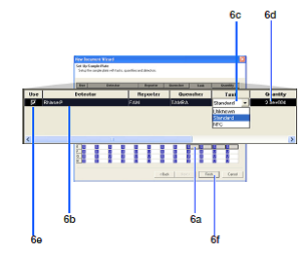
براي این منظور چاهک و يا چاهکهاي مورد نظر را با ctrl-click انتخاب کنيد (6a). سپس نام Detectorها براي چاهکهاي انتخاب شده را انتخاب نموده (6b)، سپس از گزينه Task نوع نمونه (Unknown يا standardيا NTC) انتخاب ميشود (6c). در باكس Quantity غلظت نمونه استاندارد را وارد و در پايان كلمه Finish را كليك كنيد. (شکل 4)
شکل 4: انتخاب وظیفه هر کدام از چاهکها وتعیین غلظت استانداردها
- سپس در پنجره جديدي كه باز ميشود كلمه Setup را انتخاب كرده و بر روي كلمه plate كليك كنيد تا پنجره آن باز شود. چاهک و يا چاهکهاي مورد نـظرتان را انتخاب نموده و بـا Right click بر روي دكمه موس گزينه well Inspector را انتخاب كرده و كليك نماييد. سپس در باكس sample name نام نمونه را انتخاب كنيد. در قسمت Detector تيك آن را بزنيد و در قسمت باكس reference day نام رنگ مرجع بكار رفته در آزمون را انتخاب كنيد و در پايان بر روي Close كليك نمائيد.
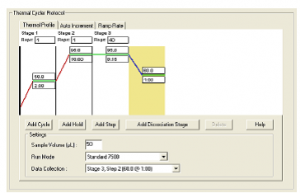
- در پايان براي بكار انداختن سيكلهاي حرارتي بر روي Instrument كليك كرده و در اين صفحه بر حسب اينكه آزمون شماOne step RT- PCR ياTwo step باشد سيكلهاي حرارت را در قسمت مربوطه تنظيم كرده و سپس در قسمت Sample Volume حجم واكنش و در قسمت Data Collection مشخص كنيد كه فلورسانس تابشي در كدام Stage@ step جمعآوري گردد. در پايان کلید Start را بزنيد كه دستگاه ضمن درخواست Save برنامه به كار ميافتد. (شکل 5)
شکل 5: انتخاب سیکلهای حرارتی
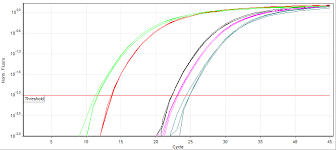
بـــــــــراي مشاهده لحظه به لحظه پيشرفت واكنش قسمت Result را كليك كرده و سپس Plot amplification را كليك كنيد و بر روي صفحه مانيتور لحظه به لحظه پيشرفت واكنش را مشاهده كنيد. معمولاً بر اساس اينكه تعداد كپي اوليه موجود در نمونه چقدر باشد ميتوان منحني تكثيري نمونه را مشاهده كرد. هرچه تعداد كپي اوليه عامل مورد نظر در نمونه بيشتر باشد در نتيجه Ct كاهش يافته و منحني زودتر رؤيت ميگردد. (شکل 6)
شکل 6: مشاهده قسمتهای مختلف آزمایش از روی صفحه مانیتور
آناليز دادهها و گزارش جوابها:
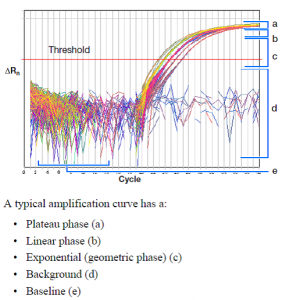
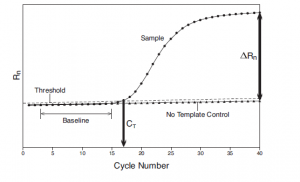
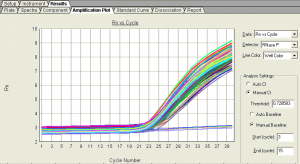
بطور كلي هر نمونه مثبت بايد داراي منحني تكثير (Amplification plot) با ويژگي و تعاريف زير باشد: (شکل 7)
شکل 7: منحني تكثير (Amplification plot)
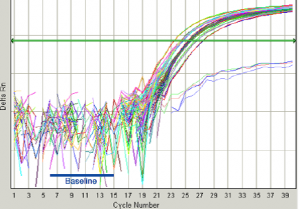
شکل 8: فازهای مختلف منحنی تکثیر
هر منحني بايد داراي سه فازBaseline ، Exponential وplateau باشد، در غير اين صورت جواب قابل قبول نيست (شکل 8).
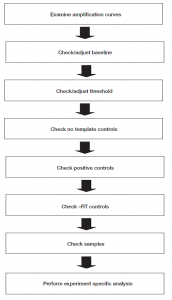
براي آناليز دادهها طبق نمودار شماره 1 عمل میگردد.
نمودار شماره 1: نحوه آنالیز دادهها
.تنظيم Baseline:
همانگونه که ذکر شد تنظیم Baseline و Thresholdدر کسب یک نتیجه درست و همچنین تفسیر صحیح نتایج بسیار مهم میباشد، برای این منظور به (شکل 9) دقت کنید.
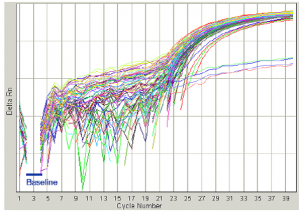
 |
در شكل مقابل baseline به خوبي تنظيم شده و بلافاصله چند سيكل بعد از Baseline منحنيهاي تكثيري شروع شده است. |
 |
در شكل مقابل baseline خيلي پائين انتخاب شده است كه در اين حالت بايد End cycle را افزايش داد. |
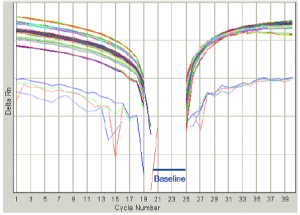 |
در شكل مقابل Baseline خيلي بالا انتخاب شده كه در اين حالت بايد End cycle را كاهش داد. |
شکل 9: نحوه تنظيم Baseline
تنظيم Threshold Line
روش تنظیم Threshold Line در شکل شماره 10 نشان داده شده است:
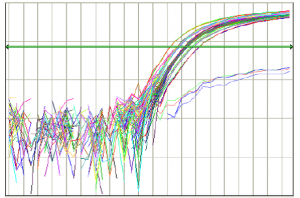 |
Threshold Line به خوبي تنظيم شده است |
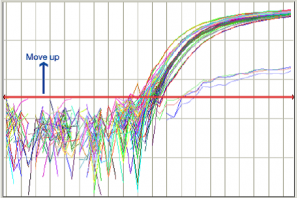 |
Threshold Line بالا كشيده شود. |
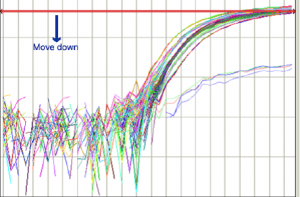 |
Threshold Line پائين كشيده شود. |
شکل 10: نحوه تنظيم Threshold Line
ساير پارامترها كه بايد ملاحظه گردد:
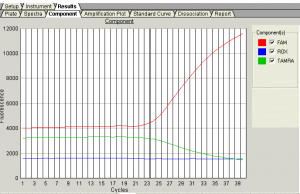
- قسمت Component Tab، كنترل كنيد اگر نمودار رنگهاي فلورسانس مورد در آزمون به شكل شماره 11 باشد، طبيعي است.
شکل 11: نمودار رنگهاي فلورسانس مورد در آزمون
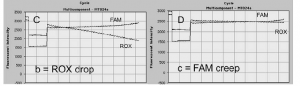
در موارد غير طبيعي ممكن است FAM creepو ROX drop اتفاق بيفتد. (شکل 12)
شکل 12
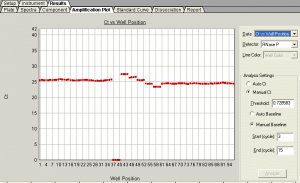
- Rn vs. Cycle (Linear) View
تشخيص تكثيرهاي واقعي بايد به شكل 13 باشـــــــــــــــــــــــــــــــــــــد كه با مشاهده Rn vs. Cycle (Linear) View مشخص ميگردد و هرگونه نمودار تكثيري كه مغايرت با آن داشته باشد بايد غير طبيعي در نظر گرفته شود.
شکل 13: منحنی تکثیری که به خوبی تکثیر در آن اتفاق افتاده است
- Rn vs. Cycle (Linear) View
با تنظيم اين پنجره Outlier مشخص ميشود و نشان ميدهد در كدام چاهک نمونه ما فاقد تكثير واقعي بوده است. (شکل 14)
شکل 14: منحنی تکثیری که به خوبی تکثیر در آن اتفاق نیفتاده است
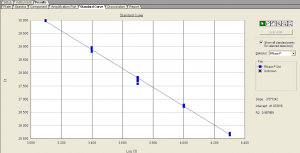
و در پايان بعد از كنترل و تنظيم موارد بالا بايد منحني استاندارد به فرم طبيعي زیر بدست آید (شکل 15).
شکل 15: منحنی استاندارد
يعني اينكه نمونهها و استـــــانداردها روي يك خط قرار گرفته باشند و Slop يا شيب منحني بايد 3.3 – تا 3.6 – باشد و بهترين شيب 3.32- است و R آزمون بالاي 0.98 باشد.
همچنين در يك آزمون نرمال بايستي نمونههاي استاندارد كه يك لگاريتم اختلاف غلظت دارند اختلاف Ct آنها 3.3 باشد.
Real-time PCR
روشهای عملی در Real Time- PCR
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام