تغییرات پروتئینها و ایزوآنزیمهای اختصاصی بافت قلب در انفارکتوس حاد میوکارد
مراد رستمي: کارشناس ارشد بیوشیمی بالینی، دانشگاه علوم پزشكي جندي شاپور اهواز
معصومه جرفی: کارشناس ارشد میکروبشناسی، دانشگاه علوم پزشكي جندي شاپور اهواز
مقدمه
وزن قلب حدود 500 گرم و بزرگی آن به اندازه مشت انسان است. قلب در هر دقيقه حدود 5 ليتر خون يا بيشتر (روزانه 7200 ليتر) را پمپ ميکند. خوني که به وسيله قلب جريان مييابد، نيازهاي غذايي و اکسيژن سلولها را تأمين ميکند. ایسکمی، مهمترین بیماری قلبی است که در نتیجه فقدان منبع خون کافی برای قلب رخ میدهد. عضله قلب به یک منبع تغذیه ثابت که توسط سیستم سرخرگ کرونری تأمین میشود، وابسته بوده و به آترواسکلروز بسیار حساس است.
آترواسکلروز، فرآیند مزمنی است که طی آن، آسیب به اندوتلیوم و تشکیل آسیبهای انسدادی عروق موسوم به پلاک، اتفاق میافتد. در مراحل اولیه آترواسکلروز، جریان خون کرونری به تدریج کاهش یافته، اما هنوز علائم و شواهد آزمایشگاهی آسیب قلبی وجود ندارد. هنگامی که قطر سرخرگ کرونری به کمتر از 20- 10 درصد مقدار اصلی خود کاهش یافته و هنگامی که نیاز به اکسیژن، افزایش مییابد (به ویژه در هنگام ورزش)، اغلب درد قفسه سینه (آنژین صدری) ظاهر میشود.
مهمترین بیماری قلبی، بیماری کرونر قلبی (Coronary heart disease ;CHD) است که میتواند منجر به انسداد حاد جریان خون کرونری موسوم به سندروم کرونری حاد (Acute coronary syndrome ;ACS) شود. ACS، با نکروز آشکار هر مقدار از میوکارد، به سکته قلبی (Myocardial infarction ;MI) معروف است.
تشکیل پلاک، موجب تحریک ترومبوز در سرخرگ کرونری و کاهش سریع جریان خون شده که در نهایت، به ACS منجر میشود. با قطع کامل جریان خون، عضله تغذیه شونده، به سمت آسیب غیرقابل برگشت ایسکمیک پیشرفت خواهد کرد و سندروم MI ایجاد خواهد شد. در انسداد ناکامل، ممکن است از آسیب غیرقابل برگشت عضله قلب، جلوگیری شود، اما بیمار آنژین شدیدی را حتی در هنگام استراحت، موسوم به آنژین ناپایدار (Unstable angina; UA) تجربه خواهد کرد. به طیف وسیعی از بیماریهای قلبی که در اثر نارسایی جریان خون کرونری ایجاد میشوند، CHD گفته میشود.
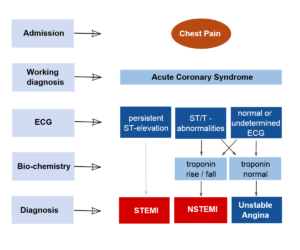
بررسیهای اولیه برای شناسایی ACS، شامل الکتروکاردیوگرافی (ECG) و اندازهگیری مارکرهای قلبی میباشد.
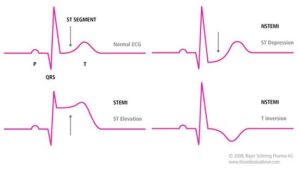
تقسیمبندی سکتههای قلبی بر اساس تغییرات ECG:
1- سکتههای همراه با بالا رفتن قطعه ST (elevation myocardial infarction; STEMIS segment-ST):
سکتههای شدید قلبی اغلب در آسیب ترانسمورال به میوکارد دخالت دارند که باعث ظهور سریع بالا رفتن قطعه ST و تأخیر امواج Q شده و به STEMIS موسوم میباشند. ACS همراه با بالا رفتن segment-ST معمولاً بر اثر انسداد کامل عروق بوده که به نوبهی خود منجر به انفارکتوس میوکارد میگردد. درمان این افراد با برقراری مجدد جریان خون در رگ از طریق درمانهای ترمبولیتیک یا جراحی عروق کرونر امکانپذیر میباشد.
2- سکتههای غیر از افزایش ST (non-ST segment elevation myocardial infarction; NSTEMIS):
سکتههایی که به مقدار کمتری از عضله قلب آسیب میرسانند و ممکن است فقط محدود به آسیب زیر اندوکارد شوند، با بالا رفتن قطعه ST و تأخیر امواج Q همراه نبوده و به سکتههای غیر از موج Q یا سکتههای غیر از افزایش ST (NSTEMIS) موسوم میباشند. ACS بدون بالا رفتن ST-Segment، در اثر انسداد جزئی عروق کرونر ایجاد میشود. نمودار بالینی این بیماران کاملاً متنوع بوده و از آنژین قفسه صدری تا MI را شامل میشود. در هر دو حالت فوق، ضایعات بافت میوکارد بر اثر انسداد عروق ناشی از تشکیل لخته یا در اثر آمبولی ایجاد میشود.
آسیب قابل ملاحظه عضله قلب، خطرات بیشتری برای کاهش توانایی قلب در پمپ کردن خون دارد که به سندروم نارسایی قلب (Heart failure ;HF) میانجامد.
عضله قلبی نسبت به سلولهای دیگر (مانند نرونها و سلولهای اپیتلیال کلیوی که در مدت کوتاهی پس از ایسکمی دچار مرگ سلولی میشوند) نسبتاً به ایسکمی مقاوم است. در حیوانات آزمایشگاهی، انسداد کامل جریان خون به قسمتی از قلب، حداقل تا 30- 20 دقیقه باعث مرگ سلولی (MI) نمیشود. با انسداد کامل سرخرگ کرونری، معمولاً گرادیانی از ایسکمی وجود دارد و محرومیت از اکسیژن در مناطقی که در مرحله آخر، جریان خون دریافت میکنند (قسمت زیر اندوکارد دیواره بطن)، وخیمتر میباشد.
سلولهایی که در حاشیه بین میوکارد ایسکمیک و میوکارد با خونرسانی طبیعی قرار دارند، ممکن است مقداری اکسیژن دریافت کنند و بنابراین ممکن است که چند ساعت زنده بمانند. افزایش مدت ایسکمی، باعث افزایش درصد سلولهایی میشود که در معرض خطر مرگ قرار دارند. ایسکمی به مدت 3 ساعت، مرگ سلولی را به 80 درصد سلولهای در معرض خطر افزایش میدهد؛ در صورتی که در ایسکمی 6 ساعته، 100 درصد سلولها دچار مرگ سلولی میشوند، از این رو، تشخیص زودرس ایسکمی و مداخله برای برگرداندن جریان خون، موجب به حداقل رساندن مرگ سلولی خواهد شد.
پاتوبیولوژی آترواسکلروز و ACS:
پاتوبیولوژی آترواسکلروز و ACS، به صورت کامل شناخته نشده است. تشکیل پلاکهای انسدادی احتمالاً با آسیبهای غیرانسدادی که به عنوان رگههای چربی شناخته میشوند، شروع شده که در سرخرگهای کرونری افراد جوانی که در جنگ و یا تصادف کشته شدهاند، مشاهده شدهاند. این آسیبها، احتمالاً توسط برداشت ذرات LDL اکسیده شده توسط ماکروفاژها، شروع شده که سپس به اندوتلیوم عروق کرونر نیز کشیده میشود. سلولهای التهابی و حدواسطهای التهابی، در پیشرفت این صدمات نقش دارند. این صدمات سرانجام به ساختارهایی حاوی هسته لیپیدی (بیشتر استرهای کلسترول) تبدیل شده که توسط چندین ماکروفاژ و سلولهای التهابی احاطه شدهاند و توسط کلاهکی از بافت همبند اندوتلیالی شده، پوشیده میشوند. این صدمات پیشرفته همچنین حاوی رگهای خونی جدید و ذخایر کلسیمی میباشند.
پلاکهای موجود در سرخرگهای کرونری، قبلاً به صورت سدهای غیرفعال و از نظر فیزیولوژیک، برگشتناپذیر جریان خون بشمار میآمدند، اما در سالهای اخیر، نقش فعال آنها در ایجاد ACS، بیشتر مشخص شده است. تعادل حدواسطهای التهابی، نیروهای برشی و عوامل دیگر میتواند باعث مستحکم شدن یا ضعیف شدن کلاهک فیبری پلاکها شوند. تحلیل کلاهک میتواند موجب آشکار شدن مواد ترومبوژنیک شده و منجر به رسوب پلاکتها و در نهایت، وسیع شدن آسیب گردد. پارگی پلاک، باعث ترومبوز همراه با انسداد کافی و ایجاد ACS میشود. استاتینها (داروهای مهارکننده HMG-CoA ردوکتاز؛ کاهندههای کلسترول) میتوانند بدون کاهش قابل ملاحظه مقدار انسداد (که به وسیله آترواسکلروز ایجاد شده است)، خطر ACS را کاهش دهند. وسعت بیماری آترواسکلروز در جریان خون کرونری، توسط آنژیوگرافی و آزمایشات دیگر، قابل تشخیص میباشد.
عوامل خطر کلینیکی برای CHD:
- استعمال دخانيات
- هيپرتانسيون (140/90 BP ≥ با داروهاي ضد فشارخون)
- HDL-C پايين (mg/dl 40 >)
- تاريخچه فاميلي CHD نابالغ (CHD در مردهاي با درجه اول خويشاوندي بيشتر از 55 سال؛ CHD در زنان با درجه اول خويشاوندي بيشتر از 65 سال)
سن (45 ≤ مردان؛ 55 ≤ زنان)
- چاقی
- عارضه ديابت
- CHD موجود از قبل
- شیوه زندگی کم تحرک
نارسایی قلبی (HF)
مهمترین بیماری قلبی پس از CHD، HF بوده که اغلب نتیجه مستقیم خود CHD میباشد. HF، یک سندروم بالینی است که با علائم مشخص و برجسته شامل خستگی، کوتاه بودن تنفس و ادم (در نتیجه اختلال در توانایی پمپاژ قلبی)، شناسایی میشود. شایعترین علت این بیماری، آسیب به میوکارد (مانند CHD) میباشد. به علت شیوع بالای CHD و بهبود زندگی افرادی که از این بیماری رنج میبرند، HF یک مشکل شدیداً رو به افزایش به ویژه در افراد میانسال میباشد. HF همچنین به وسیله مشکلات مکانیکی (مانند بیماری دریچهای)، که در عمل پمپاژ قلب مداخله میکنند، ایجاد میشود.
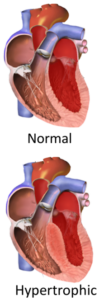
سندروم کاردیومیوپاتی هیپرتروفیک (Hypertrophic Cardiomyopathy; HCM)
سندروم کاردیومیوپاتی هیپرتروفیک (HCM)، شایعترین علت مرگ ناگهانی در جوانان بوده و در هر 1 نفر از 500 نفر، اتفاق میافتد. بیش از 240 جهش به این اختلال مربوط شده که پروتئینهای مختلف دستگاه انقباض (شامل تروپونینها، اکتین و میوزین) را تحتتأثیر قرار داده و معمولاً به صورت اتوزوم غالب به ارث میرسند.
سندروم QT طولانی (Long QT syndrome; LQTS)
سندروم QT طولانی (LQTS) ، یک اختلال در رپلاریزاسیون بطنی است که میتواند موجب مرگ ناگهانی شود. دارای چندین واریانت جداگانه بوده که به صورت اتوزوم غالب و جهشهای مغلوب در کانالهای یونی و پروتئینهای دیگر ایجاد میشود.
مارکرهای آسیب میوکارد
آنزیمهای ترانسآمیناز شامل AST (Aspartate Aminotransferase) و ALT (Alanine Aminotransferase)، جزو نخستین آنزیمهایی هستند که به عنوان مارکرهای آسیب میوکارد شناخته شدند. البته هماکنون بجز در موارد خاص، از ترانسآمینازها در تشخیص آسیب میوکارد استفاده نمیشود.
هنگامی که سلولهای عضله قلب در اثر ایسکمی آسیب میبینند، سطح AST سرم در طی 8-6 ساعت شروع به افزایش نموده و در طی 48-24 ساعت به بیشترین مقدار خود میرسد. پس از آن نیز شروع به کاهش نموده و در طی 96-72 ساعت پس از وقوع ایسکمی، سطح AST در صورت عدم ایسکمی مجدد، به حد طبیعی خود برمیگردد. در MI، میزان AST خیلی بیشتر از میزان ALT میباشد. چنانچه در جریان MI، میزان ALT نیز به مقدار قابل ملاحظه ای افزایش یابد، ممکن است حاکی از نرسیدن خون به کبد بر اثر MI و نکروز بافت کبد باشد.
به منظور کنترل سطح چربیهای خون، داروهای خانواده استاتین (بازدارنده های HMG-CoA ردوکتاز) به طور گستردهای مورد استفاده قرار میگیرند. یکی از عوارض جدی این داروها، اثر سمی روی کبد (Liver toxicity) است. بنابراین لازم است که 12-6 هفته پس از شروع درمان با استاتینها، ترانسآمینازها (AST و ALT) بررسی شوند.
لاکتات دهیدروژناز (Lactate Dehydrogenase; LDH; LD)
آنزیم LDH حاوی 5 ایزوآنزیم LDH1 تا LDH5 میباشد. LDH1 و LDH2 در عضلات قلبی و گلبولهای قرمز، LDH3 در ریهها و LDH4 و LDH5 در کبد و عضلات اسکلتی یافت میشوند. LDH میتواند به صورت توتال و یا به صورت هر کدام از ایزوآنزیمهای 5گانهی آن اندازهگیری شود. اندازهگیری ایزوآنزیمهای آن میتواند به افتراق و تشخیص بافتی که مسئول افزایش LDH میباشد، کمک نماید.
LDH نیز میتواند در موارد شک به MI، ارزیابی شود؛ اگرچه اکنون با وجود سایر آزمایشها (از قبیل تروپونین و
CK-MB)، کمتر مورد استفاده قرار میگیرد. LDH تقریباً 12 ساعت پس از آسیب بافتی در خون پدیدار شده و در
48-24 ساعت پس از ایجاد آسیب، به حداکثر مقدار خود میرسد. مقدار ماکزیمم LDH، متعاقب سکته قلبی ممکن است به 800-300 واحد در لیتر برسد. سطح LDH تقریباً به مدت 10 روز بالا باقی خواهد ماند. در موارد شک به وجود سکته قلبی، سطح LDH توتال به همراه ایزوآنزیمهای LDH1 و LDH2 معمولاً افزایش دارند که البته افزایش LDH1 از LDH2 بیشتر خواهد بود.
در افراد سالم، میزان ایزوآنزیمهای LDH به صورت زیر خواهد بود:
LDH2 > LDH1 > LDH3 > LDH4 > LDH5
متعاقب بروز MI، ترتیب این ایزوآنزیمها به صورت زیر درمیآید:
LDH1 > LDH2 > LDH3 > LDH4 > LDH5
به الگوی افزایش یافته LDH1 > LDH2 در بیماران دچار MI، الگوی Flipped گفته میشود.
کراتینکیناز (Creatine Kinase ;CK)؛ کراتینفسفوکیناز (Creatine Phosphokinase ;CPK):
کراتینکیناز میتواند به صورت توتال و یا به صورت هر کدام از ایزوآنزیمها به صورت جداگانه اندازهگیری شود. ایزوآنزیمهای CK عبارتند از:
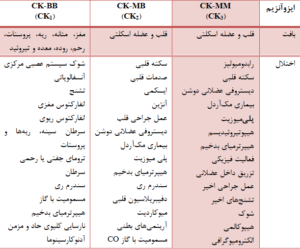
CK1 (CPK-BB): به صورت عمده در بافت مغز و عضلات صاف ریهها یافت میشود.
CK2 (CPK-MB): به صورت عمده در بافت قلبی یافت میشود.
CK3 (CPK-MM): به صورت عمده در عضلات اسکلتی یافت میشود.
جدول: جايگاه بافتي ايزوآنزيمهاي كراتين كيناز و اختلالات منجر به افزايش آنها در سرم
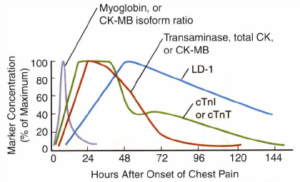
CK تقریباً 6-3 ساعت پس از ایجاد آسیب بافتی در گردش خون ظاهر شده و در طی 24-18 ساعت پس از ایجاد آسیب به بیشترین مقدار خود رسیده و سطح آن تقریباً 3-2 روز بالا باقی میماند، بنابراین CK یکی از آنزیمهای اولیه قلبی بوده که پس از وقوع انفارکتوس میوکارد شروع به افزایش مینماید.
از آن جایی که استاتینها میتوانند موجب افزایش سطح کراتینکیناز شوند، از این رو بر اساس توصیه
Adult treatment panel III (ATPIII)، قبل از شروع درمان با استاتینها، باید سطح پایه CK فرد اندازهگیری شود تا در موارد موردنیاز، این افزایش سطح CK موجب ارائه یک تفسیر اشتباه نشود.
ایزوآنزیم MB کراتین کیناز (CK-MB)
CK2 (CPK-MB) به صورت عمده در بافت قلبی یافت میشود. از ایرادهای این ایزوآنزیم، به غیراختصاصی بودن آن برای قلب میتوان اشاره کرد، از این رو، برای تفسیر نتایج آن از نسبت آن به مقدار کل CK (CK-MB/CK) استفاده میشود. مهار ایمونولوژیکی (Immunoinhibition)، اجازه مهار ایزوتوپ M از ایزوتوپهای دایمر CK را فراهم میکند. در نتیجهی مهار جزء M، تنها جزء B از CK اجازه شرکت در واکنش را خواهد یافت.
مقدار نرمال
مقدار طبیعی درصد ایزوآنزیم MB کراتین کیناز (%CK-MB) در روش الکتروفورزیس، کمتر از 3/9% و در روش ایمونواسی، کمتر از 5 میکروگرم در لیتر (5 نانوگرم در میلی لیتر) میباشد.
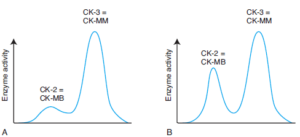
تصویر: تفکیک ایزوآنزیمهای CK در سرم یک فرد سالم (A) و در یک بیمار با سکته قلبی حاد (B)
نسبت CK-MB به CK توتال (CK-MB/CK Ratio)
به نسبت CK-MB به CK توتال (CK-MB/CK Ratio)، نسبت ایندکس نسبی (Relative index; RI) یا درصد نسبی گفته میشود. RI بالا، بیشتر بیانکننده آسیب قلبی میباشد. برای این که این نسبت، بیان کننده MI باشد، باید هم نتیجهCK-MB بیشتر از ng/ml 5 و هم مقدار RI باید از 2% بالاتر باشد.
ایزوفرمهای کراتینکیناز
در الکتروفورز با تفکیک بالا (High Resolution electrophoresis)، کراتینکیناز سرم دارای ایزوآنزیمهای CK-MM و CK-MB هتروژن میباشد. CK-MB دارای 2 باند و CK-MM دارای 3 باند مجزا میباشد. این زیرگونههای آنزیمی به عنوان ایزوفرم شناخته شده و در اثر عمل کربوکسیپپتیدازهای سرم که لیزین انتهایی زیرواحد M را میشکنند، افزایش مییابند، بنابراین اگر CK-MB، لیزین جدا شده نداشته باشد، CK-MB2 و اگر دارای یک لیزین جدا شده باشد،
CK-MB1 نامیده میشود. در مورد CK-MM نیز چنانچه لیزین جدا شده نداشته باشد، CK-MM3، اگر دارای یک لیزین جدا شده باشد، CK-MM2 و اگر دارای 2 لیزین جدا شده باشد، CK-MM1 نامیده میشود. شکستن این لیزینها تنها بعد از این که آنزیم طبیعی در اثر آسیب بافتی به گردش خون آزاد شد، اتفاق میافتد. در MI حاد، ایزوفرمهای طبیعی (بافتی) CK-MB2 و CK-MM3 به داخل خون آزاد شده و چندین ساعت طول میکشد که به ترتیب به ایزوفرمهای CK-MB1 و CK-MM2/ CK-MM1تبدیل شوند، بنابراین نسبت بالای MB1/ MB2یا MM3/MM1 نشان میدهد که آزاد شدن آنزیمها به تازگی اتفاق افتاده است. این افزایش نسبت معمولاً به مدت کوتاهی قبل از این که مقدار خالص و کلی MB سرم از محدوده رفرانس بالاتر رود، مشاهده میشود، بنابراین در 4- 3 ساعت اول بعد از شروع علائم بالینی، حساسیت تشخیصی MI بسیار مناسب میباشد.
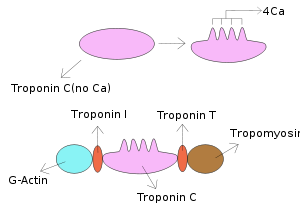
تروپونین قلبی (Troponin)
تروپونین (Tn)، یک کمپلکس تنظیمی از 3 پروتئین (TnT، TnI و TnC) است که در فواصل منظم در رشتههای نازک عضله مخطط قرار گرفته است.
| عملکرد | نوع زیرواحد | وزن ملکولی | نوع تروپونین |
| به تروپومیوزین متصل شده و باعث تشکیل کمپلکس تروپونین- تروپومیوزین میشود | زیرواحد متصل شونده به تروپومیوزین | 37 kDa | TnT |
| به اکتین در میوفیلامنتهای نازک متصل شده و به نگه داشتن کمپلکس تروپونین- تروپومیوزین در محل خود کمک میکند | زیرواحد مهاری | 24 kDa | TnI |
| با اتصال به کلسیم، موجب تغییر فضایی در TnI میشود | زیرواحد متصل شونده به کلسیم | 18 kDa | TnC |
تروپونین در عضله قلبی و اسکلتی وجود دارد. تروپونین C برای قلب، اختصاصی نبوده و بنابراین از آن در تشخیص آسیبهای قلبی استفاده نمیشود. اما تروپونینهای I و T دارای ایزوفرم قلبی بوده که برای قلب اختصاصی بوده و بنابراین از آنها در تشخیص آسیبهای قلبی استفاده میگردد.
در میوسیتهای قلبی، cTnT و cTnI، اغلب به فیبرهای عضلانی متصل بوده و فرم اتصال یافته، طی یک دوره 2- 1 هفتهای پس از انفارکتوس میوکارد، به آهستگی آزاد میشوند. بنابراین اگرچه cTnT و cTnI، پروتئینهای نسبتاً کوچکی هستند که به سرعت از جریان خون پاک میشوند، اما سطح پلاسمایی آنها بعد از آسیب قلبی، به آهستگی کاهش مییابد. مقدار کمی از cTn در سلولهای میوکارد، درون سیتوپلاسم آزاد هستند که از این مقدار، تقریباً 6% cTnI و تقریباً 5- 2% cTnT میباشد. این جزء سیتوپلاسمی آزاد، اجازه نشت سریع از سلولهای میوکارد آسیبدیده را پیدا نموده و تابلویی زمانی شبیه تابلوی زمانی CK-MB را در تشخیص MI فراهم میآورد. cTn، 24 ساعت پس از MI، به بالاترین سطح خود میرسد.
به دلیل رهاسازی آهسته cTn متصل به فیبرهای عضلانی، کاهش سریع در cTn گردش خون دقیقاً پس از مقدار حداکثر خود، معمولاً توسط یک پلات و حتی افزایش جزئی ثانویه همراه است. اهمیت این نکته در آن است که این افزایش نباید به عنوان سکته مجدد تفسیر شود. cTn گردش خون تقریباً 10- 5 روز پس از سکته، بسته به مقدار و شدت سکته، به مقدار پایه کاهش مییابد. افزایش cTnها مختص MI نبوده و در مواردی از قبیل پریکاردیت، میوکاردیت، آمبولیسم ریوی، نارسایی کلیوی و … نیز مشاهده میشود. از این رو، برای تفسیر وجود MI، نباید تنها به این آزمایشها به تنهایی اکتفا گردد.
معیارهای سازمان جهانی بهداشت، برای تشخیص AMI شامل حداقل دو مورد از سه مورد زیر میباشد:
1ـ علائم بالینی مطرح کننده بیماری ایسکمیک قلب
2ـ تغییرات نوار قلب (ECG)
3ـ افزایش و سپس کاهش نشانگرهای قلبی سرم
اغلب بیماران با علائم ایسکمیک میتوانند دارای ECG منفی یا مبهم و تستهای منفی مارکرهای قدیمی مانند CK-MB باشند، اما افزایش مشخص (هرچند بسیار جزئی) در cTn را داشته باشند.
تصویر: تغییرات آنزیمهای قلبی در سرم متعاقب وقوع انفارکتوس میوکارد
تصویر: زمان افزایش و مدت زمان حضور مارکرهای قلبی از زمان شروع سکته قلبی حاد
میوگلوبین
میوگلوبین یک هموپروتئین است که در عضله اسکلتی و قلبی به اکسیژن متصل شده و تنها یک نوع از آن در هر دو نوع عضله وجود دارد. میوگلوبین دارای وزن ملکولی 18 کیلودالتون بوده و نشت و خروج آن از سلولهای آسیبدیده، بسیار سریعتر از سایر پروتئینها میباشد. افزایش سطح سرمی میوگلوبین در سرم، 3- 2 ساعت پس از MI ایجاد شده که نسبت به سایر پروتئینها، سریعتر میباشد. میوگلوبین بیشتر توسط فیلتراسیون گلومرولی از پلاسما پاک شده و نیمه عمر آن حدود 4 ساعت میباشد. در صورتی که فعالیت کلیه، مختل شده باشد، نیمه عمر آن، بیشتر است. میوگلوبین تقریباً 6 ساعت پس از MI به بالاترین مقدار خود رسیده و پس از 24 ساعت، به مقدار پایه خود کاهش مییابد.
در افراد طبیعی، سطح میوگلوبین، بستگی به حجم عضله و فعالیت عضلانی داشته و شبیه به الگوی CK میباشد. سطوح پلاسمایی میوگلوبین در مردان بالاتر از زنان میباشد. میوگلوبین با افزایش سن افزایش مییابد که منعکسکننده کاهش فیلتراسیون گلومرولی است. علیرغم اختصاصی نبودن میوگلوبین برای میوکاردیوم، به عنوان تستی با ویژگی بالا برای MI (در هنگامی که بیماران مبتلا به نارسایی کلیوی یا آسیبهای احتمالی عضله اسکلتی کنار گذاشته شوند) (بیش از 95درصد) میباشد. حساسیت میوگلوبین را میتوان با مثبت در نظر گرفتن نتیجهای که نشاندهنده تغییر زیاد در نمونهای باشد که 3- 1 ساعت قبل گرفته شده باشد، افزایش داد؛ حتی اگر این مقادیر در فاصله مقادیر رفرنس باشند.
کربنیک انهیدراز III (Carbonic anhydrase ;CAIII)
کربنیک انهیدراز III (CAIII) آنزیمی است که در عضله اسکلتی وجود داشته، اما در عضله قلبی نیست و از این رو، از آن به عنوان مارکر منفی قلب، استفاده میشود. این آنزیم از عضله آسیبدیده به نسبت تقریباً ثابت با میوگلوبین آزاد شده و بنابراین، اگر نسبت میوگلوبین به CAIII افزایش یافته باشد، میوگلوبین یک مارکر اختصاصیتر برای آسیب میوکارد میباشد.
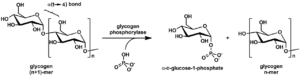
گلیکوژن فسفریلاز (Glycogen phosphorylase ;GP)
گلیکوژن فسفریلاز (GP) یک آنزیم با انتشار بسیار وسیع بوده که کاتالیزکننده مرحله اول گلیکوژنولیز میباشد.
این آنزیم، دایمری از 2 زیرواحد یکسان بوده و دارای 3 ایزوآنزیم شناخته شده میباشد که بر اساس بافت بیانکننده آنها، نامگذاری شدهاند. GPLL در کبد، GPMM در عضلات و GPBB در مغز و میوکارد بیان میشوند. GPBB زودتر از سایر مارکرها آزاد شده و ممکن است در وضعیتهای ایسکمی برگشتپذیر که در آنها، افزایش قابل توجهی از سایر مارکرها وجود ندارد، آزاد شود. در کل، در مقایسه با اندازهگیری cTn، محدود میباشد.
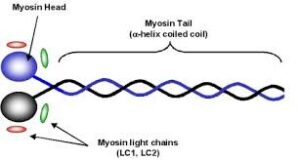
میوزین
میوزین، فیلامنتهای ضخیم دستگاه انقباض عضله را تشکیل میدهد که از یک جفت زنجیره سنگین و یک جفت از دو زنجیره سبک نوع I و II تشکیل شده است. به نظر نمیرسد که میوزین در تشخیص MI، اهمیت خاصی داشته باشد.
آلبومین تغییریافته توسط ایسکمی (Ischemia modified albumim; IMA)
IMA نوعی از آلبومین است که در آن، تمایل ملکول به یونهای فلزی در انتهای آمین، کاهش پیدا کرده است. به نظر میرسد که IMA طی واکنش آلبومین با رادیکالهای آزاد در قسمت ایسکمیک بافتی ایجاد میگردد. فایده تئوریک این تست این است که ایسکمی را قبل از آسیب غیرقابل برگشت سلولی، شناسایی میکند. مشاهده شده که در دقایق اولیه ایسکمی، در آلبومین تغییر ایجاد شده و تقریباً تا 6 ساعت طول میکشد. این تست برای ایسکمی قلبی، اختصاصی نبوده، اما برای ACS از حساسیت بالایی (90- 80%) برخوردار بوده و حساسیت آن از ECG بالاتر است.
نوع قلبی پروتئین متصلشونده به اسید چرب (Heart fatty acid binding protein ;H-FABP)
پروتئینهای متصلشونده به اسید چرب (Fatty acid binding proteins ;FABPs)، دستهای از پروتئینهای سیتوپلاسمی کوچک بوده که در بافتهایی از قبیل کبد، روده، قلب، عضلات، آدیپوسیتها، مغز، بیضه، سیستم عصبی محیطی و … به مقدار فراوان بیان میگردند. عملکرد اصلی آنها، تسهیل انتقال اسیدهای چرب بلند زنجیره و سایر ترکیبات چربی دوست از قبیل ایکوزانوئیدها و رتینوئیدها به درون سلولها میباشد. FABPها دارای انواع متعددی بوده و بیشترین مطالعه بر روی نوع قلبی آن (H-FABP) انجام گرفته است.
تصویر: مقایسه کلی سرعت تشخیص انفارکتوس میوکارد با استفاده از FABP و تروپونین
H-FABP به دلیل وزن ملکولی پایین و سیتوپلاسمیک بودن، قادر است که متعاقب وقوع MI، به سرعت در گردش خون آزاد شود. H-FABP در ACS، از حساسیت بالایی برخوردار بوده و 30 دقیقه پس از وقوع حملات ایسکمیک، قابل تشخیص میباشد.
کینتیک آزاد شدن H-FABP:
غلظت H-FABP، 8- 6 ساعت پس از وقوع علائم، به بیشترین مقدار خود رسیده و پس از 30- 24 ساعت، مجدداً به محدوده طبیعی برمیگردد. H-FABP، دارای کینتیک آزاد شدن مشابه میوگلوبین بوده، اما در مقایسه با میوگلوبین، به میزان 20- 15 برابر برای قلب، اختصاصیتر میباشد. از طرفی، به دلیل مقادیر پلاسمایی/ سرمی پایین H-FABP، احتمال ایجاد نتایج مثبت کاذب در این آزمایش، کمتر میباشد.
برگشت سریع غلظت H-FABP به محدوده پایه (24 ساعت)، در مقایسه با CK-MB و تروپونین که به ترتیب 4- 3 و
14- 10 روز طول میکشد، این آزمایش را برای نشان دادن انفارکتوس مجدد احتمالی در روزهای آینده (پس از وقوع اولیه AMI) بسیار مناسب ساخته است.
تصویر: مقایسه کینتیک آزاد شدن به درون گردش خون و کلیرانس H-FABP و سایر بیومارکرهای تشخیص آسیب قلبی
اهمیت رد کردن صحیح سکته قلبی حاد در درد حاد قفسه سینه
در کشورهای توسعه یافته، حدود 2- 1 درصد از جمعیت بزرگسال، در سال به دنبال مراقبتهای پزشکی با شکایت از درد قفسه سینه هستند. در ایالات متحده، شکایت از درد ناحیه قفسه سینه، دومین عامل مراجعه بیماران به بخش اورژانس میباشد. تنها 13- 10 درصد از بیماران بستری شده مشکوک به AMI، دارای AMI تأیید شده هستند. از طرفی ترخیص نابجای این گونه بیماران، خطر مرگومیر و ناخوشی آنها را به میزان 5 برابر افزایش خواهد داد. بنابراین با بهبود وضعیت تشخیص در این بیماران میتوان موجب کاستن از بار اجتماعی، لجستیکی و مالی در نتیجه مراجعات مکرر نابجای بیماران به مراکز درمانی شد.
قدرت پیشگویی منفی آزمایش H-FABP، سه تا 18 ساعت پس از شروع علائم درد قفسه سینه در بیماران مشکوک به AMI، بیشتر از 98- 97 درصد خواهد بود.
CRP با حساسیت بالا (High sensitivity C-reactive protein; hsCRP)
CRP یک پروتئین واکنشگر فاز حاد است که در اختلالات زیادی زیادی که بیشتر شامل عفونت باکتریایی است، افزایش مییابد. سطح CRP در طی MI نیز افزایش مییابد و افزایش سطح آن متناسب با افزایش ایزوآنزیم قلبی کراتینکیناز
(CPK-MB) میباشد. در طی آنژین، سطح CRP افزایش نمییابد. اعتقاد بر این است که سطح CRP، نسبت به LDL، یک پیشگوییکنندهی بهتر در مورد وضعیت قلبی- عروقی افراد میباشد. هنوز معلوم نیست که آیا افزایش CRP علت بیماری است یا این که نتیجه بیماری و یا هر دو میباشد.
معمولاً سطح CRP در طی 4 تا 6 ساعت پس از عملهای جراحی، افزایش یافته و 3 روز پس از انجام عمل جراحی، شروع به کاهش مینماید. عدم کاهش آن در طی 3 روز پس از انجام عمل جراحی میتواند دلالت بر عوارضی از قبیل ایجاد عفونت، انفارکتوس ریوی و … داشته باشد.
بر اساس نظریههای AHA (انجمن قلب آمریکا) و CDC (مرکز کنترل بیماریها)، افراد با مقادیر CRP کمتر از mg/dl 1 دارای ریسک کم، افراد با مقادیر بین mg/dl 3- 1 دارای ریسک متوسط و افراد با مقادیر بیشتر از mg/dl 3 دارای ریسک بالا میباشند.
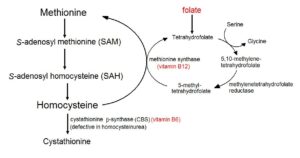
هموسیستئین (Homocysteine; Hcy)
افزایش هموسیستئین در گردش خون معمولاً ناشی از سطح پایین یکی از آنزیمهای دخیل در متابولیسم آن میباشد. به عنوان مثال، نقص خود آنزیم سیستاتیونین-β-سنتاز (CBS) و یا نقص این آنزیم در کمبود ویتامین B6 که به عنوان کوآنزیم آن میباشد، موجب افزایش سطح هموسیستئین خون میشود.
عوامل افزایشدهنده سطح هموسیستئین:
1- نقص آنزیم سیستاتیونین-β-سنتاز (CBS)
2- نقص در متیونینسنتاز
3- نقص در 5 و 10- متیلن تتراهیدروفولات ردوکتاز (MTHFR)
4- کمبود فولات
5- کمبود B12
6- کمبود B6
هموسیستئین ممکن است در تغییر LDL و تحریک برداشت آن توسط ماکروفاژها نقش داشته باشد. نشان داده شده است افرادی که دارای مقادیر بالاتری از هموسیستئین هستند، در معرض خطر بالاتری برای CHD هستند.
پپتیدهای ناتریورتیک قلبی
Brain Natriuretic Peptide (BNP), B-Type Natriuretic Peptide,
N-Terminal ProBNP (NT-ProBNP)
ناتریورتیک پپتیدها، پپتیدهایی با ساختار مشابه بوده که توسط تمام سلولهای بدن تولید میشوند. دو نوع از این پپتیدها شامل ناتریورتیک پپتید نوع A (آتریال ناتریورتیک پپتید؛ ناتریورتیک پپتید دهلیزی (ANP)) و ناتریورتیک پپتید نوع B (ناتریورتیک پپتید مغزی (BNP)) میباشند که توسط سلولهای میوکارد تولید میشوند. ANP عمدتاً توسط میوسیتهای دهلیزی قلب ساخته میشود؛ در حالی که BNP توسط میوسیتهای دهلیزی و بطنی ساخته میشود.
ANP و BNP از طریق برقراری دیورز و ناتریورز به برقراری هومئوستاز کمک میکنند. BNP از بطنهای قلب، به ویژه بطن چپ در هنگام افزایش فشار خون و یا افزایش حجم خون آزاد شده و موجب انبساط شریانها و وریدها و همچنین کاهش سطح نروهورمونهای مسئول انقباض عروق و احتباس کننده سدیم، میشود. اکنون مشخص شده است که افزایش بار بطنی منجر به آزادسازی BNP و NT-ProBNP میشود.
اگرچه ANP اولین ناتریورتیک پپتید شناخته شده است، اما نوع B آن (BNP)، دارای کاربرد گستردهتری در کلینیک بوده که ناشی از نیمه عمر طولانیتر آن در مقایسه با ANP (نیمه عمر 20 دقیقهای BNP در مقابل نیمه عمر 3 دقیقهای ANP) میباشد. علاوه بر آن، سطح BNP تحتتأثیر فعالیتهای جسمی و ورزشی قرار نگرفته، در حالی که سطح ANP میتواند تحتتأثیر انجام کارهای روزمره نیز قرار بگیرد. NT-ProBNP دارای نیمه عمر 120 دقیقهای بوده که در برخی موارد، آن را برای نشان دادن تغییرات حاد، غیرمناسب میسازد. با این وجود، از NT-ProBNP در تشخیص نارسایی قلبی استفاده میشود. مطالعات مختلف نشاندهنده قدرت پیشگوییکننده بسیار قوی میزان مرگومیر میباشد.
استفاده از BNP به عنوان یک فاکتور تشخیصی در نارسایی قلبی کاملاً نشان داده شده است. سطح BNP در بیماران دارای نارسایی قلبی علامتدار در مقایسه با بیماران دارای نارسایی قلبی بدون علامت، افزایش مییابد. همچنین بیماران با نارسایی بطنی بدون علامت در نتیجه دارو درمانی، ممکن است دارای سطح طبیعی از BNP باشند. آزمایش BNP به طور اختصاصی به تشخیص افتراقی دیسپنه (Dispnea) ناشی از نارسایی قلبی و دیسپنه ناشی از سایر علل، کمک مینماید. آزمایش BNP، به ویژه برای کمک به تشخیص افتراقی بیمارانی که با تنفس کوتاه به بخش اورژانس آورده میشوند، بسیار باارزش میباشد.
بر اساس دستورالعمل انجمن نارسایی قلبی آمریکا (Heart Failure Society of America)، تشخیص نارسایی قلبی علامتدار باید نخست بر پایه نشانهها و علائم این بیماری صورت گیرد. در مواقعی که تشخیص، غیرقطعی میباشد، تعیین سطح پلاسمایی BNP و NT-ProBNP در بیماران دارای دیسپنه که دارای نشانهها و علائم نارسایی قلبی میباشند، صورت میگیرد. غلظت ناتریورتیک پپتیدها نباید به تنهایی مورد تفسیر قرار گیرد؛ بلکه باید از آن در کنار سایر نتایج کلینیکی در تشخیص نارسایی قلبی، استفاده نمود.
بیماران با نارسایی مزمن قلبی دارای سطح بالایی از BNP بوده، در حالی که ممکن است پایدار باشند. بیمارانی که به تازگی سطح BNP آنها افزایش یافته است، نیاز به بررسیهای بیشتر از قبیل اکوکاردیوگرام دارند.
اگرچه BNP و NT-ProBNP به نسبت 1 به 1 ترشح میشوند، اما ممکن است که سطح NT-ProBNدر این بیماران، به دلیل نیمه عمر طولانیتر آن، بسیار بیشتر باشد.
با افزایش سن و در جنس مؤنث، سطح ناتریورتیک پپتیدها افزایش مییابد. بیماران با نارسایی کلیوی و یا بیماران دیالیزی ممکن است دارای سطح بالایی از BNP باشند، در حالی که نارسایی قلبی در این بیماران وجود نداشته باشد.
منابع:
1-Tietz Textbook of Clinical Chemistry and Molecular Diadnosis. 2006; 4th Edition.
2- Henrys Clinical Diagnosis and Management by Laboratory Methods. 2007; 21st Edition.
3 – Wendy Aineson and Jean Brickell. Clinical Chemistry; A Laboratory Perspective. 2007; 1st Edition.
4- Arneson W, Brickell J. Clinical chemistry; a laboratory perspective. 2007.
5- Pagana KD and Pagana TJ. Diagnostic and laboratory test refrence. 2005; 7th Edition.
6- Van Leeuwen AM, Kranpitz TR and Smith L. Laboratory and diagnostic tests with nursing implications. 2006 ; 2nd Edition.
7- Wilson DD. Manual of laboratory and diagnostic tests. 2008.
8- Carroll C., Al Khalaf M., Stevens J.W., et al. Heart-type Fatty Acid Binding Protein as an Early Marker for Myocardial Infarction. Emerg Med J. 2013; 30(4): 280-286.
9- Charpentier S, Ducasse JL, Cournot M, et al. Clinical assessment of ischemiamodified albumin and heart fatty acid-binding protein in the early diagnosis of non-STelevation acute coronary syndrome in the emergency department. Acad Emerg Med. 2010; 17: 27–35.
10- مراد رستمی و معصومه جرفی. نقش H-FABP در تشخیص سریع آسیب قلبی. ماهنامه پیام آزمایشگاه. مهر و آبان 1393، شماره 71- 70، صفحات 22-20.
مقاله مرتبط:سلولهـای بنیادین قلبـی و امید استفاده از آنها در ترمیم قلب به دنبال حمله قلبی
https://www.frontiersin.org/articles/10.3389/fcvm.2020.617277/full
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام