مروري بر تستهاي ارزيابي پروفايل آهن بدن
مراد رستمي– كارشناس ارشد بيوشيمي باليني، دانشگاه علوم پزشكي جندي شاپور اهواز
معصومه جرفي- كارشناس ارشد ميكروب شناسي، دانشگاه علوم پزشكي جندي شاپور اهواز
محمد عليمحمدي- كارشناس ارشد بيوشيمي باليني، دانشگاه آزاد اسلامي واحد اراك
آهن (Fe)، (Iron)
توزيع آهن بدن
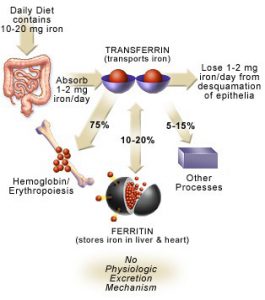
آهن از نظر مقدار، مهمترين ميكرومينرال محسوب ميگردد. رژيم غذايي روزانه تقريباً حاوي 20- 10 ميليگرم آهن بوده كه در حدود 10% آن (يعني تقريباً 2- 1 ميليگرم) جذب بدن ميشود. ميزان جذب آهن بدن متناسب با مقدار از دست دادن آهن بدن ميباشد. ملكولهاي آهن در خون به كمك ترانسفرين، منتقل ميشوند. بدن انسان حاوي 5- 4 گرم آهن بوده كه عمدتاً به فرم متصل شده به پروتئين ميباشد. تقريباً سه چهارم كل اين مقدار در پروتئينهاي هم (Heme) (عمدتاً هموگلوبين و ميوگلوبين) يافت ميشود.
تقريباً 1% آهن بدن نيز به شكل خوشههاي آهن- سولفور (Iron-Sulfur clusters) ميباشد كه به عنوان كوفاكتور در زنجيره تنفسي نقش دارد. بقيه آهن بدن نيز به فرم انتقالي در جريان گردش خون و يا به فرمهاي پروتئيني ذخيرهاي موجود ميباشد.
متابوليسم آهن
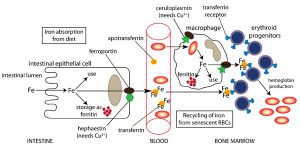
در رودهها تنها فرم دو ظرفيتي آهن (Fe2+) كه قادر به عبور از غشاء پلاسمايي ميباشد، جذب ميگردد، بنابراين با توجه به اين كه عمده آهن رژيم غذايي به فرم سه ظرفيتي موجود است، عوامل احيا كننده از قبيل ويتامين C به افزايش برداشت آهن كمك مينمايند. آهن دو ظرفيتي در رودهها از طريق ترانسپورترهاي سمت لومينال (Luminal) و بازال (Basal) سلولهاي اپيتليال روده و يا از آهن ذخيره شده در كبد، وارد گردش خون شده و در داخل خون به ملكول ترانسفرين متصل ميشود. در داخل خون، آهن دو ظرفيتي مجدداً توسط فرواكسيداز II به آهن سه ظرفيتي تبديل ميشود. مقداري از آهن جذب شده ممكن است به فرم فريتين و يا هموسيدرين در بدن ذخيره شود.
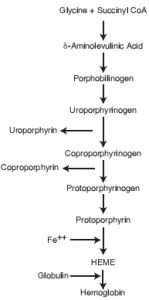
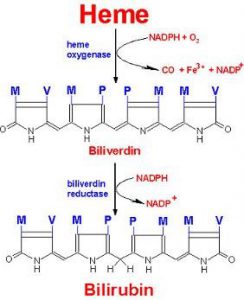
قسمت اعظم آهن جذب شده براي تشكيل گلبولهاي قرمز در مغز استخوان مورد استفاده قرار ميگيرد. همان طوري كه در تصوير زير نيز مشاهده ميشود تنها در مرحله انتهايي سنتز هم (Heme) است كه آهن دو ظرفيتي به كمك آنزيم فروشلاتاز وارد حلقه تتراپيرولي سنتز شده ميگردد.
در داخل جريان خون، 3- 2/5 گرم از آهن هموگلوبين به عنوان جزئي از گلبولهاي قرمز، در گردش ميباشد. پس از مدتي انعطاف پذيري گلبولهاي قرمز رو به كاهش گذاشته كه اين امر موجب آسيب غشاء گلبولهاي قرمز ميگردد. اين گلبولهاي قرمز فرسوده توسط ماكروفاژهاي كبد و ساير بافتها برداشته شده و تجزيه ميشوند.
بخش آلي هم (Heme) به بيليروبين اكسيده شده، در حالي كه آهن آن مجدداً به پلاسما برميگردد. ميزان آهن ناشي از بازگردش روزانه هم (Heme) به مراتب بيش از ميزان جذب شده آن توسط رودهها ميباشد.
انتقال آهن
ترانسفرين، يك بتا-گلبولين منفرد (مونومر) با وزن ملكولي 80000 دالتون بوده كه وظيفه آن جابجايي آهن در داخل خون ميباشد. پروتئين ترانسفرين شامل دو ناحيه (Domain) مشابه بوده كه هر كدام از آنها ميتواند به طور محكم به آهن سه ظرفيتي متصل شود. در حدود يك نهم ملكولهاي ترانسفرين داراي آهن در هر دو ناحيه خود، چهار نهم آنها داراي آهن متصل شده در يكي از نواحي خود و چهار نهم بقيه ترانسفرينها نيز فاقد هر گونه آهن متصل شده هستند. اين بدان معني است كه در حالت طبيعي، تنها در حدود يك سوم ترانسفرينها از آهن اشباع شدهاند.
پروتئينهاي جابجا كننده آهن مشابهي در ترشحات مختلف بدن از قبيل بزاق، اشك و شير نيز يافت شدهاند كه تحت عنوان لاكتوفرينها (Lactoferrins) ناميده ميشوند. ترانسفرين و لاكتوفرينها، غلظت آهن آزاد مايعات بدن را در محدوده زير 10-10 مول در ليتر نگه ميدارند. اين سطح پايين آهن آزاد از رشد باكتريها كه نيازمند آهن آزاد براي رشد خود ميباشند، جلوگيري ميكند.
ذخيره آهن بدن
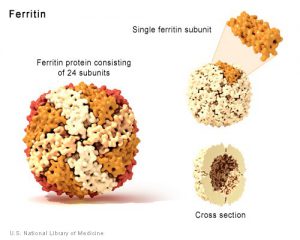
آهن اضافي به فرم فريتين در كبد و ساير بافتها ذخيره ميشود. ملكول فريتين خود متشكل از 24 زير واحد بوده كه به شكل كرههاي توخالي ميباشند. مولكولهاي فريتين پس از اكسيده كردن آهن دو ظرفيتي اضافي و تبديل آن به آهن سه ظرفيتي، آن را در قسمت داخل ملكول كروي خود به فرم Ferrihydrate ذخيره مينمايند. هر ملكول فريتين قادر به ذخيره چند هزار يون آهن از اين طريق ميباشد. علاوه بر فرم ذخيرهاي فريتين، يك فرم ذخيرهاي ديگر از آهن موسوم به هموسيدرين (Hemosiderin) نيز وجود دارد كه عملكرد آن به خوبي درك نشده است.
اختلالات ناشي از تغييرات ميزان آهن
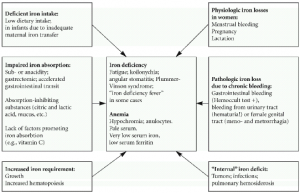
اختلالات ناشي از متابوليسم آهن در بدن متعدد بوده كه ميتوانند در برخي موارد منجر به بيماريهاي جدي شوند. فقر آهن معمولاً در نتيجه از دست رفتن خون و يا دريافت ناكافي آهن رخ ميدهد. در طي حاملگي، افزايش نياز به آهن ميتواند منجر به فقر آهن شود. در اين بيماران، گلبولهاي قرمز كوچكتر از اندازه طبيعي (ميكروسيت) بوده و داراي محتواي آهن كمتري ميباشند.
شيوع فقر آهن در كودكان، مردان، زنان قبل از سن يائسگي و زنان حامله به ترتيب در حدود 9، 2، 11 و 50% ميباشد. علت اين امر در كودكان، كاهش آهن رژيم غذايي به دليل محتواي آهن بسيار كم شير و در بزرگسالان نيز معمولاً از دست دادن خون به صورت مزمن ميباشد. علائم شايع كمخوني شامل خستگي (Tiredness)، كوفتگي مزمن (Chronic fatigue)، سرگيجه (Dizziness)، ضعف (Weakness) و سردرد (Headaches) ميباشد.
اختلالات ناشي از افزايش آهن موسوم به هموكروماتوزيس، شيوع كمتري دارند. اين اختلالات ميتوانند منشأ ژنتيكي داشته و يا در نتيجه تجويز مكرر خون رخ دهند. شيوع افزايش آهن بدن در ايالات متحده در حدود 1% ميباشد. از آن جايي كه بدن فاقد مكانيسمي براي دفع آهن است، در صورت عدم درمان، آهن اضافي با گذشت زمان در ارگانهاي مختلف بدن انباشته شده كه ميتواند منجر به اختلالات جدي در عملكرد اين ارگانها گردد. از علائم شايع ناشي از تجمع آهن در بدن به درد مفاصل (Joint pain)، كوفتگي (Fatigue)، ضعف (Weakness)، فقدان انرژي (Lack of energy)، درد شـــــــــــــــــكم (Abdominal pain)، كاهش قدرت جنسي (Loss of sexdrive) و مشكلات قلبي (Heart problems) ميتوان اشاره نمود.
به طور كلي، شرايط اصلي افزايش آهن بدن در سه دسته جاي ميگيرند:
- هموسيدروزيس (Hemosiderosis): در اين حالت، افزايش آهن بدن بدون حضور آسيب بافتي رخ ميدهد.
- هموكروماتوزيس (Hemochromatosis): در اين حالت، افزايش آهن بدن به همراه آسيب بافتي وجود دارد. اين وضعيت غالباً ناشي از افزايش مزمن جذب آهن رخ ميدهد.
- هموكروماتوزيس ارثي (Hereditary hemochromatosis): اين حالت، يك اختلال كلاسيك افزايش آهن ميباشد. شيوع فرم هموزيگوت اين اختلال در حدود 5 در 1000 است.
در هر سه وضعيت فوق، سطح سرمي آهن، اشباع ترانسفرين و فريتين بالا است. معمولاً ترانسفرين و TIBC در هموكروماتوز پايين ميباشند.
بررسي آزمايشگاهي وضعيت آهن سرم در اختلالات مختلف
يكي از متداولترين بيماريهايي كه در آزمايشگاه با آن مواجه ميشويم فقر آهن است كه آن نيز به نوبه خود ميتواند منجر به آنمي (كمخوني) گردد. آنمي فقر آهن در خانمها به علت عادتهاي ماهيانه شايع بوده، در حالي كه اين امر در آقايان بايد به طور جدي پيگيري و ريشهيابي شود. سؤالي كه مطرح ميشود اين است كه در بررسي فقر آهن انجام چه آزمايشاتي ضروري است و آيا ميتوان به اندازهگيري ميزان آهن سرم، TIBC، فريتين، هموگلوبين، MCV و … بسنده نمود و يا آزمايشات بيشتري لازم است. براي پاسخ به اين سؤال ابتدا مراحل ايجاد آنمي فقر آهن را در ارتباط با تغييرات آزمايشگاهي در جدول ذيل بررسي ميكنيم.
| مراحل مختلف | فريتين | TIBC | آهن | هموگلوبين |
| مرحله 1 | كاهش | طبيعي | طبيعي | طبيعي |
| مرحله 2 | كاهش | افزايش | طبيعي | طبيعي |
| مرحله 3 | كاهش | افزايش | كاهش | طبيعي |
| مرحله 4 | كاهش | افزايش | كاهش | كاهش |
بايد توجه داشت كه در كاهش هموگلوبين ابتدا گلبولها به صورت نروموكروم (غلظت طبيعي هموگلوبين درون سلولي) و نروموسيت (اندازه طبيعي سلول) بوده و به تدريج به فرم هيپوكروم (غلظت كاهش يافته هموگلوبين درون سلولي) و ميكروسيت (اندازه سلولي كوچكتر از حد طبيعي) در ميآيند. نوسانات روزانه آهن سرم خيلي زياد بوده و بين 30 تا 100 درصد گزارش شده است. از آن جايي كه سطح آهن سرم در شرايطي از قبيل التهابات، توليد گلبولهاي قرمز (اريتروپويز) و مصرف آهن خوراكي، تحت تأثير قرار ميگيرد، اكتفا به يك نتيجه منفرد آهن سرم، معقول به نظر نميرسد. افزايش RDW (Red Blood Cell Distribution Width) (پهناي توزيع گلبولهاي قرمز) نيز از نخستين نشانههاي هماتولوژيك فقر آهن بشمار ميرود.
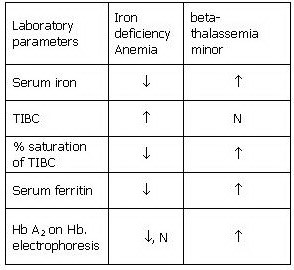
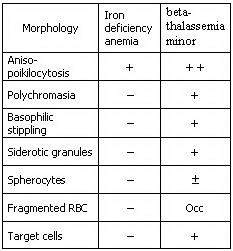
براي تخمين وضعيت آهن در بدن، اندازهگيري ترانسفرين و فريتين ميتواند جزئيات بيشتري را مشخص نمايد. براي ارزيابي و افتراق آنمي فقر آهن از تالاسمي مينور، از پارامترهاي مختلفي ميتوان بهره گرفت. اين پارامترها ميتوانند شامل تعداد گلبولهاي قرمز، ميزان MCV، MCH، Hb A2، RDW و تغييرات مرفولوژي گلبولهاي قرمز علاوه بر آزمايشهاي آهن، فريتين، TIBC و درصد اشباع ترانسفرين باشند. تغييرات اين پارامترها در آنمي فقر آهن و تالاسمي مينور در جدول ذيل آمده است.
به طور كلي، (مثلاً در مورد آزمايشات ازدواجي) افرادي كه داراي MCV و MCH به ترتيب كمتر از 80 و 27 ميباشند، ابتدا بايد به منظور اطمينان از عدم كاهش سطح آهن بدن، به مدت يكماه فرآوردههاي آهن را مصرف نموده و پس از آن مجدداً آزمايش CBC آنها چك شود، زيرا در صورت وجود همزمان آنمي فقر آهن و تالاسمي مينور در يك فرد، اين دو اختلال با همديگر همپوشاني نموده و نتيجه آزمايشات را تحت تأثير قرار ميدهند. براي مشاهده تغييرات مرفولوژيك گلبولهاي قرمز متعاقب مصرف آهن حداقل 2 هفته زمان لازم است.
در صورت عدم مرتفع شدن كاهش سطح MCV و MCH پس از مصرف آهن، آزمايشات آهن، فريتين، TIBC و سطح هموگلوبين A2 انجام ميشود. سطح هموگلوبين A2 در بتا تالاسمي مينور بيشتر از 5/3% و در آنمي فقر آهن، كمتر از 5/3% ميباشد. در آنمي فقر آهن، تعداد گلبولهاي قرمز كاهش يافته، در حالي كه در بتا تالاسمي مينور تعداد گلبولهاي قرمز افزايش مييابد. MCH كمتر از 20 به طور قوي نشان دهنده تالاسمي مينور است. از فرمول زير ميتوان براي ارزيابي اوليه افتراق آنمي فقر آهن از تالاسمي مينور استفاده نمود.
MCV-RBC-(5×Hb)-3.14
چنانچه نتيجه اين فرمول، صفر و يا يك عدد مثبت شد، فقر آهن و چنانچه يك عدد منفي حاصل شد، تشخيص تالاسمي مينور مطرح ميگردد. كارآيي اين فرمول را بيش از 99% برآورد نمودهاند.
نمونهگيري
نمونه مورد نياز شامل سرم و يا پلاسماي هپارينه ميباشد. نمونه مورد نياز براي آزمايش آهن بايد فاقد هموليز بوده و به اين منظور لازم است كه سرم و يا پلاسما در طي حداكثر 2 ساعت پس از نمونهگيري جدا شود. پايداري آهن سرم و يا پلاسماي هپارينه در دماي 15 تا 25 درجه سانتيگراد به مدت 4 روز و در دماي 2 تا 8 درجه سانتيگراد به مدت 7 روز ميباشد. آزمايش آهن حساس بوده و بايد از آلوده شدن نمونهها خودداري شود. با توجه به تغييرات روزانه آهن بدن، نمونه ناشتا توصيه ميگردد.
روشهاي اندازهگيري آهن
آزمايش آهن به روش فتومتريك و با استفاده از تركيبات مختلفي از قبيل Ferene، Bathophenanthroline، Complexing chromogen،كولومتري الكتروشيمي (Electrochemical coulometery) و اسپكتروسكوپي جذب اتمي (atomic absorption spectroscopy) انجام ميشود.
اصول اندازهگيري آهن
در تمامي روشهاي فتومتريك اندازهگيري آهن، ابتدا آهن سه ظرفيتي متصل به ترانسفرين در يك محيط اسيدي از ترانسفرين جدا شده و سپس آهن سه ظرفيتي، تحت تأثير عوامل احيا كننده به آهن دو ظرفيتي تبديل ميشود. در مرحله بعد، آهن دو ظرفيتي در اثر تركيب با يك ماده شيميايي (Ferene، Bathophenanthroline، Complexing chromogen و …)، يك كمپلكس رنگي ايجاد نموده كه با اندازهگيري آن به غلظت آهن پي برده ميشود. لازم به يادآوري است كه در روشهاي Ferene و Complexing chromogen، ميزان آهن متناسب با شدت رنگ بوده؛ در حالي كه در روش Bathophenanthroline، ميزان آهن با شدت رنگ حاصله، رابطه عكس دارد.
افزايش آهن سرم و يا پلاسما
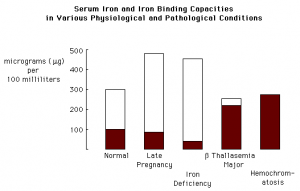
افزايش مقادير آهن در هموكروماتوزيس، هموسيدروزيس و مسموميت حاد آهن (به ويژه در مورد كودكان كه ممكن است بيش از دوز توصيه شده از ويتامينها و يا ساير مكملهاي حاوي آهن مصرف نمايند) ديده ميشود. مصرف ضد بارداريهاي خوراكي (به دليل افزايش سنتز ترانسفرين) موجب افزايش آهن سرم ميگردند. مصرف داروهاي حاوي آهن به ويژه به صورت تزريقي موجب افزايش آهن سرم ميگردند. مثلاً دريافت 300 ميليگرم از سولفات فرو (FeSO4) موجب افزايش آهن سرم به ميزان 500- 300 ميكروگرم در دسيليتر ميگردد.
مصرف فرآوردههاي حاوي آهن در بيماراني كه داراي فقر آهن هستند، يك اثر همپوشاني ايجاد مينمايد. پيك غلظت آهن سرم در طي چند ساعت پس از مصرف فرآوردههاي حاوي آهن مشاهده ميشود. اين مسئله به دليل احتمال همپوشاني براي تشخيص كمبود آهن به ويژه در افرادي كه داراي فقر آهن ميباشند حائز اهميت است. در روند هپاتيت و آسيبهاي كبدي نيز به دليل رها شدن ذخاير آهن كبد، آهن سرم افزايش مييابد. اختلالاتي كه با افزايش آهن سرم و يا پلاسما همراه هستند در جدول زير آورده شدهاند.
| Disorders | |
| HFE-associated hemochromatosis (Type 1 hemochromatosis) | Hemochromatosis disorders |
| Juvenile hemochromatosis (Type 2 hemochromatosis) | |
| TFR2- associated hemochromatosis (Type 3 hemochromatosis) | |
| Type 5 hemochromatosis | |
| Autosomal dominant siderosis (Type 4 hemochromatosis) | Siderosis disorders |
| African siderosis | |
| Atransferrinemia | Disorders of iron balance |
| Aceruloplasminemia | |
كاهش آهن سرم و يا پلاسما
كاهش آهن در آنمي فقر آهن، بيماريهاي التهابي، هموراژي، اهداء خون و خونريزيهاي شديد در دوران قاعدگي رخ ميدهد. در مراحل اوليه درمان برخي آنميها نيز ميزان آهن سرم كاهش مييابد، مثلاً در درمان آنمي پرنيسيوز با ويتامين كوبالامين (B12)، به دليل افزايش سنتز هموگلوبين و برداشت آهن از سرم و ذخاير آهن بدن، ميزان آهن كاهش مييابد.
مقادير نرمال و گروههاي مختلف سني در جدول زير آمده است.
| گروه | محدوده سني | مقادير نرمال آهن |
| مقدار طبيعي آهن براي هر دو جنس كودكـــان | نوزاد 1 تا 14 روزه | μg/dl 201- 63 |
| نوزاد 15 روزه تا 6 ماهه | μg/dl 135- 28 | |
| نوزاد 6 ماهه تا 1 ساله | μg/dl 155- 35 | |
| كودك 2 ساله تا 12 ساله | μg/dl 135- 22 | |
| زنان | تا 25 سال | μg/dl 165- 37 |
| تا 40 سال | μg/dl 134- 23 | |
| تا 60 سال | μg/dl 149- 39 | |
| زنان باردار | 12 هفته ابتداي بارداري | μg/dl 177- 42 |
| اواخر دوره بارداري | μg/dl 137- 25 | |
| تا 6 هفته پس از زايمان | μg/dl 150- 16 | |
| مردان | تا 25 سال | μg/dl 155- 40 |
| تا 40 سال | μg/dl 168- 35 | |
| تا 60 سال | μg/dl 120- 40 |
فريتين (Ferritin)
مطالعه فريتين سرم به عنوان يك انديكاتور خوب بررسي وضعيت آهن بدن بكار ميرود. سطح سرمي فريتين كه بيشترين پروتئين ذخيرهاي آهن بدن را نيز شامل ميگردد، متناسب با ميزان آهن ذخيره بدن ميباشد. سطح فريتين بسيار پايين بوده (در حدود 1% كل آهن سرم) و در تعادل با ذخاير آهن بدن ميباشد. در افراد طبيعي هر 1 نانوگرم در ميليليتر (ng/ml) از فريتين سرم تقريباً معادل 8 ميليگرم آهن ذخيره شده ميباشد. در فريتين، آهن به صورت ميسلهاي كمپلكسهاي هيدراته اكسيد فريك- فسفات كه به سطح داخلي آن متصل شدهاند، وجود دارد.
فريتين به عنوان يك انديكاتور بسيار حساس براي وضعيت آهن بدن به ويژه براي فقر آهن بجز در اختلالات التهابي مزمن از قبيل آرتريت روماتوئيد، بيماريهاي كليوي و بدخيميها بويژه لنفوما، لوكمي، سرطان سينه و نوروبلاستوما به كار ميرود. كاهش سطح فريتين سرم دلالت بر كاهش ذخيره آهن بدن دارد. سطح فريتين سرم كمتر از 12 نانوگرم در دسيليتر به عنوان معيار تشخيصي آنمي فقر آهن در نظر گرفته ميشود. كاهش سطح فريتين سرم در آنمي فقر آهن، مقدم بر ساير پارامترها از قبيل كاهش سطح آهن سرم، تغييرات MCV، MCH و تعداد گلبولهاي قرمز رخ ميدهد.
محدوديت بزرگ اندازهگيري سطح فريتين سرم از آنجا ناشي ميشود كه فريتين به عنوان يك پروتئين فاز حاد (Acute phase protein) بوده و بنابراين ميتواند افزايش آن ناشي از شرايطي غير از وضعيت ذخاير آهن بدن از قبيل بيماريهاي التهابي حاد، عفونتها، سرطانهاي متاستاتيك، لنفوماها و … باشد.
پايين بودن فريتين دليل بركمبود ذخاير ميباشد، اما بالا بودن آن فقر آهن را رد نميكند؛ زيرا فریتين جزء پروتئينهاي فاز حاد بوده و در طي عفونتها و التهابات افزايش مييابد. افزايش سطح فريتين سرم، 1 تا 2 روز پس از بيماري حاد رخ داده و در طي 3 تا 5 روز نيز به بيشترين مقدار خود ميرسد. سطح آهن سرم در تركيب با سطح آهن سرم و TIBC ميتواند ابزار مهمي در افتراق و طبقه بندي آنميهاي مختلف به شمار رود.
نمونه مورد نياز
سرم و يا پلاسماي هپارينه مورد نياز ميباشد. نمونه بايد عاري از هموليز باشد. مصرف تركيبات حاوي آهن ميتواند ميزان فريتين را تحت تأثير قرار دهد. بهتر است كه خانمها در صورت نياز به انجام اين آزمايش در طي دوره قاعدگي انجام آن را موكول به زمان پس از قاعدگي نمايند.
افزايش فريتين خون
سطح فريتين سرم با افزايش سن در مردان و زنان پس از سن يائسگي افزايش مييابد. افزايش سطح فريتين سرم به عنوان نشانه افزايش ميزان آهن به دليل هموكروماتوزيس، هموسيدروزيس، مسموميت با آهن، آنمي مگالوبلاستيك، آنمي هموليتيك، هپاتيت مزمن، تجويز اخير خون و بيماريهاي مزمن (از قبيل نئوپلاسم، الكليسم، اورميا، بيماريهاي كلاژن و بيماريهاي مزمن كبدي) ميتواند باشد. داروهاي حاوي تركيبات آهن ميتوانند منجر به افزايش سطح فريتين سرم گردند. همچنين سطح بالاي فريتين سرمي در هپاتيتهاي ويروسي مشاهده ميشود.
كاهش فريتين خون
كاهش سطح فريتين سرم در طي آنمي فقر آهن مشاهده ميشود. در موارد كاهش شديد پروتئينهاي سرم از قبيل سوء تغذيه و در طي حاملگي نيز سطح فريتين سرم كاهش مييابد. اندازهگيري فريتين سرم همچنين در بيماران با نارسايي مزمن كليوي به منظور ارزيابي وضعيت آهن بدن بكار ميرود. بيماران همودياليزي، داراي سطح پايينتري از فريتين ميباشند. سطح فريتين سرم خانمها در طي دوره قاعدگي ممكن است كاهش يابد.
مقادير نرمال
| جنسيت و گروه سني | مقادير نرمال | |
| بزرگسالان | مرد | ng/ml (μg/L) 300- 12 |
| زن | ng/ml (μg/L) 150- 10 | |
| كودكان | تازه متولد شده | ng/ml (μg/L) 200- 25 |
| 1 ماهه | ng/ml (μg/L) 600- 200 | |
| 2 تا 5 ماه | ng/ml (μg/L) 200- 50 | |
| 6 ماهه تا 15 سال | ng/ml (μg/L) 142- 7 |
ظرفيت آهن ترانسفرين (TIBC) Total iron binding capacity
مقدمه
آهن در سرم به گلبوليني به نام ترانسفرين متصل ميشود. معمولاً ترانسفرين از آهن اشباع نبوده؛ به طوري كه در افراد سالم مقدار آهن متصل شده به ترانسفرين در حدود يك سوم حداكثر توانايي ترانسفرين در انتقال آهن است. مقدار اضافه آهني كه اين پروتئين ميتواند جذب كند تا كاملاً اشباع شود به نام ظرفيت آهن اشباع نشده (UIBC) (Unsaturated Iron Binding Capacity) ناميده ميشود. به عبارتي ديگر، UIBC و يا آپوترانسفرين، قسمتي از ترانسفرين است كه از آهن، اشباع نشده است. آزمايش TIBC به اندازهگيري بيشترين مقداري از آهن كه ميتواند به پروتئينهاي سرم، به ويژه ترانسفرين متصل شده و در داخل خون ذخيره گردد، گفته ميشود.
بنابراين TIBC در حقيقت اندازهگيري غير مستقيم ترانسفرين ميباشد. لازم به ذكر است كه فريتين جزء پروتئينهاي TIBC محسوب نميشود، زيرا فريتين به فرم ذخيرهاي آهن متصل است. TIBC در 70% بيماران دچار فقر آهن افزايش مييابد. سطح سرمي پايين آهن به همراه افزايش TIBC، در تشخيص فقر آهن بسيار كمك كننده و مفيد است. در شرايطي كه نياز به آهن افزايش مييابد (مانند فقر آهن و يا اواخر حاملگي)، TIBC افزايش يافته، در حالي كه درصد اشباع ترانسفرين كاهش مييابد.
TIBC با ميزان دريافت آهن، تغييرات كوچكي را خواهد داشت و حال آن كه بيشتر منعكس كننده عملكرد كبد (به خاطر توليد ترانسفرين در كبد) و ميزان تغذيه در مقايسه با متابوليسم آهن ميباشد. همچنين مقادير ترانسفرين براي مانيتور كردن بيماراني كه يك دوره دريافت تغذيه زياد (Hyperalimentation) دارند به كار ميرود. به طور كلي آزمايش TIBC در مواردي كه ميزان آهن سرم بسيار پايين و يا بالا ميباشد درخواست ميشود.
نسبت آهن سرم به TIBC را اشباع ترانسفرين و چنانچه اين ميزان در عدد 100 ضرب شود، درصد اشباع ترانسفرين (TS%) (Transferrin saturation%) مينامند.
كاهش درصد اشباع ترانسفرين به كمتر از 16% نشان دهنده فقر آهن است. در بچهها اين نسبت كمتر بوده و تا 7% هم ميرسد. در بيماران دچار آنميهاي هموليتيك، سيدروبلاستيك و يا مگالوبلاستيك، بيماران داراي افزايش آهن و يا مسموميت با آهن، اشباع ترانسفرين افزايش مييابد. در بيماران مبتلا به هموكروماتوزيس، ترانسفرين و TIBC، بسيار پايين بوده اما درصد اشباع ترانسفرين بسياربالاست؛ به نحوي كه در اين بيماران درصد اشباع ترانسفرين به بيش از 80- 70% (و حتي گاهي تا 100%) نيز ميرسد. درصد اشباع ترانسفرين نيز با تأثير از آهن، نوسان روزانه زيادي داشته و اختصاصي نيست. كاهش همزمان آن با فريتين به عنوان فقر آهن قابل تفسير است.
نمونهگيري
نمونه مورد نياز شامل سرم و يا پلاسماي هپارينه ميباشد. نمونه مورد نياز براي آزمايش آهن بايد فاقد هموليز بوده و به اين منظور لازم است كه سرم و يا پلاسما در طي حداكثر 2 ساعت پس از نمونهگيري جدا شود. آزمايش TIBC، حساس بوده و بايد از آلوده شدن نمونهها خودداري شود. كليه ظرفهاي آزمايشگاهي مورد نياز نيز از قبيل لولههاي آزمايش، كووتها و … را بايد ابتدا با اسيد كلريدريك 1 نرمال و سپس با آب مقطر كاملاً عاري از آهن شستشو داد و سپس استفاده نمود. نمونه سرم و يا پلاسماي مورد نياز نيز نبايد فريز شده باشد. با توجه به تغييرات روزانه آهن بدن، نمونه ناشتا توصيه ميگردد.
روشهاي اندازهگيري TIBC
اندازهگيري TIBC سرم و يا پلاسما معمولاً با روش Magnesium Carbonate Precipitating انجام ميشود.
اصول اندازهگيري TIBC
تعيين TIBC در حقيقت اندازهگيري غير مستقيم غلظت ترانسفرين خون است. به اين منظور يون آهن (به فرم فريك آمونيوم سيترات و يا فريك كلرايد) به سرم و يا پلاسماي مورد آزمايش افزوده شده تا تمام جايگاههاي موجود در ترانسفرين از آهن اشباع شود. سپس آهن اضافي به كمك رزينهاي تعويض يوني و يا با شلاته كردن توسط كربنات منيزيوم (MgCO3) از محيط عمل خارج گرديده و پس از سانتريفوژ كردن و دكانته كردن (Decanted) مايع رويي كه حاوي ترانسفرين اشباع شده ميباشد، كل آهن متصل شده به ترانسفرين (با كمك روش اندازهگيري آهن) اندازهگيري ميگردد.
افزايش TIBC سرم و يا پلاسما
آنمي فقر آهن، پلي سيتمي ورا، حاملگي (به ويژه اواخر حاملگي)، مصرف ضد بارداريهاي خوراكي و استروژن درماني با افزايش سطح ترانسفرين همراه هستند.
كاهش TIBCسرم و يا پلاسما
ترانسفرين، يك «پروتئين واكنشگر فاز حاد منفي» بوده و در واكنشهاي التهابي حاد متعددي، سطح آن كاهش مييابد. همچنين در بيماريهاي مزمني از قبيل بدخيميها، بيماريهاي عروقي كلاژن، بيماريهاي كبدي و اختلالات التهابي مزمن (به دليل كاهش سنتز ترانسفرين)، سطح ترانسفرين كاهش مييابد. در هموكروماتوزيس، بيماريهاي كبدي، سندروم نفروتيك و بيماريهاي كليوي كه در آنها از دست رفتن پروتئين از طريق ادرار رخ ميدهد نيز كاهش سطح TIBC را شاهد هستيم. هيپوپروتئينمي (كاهش سطح پروتئينهاي خون) نيز با كاهش سطح ترانسفرين در ارتباط است. براي بررسي سوء تغذيه ممكن است كه به موازات درخواست پره- آلبومين (Prealbumin)، اندازهگيري TIBC نيز درخواست شود.
تغييرات پارامترهاي آهن، TIBC و فريتين در برخي اختلالات در جدول زير آمده است.
مقادير نرمال
مقادير نرمال TIBC در افراد سالم μg/dl 440- 230 ميباشد.
مقادير نرمال درصد اشباع ترانسفرين براي مردان 50- 20% و براي زنان 50- 15% است.
پروتوپورفيرينهاي آزاد گلبولهاي قرمز (FEP)
(Free Erythrocyte Protoporphyrins)
اين آزمايش، يك تست غربالگري به منظور تشخيص فقر آهن و مسموميت با سرب، به ويژه در كودكان ميباشد. در هر دو شرايط فوق، آخرين مرحله سنتز هم (Heme) به ترتيب در اثر عدم وجود آهن و اثر مهاري سرب متوقف ميشود، بنابراين، پيشسازهاي هم (Heme)، به ويژه پروتوپورفيرين IX تجمع مييابند. افزايش FEP همچنين در موارد نادر اريتروپوئتيك پورفيريا (Erythropoietic porphyria) و اريتروپوئتيك پروتوپورفيريا (Erythropoietic protoporphyria) ديده ميشود. اختلالات تالاسميك داراي سطح طبيعي از FEP ميباشند.
رنگ آميزي سيتوشيمي (Cytochemical staining)
رنگ آميزي Cytochemical هموسيدرين در آسپيرههاي مغز استخوان به وسيله واكنش Prussian blue، قطعيترين آزمايش براي بررسي وضعيت آهن ميباشد. اين آزمايش به عنوان استاندارد طلايي (Gold standard) پذيرفته شده است.
تعيين مقدار آهن كبد (Quantitative iron in liver)
اندازهگيري آهن در نمونه بيوپسي كبد در تشخيص هموكروماتوزيس به ويژه در مواردي كه سطح سرمي آهن و TIBC در حد مرز (Borderline) باشد، بسيار كمك كننده است. تهاجمي بودن اين روش، بزرگترين عيب آن به شمار رفته و انجام آزمايش را مشكل ميسازد. مقادير نرمال آهن در بيوپسي كبد، 300- 100 ميكروگرم در هر گرم از بافت مرطوب (Wet tissue) ميباشد.
Serum Transferrin Receptor assay (sTfR) (TfR)
تستهاي آزمايشگاهي بررسي وضعيت آهن بدن شامل آهن سرم، TIBC و فريتين سرم بوده كه هر كدام از اين پارامترها داراي مزايا و معايب خاص خود ميباشند. سطح آهن سرم و TIBC در تشخيص مراحل پيشرفته آنمي فقر آهن مفيد بوده اما حساسيت آنها در تشخيص مراحل اوليه آنمي فقر آهن، محدود است. برعكس، سطح فريتين سرم در تشخيص مراحل اوليه آنمي فقر آهن، بسيار مفيد بوده؛ اما مزاياي آن تحتالشعاع افزايش غير اختصاصي آن در بيماريهاي التهابي و آسيب سلولهاي كبدي (Hepatocellular disease) قرار گرفته است، از اين رو نياز به ماركر بهتري براي ارزيابي وضعيت بدن احساس ميشد كه با معرفي sTfR به اين نياز پاسخ داده شده است.
اغلب سلولهاي بدن در سطح خود داراي رسپتورهاي ترانسفرين بوده كه وظيفه آنها انتقال آهن متصل شده به ترانسفرين پلاسما به درون سلول ميباشد. اين رسپتورهاي محلول ترانسفرين جزء گليكوپروتئينهاي گذرنده از عرض غشاي سلولي (Trans-membrane glycoprotein) بوده كه ميزان برداشت آهن موجود در گردش خون به درون سلولها را بر عهده دارند. در داخل خون، آهن از طريق اتصال به ترانسفرين منتقل شده و ترانسفرين نيز از طريق اتصال به رسپتورهاي ويژه ترانسفرين (TfR) در سطح سلولهاي هدف و با كمك پديده اندوسيتوز، آهن خود را به درون سلولها منتقل مينمايد.
در نتيجه pH پايين اندوزومها، آهن به درون سيتوپلاسم آزاد شده و ترانسفرين آزاد شدهي فاقد آهن نيز مجدداً به رسپتور سطح سلولي خود متصل شده و به سطح سلولي برميگردد و متعاقب آن آزاد ميشود. تراكم اين رسپتورهاي سطح سلولي در ردههاي گلبولهاي قرمز مغز استخوان و جفت از ساير بافتها بيشتر بوده كه به خاطر نياز بيشتر اين دو بافت به آهن در مقايسه با ساير بافتها ميباشد.
تعداد رسپتورهاي محلول در سرم و يا پلاسما با تعداد آنها در غشاء سلول متناسب است. نياز متابوليك سلولهاي داراي كمبود آهن، نياز به افزايش توليد رسپتورهاي ترانسفرين سطح سلولي (TfR) به منظور تسهيل برداشت بيشتر آهن و سركوب سنتز فريتين ميباشد. برعكس، در طي افزايش محتواي آهن سلولها، سنتز فريتين افزايش و توليد TfR، سركوب ميگردد.
sTfR در سرم نيز قابل تشخيص بوده و به عنوان يك ماركر بسيار خوب براي نشان دادن توليد گلبولهاي قرمز (Erythropoiesis) معرفي شده است. سطح sTfR سرمي در بيماران با فقر آهن و در شرايط با هيپرپلازي رده گلبولهاي قرمز (Erythroid hyperplasia) از قبيل آنمي هموليتيك، بتا تالاسمي و پليسيتمي افزايش و در شرايط هيپوپلازي رده گلبولهاي قرمز (Erythroid hypoplasia) از قبيل آنمي آپلاستيك، كاهش مييابد. مهمترين ارزش اندازهگيري sTfR كمك به تشخيص افتراقي آنميهاي ميكروسيتيك ميباشد. افزايش سطح sTfR سرمي، منعكس كننده كاهش آهن درون سلولي بوده و اندازهگيري آن به افتراق آنمي ناشي از التهاب از آنمي ناشي از فقر آهن كمك ميكند.
TfR جديدترين آزمايشي است كه فقر آهن را در سطح سلولي بررسي مينمايد. اين آزمايش انديكاتور بهتري براي ارزيابي وضعيت آهن بدن بوده و همچنين تحت تأثير التهاب و سن نيز قرار نميگيرد. در طي كاهش آهن به منظور كاهش جبران آن، ميزان اين رسپتورها افزايش مييابد. ميزان رسپتورهاي فوق در آنمي فقر آهن به ميزان 3 تا 4 برابر ميزان طبيعي افزايش مييابد.
ارزش آزمايش sTfR در تشخيص آنمي فقر آهن، قابل مقايسه با فريتين بوده و همچنين توانايي افتراق آنمي ناشي از بيماريهاي مزمن از آنمي ناشي از فقر آهن به ويژه در افراد مسن را نيز دارا ميباشد. غلظت sTfR در آنمي فقر آهن با يك شيب تند افزايش يافته؛ در حالي كه غلظت آن در آنمي ناشي از بيماريهاي مزمن كاهش مييابد. اهميت افتراق آنمي ناشي از فقر آهن از آنمي ناشي از بيماريهاي مزمن در درمانهاي متفاوت اين دو بيماري بوده و بنابراين ضرورت دارد كه بتوان با كمك آزمايشهاي غير تهاجمي از قبيل sTfR، اين دو اختلال را از يكديگر افتراق داد.
تاكنون بررسي مغز استخوان به عنوان ماركر قطعي تشخيص فقر آهن مطرح بود كه با توجه به تهاجمي بودن اين روش و رضايت كمتر بيماران از انجام اين آزمايش، انجام آن را با مشكل همراه ميساخت. افزايش sTfR در تشخيص آنمي فقر آهن داراي حساسيت و اختصاصيت 100% است؛ در حالي كه ميزان حساسيت و اختصاصيت كاهش sTfR در تشخيص آنمي ناشي از بيماريهاي مزمن به ترتيب 6/66% و 100% ميباشد.
هنگامي كه ميزان فريتين سرم و يا پلاسما از 12 ميكروگرم در ليتر كمتر شود، اين رسپتورها شروع به افزايش ميكنند. برخلاف فريتين، ميزان اين رسپتورها در بيماريهاي التهابي و يا كبدي تغيير نمييابد و از اين رو ميتواند در افتراق آنمي فقر آهن از آنمي بيماريهاي مزمن مفيد باشد. سطح sTfR در بيماران داراي آنمي فقر آهن داراي رابطه معكوس با سطح فريتين سرم، غلظت هموگلوبين، MCV و MCH است. اعتقاد بر اين است كه در آنمي فقر آهن، ميزان اين رسپتورها نسبت به ساير پارامترها از قبيل MCV و پروتوپورفيرين گلبولهاي قرمز سريعتر تغيير نموده و از اين رو شاخص حساستري نسبت به MCV و پروتوپورفيرين گلبولهاي قرمز بشمار ميرود. همچنين نشان داده شده است كه اندازهگيري sTfR به منظور تشخيص آنمي فقر آهن در طي حاملگي شاخص مناسبتري در مقايسه با فريتين، پروتوپورفيرين گلبولهاي قرمز و MCV ميباشد.
روشهاي اندازهگيري sTfR
اندازهگيري sTfR ميتواند از طريق Enzyme immunoassay صورت گيرد.
References:
1-رستمي م.، جرفي م. و عليمحمدي م. آزمايشهاي كاربردي در مامايي. انتشارات معتبر. اهواز. 1390. چاپ اول.
2- Tietz Textbook of Clinical Chemistry and Molecular Diadnosis. 2006; Fourth Edition.
3- Henrys Clinical Diagnosis and Management by Laboratory Methods. 2007; Twenty-First Edition.
4- Harrisons principles of internal medicine. 2005; 16th Edition.
5-Arneson W, Brickell J. Clinical chemistry; a laboratory perspective. Philadelphia: Davis Company; 2007.
6-Lehninger Principles of Biochemistry. 2004; 4th Edition.
7-Fauci, Anthony S., et al. Harrison’s Principles of Internal Medicine. 2008; 17th Edition.
8-Pagana KD and Pagana TJ. Diagnostic and laboratory test refrence. 2005; 7th Edition.
9-Cavanaugh BM. Nurses manual of laboratory and diagnostic tests. 2003; 4th Edition.
10-Van Leeuwen AM, Kranpitz TR and Smith L. Laboratory and diagnostic tests with nursing implications. 2006 ; 2nd Edition.
11-Wilson DD. Manual of laboratory and diagnostic tests. 2008.
12-Munker R., Hiller E., Glass J. and Paquette R. Modern hematology; Biology and clinical management. 2007; 2nd Edition.
13-Provan D. and Gribben J. Molecular hematology. 2000; 2nd Edition.
14-Ciesla B. Hematology in practice. 2007.
15-Beck N. Diagnostic hematology. 2009.
https://medlineplus.gov/lab-tests/iron-tests/
https://medlabnews.ir/%d9%87%d9%be%d8%b3%db%8c%d8%af%db%8c%d9%86/
دانلود کنید
ورود / ثبت نام