بیولومینسانس و کاربرد آن در روشهای ایمونواسی
امیررضا حیدری، دانشجوی کارشناسی ارشد ایمونولوژی
چکیده
بیولومینسانس (زیستتابی) پدیدهای طبیعی در میان برخی از جانوران بیمهره است که در اثر برهمکنشهای بیوشیمیایی در پیکر این موجودات سبب ساطع شدن نور میگردد. بیش از پنج دهه از بکارگیری تکنیکهای ایمونواسی در آزمایشگاههای تشخیص طبی و تحقیقاتی میگذرد؛ در این مدت نشانگرهای (labels) گوناگونی برای کنژوگه شدن با آنتیژن یا آنتیبادی استفاده شده است. امروزه پروتئینهای بیولومینسانس با توجه به قابلیتهای بالقوه، از جمله نورافشانی در تاریکی و تشخیص مقادیر بسیار ناچیز آنالیت در نمونه، انتخاب مناسبی جهت استفاده در ایمونواسی است. همچنین انعطافپذیری بالای این پروتئینها در ایجاد تغییرات ژنتیکی در ساختارشان جهت بالا بردن بهرهوری و تغییر طولموج تولیدی، آنها را به مولکولهای منحصربهفرد در حوزههای تشخیصی و ردیابی تبدیل کرده است. در این مقاله مروری ما به بررسی ویژگیهای پدیده بیولومینسانس و کاربردهای آن در تشخیصهای آزمایشگاهی در حوزههای بالینی و تحقیقاتی خواهیم پرداخت.
واژههای کلیدی: بیولومینسانس، ایمونواسی، آنتیژن، آنتیبادی
مقدمه
در اواخر دهه 1950 میلادی، روزالین یالو و سالامون برسون تکنیک ایمونواسی را پایهگذاری کردند. از آن سال به بعد همواره چهار اصل در این تکنیک رعایت شده است:
- وجود آنتیژن (آنالیت) برای شناسایی
- حضور آنتیبادی جهت شناسایی آنالیت
- مرحلهی جهت جدا کردن کمپلکسهای آنتیژن- آنتیبادی تشکیلشده از آنتیژن و آنتیبادیهای آزاد (در صورت هترژن بودن فاز جداسازی)
- روشی برای تشخیص و اندازهگیری کمپلکسهای ایمنی تشکیلشده
بعد از اهمیت اختصاصی بودی آنتیبادی علیه آنتیژن موردنظر در هر سنجش ایمنی، نوع برچسب مورداستفاده میتواند علاوه بر تعیین سیستم تشخیصی مختص همان برچسب، ارتباط مستقیمی با میزان حساسیت سیستمهای ایمونواسی جهت شناسایی و اندازهگیری کمپلکسهای ایمنی داشته باشد. در طول چند دههی گذشته نشانگرهای گوناگونی در سیستمهای ایمونواسی مختلف مورداستفاده قرار گرفتند. رادیوایزتوپها اولین برچسبها بودند که موردتوجه قرار گرفتند، اما به علت ناپایدار بودن و مضرات بهکارگیری ترکیبات رادیواکتیو بهتدریج جایگزینهایی برای آنها پیدا شد. مولکولهای فلورسانس و کمولومینسانس، آنزیمها و پروتئینهای بیولومینسانس از جمله این ترکیبات جایگزین هستند (1).
در این بررسی سعی داریم تا با معرفی پدیده زیستتابی، جنبههای سودمند استفاده از عوامل تولیدکننده آن را بهعنوان نشانگرهای آنتیژنها و یا آنتیبادیها در آزمایشگاههای بالینی و تحقیقاتی مورد بررسی قرار دهیم.
پدیده بیولومینسانس و پروتئینهای تولید کننده آن
بیولومینسانس به معنی تولید و انتشار نور توسط برخی از بیمهرگان خشکی و دریا است. این نور در اثر یک واکنش بیوشیمیایی توسط گروهی از آنزیمها در پیکره این موجودات اتفاق میافتد. این آنزیمها سوبسترای خود را به محصول تبدیل میکنند. محصول موردنظر در حالت برانگیختهای از سطح انرژی قرار دارد که بهمحض بازگشت به سطح پایه انرژی خود یک فوتون نوری آزاد میکند. در سال 1962 آقای شیمامورا اولین پروتئین با خاصیت زیستتابی را از پیکره یک عروس دریایی به نام Aequorea victoria استخراج و شناسایی کرد و به افتخار نام گونه مذکور، پروتئین کشفشده را آکوارین (aequorin) نامید (2).
بهطورکلی پروتئینهای بیولومینساس آنزیمهایی هستند که سوبستراهای خود را در حضور اکسیژن اکسیده میکنند و بر مبنای مسیر واکنش اکسیداسیون و نوع سوبسترا به دو دسته طبقهبندی میشوند:
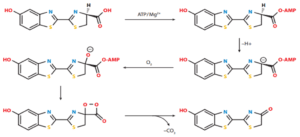
- لوسیفرازها (luciferases): شناختهشدهترین آنزیم این دسته در خانوادهای از حشرات به نام Lampyridae وجود دارد که به آن firefly luciferase میگویند. این آنزیم سوبسترایی معروف به لوسیفرین (luciferin) دارد که در حضور اکسیژن و ATP قادر است آن را به اکسیلوسیفرین تبدیل کند (شکل 1).
شکل 1- واکنش اکسیداسیون لوسیفرین توسط firefly luciferase
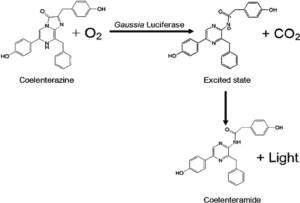
علاوه بر موجودات خشکی، برخی بیمهرگان دریایی هم دارای این آنزیم میباشند. لوسیفراز این موجودات به ATP نیاز نداشته و سوبسترای آنها ترکیبی به نام کو-النترازین (coelenterazine) است (2) (شکل 2).
شکل 2- واکنش اکسیداسیون coelentrazine به coelenteramide توسط لوسیفرازهای بیمهرگان دریایی
- فوتوپروتئینها (photoproteins): این دسته از پروتئینهای بیولومینسانس، آنزیمهایی هستند که از طریق نیروهای غیرکووالان همواره به سوبسترای خود بهصورت یک کمپلکس آنزیم- سوبسترا متصل هستند. سوبسترای این آنزیمها کو-النترازین است. این کمپلکس پایدار بهمحض حضور یون کلسیم دچار تغییر کنفورماسیونی شده و آنزیم میتواند سوبسترای خود را اکسیده کرده و به coelenteramide تبدیل کند (شکل 3). میتوان به آکوارین بهعنوان یکی از شناختهشدهترین فوتوپروتئینها اشاره کرد (3).
شکل 3- ساختار یک فوتوپروتئین شامل تک زنجیره پپتیدی که در اتصال غیرکووالان با سوبسترای خود coelentrazine قرار دارد. به محض حضور کلسیم در جایگاههای مشخص شدهی پپتید، آنزیم فعالیت خود را به دست میآورد
مقایسه دو پدیده فلورسانس و بیولومینسانس
در طبیعت دو دسته پروتئین با قابلیت ساطع کردن نور وجود دارد:
- پروتئینهای فلورسانس: مهمترین مثال از این پروتئینها green fluorescence protein (GFP) میباشد که خود قادر به تولید نور نیست بلکه میتواند نور دریافتی از محیط را در طولموج دیگری نشر دهد.
- پروتئینهای بیولومینسانس: مزیت این گروه نسبت به پروتئینهای فلورسانس، قابلیت تولید نور و ساطع کردن آن در محیطهای تاریک است.
تولید خودبخودی نور توسط پروتئینهای لومینسانس سبب برتری آنها نسبت به پروتئینها و ترکیبات شیمیایی فلورسانس در امر تشخیص و ردیابی آنالیتها و یا آنتیبادیهای نشاندارشده با آنها میگردد، زیرا بر اساس معیار نسبت سیگنال به پارازیت (signal to noise ratio)، هر چه میزان نور زمینه کمتر باشد، این نسبت بیشتر شده و محدوده تشخیصی حساسیت بیشتری پیدا میکند (4).
کاربردها
بیولومینسانس- الایزا (BL-ELISA)
از پروتئــینهای بیــولومینـــسانس امروزه میتوان بهعنوان جایگزیـــــــــــنهای مناسبی بهجای نشانگرهای فلورسانس و آنزیمی (در روش الایزا) استــــــفاده کرد. در تکنیکی که اصطلاحــــــــــــــاً به آن (BL-ELISA) bioluminescence –ELISA گفته میشود، پروتئینهای بیولومینساس بهعنوان کنژوگههای شیمیایی یا ژنتیکی به آنالیت یا آنتیبادی در تستهای ایمونواسی اتصال پیدا میکنند (5). در مطالعات گذشته مشاهده شده بود که لوسیفرازها در صورت کنژوگه شدن از طـــــریق رابطهای متقابل (cross-linkers) قابلیت آنزیمی خود را تا حدود زیادی از دست میدهند، ولی فوتوپروتئینها بخصوص آکوارین و اوبلین در این مورد بسیار انعطافپذیرتر نشان دادند (6). امروزه با توجه به پیشرفت مهندسی ژنتیک میتوان از هر دو گروه پروتئینهای بیولومینساس بهصورت کنژوگههای ژنتیکی با آنتیبادیهای نوترکیب همچون scFv و یا آنالیتهای پپتیدی و پروتئینی استفاده کرد. مزیت این کار استفاده از فرم طبیعی پروتئین بیولومینسانس و کاهش هزینه و وقت صرفشده جهت فراهم کردن شرایط لازم برای کنژوگاسیون شیمیایی است (7).
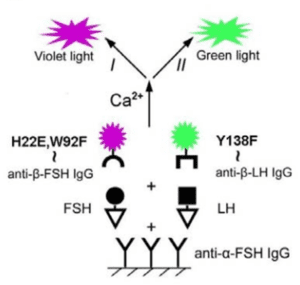
برخلاف پروتئینها و ترکیبات فلورسانس که مدت زمان نشر نور طولانیتر و تنوع طیف نوری نشردادهشده بیشتری دارند، مدت زمان نور ساطعشده از پروتئینهای بیولومینسانس کمتر از چند ثانیه است و تنوع کمتری هم در تولید و نشر نور با طولموجهای گوناگون دارند. محققین در سالهای اخیر برای رفع این دو مشکل، دستورزی بر روی ژنهای این مولکولها را آغاز کردهاند و تاکنون توانستهاند برای برخی از این پروتئینها همولوگهای مهندسی شدهای را طراحی کنند. یکی از این نمونهها استفاده از دو پروتئین نوترکیب اوبلین برای بررسی همزمان دو هورمون LH و FSH است (3) (شکل 4).
شکل 4- استفاده از پروتئینهای نوترکیب اوبلین که از لحاظ ژنتیکی مورد دستورزی قرار گرفتهانـد در تست BL-ELISA رقابتی همزمان هورمونهایLH و FSH. پروتئین اوبلین به طور طبیعی دارای طولموج 491nm است و به همین دلیل نشر نور آبی رنگ دارد. پروتئینهای نوترکیب جهشیافته از این مولکول در این تست بکار برده شده و قادر به نشر نور سبز و بنفش میباشند
همراه با دستورزی ژنهای پروتئینهای بیولومینسانس، تحقیقات برای استفاده از آنالوگ سوبستراهای اصلی این پروتئینها جهت بالا بردن میزان بهرهوری واکنش آنزیمی و تنوع در طیف نور ساطعشده در اثر تبدیل سوبسترا به محصول هم در جریان میباشد، بهطور مثال تا به امروز آنالوگهای coelentrazine که سوبسترای آکوارین میباشد در اثر تغییرات شیمیایی روی ساختمان مولکول اصلی سنتز شدهاند که علاوه بر افزایش دوام نور ساطعشده از محصول واکنش آکوارین و این آنالوگها، طولموج نورهای ساطعشده هم متفاوت خواهند بود(4).
بیولومینسانس- الایزا و تشخیص مارکرهای زیستی با غلظتهای ناچیز در مایعات بدن
چند ویژگی بارز روش بیولومینسانس- الایزا باعث شده این تکنیک جایگاه مناسبی برای تشخیص آنالیتهای با غلظت ناچیز در انواع نمونههای گرفته شده از مایعات بدن پیدا کند(1, 6). در ادامه به برخی از این ویژگیها اشاره میکنیم:
- عدم داشتن خطرات بالقوه همچون تشعشعات رادیواکتیو حاصل از فروپاشی نشانگرهای رادیوایزوتوپ
- داشتن حساسیت تشخیصی بسیار بالا و تشخیص مقادیر غلظتی کمتر از پیکومولار در نمونه
- عدم نیاز به منبع نور تهییجی و درنتیجه بالا رفتن حساسیت تکنیک به دلیل بالا رفتن نسبت سیگنال به پارازیت (signal to noise ratio)
- داشتن بالاترین عملکرد کوانتومی (quantum yield) در میان تمام نشانگرهای تولیدکننده فوتون
- داشتن دامنه پویا (dynamic range) نسبتاً وسیع جهت تشخیص محدودهی غلظتی بسیار گسترده
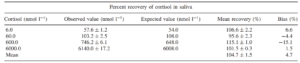
امروزه از آکوارین بهصورت کنژوگههای شیمیایی برای تشخیص نمونهی سرمی هورمونهای کورتیزول و تیروکسین در تستهای بیولومینسانس- الایزای رقابتی استفاده میشود، همچنین اخیراً با توجه به اینکه در افراد مبتلا به انواع اختلالات ترشح کورتیزول (مانند افراد مبتلا به سندرم کوشینگ و یا آدیسون) باید میزان سطح هورمون در طول یک شبانهروز موردسنجش قرار بگیرد، استفاده از نمونه بزاق افراد جایگزین روش تهاجمی نمونهگیری از سرم شده است. کورتیزول در بزاق بهصورت غیرمتصل به پروتئین و در فرم فعال خود است ولی از طرفی 50 تا 10 برابر غلظت کمتری از نمونه سرمی دارد. با وجود غلظت پایین کورتیزول بزاقی، نشان داده شده که آکوارین بهعنوان نشانگر در روش بیولومینسانس– الایزا با دقت بسیار بالایی مقادیر را در نمونههای بزاقی تشخیص میدهد (6) (جدول 1).برخی از مارکرهای زیستی بهخصوص هورمونها و مارکرهایی که در تشخیص استعداد ابتلا به بیماریهای قلبی عروقی نقش دارند، در غلظتهای بسیار ناچیز در سرم وجود داشته که تشخیص و اندازهگیری میزان آنها در سرم افراد از طریق تکنیکهای رایج ایمونواسی کاری دشوار است. استفاده از نشانگرهای بیولومینسانس با خصوصیات برجسته ذکرشده علاوه بر افزایش حساسیت تشخیص مارکرهای زیستی، سرعت انجام تست را هم افرایش میدهند، بهگونهای که کیتهای تجاری که امروزه برای تعیین میزان مارکرهای زیستی با غلظت پایین استفاده میشود دارای مراحل پیشآنالیزی هستند، درحالیکه هنگام استفاده از تکنیک بیولومینساس- الایزا نیازی به انجام این مراحل نیست.
جدول 1- بررسی مقادیر کورتیزول بزاقی به کمک نشانگر آکوارین و مقایسه آن با مقادیر موردانتظار
همچنین تستهایی درزمینه بررسی مقادیر آنالیتهای مرتبط با بیماریهای قلبی و عروقی هم با این تکنیک قابل انجام است. پروتئین C یک پلاسمالوژن وابسته به ویتامین K است که بهعنوان یک پادبند (anticoagulant) در خون عمل میکند. کمبود این پروتئین میتواند عامل ایجاد ترومبوز عروق باشد، لذا بررسی منظم سطح این پروتئین برای افرادی که استعداد ابتلا به ترومبوز عروقی دارند ضروری است. میزان غلظت فیزیولوژیک این پروتئین در سرم حدود 65 nM است. شناسایی این میزان ناچیز نیاز به تکنیکی دارد که حساسیت بالایی برای تشخیص و اندازهگیری مقادیر بسیار کم با دقت زیاد داشته باشد. بکارگیری آکوارین بهصورت کنژوگه ژنتیکی متصل به اپیتوپ HPC4 از پروتئین C در تستهای بیولومینسانس- الایزای رقابتی امروزه گزینه مناسبی برای بررسی سطح سرمی این مارکر زیستی است (جدول 2).
در نهایت، بررسی منظم و دورهای میزان مصرف داروی دیگوکسین از طریق اندازهگیری مقدار آن در سرم با استفاده از کنژوگههای شیمیایی آکوارین امکانپذیر است. دیگوکسین داروی موردنیاز برای بیماران با نارسایی قلبی است که میزان مناسب آن در سرم باید در محدودهی (2/0 – 0/8 ng ml-1) باشد در غیر این صورت میتواند کشنده باشد، بنابراین میزان مصرفی آن در این بیماران همواره باید کنترل شود. روشهای معمول اندازهگیری این دارو نیاز به جداسازی این ترکیب از نمونههای بیمار دارد که بسیار وقتگیر است، اما بکارگیری تکنیک بیولومینسانس- الایزا مبتنی بر آکوارین کنژوگه با دارو، نیاز به مراحل جداسازی قبل از آنالیز را برطرف کرده و محدوده تشخیص را تا آستانه 10 –10× 3 M پایین آورده است (6).
جدول 2- خلاصهای از پارامترهای مهم جهت آنالیز برخی هورمونها ومارکرهای زیستی مرتبط با بیماریهای قلبی و عروقی توسط تکنیک بیولومینسانس- الایزا مبتنی بر آکوارین
پروتئینهای بیولومینسانس و بکارگیری آنها در تهیه پروفایل آنتیبادیها
نسل دوم تکنیکها جهت تهیه پروفایل آنتیبادی، بکارگیری آرایههای پروتئینی (protein arrays) است که در حال حاضر جایگاه ویژهای در آنالیز پاسخهای آنتیبادی به آنتیژنهای نوترکیب دارد. در این تکنیک تراشههایی (chips) طراحی میشود که قابلیت بارگذاری صدها و یا هزاران آنتیژن نوترکیب را در سطح خود دارد، بهاینترتیب با اضافه کردن سرم حاوی آنتیبادی کنژوگه با مولکول فلورسانس امکان آنالیز همزمان تعداد فراوانی از آنتیژنهای نوترکیب فراهم میشود.آنالیز و بررسی پاسخ ایمنی هومورال به عفونتها و واکسیناسیون در جمعیتها و همچنین شناسایی اتوآنتیبادی تولیدشده علیه آنتیژنهای خودی یکی از اهداف مهم در حوزه تشخیص و کنترل بهموقع بیماریهای عفونی، نظارت بر تولید واکسنهایی با کارایی مناسب و شناسایی افراد مبتلا و یا مستعد به بیماریهای خودایمنی است. تکنیکهای ایمونواسی همچون الایزا و وسترن بلاتینگ (western blotting) در گذشته برای تهیه پروفایل آنتیبادی از طریق بررسی پاسخ آنتیبادی به آنتیژنهای نوترکیب مورداستفاده قرار میگرفت، ولی اشکال عمده این دو روش بررسی پاسخ علیه یک یا تعداد محدودی از آنتیژنهای نوترکیب بهطور همزمان بود.
تکنیک آرایههای پروتئینی با وجود داشتن ویژگیهای برجسته، دارای معایبی هم میباشد که از جمله آنها میتوان به عدم شناسایی اپیتوپهای فضایی، عدم ایموبلیزه شدن برخی آنتیژنهای نوترکیب به سطح تراشه و پایین بودن دامنه پویای محدوده تشخیص اشاره کرد. در سالهای اخیر تکنیکی ابداع شده است که تاحدودی عیــوب آرایـــههای پـــروتئیـــنی را پوشــــش میدهد. این تکنـــیک ایمــــــــــــــونواسی که به نام LIPS (luciferase immune precipitation system) شناخته میشود مبتنی بر استفاده از کنژوگههای ژنتیکی نوعی لوسیفراز به نام رنیلا لوسیفراز Renilla luciferas یا Ruc است که در فاز محلول و بهصورت ایمونواسی هموژن صورت میگیرد. این تکنیک به دلیل اجرا در فاز محلول، مشکلات استفاده از تراشه در آرایههای پروتئینی که منجر به از دست دادن برخی از آنتیژنها در مرحله ایموبلیزه کردن و از دست دادن اپیتوپهای فضایی میشود را برطرف میکند. عمدهترین ایراد تکنیک LIPS، همچون الایزا و وسترن بلاتینگ، عدم توانایی در تهیه پروفایل مجموعهای از آنتیبادیها بهطور همزمان است، بنابراین در هر زمان فقط توانایی تشخیص یک نوع آنتیژن نوترکیب را دارد (8).
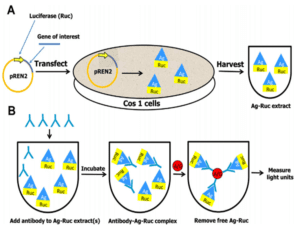
دو مرحله در انجام تکنیک LIPS وجود دارد (9) (شکل 5):
- تولید آنتیژن نوترکیب الحاق ژنتیکیشده با رنیلا لوسیفراز (Ruc): در این مرحله ابتدا ژن مربوط به آنتیژن موردنظر بهوسیله یک قطعه نوکلئوتیدی به ژن رنیلا لوسیفراز الحاق شده و سپس در یک وکتور مناسب سلولهای پستانداران (غالباً pREN2) قرار داده میشوند. این وکتور در رده سلولی Cos1 کلون میشود. بعد از 36 الی 48 ساعت سلولها در cold lysis buffer لیز میشوند و عصاره پروتئینی گرفته خواهد شد.
- فاز اجرایی LIPS: بعد از استخراج عصاره پروتئینی نیازی به خالصسازی آن برای جدا کردن پروتئینهای نوترکیب نیست، بنابراین محلول حاوی عصاره را در میکروپلیتها تقسیم کرده و به هر چاهک، سرم حاوی آنتیبادی اضافه میکنیم. انکوباسیون به مدت 1 الی 2 ساعت در دمای 4 درجه سانتیگراد انجام میگیرد، سپس محلول حاوی کمپلکسهای آنتیبادی- آنتیژن به میکروپلیتهای حاوی دانهها beads)) A/G منتقل میشود. در انتها شستوشو جهت حذف آنتیژن و یا آنتیبادیهای تک از کمپلکسهای آنتیژن- آنتیبادی متصل به دانههای A/G انجام میگیرد و نمونهها در دستگاه لومینومتر با اضافه شدن سوبسترا (coelenterazine) مورد آنالیز قرار میگیرد.
در یک جمعبندی کلی از این بخش باید گفت در حال حاضر تکنیک آرایههای پروتئینی روش ارجح برای تهیه پروفایل آنتیبادی برای مقاصد گوناگون است. تکنیک LIPS بهعنوان یک روش کمکی میتواند جهت درک بهتر و اختصاصیتر از آنتیژنها و بهویژه اپیتوپهای فضایی آنها مورداستفاده قرار بگیرد (8).
شکل 5- مــراحــل مــربــوط بــه تکنیــــــــک (LIPS)
luciferase immunoprecipitation system
(A) تولید آنتیژن نوترکیب الحاق ژنتیکی شده با رنیلا لوسیفراز (Ruc)
(B) فاز اجرایی LIPS
جمعبندی و چشماندازهای آینده
پروتئینهای بیولومینسانس ویژگیهای منحصربهفردی برای تبدیل شدن به نشانگرهای قدرتمند موردنیاز در تکنیکهای ایمونواسی دارند. توانایی تولید خودبخودی نور در محیطهای تاریک، داشتن محدوده تشخیصی بسیار حساس برای غلظتهای کمتر از پیکومولار آنالیت در نمونه و قابلیت ژن این نوع پروتئینها جهت دستورزیهای گوناگون ژنتیکی بدون از دست دادن خصوصیت کلی زیستتابی از جمله این ویژگیها میباشند. امروزه، با توجه به مطرح شدن و طراحی سیستمهای تشخیصی کوچکسازی شده (miniaturized) همچون سیستمهای” آزمایشگاه بر روی تراشه” یا همان lab-on-a-chip، پروتئینهای بیولومینسانس ارزش خود را در میان نشانگرهای موجود بیشتر میتوانند نشان دهند، زیرا این نوع سیستمها غالباً حجمهای بسیار کم از نمونه را لازم دارند. استفاده از نشانگرهای رایج در تستهای ایمونواسی کار تشخیص آنالیت در حجم کم را با مشکل روبرو میکند، لذا، تکنیک بیولومینسانس- الایزا با داشتن دامنه پویای وسیع تشخیصی و بالاترین عملکرد کوانتــــومی (quantum yeild) در میان تمام نشانگرهای تولیدکننده فوتون، آنالیتها با غلظت بسیار پایین را با دقت بالا سنجش خواهد کرد (6).
تکنیک LIPS در سالهای اخیر در پروژههای تحقیقاتی بهعنوان روشی کمکی برای تکنیک آرایههای پروتئینی مورداستفاده قرار گرفته است. این احتمال وجود دارد که در سالهای آینده با بهبود و ارتقاء سطح بهرهوری این روش، روزی جایگزین تکنیک قدرتمند آرایههای پروتئینی در تهیه پروفایل آنتیبادی جهت تشخیص عفونتها، اتوآنتی بادیها و آنالیز کارایی واکسنها شود.
منابع:
- Frank LA, Krasitskaya VV. Application of enzyme bioluminescence for medical diagnostics. Bioluminescence: Fundamentals and Applications in Biotechnology-Volume 1: Springer; 2014. p. 175-197.
- Scott D, Dikici E, Ensor M, Daunert S. Bioluminescence and its impact on bioanalysis. Annual review of analytical chemistry 2011;4:297-319.
- Frank LA. Ca2+-regulated photoproteins: effective immunoassay reporters. Sensors 2010;10:11287-11300.
- Rowe L, Dikici E, Daunert S. Engineering bioluminescent proteins: expanding their analytical potential. Analytical chemistry 2009;81:8662-8668.
- Oyama H, Morita I, Kiguchi Y, Miyake S, Moriuchi A, Akisada T, et al. Gaussia Luciferase as a Genetic Fusion Partner with Antibody Fragments for Sensitive Immunoassay Monitoring of Clinical Biomarkers. Analytical chemistry 2015;87:12387-12395.
- Rowe L, Teasley K, Dikici E, Qu X, Ensor M, Deo S, et al. Recombinant Aequorin‐Based Systems for Biomarker Analysis. Handbook of Biosensors and Biochips 2007.
- 7. Zeng X, Shen Z, Mernaugh R. Recombinant antibodies and their use in biosensors. Analytical and bioanalytical chemistry 2012;402:3027-3038.
- Burbelo PD, Ching KH, Bush ER, Han BL, Iadarola MJ. Antibody-profiling technologies for studying humoral responses to infectious agents. Expert review of vaccines 2010;9:567-578.
- Burbelo PD, Lebovitz EE, Notkins AL. Luciferase immunoprecipitation systems for measuring antibodies in autoimmune and infectious diseases. Translational Research 2015;165:325-335.
مگنتیک ایمونواسی و کاربردهای آن
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام