استفاده از بیوسنسورها در تشخیص دقیق و زودهنگام سرطان
محمدحسن جعفری نجفآبادی: دانشجوی دکترای تخصصی زیستفناوری پزشکی، دانشگاه علوم پزشکی مشهد
1 مقدمه
سرطان سومین عامل مرگومیر در کشورهای در حال توسعه از جمله ایران است. این بیماری در کشورهای توسعهیافته دومین عامل مرگومیر است. در ایران سالانه بیش از 30/000 نفر بر اثر ابتلا به این بیماری جان خود را از دست میدهند. در مورد سرطان دو فاکتور محیط (الکل، سیگار، پرتو و مواد شیمیایی) و وراثت (جهشهای ارثی و اختلال سیستم ایمنی) خطر ابتلا به این بیماری را افزایش میدهند. همچنین در سرطانهایی مانند معده و دهانه رحم به ترتیب آلودگیهای باکتریایی و ویروسی خطر ابتلا را افزایش داده است. طبق آمارهای سال 1387 شایعترین سرطان در مردان و زنان ایرانی به ترتیب پوست و پستان بوده؛ در حالی که آمار جهانی، سرطان پروستات را شایعترین سرطان در بین مردان عنوان میکند. جامعه سرطان آمریکا (ACS) تخمین زده است که میانگین نرخ زندهمانی پنجساله در بین سالهای 1996 تا 2004 به 66% (در مقایسه با 50% در بین سالهای 1975 تا 1977) رسیده است که به دلیل پیشرفت فناوریهای درمانی و تشخیص زودهنگام است.
ظهور فناوری بیوسنسورها و استفاده از آنها امکان تشخیص زودهنگام و درمان مؤثرتر را خصوصاً در مورد سرطانهایی که در مراحل انتهایی تشخیص داده میشوند یا به درمان پاسخ ضعیفی دارند، فراهم کرده است. سرطان به دلیل انباشته شدن جهشهای ژنتیکی و اختلالات اپیژنتیکی که در نهایت باعث رشد غیرقابل کنترل سلول میشوند، به وجود میآید. سلولهای سرطانی بهصورت ذاتی به مرگ برنامهریزیشده سلولی (آپوپتوز) و عوامل دفاعی جلوگیری کننده از رشد مقاوم هستند. در مراحل نهایی بیماری، سلولهای سرطانی از مکان اولیه خود حرکت کرده و در نقاط مختلف بدن لانهگزینی میکنند که متاستاز نامیده میشود، در این هنگام بیماری غیرقابل درمان است. دو مکانیسم مشترک در تومورزایی، فعال شدن آنکوژنها و غیرفعال شدن ژنهای سرکوبکننده تومور[1] (TGS) است. فعال شدن آنکوژنها از طریق موتاسیون یا دو برابر شدن ژنهای پروتوآنکوژن که بهصورت طبیعی در تنظیم چرخه سلولی، تکثیر و تمایز نقش دارند، انجام میشود، برای مثال در 33% از سرطانهای پستان، تعداد فاکتور رشد اپیدرمی انسانی (Her-2) که یک گیرنده رشد سلولی بوده و در سلولهای طبیعی هم وجود دارد، افزایش یافته است. هرسپتین که یک آنتیبادی مونوکلونال است و امروزه بهعنوان درمان برای سرطان پستان به کار میرود، بهصورت مستقیم گیرنده Her-2 را مهار میکند. ژنهای سرکوبکننده تومور همانطور که از نامشان مشخص است در هنگام رشد و تکثیر نامناسب سلولی یا به وجود آمدن اختلال در مراحل سیکل سلولی فعال شده و با متوقف کردن تکثیر و رشد، از به وجود آمدن سلول غیرطبیعی جلوگیری میکنند. از ژنهای سرکوبکننده تومور دخیل در سرطان که بهخوبی مطالعه شدهاند، میتوان به پروتئینهای رتینوبلاستوما (Rb)، BRCA1/2 و p53 اشاره کرد، به عنوان مثال جهش در ژن BRCA1 در 50% از سرطانهای پستان موروثی و 80% تا 90% از سرطانهای تخمدان با ریشه وراثتی، به اثبات رسیده است.
در روش سنتی غربالگری[2] سرطان، پس از گرفتن بیوپسی از بافت سرطانی و رنگآمیزی سلولها، تغییرات مرفولوژی سلول بهعنوان شاخصی برای تشخیص سلولهای سرطانی است. این روش علاوه بر تهاجمی[3] بودن، زمانی سرطان را تشخیص میدهد که این بیماری در مراحل کشنده است. روشهای مبتنی بر ایمنی سنجی[4] (مثل الایزا) از دیگر روشهای تشخیصی میباشند که در آن از یک بیومارکر بهعنوان شاخص بیماری استفاده میشود. این روشها با وجود حساسیت و انتخابی بودن، زمانبر و وقتگیر میباشند. علاوه بر این به دلیل عدم تشخیص غلظت پایین بیومارکرهای سرطانی، توانایی شناسایی این بیماری را در مراحل اولیه دارا نیستند. روشهای مبتنی بر ابزار مولکولی (ژنومیکس و پروتئومیکس) نیز میتوانند برای تشخیص به کار گرفته شود که به دلیل پیچیدگی، بیشتر برای اهداف تحقیقاتی مورداستفاده قرار میگیرد. تشخیص زودهنگام، اختصاصی و درست سرطان از مهمترین نیازهایی است که توسعه روشهای جدید را توجیهپذیر کرده است، به عنوان مثال به علت پیچیده بودن فرایند سرطان و دخیل بودن تغییرات ژنتیکی و اپیژنتیکی وسیع در آن، نمیتوان با بررسی یک مارکر یا یک ژن از وجود سرطان اطمینان حاصل کرد، به این دلیل توسعه روشهایی که در آن از چندین مارکر[5] برای تشخیص استفاده میکنند، ضروری به نظر میرسد. به عنوان مثال، بیوسنسورهای الکتروشیمیایی یکبار مصرفی ساخته شدهاند که همزمان توانایی تشخیص دو بیومارکر سرطانی CA19-9 و CA125 را در غلظت پایین دارا است. در زمینهی بیوسنسورهای تشخیصی سرطان، تحقیقات وسیعی برای یافتن بیومارکرهای سرطانی جدید در حال انجام است. اهمیت این موضوع کاملاً واضح است، چرا که با یافتن یک بیومارکر مناسب، بیش از نصف راه ساخت یک بیوسنسور تشخیص زودهنگام پیموده شده است.
2 بیومارکرهای سرطانی
این بیومارکرها را آنتیژنهای مرتبط با تومور هم نامیدهاند و با پیشرفتهای وسیع در زمینه تحقیقات ژنومیکس و پرتئومیکس، تعداد آنها بهصورت روزافزون در حال افزایش است. انستیتو بینالمللی سرطان (NCI) بیومارکر را بعنوان مولکولی معرفی میکند که در خون و دیگر مایعات بدن وجود داشته و میتواند نشانهای از وجود یک فرایند نرمال با غیر نرمال باشد. از منابع معتبر بیومارکرهای سرطانی مورداستفاده در تشخیص و پیشآگاهی میتوان به پایگاههای داده NCBI[6] و Cancer Research UK اشاره کرد. از این بیومارکرها میتوان در ارزیابی پاسخ بدن به بیماری یا درمان، استفاده کرد. برای هر یک از این بیومارکرها یک غلظت آستانه[7] وجود دارد که اگر از آن حد بیشتر باشد، یکی از گزینههای موجود، بیماری سرطان است. بیومارکرها بسیار وسیع بوده و میتواند شامل DNA (جهش، تبادل، تکثیر و…)، RNA (بیان نامناسب آنکوژن یا ژن سرکوبکننده تومور) یا پروتئین (هورمون، آنتیبادی، پروتئین آنکوژن یا سرکوبکننده تومور) باشد. بیومارکرهای سرطانی ابزار قدرتمندی برای تشخیص زودهنگام سرطان، مانیتورینگ مراحل مختلف بیماری و تعیین میزان پاسخ سرطان به درمان، به شمار میروند. در ادامه چند بیومارکر سرطانی بهعنوان نمونه آورده شده است.
2-1 آنتیژن اختصاصی پروستات(PSA[8])
PSA یکی از اولین بیومارکرهایی بود که کشف شد و بهسرعت راه خود را برای استفاده بالینی در تشخیص سرطان پروستات باز کرد. مطالعات، بالا بودن سطح PSA را بهطور مستقیم با سرطان پروستات مرتبط دانستهاند. سطح نرمال PSA در حد 4 نانوگرم بر میلیلیتر است. در حدود 30% مردان با سطح PSA بین 4/1 تا 9/9 نانوگرم بر میلیلیتر، مبتلا به سرطان پروستات هستند. البته سطح بالای این آنتیژن همیشه نماینده تومور بدخیم نبوده و هایپرپلازیهای خوشخیم پروستات و همچنین پروستاتیت (التهاب پروستات) هم میتواند باعث افزایش این آنتیژن گردد. علاوه بر این برخی مطالعات نشان داده است که افراد دارای سطح بالای این آنتیژن، سرطان پروستات نداشتند؛ بنابراین استفاده از بیوسنسورها به دلیل استفاده همزمان از چندین بیومارکر، میتواند تا اندازهی قابلتوجهی ابهامات موجود در روشهای مرسوم را مرتفع سازد.
2-2 آنتیژن سرطانی 125 (CA125)
آنتیژن سرطانی 125 اکثراً با سرطان تخمدان مرتبط بوده ولی در بیماریهایی مثل سرطان رحم، پانکراس، پستان، ریه و روده بزرگ نیز ردپای آن دیده میشود. بهعلاوه شرایط غیر بیماریزایی مانند قاعدگی و حاملگی نیز باعث افزایش سطح آن میگردد. در 90% از زنان دارای سرطان پیشرفته تخمدان و همچنین 40% از بیماران دارای بدخیمی داخل شکمی، سطح آن افزایش مییابد. با اینهمه باید توجه داشت که 50% از مبتلایان، دارای سطوح نرمال این آنتیژن میباشند. سیر افزایشی CA125 میتواند بهعنوان شاخصی برای ردیابی سیر تحول تومورهای خوشخیم به سمت بدخیمی مورداستفاده قرار گیرد.
2-3 آنتیژن CA15-3
بیومارکری است که برای آنالیز پیشرفت بیماری سرطان پستان به کار میرود. مطالعات نشان دادهاند که غلظت آن از 10% در مرحله ابتدایی سرطان تا 75% در مراحل انتهایی متغیر بوده و از این طریق میتوان پیشرفت بیماری را تشخیص داد.
3 بیوسنسورها و سرطان
بیوسنسور وسیلهای است که یک آنالیت بیولوژیکی را خواه در محیط و یا درون بدن، مورد شناسایی قرار میدهد. اطلاعات وجود یا عدم وجود آنالیت (شامل پروتئین، نوکلئیک اسید و ترکیبات متابولیکی مانند گلوکز) و همچنین سطح آن در این وسایل به پالسهای الکتریکی تبدیل شده و پس از تقویت شدن، نمایش داده میشود. در پزشکی از بیوسنسورها برای مانیتورینگ سطح قند خون در افراد دیابتی، تشخیص پاتوژنها و همچنین تشخیص و مانیتورینگ سرطان استفاده شده است. در مورد سرطان، آنالیت، بیومارکرهای توموری هستند که از طریق اندازهگیری سطح آنها، وجود یا عدم وجود سرطان، بدخیمی یا خوشخیمی و همچنین مؤثر بودن یا نبودن درمان، قابلتشخیص است.
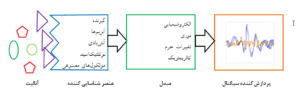
یک بیوسنسور دارای سه جزء: عنصر شناسایی کننده[9] مبدل سیگنال[10] و پردازش کننده سیگنال[11] است (شکل 1).
شکل 1: اجزای اصلی یکی بیوسنسور
عنصر شناساییکننده از اجزای ضروری یک بیوسنسور بوده و شناسایی اختصاصی آنالیت موردنظر را از طریق مکمل بودن (از نظر شکل فضایی) عنصر شناسایی کننده و آنالیت انجام میدهد (شکل1). گیرندههای سطح سلولی یکی از این عناصر شناسایی کننده هستند. این گیرندهها در حالت طبیعی در زمان اتصال به لیگاند خود، فرایندهای بسیار مهمی ازجمله فعال کردن یک G پروتئین، پروتئین کیناز یا فسفاتار و همچنین تغییراتی در کانالهای یونی و … انجام میدهند، اما باید توجه داشت این گیرندهها، تاخوردگی مناسب خود را تنها زمانی که درون غشاء هستند به دست میآورند، بنابراین استفاده از گیرندههای خالصشده در بیوسنسورها تا حدودی عملکرد و پایداری آنها را تحتتأثیر قرار دهد.
3-1 عنصر شناساییکننده یک بیوسنسور
3-1-1 آنتیبادیها
بیوسنسورهایی که در آنها عنصر شناساییکننده، آنتیبادی است تحت عنوان ایمونوسنسورها شناخته میشود. شناسایی آنالیت توسط این عناصر بسیار اختصاصی و سریع بوده و همچنین نیاز به خالصسازی آنالیت موردنظر برای شناسایی وجود ندارد. در برخی موارد برای استفاده از آنتیبادی در بیوسنسورها، باید آنها را برچسبگذاری[12] نمود. گاهی این برچسبگذاری توسط رنگهای فلورسنت انجام میشود که نمونههای آن را میتوان در ایمونوسنسورهای دارای مبدلهای نوری مشاهده کرد و یا در ایمونوسنسورهای الکتروشیمیایی آمپرومتریک از آنزیمهای اکسیداسیون احیایی مثل HRP[13] برای این کار استفاده میشود. در بعضی از موارد مانند ایمونوسنسورهایی که از مبدلهای FET[14] یا میکروکانیلور[15] استفاده میکنند، آنتیبادی بدون برچسب[16] استفاده میشود. بیوسنسور تشخیص سرطان پروستات که امروزه بصورت بالینی مورداستفاده قرار میگیرد، از عنصر شناساییکننده آنتیبادی ضد PSA (anti-PSA) استفاده میکند.
3-1-2 آنزیمها
آنزیمهای آلوستریک دارای پتانسیل بالایی برای استفاده در بیوسنسورها هستند، به این صورت که بخش تنظیمی آنزیم بهعنوان عنصر شناساییکننده و بخش کاتالیتیک آنزیم بهعنوان مبدل مورداستفاده میگیرد. برای مثال در مورد سنسور گلوکز که از آنزیم گلوکز اکسیداز استفاده میکند، آنزیم گلوکز اکسیداز در حضور اکسیژن، گلوکز را اکسید کرده و تولید گلوکونولاکتون و پراکسید هیدروژن میکند و همزمان یک مبدل آمپرومتریک میزان مصرف اکسیژن و تولید پراکسید هیدروژن را به مقدار قند خون تبدیل میکند.
3-1-3 نوکلئیک اسید
آپتامرها[17] از نوکلئیک اسیدهایی هستند که به دلیل شکل فضایی خاص که از طریق تاخوردگی به دست آورده و مکمل مولکول هدف است، به مولکول موردنظر اتصال اختصاصی و پایداری برقرار میکند و به این دلیل در بیوسنسورها بعنوان عنصر شناساییکننده، بسیار مورداستفاده قرار گرفتهاند. شیوه انتخاب و تولید این عناصر که از طریق جستجو در میان کتابخانهای بزرگ از الیگونوکلئوتیدهای تصادفی برای اتصال اختصاصی به یک مولکول هدف است (روش SELEX)، باعث شده است برای جستجوی بیومارکرهای سرطانی جدید مورداستفاده قرار گیرد. از مزایای آپتامرها در مقایسه با آنتیبادیها میتوان به هزینه پایین تولید و پایداری بیشتر اشاره کرد، اما ازنظر اختصاصی بودن، بهطور میانگین آنتیبادیها همچنان بهتر هستند.
3-1-4 پلیمرهای حکاکی شده مولکولی[18](MIPs)
گیرنده مصنوعی مولکولهای مختلف بوده که توسط تشکیل پلیمر در اطراف یک مولکول هدف که قالب[19] نامیده میشود به وجود میآیند. پس از خارج ساختن مولکول هدف (بعنوان مثال تجزیه شیمیایی)، پلیمر باقیمانده به دلیل مکمل بودن با مولکول هدف، میتواند بعنوان گیرنده آن مولکول مورداستفاده قرار گیرد، بهعنوانمثال از یک MIP اختصاصی برای ردیابی نوکلئوزید پیریمیدین در ادرار که بهعنوان یک بیومارکر سرطانی بهحساب میآید، استفاده شده است. از مزایای این عناصر شناساییکننده میتوان بهسادگی تولید و همچنین پایداری بالای آنها اشاره کرد. با این حال به دلیل هزینه بالای تولید در بعضی موارد و همچنین نیاز به یک قالب مولکولی و خالصسازی نهایی گیرنده از این قالب، استفاده از آنها در مقایسه با آنتیبادیها محدود شده است.
3-2 مبدل در بیوسنسورها
پس از شناسایی یک آنالیت (بیومارکر سرطانی) توسط عنصر شناساییکننده، تغییراتی از نظر خصوصیات نوری، الکتروشیمیایی، جرمی و یا گرمایی در مبدل اتفاق میافتد که پس از مقایسه آن با حالت پایه (عدم وجود آنالیت)، مبدل مقدار آنالیت را به سیگنال الکتریکی قابلفهم برای پردازشگر تبدیل میکند. بهصورت کلی مبدلها در چهار گروه: الکتروشیمیایی (بعنوان مثال آمپرومتریک، پتانسیومتریک)، مبدلهای نوری (بعنوان مثال فلورسنت، لومینسنت)، مبدلهای جرمی (پیزوالکتریک) و مبدلهای کالریمتریک (که به دلیل عدم استفاده از این مبدلها در بیوسنسورهای تشخیصی سرطان، موردبحث واقع نمیشود) قرار میگیرند. به دلیل اهمیت این جزء، تقسیمبندی بیوسنسورها نیز همین اساس انجام میشود
3-2-1 بیوسنسورهای الکتروشیمیایی
به دلیل سادگی استفاده، پرتابل بودن و سایز کوچک، از متداولترین بیوسنسورها به شمار میروند. بعنوان مثال سنسور گلوکز که انقلابی در اندازهگیری سریع قند خون ایجاد کرد از این دسته بیوسنسورهاست. دو دسته از مهمترین بیوسنسورهای این گروه، بیوسنسورهای پتانسیومتریک و آمپرومتریک هستند. بیوسنسورهای پتانسیومتریک از الکترودهای یون انتخابی بهره میبرند و با مقایسه میزان اختلاف پتانسیل ایجادشده در اثر شناسایی مولکول هدف توسط قسمت شناساییکننده، مقدار مولکول هدف را در فاز محلول تخمین میزنند. یکی از انواع خاص این بیوسنسورها که امیدواری زیادی برای استفاده از آن در تشخیص بالینی سرطان ایجاد کرده، سنسور پتانسیومتریک قابل آدرسدهی با نور(LAPS)[20] است که با جفت شدن با یک عنصر شناساییکننده فاژی (pahge-LAPS)، برای شناسایی بیومارکر سرطانی hPRL-3 و سلولهای سرطانی پستان مورداستفاده قرار گرفته که بسیار موفقیتآمیز بوده است. در مقابل، بیوسنسورهای آمپرومتریک، میزان جریان را بین دو الکترود اندازهگیری میکنند. این شدت جریان در اثر واکنشهای اکسایش و کاهش در حین شناسایی مولکول هدف توسط بخش شناسایی بیوسنسور به وجود میآید. از این بیوسنسورها برای شناسایی جهشها در بخش خاصی از DNA توسط یک عنصر شناساییکننده DNA اختصاصی که به ناحیه جهش هیبرید میشود، برای تشخیص سرطان استفاده شده است، برای مثال تشخیص جهش در پروتئین BRCA1/2 که وابسته به سرطان پستان ارثی است، توسط نوع خاصی از این بیوسنسور که chrono-potentiometric نامیده میشود، با موفقیت انجام گرفته است. سیتوسنسورها یک نوع بیوسنسور الکتروشیمیایی بر پایه سلول هستند که از طریق اندازهگیری تغییرات امپدانس[21] سلول در پاسخ به آنالیت، میزان مولکول هدف (آنالیت) را تعیین میکنند، برای مثال در مطالعه میزان اثر داروهای ضد سرطان که باعث القای آپوپتوز از طریق p53 در این سلولها میشود، از سیتوسنسورها استفاده میشود. این بیوسنسورها با اندازهگیری میزان تغییرات شدید غشاء (نفوذپذیری یونی، اختلال در یکپارچگی غشاء) که بهطور معمول در حین فرآیند آپوپتوز اتفاق میافتد، میزان اثر دارو را مشخص میکنند.
3-2-2 بیوسنسورهای نوری
این بیوسنسورها از مبدلهای نوری استفاده میکنند که در آنها، میزان تغییرات طولموج نور و یا رزونانس پلاسمون سطح(SPR)[22] که براثر شناسایی آنالیت بوجود میآید، بهصورت الکتریکی درآمده که قابل تفسیر است، برای مثال بیوسنسورهای کریستال فوتونی با اندازهگیری نور منعکسشده توسط کریستال، مکان و زمان اتصال و جداشدن سلولها و مولکولها را از سطح کریستال تشخیص میدهند. توسط این بیوسنسور تغییرات سلولهای سرطان پستان (آپوپتوز یا تکثیر) در مواجهه با داروی دکسوروبیسین، تعیین شده است.
3-2-3 بیوسنسورهای جرم پایه[23]
در میان بیوسنسورهای جرم پایه، بیوسنسورهای پیزوالکتریک در تشخیص سرطان بسیار مورداستفاده قرار گرفته است. در این بیوسنسورها یک ماده پیزوالکتریک مثل کریستال کوارتز وجود دارد که با تغییرات جرمی که براثر شناسایی آنالیت توسط عنصر شناساییکننده بوجود میآید، جرم آن تغییر میکند و این عامل باعث تولید یک جریان الکتریکی میگردد که قابل اندازهگیری است. بعنوان مثال از یک بیوسنسور پیزوالکتریک جفت شده با PCR برای تشخیص جهش در ژن p53 استفاده شده است.
3-3 بیوسنسورها و نانوتکنولوژی
استفاده از نانوتکنولوژی در توسعه بیوسنسورها با افزایش شانس تشخیص سرطان در مراحل اولیه، باعث بهبودی نرخ زندهمانی بیماران شده است. برای مثال استفاده از MRI در تشخیص سرطان متداول بوده ولی این تکنیک توانایی تشخیص تومورهای کمتر از چند سانتیمتر را ندارد. استفاده از نانومواد در این روش باعث افزایش حساسیت و دقت در این روش شده است، علاوه بر این استفاده از نانوتکنولوژی در بیوسنسورها با کوچکسازی آنها، باعث افزایش دسترسی و تشخیص مارکرهای سرطانی و همچنین افزایش اختصاصیت سیگنال و کم شدن هزینه، خواهد شد. نانوذرات دارای قطر بین 1 تا 100 نانومتر بوده و به این دلیل دارای نسبت سطح به حجم وسیعی میباشند. افزایش نسبت سطح به حجم باعث تشخیص و تصویربرداری بهتر شده و دارورسانی به تومورهای غیرقابل دسترس را بهبود میبخشد، همچنین این خاصیت امکان تشخیص حتی یک مولکول بیومارکر را فراهم میکند. نانوکانتیلورها، نانووایرها و نانوکانالها از مثالهای مورداستفاده در مبدلهای بیوسنسور هستند، برای مثال از بیوسنسورهای دارای نانووایر در تشخیص miRNAهای سرطانی که با پیشرفت سرطان مرتبط هستند، استفاده شده است. از نانولولههای کربنی تکلایه (SWCNTs) در بیوسنسورهای الکتروشیمیایی به منظور افزایش حساسیت واکنش آنزیمی استفاده شده است. نقاط کوانتومی[24]، نانوکریستالهای دارای خاصیت لومینسنت بوده که به جای برچسبگذاری فلورسنت مورداستفاده قرار میگیرند. این نانومواد را میتوان به آنتیبادیها متصل کرد و در ایمونوسنسورهای دارای مبدل نوری مورداستفاده قرار داد. نقاط کوانتومی دارای طیف نشری زیاد و باریک بوده و این خاصیت اجازه استفاده همزمان از آنها را در آنالیزهای تسهیم[25] شده، با کمترین نویز فراهم میآورد.
4 نتیجهگیری
امروزه با کشف بیومارکرهای سرطانی جدید که دارای اختصاصیت و همبستگی زیاد با بیماری سرطان هستند، راه برای تشخیص این بیماری توسط بیوسنسورها هموار شده است. یکی از خصوصیات مهم در بیوسنسورها که آنها را برای تشخیص زودهنگام مناسب میسازد، توانایی استفاده از چندین بیومارکر سرطانی در یک آزمایش است، چرا که در بعضی از موارد، بالا بودن یک بیومارکر، همبستگی بالایی با بیماری نداشته و نتایج مثبت کاذب ما را گمراه کند. همچنین ورود نانوتکنولوژی به قسمتهای مختلف یک بیوسنسور، علاوه بر کوچکسازی، اختصاصیت را زیاد کرده و با شناسایی بیومارکرها در غلظتهای کم (مراحل اولیه بیماری)، تشخیص زودهنگام بیماری سرطان را ممکن میسازد. با اینکه کوچکسازی بیوسنسورها، امکان تولید دستگاههای POC[26] (خودمراقبتی) را افزایش میدهد؛ اما باید توجه داشت که حرکت از سمت نمونههای آزمایشگاهی بیوسنسور به سمت دستگاههای POC که در آنها آنالیز نمونهها در زمان و مقیاس بسیار کم انجام میشود، نیاز به بررسی و آزمایشهای بیشتر دارد.
منابع:
1-Bohunicky, B., & Mousa, S. A. (2011). Biosensors: the new wave in cancer diagnosis. Nanotechnology, science and applications, 4, 1.
2-Moina, C., & Ybarra, G. (2012). Fundamentals and Applications of Immunosensors. ADVANCES IN IMMUNOASSAY TECHNOLOGY, 65.
3-Tothill, I. E. (2009, February). Biosensors for cancer markers diagnosis. InSeminars in cell & developmental biology (Vol. 20, No. 1, pp. 55-62). Academic Press.
4- http://www.ncii.ir/
[1] -Tumor Suppressor Genes
[2] -Screening
[3] – Invasive
[4] – Immunoassays
[5] – Multimarker
[6] – National Center for Biotechnology Information
[7] – Thresholds
[8] – Prostate-specific antigen
[9] -Recognition element
[10] -Signal transducer
[11] -Signal processor
[12] – Labeled
[13] – Horseradish peroxidase
[14] – Field-effect transistors
[15] – Microcantilever
[16] – Label-free
[17] – Aptamers
[18] -Molecular imprinting polymers
[19] -Template
[20] – Light-Addressable Potentiometric Sensor
[21] – Impedance
[22] -Surface plasmon resonance
[23] -Mass based biosensors
[24] – Quantum dots
[25] – Multiplexed analysis
[26] -Point of care
https://medlabnews.ir/%d8%aa%d8%b4%d8%ae%db%8c%d8%b5-%d8%b3%d8%b1%db%8c%d8%b9-%d8%b9%d9%88%d8%a7%d9%85%d9%84-%d9%85%db%8c%da%a9%d8%b1%d9%88%d8%a8%db%8c-%d8%a8%d8%a7-%d8%a8%db%8c%d9%88%d8%b3%d9%86%d8%b3%d9%88%d8%b1%d9%87/
https://medlabnews.ir/%d9%86%d8%a7%d9%86%d9%88%d8%a8%db%8c%d9%88%d8%b3%d9%86%d8%b3%d9%88%d8%b1-2/
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام