تشخیص آزمایشگاهی نئوپلاسمهای بافت خونساز 2017
قسمت سوم
دكتر حبیبالله گلافشان عضو هيئت علمي دانشگاه علوم پزشكي شيراز
نگين شكرگزار كارشناس ارشد هماتولوژی و بانک خون دانشگاه علوم پزشكي شيراز
کاربردهای ایمونوهیستوشیمی در نئوپلاسمهای خون
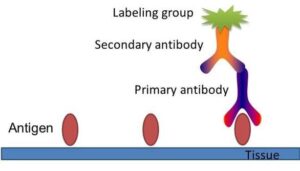
روشهای ایمونوهیستوشیمی روی برشهای غدد لنفاوی یا برشهای بافتی مغز استخوان انجام میگیرد و نقش مهمی در تشخیص لنفوما دارد. در این روش شناسایی آنتیژن با استفاده از آنتیبادیهای مونوکلونال نشاندار انجام میگیرد که پس از واکنش موجب تغییر رنگ یک سوبسترا میگردد.
اصول ایمونوهیستوشیمی برای یافتن آنتیژنهای بافتی با استفاده از آنتیبادی اختصاصی و آنتیهیومن گلوبولین کانژوگه شده با آنزیم در کنار سوبسترا
از مهمترین کاربردهای هیستوشیمی عبارتند از:
1- تأیید تشخیص لنفوم فولیکولار با نشان دادن اینکه سلولهای سرطانی که شبیه به لنفوسیت با هستهای شکافدار هستند برای مارکرهای CD10 و BCL2 مثبت هستند. در حالی که در یک فولیکول لنفاوی واکنشی مارکر BCL2 منفی است.
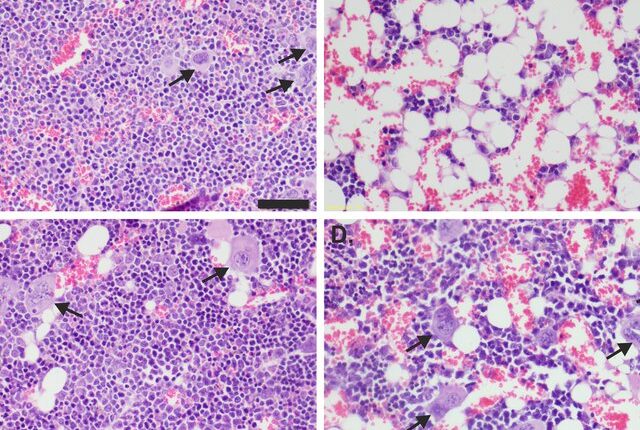
در شکل فوق رنگآمیزی برای سیکلین D1 هستهای برای تشخیص لنفوم مانتل و در کنار آن دو لنفوسیت با هسته قاچخورده که از ویژگی لنفوم فولیکولار است مشاهده میگردد
2- تأیید تشخیص لنفوم مانتل با نشان دادن اینکه سلولهای سرطانی مارکر CD5 و سیکلین D1 هستهای را بیان میکنند در حالی که در لوسمی مزمن لنفوسیتیک مارکر سیکلین منفی است.
3- تأیید تشخیص لنفوم هاچکین کلاسیک که برای مارکرهای CD15 و نیز CD30 اغلب مثبت بوده و افتراق آن از لنفوم هاچکین نودولار با غالب بودن لنفوسیتهایی از نظر مارکرهای CD15 و CD30 معمولاً منفی بوده بیان بیشتر آنتیژنهای رده سلول B مانند CD20 و CD79a را دارند، مشخص میشود.
4- تأیید لنفوم بورکیت با نشان دادن سلولهای B که از نظر BCL2 منفی و از نظر BCL6 مثبت بوده و دارای فراکسیون اندکس تکثیری بالا حدود 100% هستند که با استفاده از KI-67 یا آنتیبادی مونوکلونال مشابه قابل ارزیابی است.
5- تقسیمبندی لنفوم منتشره سلولهای لنفوم بزرگ B (DLBCL) از نظر فاکتورهای پیشآگهی
6- تأیید تشخیص لوسمی سلولهای مویی با نشان دادن بیان مارکرهای CD25، CD72 و آنکسین A1
7- تأیید کلونالیتی پلاسماسل که شناسایی آنها محدود به زنجیره سبک سیتوپلاسمی است.
8- تشخیص سلولهای لنفوم هاچکین و غیر هاچکین متاستاز یافته
9- تأیید تشخیص لوسمی سلولهای مودار با جهش BRAF
10- ایمونوهیستوشیمی برای شناسایی آنزیم تریپتاز سلولهای ماست (mast) و بیان ناهنجار CD2 و CD25 توسط این سلولها در تشخیص ماستوسیتوز سیستمیک
لوسمی سلولهای ماست سل
کاربردهای روش FISH در تشخیص نئوپلاسمهای بافت خونساز
در روش FISH (Fluorescence in situ hybridization) از اولیگونوکلئوتیدهای نشاندار استفاده میشود که بهتوالی خاصی از DNA پیوند داده میشود؛ برای مثال از پروبهای سانترومر برای تشخیص مونوزومی و تریزومی و از پروبهای اختصاصی جایگاه (locus specific) برای شناسایی انکوژنها و ژنهای سرکوبگر تومور استفاده میشود.
با استفاده از دو پروب با فلوروکرومهای مختلف میتوان جابهجایی و بازآرایی ژنها را مورد مطالعه قرار داد و شاهد پخش و ادغام دو نور مختلف در جابهجاییها بود. در اغلب موارد یکی از پروبها با فلورسانس سبز و دیگری با قرمز نشاندار شده است، بهطوریکه ادغام دو ژن بهصورت رنگ زرد ظاهر میشود. وقتی که یک ژن مانند MLL (KMT2A) با تعداد زیادی ژن توانایی بازآرایی دارد، میتوان از دو پروب که نواحی ʹ3 و ʹ5 را پوشش داده و همپوشانی دارند، با استفاده از پروبهایی که موجب شکسته شدن نور در دو رنگ
(double color break apart) میشوند، جابهجایی کروموزومی را تشخیص داد.
روش FISH قابلیت کاربرد در متافاز و اینترفاز را دارد و استفاده از آن در موارد زیر بسیار ارزشمند است:
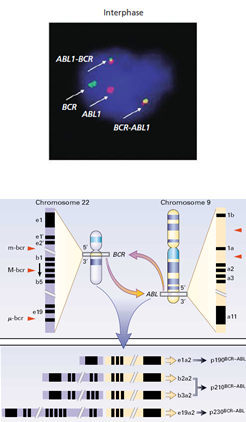
- اسکرین کردن ادغام BCR/ABL در لوسمی مزمن میلوسیتیک (نمونه خون محیطی قابل قبول است در حالی که بهتر است آنالیز سیتوژنتیک را روی نمونه مغز استخوان انجام داد).
بهکارگیری روش FISH برای مشاهده ادغام BCR-ABL در لوسمی مزمن مایلوسیتیک
- تأیید تشخیص یک لنفوم ویژه؛ بـرای مثال ادغام BCL2-IgG در لنفوم فولیکولار و ادغام CCND1-IGHG1 در لنفوم مانتل و ادغام Myc/IGHG1 در لنفوم بورکیت
- شناسایی جابهجاییها یا وارونگیها و یا آنوپلوئیدی در مواردی که روش سیتوژنتیک به علت اینکه سلولهای سرطانی وارد میتوز نشده و یا متافاز دارای کیفیت ضعیف است جواب قابل قبولی بهدست نمیآید؛ برای مثال شناسایی t(8;21)، t(15;17) و inv(16) یا بازآرایی ژن MLL یا شناسایی iAMP21 (با استفاده از پروب Runx1) یا هایپردیپلوئیدی با استفاده از پروبهای سانترومیک
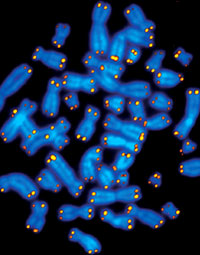
رنگآمیزی فلورسانس سانترومر برای شمارش کروموزومها و محاسبه پلوئیدی
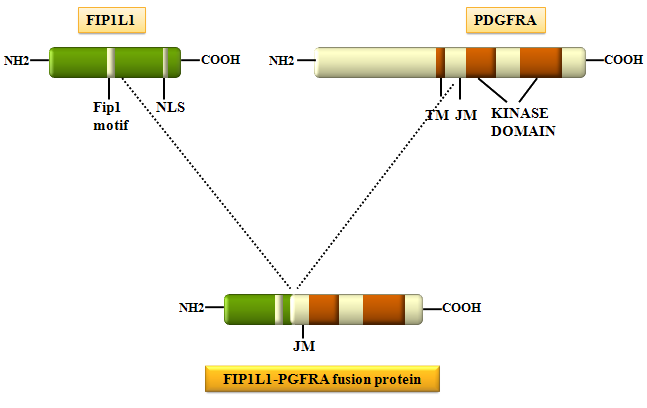
- اسکرین کردن ادغام نهفته (Cryptic) دو ژن FiP1L1-PDGFRA با مشاهده حذف ناحیه بین ژنی CHIC2 در لوسمی مزمن ائوزینوفیلیک
ادغام ژنهایFIPIL1 و PDGFRA ناشی از حذف بینابینی کروموزوم 4 که با ائوزینوفیــــلی تک ردهای همراه میباشد.
- یافتن اطلاعات پیشآگهیدهنده در لوسمی مزمن لنفوسیتیک (CLL) از قبیل تریزومی 12، del(6)، del(11)، del(17) و del(13) که همگی بهجز del(13) با پیشآگهی نامطلوب همراهند.
کاریوتایپ اسپکترال (spectral) یا 24 رنگی FISH یک تفسیر روش FISH است که میتوان هر جفت از کروموزوم را در یک رنگ مخصوص مشاهده کرد و به عنوان روش مکمل در سیتوژنتیک متافاز میتوان بازآراییهای پیچیده بهجز وارونگی را تشخیص داد.
کاربردهای آنالیز ژنتیک مولکولی در تشخیص نئوپلاسمهای خونی
(molecular genetic analysis)
آنالیز ژنتیک مولکولی شامل ساترن بلات (southern blot)، واکنش زنجیرهای پلیمراز (PCR) برای مطالعه ژنوم DNA و RT-PCR (واکنش زنجیرهای پلیمراز با ترانسکریپتاز معکوس) برای مطالعه RNA بعد از نسخهبرداری معکوس است.
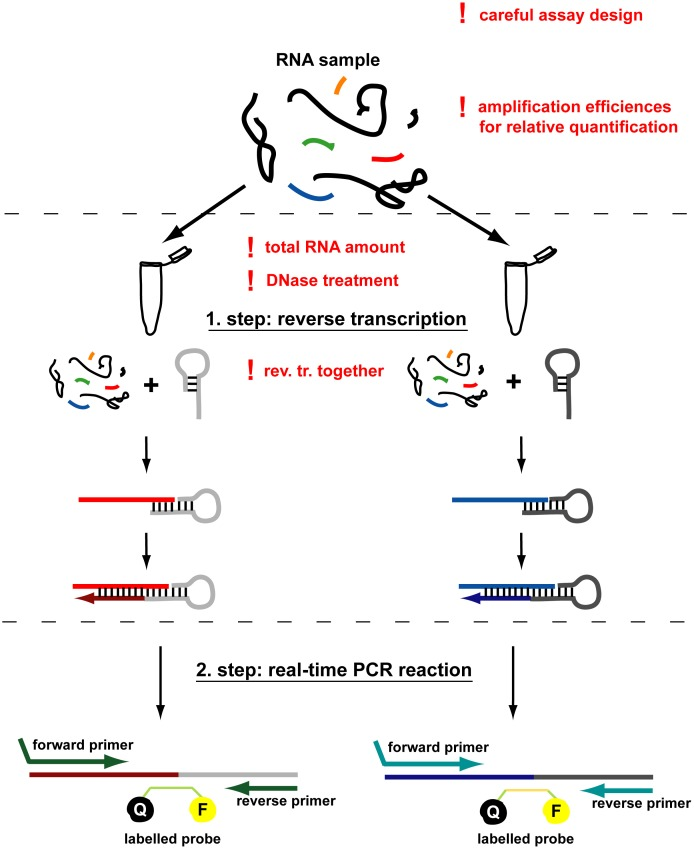
سازوکارهای RT-qPCR
از روش PCR میتوان به شیوه کمی در Real Time qPCR استفاده کرد که نقش مهمی در پیگیری درمان لوسمیها و محاسبه باقیمانده سلولهای لوسمی (MRD) پس از درمان دارد. روشهای PCR و RT-PCR میتوانند جایگزین آنالیز سیتوژنتیک متافاز در زیرگروههایی از لوسمیها و لنفومها شوند؛ اما بههرحال هدف و تارگت روشهای PCR مشخص است که به دنبال چه نوع اختلالی هستیم در حالی که روشهای سیتوژنتیک قادر به تشخیص و پیشآگهی میباشند. از مزایای روشهای PCR استفاده از نمونه کم DNA بوده و نیاز به سلولهای قابل تکثیر ندارد.
آنالیز مولکولی اجازه تشخیص بازآرایی نهفته ETV6-Runx1 در جابهجایی t(12;21) در لوسمی حاد لنفوبلاستیک که از نظر درمان و پیشآگهی بسیار مهم است را میدهد. ژنومیک PCR را میتوان روی نمونههای نگهداری شده انجام داد. از کاربردهای آنالیز ژنومیک PCR و RT-PCR عبارتند از:
1- تشخیص بازآرایی ژنهای زنجیره سبک و سنگین ایمونوگلوبولینها و گیرنده سلولهای T(TCR) که میتواند شاهدی بر کلونالیتی باشد.
2- شناسایی بازآرایی کروموزومی در ارتباط با لوسمی و لنفوم از طریق ادغام ژنی؛ برای مثال تشخیص CCND1-IGHG1 که بیانگر t(11;14) در لنفوم مانتل و یا شناسایی ادغام BCL2-IGH در جابهجایی t(14;18) که نمایانگر لنفوم فولیکولار است. هرچند که بهطور مطلق اختلالات فوق، اختصاصی نیستند؛ برای مثال جابهجایی ژن سیکلین در مالتیپل مایلوما و جابهجایی BCL2 در DLBCL (لنفوم سلولهای بزرگ B) گزارش شده است ولی یک زمینه هیستولوژی میتواند موارد فوق را تأیید کند.
3- شناسایی جهشهای ژنی در ارتباط با لوسمیها؛ برای مثال جهش Kit D816V در ماستوسیتوز سیستمیک و یا شناسایی جهش Jak2V617F یا جهشهای اگزون 12 ژن Jak2 در یک زمینه پرخونی که نشانه پلیسیتمی ورا است. برای تشخیص مایلوفیبروز و ترومبوسیتمی اساسی چنانچه جهش Jak2 منفی باشد، از جهشهای CARL (کالرتیکولین) و MPL (گیرنده ترومبوپویتین) استفاده میشود.
4- پیشآگهیدهنده که از نظر درمان نقش مهمی دارد؛ برای مثال تشخیص ادغام ETV6-Runx1 در جابهجایی نهفته t(12;21) بیانگر پیشآگهی مطلوب در ALL، شناسایی ادغام TCF3/PBX1 در جابهجایی t(1;19) با پیشآگهی خوب و ادغام MLL-MIIT2 در جابهجایی t(4;11) با پیشآگهی نامطلوب و شناسایی BCR/ABL در ALL نیز با پیشآگهی نامطلوب همراه است. در Multiplex PCR با بهکارگیری تعدادی از زوج پرایمرها در یک ویال واکنش میتوان بیش از یک بازآرایی را مورد مطالعه قرار داد.
5- پیدا کردن فاکتورهای پیشآگهیدهنده در AML با کاریوتایپ نرمال: برای مثال جهش Flt3 (ITD) دارای پیشآگهی نامطلوب است. دوبل شدن جزئی تاندم در ژن MLL نیز دارای پیشآگهی بد است در حالی که جهش NPM1 در صورتی که با جهش Flt3 همراهی نداشته باشد، دارای پیشآگهی مطلوب است. جهش CEBPA (فاکتور نسخهبرداری برای بلوغ رده مایلوئیدی)، چنانچه هر دو آلل را گرفتار سازد و با جهــش Flt3 ITD همراه نباشد، دارای پیشآگهی مطلوب است.
6- تجسس فاکتورهای پیشآگهی در لوسمی مزمن لنفوسیتیک (CLL): هایپرموتاسـیون سوماتیک (somatic hypermutation) که تعریف آن عبارت است از توالی IGHV (قسمت متغیر زنجیره سنگین) که کمتر از 98% آن همولوژی با سلولهای زایا دارد. موتاسیون هایپرسوماتیک در 50 تا 60% موارد CLL با پیشآگهی مطلوب مشاهده میشود. جهشهای P53 نیز از نظر پیشآگهی و راهنمایی درمان مهم هستند.
7- شناسایی باقیمانده سلولهای سرطانی (MRD): با استفاده از فیوژن Runx1-Runx1T1 یا جابهجایی 8 و 21 و CBFB-MYH11 در AML با وارونگی کروموزوم 16 یا جابهجایی 16;16 و ادغام PML-RARα در لوسمی پرومایلوسیتیک و همچنین با استفاده از بازآرایی و جهش ژنهای MLL، Flt3، NPM1 و CEBPA میتوان باقیمانده سلولهای سرطانی را پس از درمان محاسبه و شیوه درمان را ارزیابی کرد.
لوسمیهای حاد لنفوبلاستیک در طبقهبندی WHO
فاکتورهای پیشآگهی
لوسمیهای مایلوئیدی با اختلالات کروموزومی فاکتورهای نسخهبرداری مانند فاکتور نسخهبرداری اتصال به هسته مرکزی (CBF یا Core binding factor) از قبیل جابهجایی 8 و 21 با ادغام Runx1-Runx1T1 و وارونگی کروموزوم 16 (inv16) یا جابهجایی 16 و 16 با ادغام CBFβ/MYH11 با سرعت بهبودی بالا، کاهش خطر عود، شیوع بیشــــــتر بهبـــــودی در عود دوم و همـــــــراه با ادامه زندگی بیشتر از 5 سال (5 years survival) از بدو تشخیص تا حد 65 تا 75% میباشند. گفتنی است که Runx1 که نام دیگر آن CBFα میباشد، در پیوند با CBFβ، فاکتور نسخهبرداری مرکزی را برای بلوغ سلولهای میلوئیدی شکل میدهد. شیوع جهش Flt3 و بیان پروتئینهای مقاوم سطحی به داروها در این دسته از بیماران کاهش دارد.
لوسمی حاد پرومایلوسیتیک در گروهی ویژه جای دارد و به رتینوئیک اسید حساس است. در اکثر موارد جابهجایی 15 و17 حساسیت سلولهای سرطانی را به ترکیبات آترا (ATRA) و آرسنیک تریاکسید پیشبینی میکند و موجب تخریب انکوپروتئین PML-RARα میگردند که ناشی از ژنهای ادغام شده میباشد. سلولهای لوسمی با تغییرات ژنتیکی دیگری از قبیل از دست دادن کروموزوم X و حذف 9q در موارد جابهجایی 8 و21 و تریزومی 22 در وارونگی 16 و تریزومی 8 در جابهجایی 15و 17 همراه هستند که این تغییرات روی پیشآگهی مطلوب این گروه اثرات زیادی ندارد.
جهش Flt3-ITD (internal tandem duplication) گرچه در 35% موارد لوسمی پرومایلوسیتیک (APL) مشاهده میگردد ولی روی پیشآگهی با توجه به شمارش WBC اثری ندارد.
حدود 15% بیماران جوان مبتلا به لوسمیهای مایلوئیدی دارای یک سری اختلالات کروموزومی با سرعت بهبودی پایین و ریسک بالای عود هستند که شامل +11q، -5del، -7del، t(3;3)/inv(3)، t(9;22) و کاریوتایپ کمپلکس است. در بیماران فوق، بهبودی کوتاهمدت رخ میدهد و پیوند تنها راه درمان است که باز هم ممکن است با عود همراه باشد.
سلولهای لوسمی در بزرگسالان نسبت به کودکان دارای بیان بالای پروتئینهای مقاوم چند دارویی بوده و از این رو مقاومت بیشتری به شیمیدرمانی دارند. بیماران مبتلا به لوسمی که با اولین دوره شیمیدرمانی وارد مرحله بهبودی میشوند، خطر عود کمتری دارند؛ برای مثال باقی ماندن سلولهای لوسمی در مغز استخوان در روز 14 از درمان، راهنمای درمان بیشتر است. درصد سلولهای بلاست در مغز استخوان بعد از اولین دوره درمان، پیشبینیکننده است، برای مثال چنانچه در این حالت تعداد سلولهای بلاست بیشتر از 15% باشد، گرچه بیمار وارد مرحله بهبودی میشود ولی شانس عود زیاد است. سیتوژنتیک سلول سرطانی و سن در پاسخ به درمان نقش مهمی دارند.
جهش Flt3-ITD یک فاکتور پیشبینیکننده مهم نهتنها برای بهبودی بلکه برای پیشبینی عود لوسمی است. جهش نوکلئوفسمین-1 (NPM1) گرچه دارای پیشآگهی مطلوب است ولی همراه شدن با جهش Flt3 اثرات مطلوب آن را خنثی میکند.
حدود 10% بیماران بهویژه آن دسته که دارای کاریوتایپ نرمال هستند، دارای جهش در فاکتور نسخهبرداری CEBPA (CCAAT/enhancer binding protein) میباشند. چنانچه جهش هر دو آلل را شامل شود و بدون همراهی با جهش Flt3 باشد، دارای پیشآگهی مطلوب است. جهش C-kit در 20 تا 30% موارد لوسمیهای CBF (core binding factor) مشاهده شده که با پیشآگهی نامطلوبی همراه است و اثرات منفی بر مطلوب بودن جهشهای CBF میگذارد. گفتنی است که بازدارندههای C-kit و Flt3 ممکن است در درمان این لوسمیها نقش داشته باشند.
جهش ژن تومور ویلمز (WT1) که مانند جهش Flt3 یک پدیده ثانویه در آسیبزایی لوسمیها است، در اکثر موارد گویای خطر بالای درمان ناموفق است.
شمارش گلبولهای سفید در بدو تشخیص نیز از فاکتورهای پیشبینیکننده بهبودی است اما به اهمیت سیتوژنتیک نمیباشد. معمولاً شمارش بیشتر از 50000 در میلیمتر مکعب دارای پیشآگهی نامطلوب در بیشتر زیرگروههای لوسمی است و در لوسمی پرومایلوسیتیک شمارش بیشتر از 10000 با خطر عود همراه است.
بیان پروتئینهای مقاوم چند دارویی بهویژه گلیکوپروتئین P محصول ژن MDR1 روی کروموزوم 7 در سطح سلولهای لوسمی افراد بزرگسال با مقاومت به شیمیدرمانی همراه است. از پروتئینهای مقاوم چند دارویی دیگر میتوان به پروتئین LRP (Lung resistance protein) که ژن آن روی کروموزوم 6 قرار دارد اشاره کرد.
شناسایی باقیمانده سلولهای لوسمی (MRD، minimal residual disease)
حساسیت روشهای شناسایی باقیمانده سلولهای سرطانی (MRD)، بالاتر از آستانه تشخیصی آن با میکروسکوپ نوری است. ارتباط چشمگیری بین MRD با روشهای RT-qPCR و فلوسیتومتری چند پارامتری (MFC-MRD) و نتیجه درمان دارد و پیوند یا عدم پیوند، پیگیری پس از درمان برای پیشبینی عود، پیگیری قبل و بعد از پیوند برای خطر عود و شناسایی مارکرها برای ردیابی خط درمان از نتایج MRD میباشند.
آنالیز مولکولی و فلوسیتومتری از روشهای عمومی برای تعیین MRD میباشند. حدود 60% لوسمیهای بچهها و بزرگسالان دارای مارکر اختصاصی لوسمی از قبیـــــل ادغام ژنی و یا جهشهای خاص است که با RT-qPCR (Real Time quantitative PCR) میتوان MRD را محاسبه کرد.
با توجه به اینکه تشخیص MRD در ادغامهای ژنی وابسته به RNA بوده که زود تجزیه میشود، بایستی هماهنگی بهعمل آید که نمونه تشخیصی در 24 ساعت ارسال گردد. حساسیت آزمایش بستگی به هدف جستوجو در MRD (target MRD) و مقایسه آن در سلولهای بلاست دارد که در رابطه با نوع AML و بین بیماران متفاوت است. سنجش RT-qPCR قادر به شناسایی یک سلول لوسمی AML در میان 104 تا 105 سلول نرمال مغز استخوان است. حساسیت آنالیز خون محیطی برای MRD حدود 1-Log ضعیفتر است.
محاسبه MRD بهطور گسترده در لوسمی پرومایلوسیتیک با مارکر PML-RARα اهمیت دارد چون دستیابی به بهبودی مولکولی مغز استخوان پس از درمان برای بهبودی الزامی است. بیشتر عودها را میتوان از دوباره پیدا شدن نسخهبرداری PML-RARα (نسخهبرداری دو ژن در هم ادغام شده در t(15;17)) تشخیص داد.
محصول نسخهبرداری ادغام ژنهای Runx1-Runx1T1، CBFβ/MYH11، DEK-NUP14 و جهش NPM1 همگی از تارگتهای مهم برای یافتن MRD در زیرگروههای مختلف لوسمی است.
محاسبه کمی MRD با آنالیز فلوسیتومتری، وابسته به تشخیص اولیه بیان ناهنجار مارکر لوسمی (LAIP) در بدو تشخیص است که این مارکر در سطح سلولهای نرمال وجود ندارد یا بیان بسیار اندکی دارد.
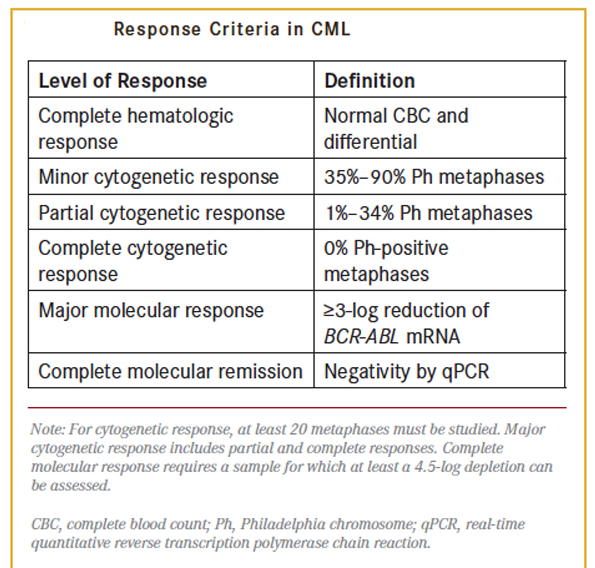
معیارهای سطح پاسخ بیمار مبتلا به لوسمی مزمن مایلوسیتیک به درمان
تشخیص آزمایشگاهی نئوپلاسمهای بافت خونساز 2017 (2)
بازنگری لوسمیهای خانواده مایلوئیدی (3)
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام