-
الایزا
- قسمت اول
روشهای کنترل کیفی و مدیریت خطا
سید آرمان مهدوی1
دانشجوی کارشناسی ارشد بیوتکنولوژی پزشکی، مرکز تحقیقات بیولوژی مولکولی، دانشگاه علوم پزشکی بقیهالله، تهران، ایران (نویسنده مسئول) (livesnuff@gmail.com)
چکیده:
الایزا (Enzyme Linked Immunosorbent Assay) بهعنوان یکی از مهمترین روشهای Immunoassay با کاربردهای فراوان در آزمایشگاه تشخیص طبی و تحقیقاتی نیازمند بازخوانی انواع روشهای کنترل کیفی و همچنین بررسی جوانب عمومی و اختصاصی تولید خطاهای احتمالی با آن است تا از صحت و دقت دادههای بهدستآمده اطمینان حاصل گردد. در این مقاله خلاصهای از جدیدترین یافتهها و دستاوردها در مورد الایزا شامل روشهای کنترل کیفی و همچنین ردیابی خطاهای احتمالی مورد بررسی قرار گرفته است.
کلمات کلیدی: الایزا، کنترل کیفی، منابع خطا، کنترل دقت، کنترل صحت
مقدمه و تاریخچه:
در مواردي كه واكنش آنتیژن– آنتیبادی قابلرؤیت نباشد بايد به نحوي اين واکنشها آشكار شود. اين امر منجر به پديد آمدن نسل جديدي از روشها به نام Labeled Immunoassay شد. در اين واکنشها، آنتیبادی يا آنتیژن توسط موادي نشاندار میشد. قبل از توسعه الایزا، تنها راه برای انجام آزمایش بررسی واکنش آنتیژن و آنتیبادی روش radioimmunoassay بود. در این روش با استفاده از آنتیژن یا آنتیبادی نشاندارشده با رادیواکتیو که سیگنال را فراهم میکند، نشان میدهند که آیا کمپلکس یک آنتیژن یا آنتیبادی خاص در نمونه وجود دارد یا خیر.
این روش ابتدا در مقاله علمی Rosalyn Sussman Yalow و Berson در سال 1960 منتشر شد، اما وجود خطرهای فراوان کار با مواد رادیواکتیو محققان را بر آن داشت تا روشی جایگزین جهت ردیابی واکنش آنتیژن- آنتیبادی را دنبال کنند. به همین منظور طی پژوهشهای متعدد، تکنیک جایگزین برای انجام این کار توسط Wide و Jerker Porath در سال 1966 معرفی شد و در سال 1971، Peter Perlmann and Eva Engvall در دانشگاه استکهلم در سـوئد و Anton Schuurs and Bauke van Weemen در هلند بهطور مستقل مقالههایی را منتشر کردند که این دانش را به روشهای انجام EIA /ELISA تبدیل کرده است (1).
در این مقاله با توجه به حجم دادهها و اطلاعات موجود، همچنین عدم وجود پژوهشهای کاربردی در زمینه کنترل کیفی، تکنیک الایزا به جمعآوری زمینههای اصلی و کاربردیترین روشهای کنترل کیفی و اندازهگیری صحت و دقت آن پرداخته شده است و از متنها و گزارشهای منتشرشده سنجههای اداره امور آزمایشگاهها همچنین دستورالعملهای آزمایشگاه رفرانس در مقایسه و تطبیق با متدهای مورد استفاده جهانی استفاده شده است تا تمامی جوانب کنترل کیفی در آزمایشگاه تشخیص طبی و تحقیقاتی بهطور جامع بررسی انجام شده باشد. در همین راستا ابتدا با استفاده از پایگاههای اطلاعاتی نظیر PubMed و مقالات منتشرشده در آن، اصول اولیه و مفاهیم کاربردی شرح داده شده، سپس با مطالعه مقالات منتشرشده و دستهبندی روشها و دستورالعملهای انجامشده با مقایسه دستورالعملهای منتشرشده توسط آزمایشگاه رفرانس به جمعبندی رسیده و از آنها در این مقاله استفاده شده است.
تعریف:
الایزا نام عمومي براي اینگونه روشها است كه بهصورت رايج استفاده میشود و به عبارتي ارزیابیهای سنجش ايمني آنزيمي كه در آنها آنتیبادی يا آنتیژن بر روي يك فاز جامد Coat میشود به نام الايزا شناخته شده است.
در این روش با ایجاد کمپلکس آنتیژن-آنتیبادی در سطح میکروپلیت با استــــــــفاده از آنزیم نشاندارشـــده و TMB (Tetramethylbenzidine) كه همان سوبسترا بوده، ایجاد سیگنال کرده و با رسم نمودار استاندارد بر اساس غلظت و جذب نوری محاسبهشده مقدار آنالیت موردنظر را محاسبه میکنند. در این روش بجای رادیو ایزوتوپ برای نشاندار کردن، از یک آنزیم استفاده میشود. چنانچه آنتیژن نشاندار شود EIA (Enzyme Immunoassay) و اگر آنتیبادی نشاندار شود IEMA (Immunoenzymometric Assay) نامیده میشود.
بهطور کلی در ساختار توضیحدهنده، انجام واکنش توسط یکی از شرکتهای سازنده کیت الایزا و تیم کنترل کیفی منتشرکننده مقاله به مقایسه این دو روش کاربردی و ارزیابی هرکدام پرداخته شده است (2).
مزایای روش IEMA نسبت به EIA
1- سهولت نشاندارسازی:
با توجه به اینکه در روشEIA ، مولکولهای آنتیژن اغلب از جنس هاپتن بوده که مولکولهایی با جرم مولکولی کمتر از هزار دالتون میباشند، لذا محدودیت گروههای عاملی در مولکولهای موردنظر، نشاندارسازی را محدود ساخته و اغلب نیاز به واکنشهای تخصصی و پیچیده دارد، اما در روش IEMA چون نشاندارسازی بر روی مولکول بزرگ آنتیبادی صورت میگیرد که دارای انواع گروههای عملکردی است، لذا نشاندارسازی آن بهراحتی با روشهای ساده و عمومی امکانپذیر است (3).
2- افزایش ویژگی:
در روش EIA با توجه به اینکه از یک آنتیبادی برای شناسایی منفرد استفاده شده، درحالیکه در روش IEMA استفاده از دو آنتیبادی امکان شناسایی مضاعف را میسر میسازد، ازاینرو ویژگی IEMA نسبت به EIA بیشتر است.
3- افزایش حساسیت:
با توجه به اینکه در روش IEMA به ازای تکتک آنالیتها، کمپلکس نشاندار وجود داشته و همچنین جایگاههای نشاندارسازی بالقوه آن بیشتر است، لذا هم بدلیل رابطه یکبهیک بین آنالیت و کمپلکس نشاندار و هم بیشتر بودن جایگاههای بالقوه نشاندارسازی، حساسیت روش IEMA نسبت به EIA بیشتر است.
4- کاهش زمان انکوباسیون:
با نظر به اینکه واکنش آنتیژن و آنتیبادی یک واکنش تعادلی دوطرفه بوده که طبق اصل لوشاتلیه با افزودن هر یک از مواد در یکی از طرفین معادله، تعادل به سمت طرف دیگر پیشرفت مینماید، ازاینرو بدلیل اینکه در روش IEMA غالباً رقابت وجود نداشته و برای حصول اطمینان از کفایت آنتیبادیها بهمنظور تشکیل کمپلکس در غلظت بالای آنالیت، همواره مقادیر زیادی از آنتیبادی بکار میرود؛ در نتیجه غلظت بالای مواد اولیه، سرعت به تعادل رسیدن یا زمان انکوباسیون را کاهش میدهد.
5- افزایش محدوده عملکرد:
محدوده عملکرد که محدوده قابل اندازهگیری برای آنالیت بوده و فاصله بین اولین و آخرین نقطه استاندارد را شامل میشود، در روش IEMA حدود صد برابر بیشتر از EIA است (4)، بنابراین ارجحیت تکنیک IEMA در تولید کیتهای نسل جدید الایزا مورد توجه قرار گرفته، اما همچنان در بعضی از تستها از روش EIA در جهت ارزیابی فرآیند و کنترل کیفی آنها استفاده میشود. امروزه در آزمایشگاههای تحقیقاتی و تشخیص طبی اساس کار و طراحی کیتهای آزمایشگاهی بر اساس 3 رویکرد کلی و دستهبندی آنها انجام میشود:
طبقهبندی الایزا:
- Indirect Elisa (الایزای غیرمستقیم)
- Sandwich Elisa (الایزای مستقیم یا ساندویچی)
- Competetive Elisa (الایزای رقابتی)
الایزای ساندویچ:
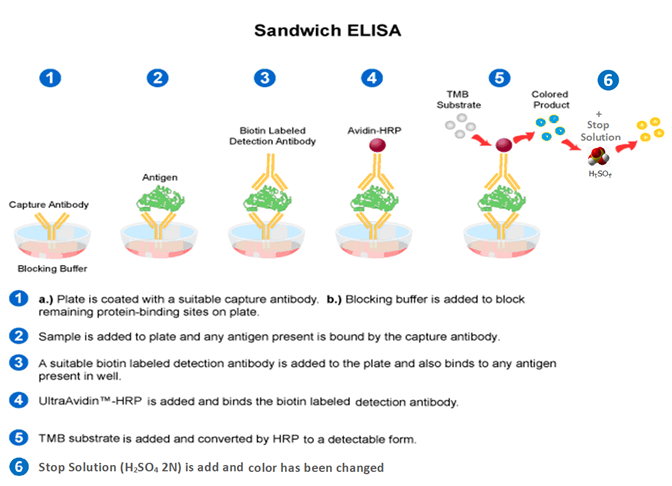
در این روش آنتیبادی اختصاصی در کف میکروپلیتها کوت میشود. در ادامه، نمونه مورد بررسی كه حاوي آنتيژن با غلظت نامعلوم است و يك سري محلولهاي استاندارد كه غلظت آنتيژن آنها معلوم است به حفرات جداگانه اضافه ميشوند تا به آنتيبادي متصل گردند. پس از انکوباسیون به مدت زمان کافی، در صورت حضور آنتیژن در نمونه، آنتیبادی میچسبد. آنتیژنهای متصلنشده پس از شستشو حذف ميشوند و آنتيبادي دوم که اغلب پلیکلونال است، با آنزيم نشاندارشده به حفرات اضافه میشود. آنتيژن مثل يك پل عمل ميكند و لذا هرچه آنتيژن بيشتري در محلول آزمون يا استاندارد وجود داشته باشد، آنتيبادي دوم بيشتری متصل ميشود.
پس از گذشت زمان انکوباسیون معینشده برای این مرحله و شستشو و حذف آنتیبادیهای دوم نچسبیده، [1]HRP در بافر مناسب و غلظت تعیینشده اضافه میگردد و زمانی برای اتصال آن به آنتیبادی دوم داده میشود. برای افزایش قدرت اتصال آنزیم به آنتیبادی دوم از قدرت تقویتکنندگی بيوتين-آويدين، بيوتين-استرپتواويدين و یا لكتين-ليگاند و … استفاده میشود. البته در برخی از کیتها آنتیبادی دوم از قبل با آنزيم نشاندار شده (Conjugation) است که در این حالت بهدلیل اینکه آنزیم از قبل به آنتیبادی دوم چسبیده است زمان انکوباسیون برای آنتیبادی دوم و آنزیم یکی میشود (شکل 1-1).
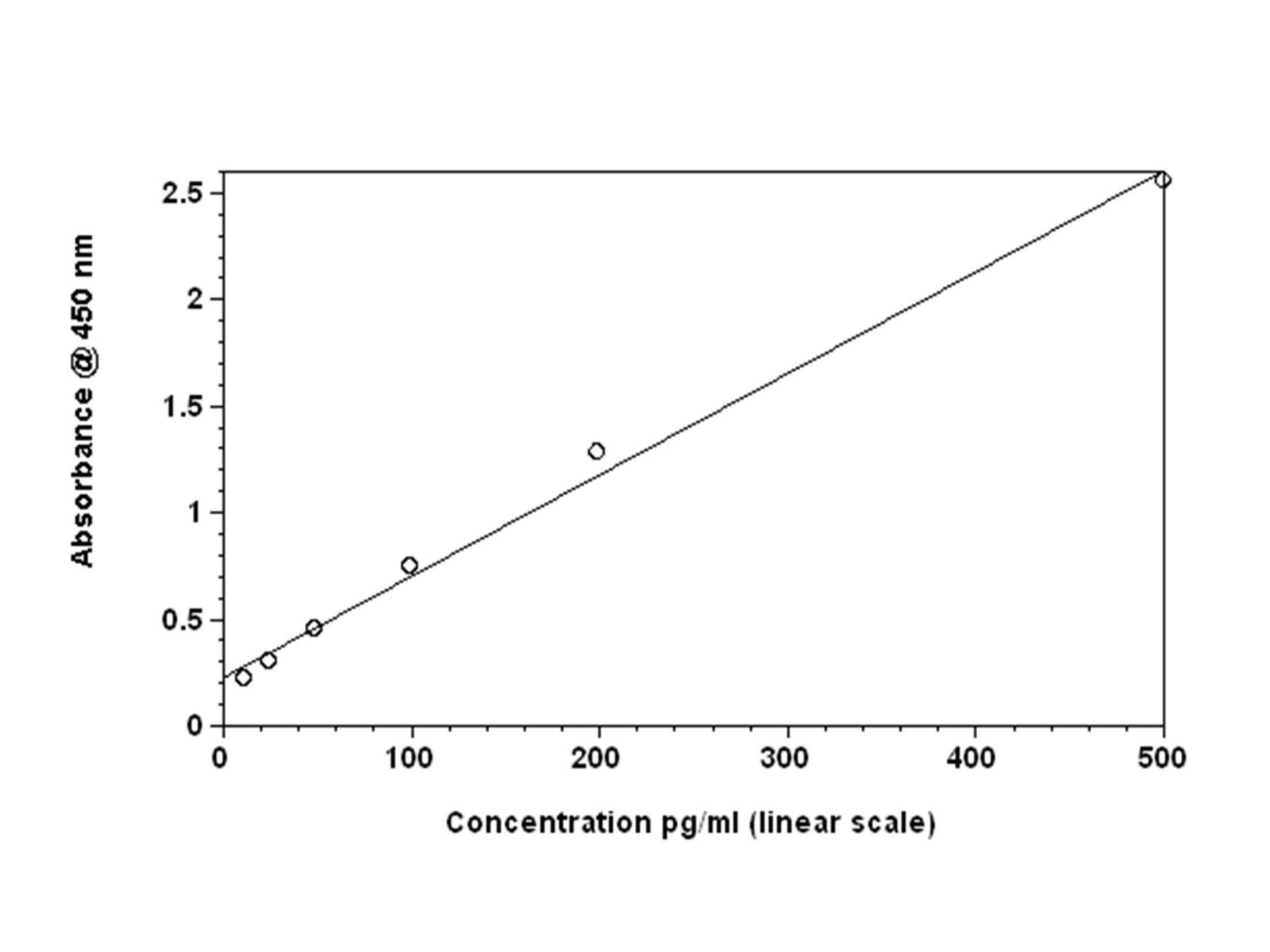
پس از شستشوی نهایی که مهمترین شستشوی یک الایزا است چرا که در صورت باقی ماندن کمترین مقدار آنزیم نچسبیده میتواند موجب ایجاد رنگ اضافی در مرحله بعدی گردد، در مرحلهی بعدی برای اینکه سوبسترا بر اثر آنزیم محصول رنگی تولید نماید باید با یک رنگزا (کروموژن) همراه باشد. با اضافه کردن سوبسترا و دادن زمان مناسب جهت انجام واکنش، رنگزایی انجام میشود، سپس با اضافه نمودن محلول متوقفکنندهStop Solution (Sulfuric Acid) و تولید رنگ زرد، میزان تشکیل رنگ نشانگر میزان آنتیژن در نمونه آزمون است. در نهايت رنگ تولیدشده توسط دستگاه خوانده میشود. از جذب نوری محلول رنگی ایجادشده در چاهکهای مربوط به محلولهاي استاندارد استفاده ميشود تا منحني میزان جذب نوری به غلظت آنتيژن در استانداردها رسم شود و نهایتاً با رسم نمودار میتوان با بردن جذب نوری محلول رنگی ایجادشده در چاهکهای مربوط به نمونهها، مقدار آنتيژن را بهصورت دقیق محاسبه نمود (شکل 2-1).
شکل (1-1): نمای کلی واکنش آنتیژن و آنتیبادی در الایزای ساندویچ
https://www.creative-diagnostics.com/ELISA-guide.htm
شکل (2-1): نمودار نتایج حاصله از الایزای مستقیم برحسب غلظت/ جذب نوری
https://www.echelon-inc.com/index.php?module=Products&func=detail&id=768
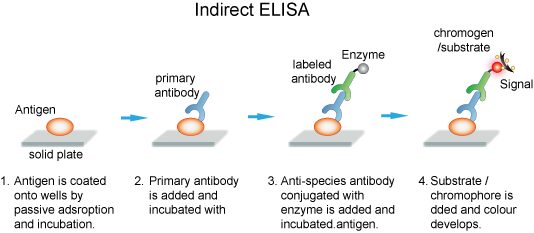
الايزاي غیرمستقیم
براي تعيين آنتیبادی اختصاصي و يا تيتراسيون آنتیبادی در نمونههاي سرمي استفاده میشود. در این واکنش آنتیژن اختصاصی به جدار چاهکها (از جنس پلياستيرن) متصل شده (كوت میشود) و سپس نمونه حاوي آنتیبادی به چاهکها اضافه میشود. پس از افزودن نمونه و طي زمان انكوباسيون، شستشو انجام شده و سپس آنتيهيومن گلوبولين نشاندارشده با آنزیم به چاهك اضافه میشود (شکل 3-1).
اختصاصيت روش بستگي به آنتیژن كوتشده در چاهکها دارد. براي جلوگيري از جذب غیراختصاصی پروتئینهای موجود در سرم و جلوگيري از اشغال نقاط اتصال آنتیژن، نمونه بهوسیله بافر رقیقکننده رقيق میشود.
شکل (3-1): الایزای غیرمستقیم با اتصال آنتیبادی اختصاصی موجود در نمونه به آنتیژن کوتشده
https://www.creative-diagnostics.com/ELISA-guide.htm
الایزای رقابتی یا مهاری:
در روشهای رقابتی، اساس سنجش بر رقابت دو آنتیژن یا دو آنتیبادی (که یکی از آن دو نشاندار است) برای اتصال به لیگاند با مقدار محدود استوار است. اگر هر دو آنالیت نشاندار و غیرنشاندار با هم به سیستم اضافه شوند، روش را رقابتی مینامند، ولی چنانچه ابتدا آنالیت اضافه شده و پس از یک دوره انکوباسیون آنالیت نشاندار اضافه گردد روش را مهاری یا بالکینگ مینامند. در روش مهاری ممکن است در بین 2 مرحله و قبل از اضافه نمودن آنالیت بعدی شستشو انجام شود یا انجام نشود. مثال بارز روشهای رقابتی و مهارتی سنجش T3،T4 است. انواع روشهای رقابتی عبارتند از:
الف) روش رقابتی یا مهاری برای آنتیژن:
اساس این روش بر رقابت بین آنتیژن نشاندار و آنتیژن موجود در نمونه برای اتصال به یک آنتیبادی اختصاصی کوتشده در چاهک استوار است. در این روش مقدار آنتیبادی کوتشده باید محدود باشد و ملکول سیگنالدهنده همان آنتیژن نشاندار است، اساس RIA و EIA کلاسیک بر همین روش استوار است (5).
در این روش منحنی پاسخ دوز بهصورت معکوس خواهد بود؛ بدین معنی که آنالیت نشاندار در حضور مقادیر زیادی از آنالیت غیرنشاندار موجود در نمونه به مقدار کمتری به آنتیبادی متصل میشود و در نتیجه سیگنال هم بوجود میآید.
محدوده تعیین آنالیت با این روش ممکن است بهوسیله استفاده از مولکول نشاندار با فعالیت اختصاصی زیاد تقویت شود، اما حداقل مقدار قابل تشخیص (کمترین مقدار از آنالیت که قابل تشخیص خواهد بود) توسط تمایل آنتیبادی مورد استفاده تعیین میشود، با این وجود غلظتهای خیلی کم از هاپتنها عموماً توسط همین روش قابل تعیین هستند.
در برخی از موارد، نشاندار کردن روی خصوصیات هاپتن اثر میگذارد، در نتیجه در روش رقابتی برای تعیین آنتیژن از یک آنتیبادی نشاندار استفاده میشود، در این نوع از سنجشها ضروری است که فاز جامد توسط آنتیژن با مقدار کم و ثابت پوشیده شود، در این روش آنالیت موجود در نمونه با آنالیت کوتشده در چاهک برای اتصال به آنتیبادی نشاندار رقابت میکند. در اینجا هم منحنی استاندار معکوس است، از این روش بیشتر برای سنجش به روش کمیلومینسانس استفاده میشود (6).
ب) روش رقابتی برای آنتیبادی:
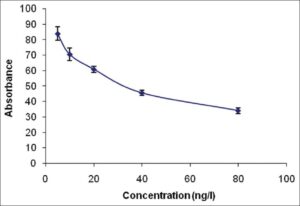
در این روش بین دو آنتیبادی یکی در نمونه بهصورت غیرنشاندار و یکی بهصورت نشاندارشده با آنزیم برای اتصال به یک آنتیژن فیکسشده در چاهک رقابت صورت میپذیرد، بدیهی است هر چه مقدار آنتیبادی نمونه بیشتر باشد، آنتیبادی نشاندار کمتری به چاهکها متصل شده و سیگنال نیز کمتر خواهد بود و در نتیجه منحنی استاندارد نیز معکوس است شکل (4-1).
شکل (4-1): نمودار حاصل از نتایج الایزای رقابتی با رابطه معکوس جذب نوری/ غلظت
https://www.semanticscholar.org/paper/A-simple-Competetive-ELISA-using
کنترل کیفی الایزا:
کنترل کیفیت در آزمایشگاه به کلیه روشها و دستورالعملهایی گفته میشود تا نتیجه فرآیند هم از نظر دقت و هم از لحاظ صحت مورد تأیید قرار بگیرد، به همین منظور در رابطه با تست الایزا مباحث کنترل کیفی در موارد زیر دنبال میشود:
1- برای شناسایی تمامی دادههای غیر قابل قبول
2- برای ردیابی روند نتایج (دور شدن از نمودار کنترل)
3- برای تحقق بخشیدن به الزامات لازم برای شناخت خارجی که آزمونها در سطح قابل قبول انجام میشود (زمانی که نتایج برای اهداف تجاری بینالمللی مورد استفاده قرار میگیرند، مهمتر است (2).
تعيين شاخصهای عملکردی کیتهای الایزا
حساسیت تشخیصی (Diagnostic sensitivity)
شامل تعداد افراد بیماری است که دارای آزمایش مثبت هستند و ارزش اصلی آن شناساندن افراد بیماری است که نتیجه آزمایش منفی دارند (گروه منفی کاذب).
ویژگی تشخیصی (Diagnostic specificity)
ویژگی تشخیصی شامل تعداد افراد غیربیمار است که آزمایش منفی دارند و ارزش اصلی آن تعیین افراد غیربیماری است که نتیجه آزمایش مثبت دارند (گروه مثبت کاذب).
روش اندازهگیری ویژگی تشخيصی و حساسيت تشخيصی در کیتهای الایزا
1- اندازهگیری بر روی تعداد زیادی نمونه سرم کنترل مثبت و منفی (یا سرم رفرانس)
2- جداسازی افراد بیمار از غیربیمار با روشهای استاندارد و مرجع
3- مقایسه دو روش اندازهگیری معمول و روش مرجع و محاسبه آماری شاخصها (4)
شاخصهای اجرایی در کیتهای الایزا
نخستین گام در ارزیابی کیتهای الایزا تعیین شاخصهای اجرایی برای آن است.
این شاخصها از نظر تعریف شامل کلیه آزمایشهایی هستند که دقیق و صحیح بودن عملکرد یک کیت را نشان میدهند. بسته به کمی یا کیفی بودن کیتهای الایزا این شاخصها متفاوت هستند. در کیتهای کمی در مرحله نخست پس از اطمینان از درست بودن منحنی استاندارد کیت و منطبق بودن آن با منحنی معرفیشده از سوی سازنده اقدام به بررسی شاخصهای اجرایی مینمایند (7).
این شاخصها به ترتیب عبارتند از:
1- دقت یا بررسی تکرارپذیری کیت (precision)
2- صحت یا بررسی صحیح بودن (Accuracy)
3- حساسیت
دقت (precision) الایزا
نخستین معیار مهم در شاخصهای اجرایی مسئله دقت در کیتهای آزمایشگاهی است. دقت به معنی تکرارپذیری یک آزمایش است. برای محاسبه آن در اولین مرحله نیاز به تهیه یک نمونه ثابت داریم. این نمونه میتواند پولد سرم (مخلوط سرمی)، سرم کنترل تجاری، سرم کنترل کیت یا هر نمونهای باشد که مقدار پایدار و ثابتی دارد. دومین نکتهای که بهتر است به آن توجه شود این است که بهجای یک نمونه، سه نمونه را بهصورت جداگانه مورد آزمایش قرار دهیم. این سه نمونه در اصل حاوی مقادیر بالا، متوسط و پایین آنالیت موردنظر ما خواهند بود و این اطمینان را به ما میدهند که در این سه طیف، کیت دارای نتایج تکرارپذیری است. پس از تهیه نمونه، دومین اقدام تعریف سطح تکرارپذیری یا در اصل طبقهبندی دقت است؛ از همین رو دقت را میتوان به انواع مختلفی طبقهبندی کرد:(4)
درون سنجی (intra-assay)
در این نمونه دقت، میبایست با یک نمونه، وضعیت تکرارپذیری را در طی یک آزمایش کاری و درون یک پلیت مورد ارزیابی قرار داد. این نوع دقت توانایی یک روش را برای تعیین مقدار یک نمونه در یک آزمایش ارزیابی مینماید.
برای انجام این کار چندین استریپ از یک پلیت را با یک نمونه مورد آزمایش قرار میدهیم (حداقل20 بار ) و نتایج حاصله را ثبت میکنیم. جهت محاسبه میبایست دقت نمود تا از غلظت بدستآمده و نه OD ، جهت محاسبات استفاده نماییم، از همین رو نخست میانگین کلیه غلظتها X را محاسبه نموده و انحراف استاندارد (SD) آنها را بدست میآوریم. با تقسیم انحراف استاندارد بر میانگین و ضرب آن در عدد100، ضریب تغییرات (CV%) بدست میآید که نشاندهنده میزان پراکندگی نتایج بدست آمده است.
CV% = SD/ X × 100
با ترسیم ضریب تغییرات در غلظتهای مختلف میتوان منحنیی بدست آورد که آن را گزارش دقت PRECISION PROFILE مینامند و میتوان از آن برای تعیین طیف کاری که بیشترین میزان تکرارپذیری را دارا باشد، استفاده نمود (دستورالعمل آزمایشگاه رفرانس).
ميان سنجی (Inter-assay)
اهمیت این نوع دقت در این نکته است که توانایی یک روش را در تعیین مقدار یک نمونه در طی آزمایشا ت متعدد میسنجد.
برای تعیین این نوع دقت دو راه وجود دارد:
روش نخست در طی دو آزمایش مختلف در طی یک روز و با فاصله 2 ساعت از یکدیگر انجام میگیرد. برای تعیین این نوع دقت که مشهور بهدقت مابین آزمایشی between -Run Precision است، میبایست در هر بار انجام آزمایش هر نمونه را چهار بار مورد آزمایش قرار داد و محاسبات نیز همانند قبل انجام میگیرد.
در روش دوم مابین روزهای مختلف نتیجه آزمایش را بررسی میکنیم Between -day precision . در این روش نیز نمونه مورد آزمایش در هر بار انجام آزمایش میبایست چهار بار تست شود (7).
صحت (Accuracy) الایزا
صحت در اصل بیانگر مقدار واقعی یک آزمایش است و میزان نزدیک بودن میانگین آنالیتهای اندازهگیریشده را با مقدار واقعی آن مورد بررسی قرار میدهد. به اختلاف حاصل از این دو، عدم صحت یا سوگرایی یا Bias میگویند.
بررسی تداخلات (interference) الایزا
یکی از موارد مهم مؤثر بر روی صحت یک کیت، مسئله تداخلات است. تداخلات میتوانند هم باعث سوگرایی مثبت و یا نتایج مثبت کاذب و هم سوگرایی منفی و یا نتایج منفی کاذب در آزمایشها گردند. از عوامل مختلفی که باعث بروز تداخل میگردند میتوان به تأثیر هتروفیل آنتیبادی، فاکتور روماتوئیدی و اثر هوک اشاره کرد. آنتیبادیهای هتروفیل گروهی از آنتیبادیها هستند که در پی تماس مستقیم و یا غیرمستقیم با حیوانات در انسان ایجاد میشوند. این آنتیبادیها با چسبیدن به قسمتهای FC ملکولهای آنتیبادی میتوانند باعث سوگرایی مثبت و منفی در آزمایشها شوند. فاکتور روماتوئیدی از عوامل دیگر تداخلکننده محسوب میشود. جنس این فاکتور از جنس IgM بوده و علیه قسمت FC مولکولهای IgG است. این فاکتور را میتوان در بسیاری از بیماران مبتلا به بیماریهای خود ایمنی مشاهده نمود .(8)
گاهی در آزمایشهای یک مرحلهای با فرمت ساندویچی که در نمونه مقدار بسیار زیادی آنالیت وجود داشته باشد میتوان جوابهای منفی مشاهده نمود که به این پدیده اثر هوک اطلاق میگردد. اثر هوک (hook effect)
عبارت از کسب نتایج منفی کاذب در غلظت بالای آنالیت است، در واکنشهای ایمونولوژی اتفاق افتاده و معادل پدیده پروزون در واکنشهای سرولوژی است. در این پدیده غلظت آنالیت که میتواند آنتیژن یا آنتیبادی باشد، از بالاترین استاندارد نیز بسیار بالاتر بوده و لذا علیرغم زیاد بودن آنتیژن یا آنتیبادی مورد آزمایش در سرم، نتیجه منفی کاذب حاصل میگردد.
بهدلیل نتایج منحرفکننده و نامطلوبی که اثر هوک میتواند بر آزمونهای ایمنی سنجی باقی گذارد، تحقیقات زیادی در زمینه شناخت این پدیده و چگونگی خنثیسازی آن انجام شده است که یکی از آنها با توجه به اینکه پدیده هوک در روش EIA بدلیل تکمرحلهای و مستقیم بودن روش آزمایش، شایعتر از روش IEMA است؛ عدم استفاده از اینچنین کیتهایی است. در شرایطی که ناچار به استفاده از چنین کیتهایی باشیم، برای اطمینان از صحت نتیجه، اول از کیتهایی استفاده شود که محدوده شروع پدیده هوک در آن قید شده باشد و ثانیاً بایستی هر جواب منفی را با رقتهای بالاتری از همان سرم تکرار نمود.
البته باید توجه داشت که اگرچه پدیده هوک غالباً در اثر فزونی آنالیت اتفاق میافتد، ولی تحقیقات انجامشده توسط محققان ثابت نموده که منحصراً بالا بودن میزان آنالیت تنها عاملی نیست که در بروز این پدیده دخالت داشته و لذا عوامل دیگری نیز نظیر توزیع و پراکندگی اپیتوپها، وجود اپیتوپهای مشابه و یا استفاده از دو آنتیبادی مونوکلونال که بر ضد دو اپیتوپ مختلف تهیه شدهاند، میتواند در بروز پدیده هوک مؤثر باشد که نمونه آن نیز ایجاد پدیده هوک در روشهای IEMA علیرغم دومرحلهای بودن آنها است که علت آن در نتیجه استفاده از دو آنتیبادی مونوکلونال بر ضد دو اپیتوپ مختلف است .(9)
مکانیسم این اثر به این شکل است که در آزمایشهای ساندویچی یک مرحلهای، با افزودن نمونه و آنتیبادی نشاندارشده بهصورت همزمان بدلیل وجود مقدار بسیار زیاد آنالیت، هردو آنتیبادی (آنتیبادی نشاندار در محلول و آنتیبادی موجود در کف چاهکها) توسط مولکولهای آنالیت اشغال میگردند و امکان ایجاد پل رابط مابین آنتیبادی موجود در کف چاهک و آنتیبادی نشاندار در محلول از بین میرود. حاصل این مسئله مشاهده نتایج منفی کاذب در آزمایشها است و بهترین مثال عملی آن را نیز میتوان در خانمهای باردار دارای مقدار زیاد هورمون HCG دید.(10)
در این گروه از افراد چنانچه آزمایشها بهصورت یک مرحلهای یعنی افزودن همزمان نمونه بیمار با کنژوگه صورت گیرد، احتمال مشاهده نتایج منفی کاذب وجود دارد. برای رفع این مشکل نیز میتوان با رقیق کردن نمونه مورد آزمایش و یا با دو مرحلهای کردن آزمایشها تأثیر اثر هوک را از بین برد.
حساسيت (SENSITIVY) الایزا
حساسیت بنا به تعریف به کمترین مقدار آنالیت که از صفر قابل تفکیک باشد اطلاق میگردد. حساسیت به دو گروه آنالیتی و عملکردی تقسیمبندی میشود.
حساسيت آناليتی ( Analytical sensitivity)
در این نوع حساسیت که اکثر سازندگان کیتها از آن استفاده میکنند 20 بار استاندارد صفر را مورد آزمایش قرار میدهند و 2 انحراف استاندارد بالاتر (در تستهای ایمونومتریک) و یا پایینتر (در تستهای رقابتی) را محاسبه مینمایند .جهت مشاهده این نتیجه میبایست حتماً به بروشور کیت مراجعه نمایید و چنانچه حساسیت یک کیت بهطور مثال 0.2 IU/ml ذکر گردیده بود، گزارشهای نتیجه کمتر از این حد خطا است.
حساسيت عملکردی (Functional sensitivity)
این نوع حساسیت منطبق بر میزان دقت در نمونههایی با مقادیر بسیار پایین است. در این روش با رقیق نمودن نمونه یا سرم دارای مقدار پایین آنالیت و رسم منحنی precision profile برای آن غلظتی که در آن میزان دقت، حداکثر به ضریب
(% Cv 20 درصد) رسیده باشد، بهعنوان حساسیت تلقی میگردد. جهت تعیین این نوع حساسیت میبایست نمونه سرم با غلظت پایین آنالیت را انتخاب نمود و از آن رقتهای مختلف تهیه کرد و بر روی هر رقت چندین بار آزمایش انجام داد و ضریب تغییرات cv% را محاسبه نمود. کمترین مقداری از آنالیت که در آن ضریب تغییرات به کمتر از 20 درصد رسیده باشد بهعنوان حساسیت عملکردی تلقی میگردد.
منابع ایجاد خطا در الایزا
1- عدم رعايت روش ذکرشده در بروشور (كمپاني سازنده ممکن است بدون اطلاع قبلي روش كار خود را عوض كند).
2- باز كردن فويل حاوي پليت (بلافاصله بعد از آنكه از يخچال خارج شد): پليت سرد، بخار آب موجود در هوا را به قطرات كوچكي تبديل میکند كه روي جدارهاي چاهکها خواهد نشست. اين عمل سبب میشود كه در برخي تستها كه حجم نمونه كم است (مثلاً 10 ميكروليتر) نمونه رقیق شود. در هنگام باز كردن فويل حاوي پليت به كپسول نمگیر موجود در آن دقت شود. اگر پوشش فوق سوراخ باشد كپسول نمگیر تغيير رنگ میدهد و يا سيليكاژل موجود در آن به هم میچسبد.
3- اثر همولیز بر روی نتایج: هموگلوبين به دليل ماهيت پروتئيني، فعاليت پراكسيدازي داشته و همچنين به دليل وجود آهن و هم میتواند سرعت واكنش پراكسيد هيدروژن و كروموژن را تسريع کرده و بهطور كاذب باعث افزايش جذب نوري شود. از طرفي هموگلوبين واكنش آنتیژن و آنتیبادی را دستخوش تغيير میکند و زمان به تعادل رسيدن واكنش را افزايش میدهد (مثل Free T4 که بهطور كاذب كاهش مییابد).
4- تأثیر ضد انعقاد استفادهشده: ضد انعقاد EDTA بهعنوان شلاتهکننده یونهای فلزی میتواند روی (ZN) که بهعنوان كوفاكتور آنزيم آلكالين فسفاتاز است را مهار کند. فلوئور سديم كه بهعنوان نگهدارنده قند استفاده میشود میتواند فعاليت آنزيم اورهآز را مهار کند، بنابراين در سنجشهايي كه از آنزيم اورهآز بهعنوان ماده نشانگر استفاده شده است، تداخل میکند .(10)
سديم آزايد بهعنوان يك مهارکننده قوي آنزيم پراكسيداز است و هرگز نبايد در سنجشهایی كه نشانگر آنزيمي آنها پراكسيداز است از نمونه حاوي سديم آزايد استفاده شود (9).
5- پليتها در هنگام رنگزایی بايد در دماي 25-18 درجه سانتيگراد قرار گرفته و در معرض باد سرد و گرم نباشند چرا كه دماي محيط میتواند سرعت واكنش رنگزایی را تغيير داده و در نتيجه منجر به رنگزایی كم يا زياد شده و با بیاعتبار كردن كنترل مثبت و منفي كل كار انجام شده را بیاعتبار (invalid) کند .(3)
6- خطا در زمان انكوباسيون (خطاي زماني در انكوباسيونهاي کوتاهمدت بيشتر است). در مرحله انكوباسيون و در اثر آنزيم به يك محصول رنگي – تبديل میشود- بههیچوجه از فويل آلومينيومي براي پوشاندن سطح پليت استفاده نشود.
مشكلات مرتبط به شستشو در الایزا:
عمل شستشو جهت جدا كردن تركيبات اتصاليافته به كف چاهك از تركيباتي كه متصل نشدهاند صورت میگیرد. غير از تركيبات محلول شستشو، نكات ديگري نيز بايد مدنظر قرار گيرد.
فشار بالاي شستشو در روش دستی ناشی از تخليه سريع بافر است كه منجر به جداسازي و حذف اتصالات اختصاصي از كف چاهکها و كاهش كاذب (OD) ميگردد.
فشار پایین شستشو به علت تخليه آهسته بافر در روشهای دستي منجر به عدم دفع كامل اتصالات غیراختصاصی و افزايش كاذب جذب نوري (OD) ميگردد (11).
مشكلات مربوط به شستشو بهسختی قابل تشخيص بوده و بهصورت اتفاقي با خواندههایی كه خيلي بالا و يا پايين باشد مشخص میشوند. رفع اين مشكل كاليبره كردن مجدد دستگاه شوينده است. محلول شستشو معمولاً غلیظتر بوده و بايد در آزمايشگاه رقيق شود. اگر رقت درست صورت نگيرد و محلول غلیظتر از حد توصيهشده باشد، منجر به تخريب و جدا شدن مولکولهای اتصاليافته میشود و برعکس كاهش توانايي محلول شستشو بدليل رقیقسازی زياد باعث عدم جدا شدن اتصالات غیراختصاصی و ايجاد جذب زمینهای بالا میشود. مرحله شستشو حداقل بايد سه بار انجام شود و محلول اضافي بايد تخليه شده و يا آسپيره گردد. در نهايت بايد محلول اضافه داخل چاهك با كوبيدن بر سطح يك كاغذ يا دستمال نمگیر خالي شود (دستورالعمل کنترل کیفی آزمایشگاه رفرانس قم).
7- Soak time: رعايت زمان خيس خوردن سبب میشود كه اتصالات غیراختصاصی از چاهکها كنده شود. عدم رعايت اين موضوع موجب ايجاد يك رنگ زمينه در كل چاهکهای پليت كاري خواهد شد و اگر تست فاقد چاهك بلانك باشد اين موضوع منجر به ايجاد جوابهای كاذب میشود. اين زمان در بروشور کیت آمده است و بين 30 ثانيه تا چند دقيقه متغير است.
8- ليپمي در سنجش آناليتهايي كه يك مولكول آبگریز است بدليل آنكه توزيع آناليت بين دو فاز آبگریز و آبدوست به دليل وجود ليپيد مختل میشود و همینطور در بعضي از آناليتها كه به پروتئين حامل متصل میشود وجود اسيد چرب آزاد ممكن است در اتصال آناليت به پروتئين حامل تداخل نمايد و سبب افزايش كاذب ميزان آناليت آزاد میشود (بهخصوص هورمونهای تيروئيدي و استروئيدي)، بنابراين ناشتا بودن در اين آزمايشها ضروري است.
9- تماس دﺳﺖ ﺑﺎ ﻧﻮك ﺳﻤﭙﻠﺮ و آلودگی ﺑﺎﮐﺘﺮﯾﺎل آن میتواند ﻣﻨﺠﺮ ﺑﻪ آلودگی ﻣﺤﻠﻮل کنژوگه و ﺗﻀﻌﯿﻒ ﯾﺎ ﺧﻨﺜﯽ ﺷﺪن ﻣﻌﺮف کنژوگه ﮔﺮدد. اﺳﺘﺎفیلوکوکها و اﺳﺘﺮﭘﺘﻮﮐﻮكها بهواسطه رﺳﭙﺘﻮر FC ﻗﺎدر ﺑﻪ ﺟﺬب غیراختصاصی اﯾﻤﻮﻧﻮﮔﻠﻮﺑﯿﻦ G در ﻣﺤﯿﻂ ﺑﻮده و ﻣﻨﺠﺮ ﺑﻪ ﺟﺬب آﻧﺘﯽﺑﺎدي کنژوگه و ﺗﻀﻌﯿﻒ ﺗﯿﺘﺮ کنژوگه میگردند.
10-EDGE EFFECT يا اثر حاشيهاي: انكوباتور 37 درجه سانتيگراد بهواسطه شوك حرارتي و اختلاف حرارت محيط كار و محيط داخلي انكوباتور حاصل ميگردد و عمدتاً در سطح استريپهايي كه مجاور درب خارجي انكوباتور قرار دارند ايجاد ميشود و جذب نوری (OD) غیریکنواخت خصوصاً در استريپهاي ابتدايي حاصل ميشود. اين امر بهواسطه ورود ناگهاني سرماي محيط به داخل انكوباتور است، لذا از انكوباسيون پليتهاي الايزا در مکانهایی كه شرايط محيطي متغير دارند، پرهيز گردد (6).
منابع:
- Klein A، Barausse E، Sesana A، Petiteau A، Berti E، Babak S، et al. Science with the space-based interferometer eLISA: Supermassive black hole binaries. Physical Review D. 2016;93(2):024003.
- Jaedicke KM، Taylor JJ، Preshaw PM. Validation and quality control of ELISAs for the use with human saliva samples. Journal of immunological methods. 2012;377(1-2):62-5.
- Shah K، Maghsoudlou P. Enzyme-linked immunosorbent assay (ELISA): the basics. British journal of hospital medicine (London، England: 2005). 2016;77(7):C98-101.
- Tighe PJ، Ryder RR، Todd I، Fairclough LC. ELISA in the multiplex era: potentials and pitfalls. Proteomics Clinical applications. 2015;9(3-4):406-22.
- Henry SM، Sutlief E، Salas-Solano O، Valliere-Douglass J. ELISA reagent coverage evaluation by affinity purification tandem mass spectrometry. mAbs. 2017;9(7):1065-75.
- Aydin S. A short history، principles، and types of ELISA، and our laboratory experience with peptide/protein analyses using ELISA. Peptides. 2015;72:4-15.
- Persat F، Lachaud L، Raberin H، Poggi B، Roques C، Gangneux JP. [Internal and external quality controls for Elisa techniques of aspergillosis serodiagnosis: proposals of the group “serodiagnostic fongique” of the Societe francaise de mycologie medicale]. Journal de mycologie medicale. 2013;23(1):15-20.
- Kanev AN، Vorob’eva MS، Shalunova NV، Karpovich LG، Netesov SV، Maksiutov AZ، et al. [Development of sera reference panels for quality control of ELISA diagnostic kits in Russia]. Vestnik Rossiiskoi akademii meditsinskikh nauk. 1998(3):47-51.
- Leeflang MM، Ang CW، Berkhout J، Bijlmer HA، Van Bortel W، Brandenburg AH، et al. The diagnostic accuracy of serological tests for Lyme borreliosis in Europe: a systematic review and meta-analysis. BMC infectious diseases. 2016;16:140.
- Goens G، Rusu D، Bultot L، Goval JJ، Magdalena J. Characterization and quality control of antibodies used in ChIP assays. Methods in molecular biology (Clifton، NJ). 2009;567:27-43.
- Sue MJ، Yeap SK، Omar AR، Tan SW. Application of PCR-ELISA in molecular diagnosis. BioMed research international. 2014;2014:653014.
[1] Horseradish Peroxidase
مروری بر الایزا خطایابی و رفع ایرادات احتمالی در کار با سیستم الایزا
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام


بسيار مفيد و قابل استفاده. و با اختصار .ممنون
ممنون از نظر لطف شما