تعامل میان سلولهای Th1 ،Th2 و Th17
فتانه توسلیان، دانشجوی دکتری تخصصی ایمونولوژِی پزشکی، دانشگاه تربیت مدرس، دانشکده پزشکی
دکتر احمد زواران حسینی، استاد گروه ایمونولوژی، دانشگاه تربیت مدرس، دانشکده پزشکی، گروه ایمونولوژی
الهام عبدالهی، دانشجوی دکتری تخصصی ایمونولوژی پزشکی، دانشگاه علوم پزشکی مشهد، دانشکده پزشکی
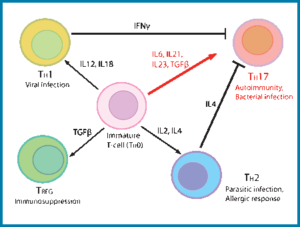
سلولهای +ThCD4 به عنوان سلولهای کلیدی سیستم ایمنی شناخته میشوند که در پاسخهای پیشگیرانه و دفاعی در مقابل پاتوژنها نقش مهمی ایفا میکنند. در دو دهه گذشته ادعا شده که سلولهای +TCD4 به دو زیرگروه مجزا با ویژگیهای عملکردی جداگانه تقسیم میشوند که آنها را به عنوان Th1 و Th2 میشناسیم. سلولهای Th1 ترشح کننده IFNɣ هستند که ایمنی سلولی در برابر پاتوژنهای درون سلولی را القا میکنند در حالی که سلولهای Th2 ترشح کننده IL-4 هستند که موجب تحریک ایمنی هومورال در برابر کرمهای پاتوژن میشوند. این نوع تقسیمبندی تا سال 2005 مورد قبول بود تا زمانی که زیرگروه سومی از سلولهایT به نام Th17 نیز کشف شد. سلولهایTh17 با ترشح IL-17 شناخته میشوند و ممکن است در دفاع بر علیه پاتوژنهایی که سلولهای Th1 و Th2 قادر به ریشهکنی آنها نیستند از جمله باکتریهای خارج سلولی و همچنین قارچها درگیر باشند.
مقدمه
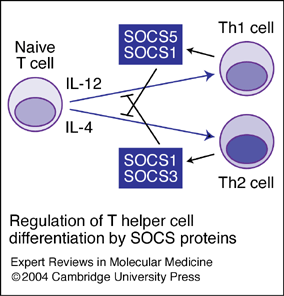
سلولهای Th1 ,Th2و Th17 هر کدام در پاسخ به سایتوکینهای مختلفی تمایز پیدا میکنند و هر کدام از زیرگروهها توانایی مبارزه با میکروارگانیزمهای خاصی را دارند (1). در طی پاسخهای ایمنی، سلولهای سیستم ایمنی ذاتی PAMPS را شناسایی کرده و سایتوکینهای خاصی را برای القای تمایز سلولهای T ترشح میکنند، برای مثال IL-12 که باعث القای Th1 میشود از تمایز Th2 جلوگیری میکند و IL-4 که باعث القای Th2 میشود از تمایز Th1 جلوگیری میکند و به این ترتیب سلولهایT اثرات تنظیمی بر روی یکدیگر دارند (2).
اما در مورد اثرات تنظیمی که سلولهای Th17 و سلولهای Th1 و Th2 بر روی یکدیگر دارند اطلاعات کمی در دسترس است. TGFb میتواند از تمایز Th1 و Th 2 از راههای بسیاری جلوگیری کند، مثلاً ممانعت از سیگنالرسانی از طریق IL-12R ,IFNɣR و IL-4R و همچنین باعث کاهش بیان STAT4,T-bet و GATA3 شود (3) .
شواهد اندکی نیز حاکی از آن است که IL-23 و IL-17 با کاهش بیان IL-12Rb2 و T-bet از تمایز Th1 جلوگیری میکنند (4)، اما به طور کلی دیده شده است که توانایی سلولهای Th1 و Th2 در جلوگیری از تمایز سلولهای Th17 بیشتر از توانایی سلولهای Th17 در سرکوب Th1 و Th2 است و فرضیهای که چرا مدت زمان زیادی از کشف سلولهای Th17 نمیگذرد بر این اساس است که رشد سلولهای Th17 در invitro بدون اضافه کردن آنتیبادیهای خنثی کننده IL-4 و IFNɣ بسیار نادر است (5, 6).
در موشهای فاقد T-bet سلولهای Th17 قادر به رشد هستند اما بیان T-bet در سلولهای T بکر مانع از بیانIL-17 میشود حتی زمانی که شرایط برای رشد سلولهای Th17 فراهم باشد (7). همچنین سلولهای T موش که C-maf (که یک فاکتور رونویسی مربوط به سلولهای Th2 برای بیان IL-4 میباشد) را بیان میکنند توانایی تولید IL-17 را ندارند (8). با این حال مکانیسمهای دقیقی که فاکتورهای رونویسی مربوط به Th1 و Th2 از بیان IL-17 جلوگیری میکنند به درستی شناخته نشده است. برای مثال T-bet میتواند از تکامل سلولهای Th17 در بعضی شرایط جلوگیری کند اما در شرایط دیگری سلولهایی که دو فاکتور T-bet و RORɣt را بیان میکنند تبدیل به سلولهای دوگانه مثبت ترشح کننده IL-17/IFNɣ میشوند (9). مطالعات اخیر نشان دادهاند که IL-25(IL-17E) که یکی از اعضای خانواده IL-17 است به طور غیرمستقیم از بیان IL-17 جلوگیری میکند و اثر مهاری آن از طریق افزایش پیشبرد تمایز سلولT به سمت Th2 ترشح کننده سایتوکین IL-13 از این سلولهاست (10).
بازسازی کروماتین و نحوه بلوغ سلولهای T Helper
بازسازی کروماتین (Chromatin Remodeling) نحوه وراثت ژنها را مشخص میکند و در تمایز سلولهای T کمکی نقش مهمی ایفا میکند و همچنین در برقراری تعادل در انعطافپذیری و بلوغ سلولها نقش دارد (11). نسخهبرداری فعال نیازمند وضعیت کروماتینی باز (open) میباشد تا اتصال فاکتورهای رونویسی به DNA تسهیل شود. بعضی از مکانیسمها که DNA را قابل دسترستر میکند شامل متیلاسیون DNA، تغییراتی که بر روی هیستونها اتفاق میافتد و ساختار سه بعدی خود کروماتین است. یکی از شناختهشدهترین تغییراتی که بر روی هیستونها اتفاق میافتد و باعث نسخهبرداری فعال از ژن میشود شامل متیلاسیون لیزین 4 در هیستون (3H3K4me3)، استیلاسیون هیستون (3H3AC) و استیلاسJیون هیستون 4(H4AC) است، اما شناختهشدهترین مکانیسمهایی که نسخهبرداری را سرکوب میکند شامل متیلاسیون لایزین 27 در هیستون (3H3K27me3) است. ژنهایی که الگوی دوگانه متیلاسیون را نشان میدهند مانند ( H3K4me3) و (H3k27me3) و همچنین ژنهایی که الگوی متیلاسیون را نشان نمیدهند (neither H3K4me3 nor H3K27me3) هم به نظر میرسد که آماده نسخهبرداری هستند (12, 13).
سلولهای Th17 الگوی H3AC در پرومتور IL-17a و IL-17f را القا میکنند که وابسته به STAT3 است (14). در تحقیقاتی که توسط Wei و همکارانش انجام شده بود سطح H3K4me3 و H3K27me3 در ژن سایتوکینها و فاکتورهای رونویسی اصلی مربوط به سلولهای Tبکر Th1 ,Th2 ,Th17و Treg مشخص شد و دیده شد که سلولهایT بکر هر دو الگوی دوگانه متیلاسیون و الگوی بدون متیلاسیون را بر روی ژن تمام سایتوکینها و فاکتورهای رونویسی نشان میدهند و همان طور که قابل پیشبینی بود ژنهای IFNɣ ,IL-4 و IL-17a به طور دقیقی با ژنهای Th1 ,Th2 و Th17 مرتبط بودند آن چنان که IFNɣ با H3K4me3 در سلولهای Th1 و H3K27me3 در Th2 و Th17 مشخص شد. IL-4 با H3K4me3 در سلولهای Th2 و H3K27me3 در Th1 و Th17 مشخص شد وIL-17a با H3K4me3 در Th17 و H3K27me3 در Th1 و Th2 مشخص شدند (15).
از طرف دیگر هنگامی که ژنهای مربوط بهT-bet ,GATA3 و Rorc با H3K4me3 به طور مشخص نشانهگذاری میشوند توانایی فعال شدن و یا خاموش شدن را بدست میآورند. این یافتهها مکانیسمهایی را که سلولها میتوانند ویژگیهای عملکردی دوگانه را از خود نشان دهند و یا به صورت بالقوه از یک زیرگروه به زیرگروه دیگر تبدیل شوند را توجیه میکند (16).
References:
- Tosolini M, Kirilovsky A, Mlecnik B, Fredriksen T, Mauger S, Bindea G, Berger A, Bruneval P, Fridman W-H, Pagès F. 2011. Clinical impact of different classes of infiltrating T cytotoxic and helper cells (Th1, th2, treg, th17) in patients with colorectal cancer. Cancer research 71: 1263-71
- Kalinski P, Moser M. 2005. Consensual immunity: success-driven development of T-helper-1 and T-helper-2 responses. Nature Reviews Immunology 5: 251-60
- Chen Z, O’Shea JJ. 2008. Th17 cells: a new fate for differentiating helper T cells. Immunologic research 41: 87-102
- Mok MY, Wu HJ, Lo Y, Lau CS. 2010. The relation of interleukin 17 (IL-17) and IL-23 to Th1/Th2 cytokines and disease activity in systemic lupus erythematosus. The Journal of rheumatology 37: 2046-52
- Stockinger B, Veldhoen M. 2007. Differentiation and function of Th17 T cells. Current opinion in immunology 19: 281-6
- Bettelli E, Korn T, Kuchroo VK. 2007. Th17: the third member of the effector T cell trilogy. Current opinion in immunology 19: 652-7
- Gocke AR, Cravens PD, Ben L-H, Hussain RZ, Northrop SC, Racke MK, Lovett-Racke AE. 2007. T-bet regulates the fate of Th1 and Th17 lymphocytes in autoimmunity. The Journal of Immunology 178: 1341-8
- Xu J, Yang Y, Qiu G, Lal G, Wu Z, Levy DE, Ochando JC, Bromberg JS, Ding Y. 2009. c-Maf regulates IL-10 expression during Th17 polarization. The Journal of Immunology 182: 6226-36
- Lazarevic V, Chen X, Shim J-H, Hwang E-S, Jang E, Bolm AN, Oukka M, Kuchroo VK, Glimcher LH. 2011. T-bet represses TH17differentiation by preventing Runx1-mediated activation of the gene encoding ROR [gamma] t. Nature immunology 12: 96-104
- Kleinschek MA, Owyang AM, Joyce-Shaikh B, Langrish CL, Chen Y, Gorman DM, Blumenschein WM, McClanahan T, Brombacher F, Hurst SD. 2007. IL-25 regulates Th17 function in autoimmune inflammation. The Journal of experimental medicine 204: 161-70
- Clapier CR, Cairns BR. 2009. The biology of chromatin remodeling complexes. Annual review of biochemistry 78: 273-304
- Wang GG, Allis CD, Chi P. 2007. Chromatin remodeling and cancer, Part I: Covalent histone modifications. Trends in molecular medicine 13: 363-72
- Koche RP, Smith ZD, Adli M, Gu H, Ku M, Gnirke A, Bernstein BE, Meissner A. 2011. Reprogramming factor expression initiates widespread targeted chromatin remodeling. Cell stem cell 8: 96-105
- Chen Z, Laurence A, O’Shea JJ. 2007. Signal transduction pathways and transcriptional regulation in the control of Th17 differentiation. Presented at Seminars in immunology
- Wei G, Wei L, Zhu J, Zang C, Hu-Li J, Yao Z, Cui K, Kanno Y, Roh T-Y, Watford WT. 2009. Global mapping of H3K4me3 and H3K27me3 reveals specificity and plasticity in lineage fate determination of differentiating CD4+ T cells. Immunity 30: 155-67
- O’Shea JJ, Steward-Tharp SM, Laurence A, Watford WT, Wei L, Adamson AS, Fan S. 2009. Signal transduction and Th17 cell differentiation. Microbes and Infection 11: 599-611
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام