تشخیص SARS−COV-2 anti RBD
به عنوان یک ابزار کارآمد در مدیریت پاندمی کووید 19
امید کیانی قلعه سردی
دانشجوی دکتری خونشناسی
مقدمه
سازمان جهانی بهداشت در ماه ژانویه سال 2020 بروز همهگیری با ویروس SARS−COV-2 را اعلام و نام [1]COVID-19 را برای بیماری ایجادشده توسط این ویروس تعیین کرد (1). این بیماری تاکنون منجر به ابتلای صد و بیست و دو میلیون نفر و مرگ و دو میلیون و ششصد و نود هزار نفر در کل دنیا شده است که آن را به یکی از مرگبارترین همهگیریهای کل تاریخ تبدیل کرده است. در کشور ما نیز این بیماری تا زمان نگارش این مقاله منجر به ابتلای یک میلیون و هفتصد و هشتاد نفر و مرگ شصت و یک هزار و پانصد و هشتاد و یک نفر شده است (2).
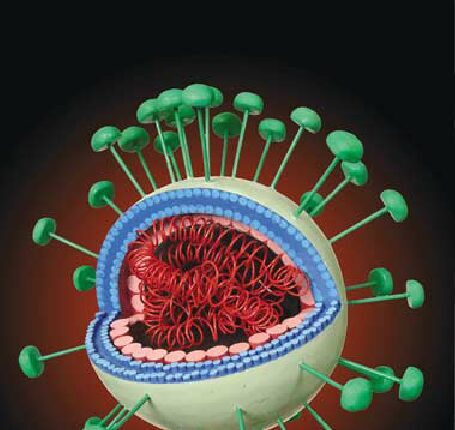
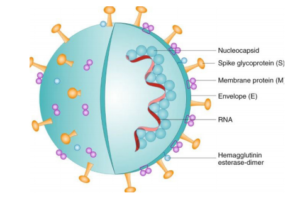
SARS-CoV-2 دارای یک RNA تکرشتهای است که چهار ناحیهی اصلی ساختمانی ویروس شامل بخش spike (S)، گلیکوپروتئین غشایی (M)، پوشش خارجی (E) و نوکلئوکپسید (N) را کد میکند (3). در شکل 1 ساختار ویروس قابل مشاهده است.
شکل 1- ساختار SARS-CoV-2 (برگرفته از رفرنس شماره 3)
این ویروس با استفاده از پروتئین S به گیرندهی ACE2 در سلولهای میزبان متصل شده و با ورود به سلول، آن را آلوده میکند. سپس ویروس تکثیر شده و آمادهی آزاد شدن و آلوده کردن سایر سلولها میشود (4).
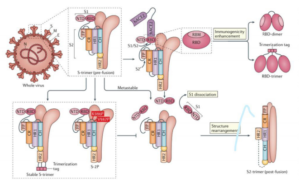
پروتئین S دارای دو زیرواحد اصلی شامل S1 و S2 است که به ترتیب در اتصال به ویروس و ایجاد فیوژن غشایی نقش دارند (5). مهمترین قسمت از زیرواحد S1، ناحیهای به نام [2]RBD است که مسئول اتصال به گیرندهی ACE2 است (5). در شکل زیر میانکنش ویروس و گیرنده ACE2 را مشاهده میکنید.
شکل 2- میانکنش SARS–CoV–2 با گیرندهACE 2
پاسخ ایمنی همورال به SARS-CoV-2 عمدتاً شامل تولید آنتیبادی نسبــــــت به آنتیژنهای N و S-RBD است که آنتیبادیهای ضد N علیرغم اتصال به ویروس، قابلیت خنثیسازی ویروس را ندارند و به همین دلیل است که در بعضی افراد با وجود بالا بودن تیتر آنتیبادی ضد N، فرد در مقابل بیماری مصون نیست و مجدداً به بیماری مبتلا میشود. در مقابل، آنتیبادیهای ضد S-RBD با اتصال به ناحیهی RBD ویروس مانع از اتصال آن به گیرندهی ACE2 میشوند و بنابراین دارای خاصیت خنثیکنندگی هستند و تحت عنوان آنتیبادیهای خنثیکننده یا نوترالیزان کووید 19 [3] شناخته میشوند (6).
در این مقاله به نقش تعیینکنندهی شناسایی آنتیبادی ضد S-RBD در تعیین مصونیت نسبت به این بیماری، کارایی واکسنها، درمان و پیشآگهی بیماری کووید 19 میپردازیم.
نقش آنتیبادی ضد S-RBD در ایجاد مصونیت و ایمنیزایی علیه SARS–CoV–2
پاسخ آنتیبادی در بدن انسان نسبت به ویروس SARS-CoV-2، عمدتاً شامل ایجاد آنتیبادی علیه بخشهای N و S (بخش S-RBD) ویروس است. آنتیبادیهای ضد بخش N، مدت کوتاهی پس از ابتلای فرد تولید میشوند اما قابلیت خنثیکنندگی ویروس و ایجاد مصونیت علیه آن را ندارند و مدت کوتاهی پس از شروع عفونت کاهش مییابند (10-7) و احتمالاً تنها کاربرد شناسایی آنها این است که بتوان از آنها در کنار سایر شاخصها بهمنظور تعیین ابتلا به ویروس استفاده کرد (10). در مقابل، آنتیبادیهای ضد RBD در مدت کوتاهی پس از ابتلا به SARS-CoV-2 (تنها شش روز بعد از مثبت شدن تست PCR) در بیماران تولید میشوند (11) و تیتر IgG ضد RBD متناسب با قدرت خنثیکنندگی ویروس و در نتیجه مصونیت نسبت به ویروس است (11).
آنتیبادیهای IgG ضد RBD به مدت طولانی در بدن فرد باقی میمانند که مطالعات مختلف، ماندگاری این آنتیبادی را از پنج ماه تا هشت ماه تعیین کردهاند (15-12). با این حال به نظر میرسد که این زمان، طولانیتر از یافتههای قبلی و بیش از هشت ماه باشد (16). در مطالعهای که اخیراً منتشر شده، مشخص گردیده است که میزان IgG ضد RBD در بیماران علامتداری که بهبود یافتهاند حداقل تا 6 ماه در سطح بالا باقی میماند و در پایان این مدت هنوز به میزان 70 درصد دارای خاصیت خنثیکنندگی و ایجاد مصونیت است (17). مطالعهای دیگر که به ارزیابی خاطرهی سیستم ایمنی نسبت به SARS-CoV-2 پرداخته، نشاندهندهی این بود که حتی سطح پایین این آنتیبادی نیز دارای خاصیت خنثیکنندگی و ایجاد مصونیت بود (12).
از مجموع مطالعات فوق میتوان اینگونه نتیجهگیری کرد که در پی ابتلا به کووید 19، IgG ضد RBD در بدن بسیاری از افراد تولید میشود که دارای خاصیت خنثیکنندگی ویروس است و به مدت طولانی (بیش از 8 ماه) در بدن فرد باقی میماند و از ابتلای مجدد فرد به بیماری جلوگیری میکند.
شناسایی آنتیبادیهای ضد S-RBD به عنوان شاخصی جهت تعیین کارایی واکسنهای SARS–CoV–2 و تعیین استراتژی واکسیناسیون
تست استاندارد طلایی برای ارزیابی ویژگی خنثیکنندگی آنتیبادیها تست [4]VNT است، اما این تست نیاز به تجهیزات پیشرفته و آزمایشگاههای مجهز دارد، در نتیجه شرکتهای کیتسازی به سمت جایگزینی این تست با تستهای با کارایی بالاتر و قابلیت انجام در آزمایشگاههای روتین رفتهاند. به دلیل اینکه IgG ضد RBD به عنوان شاخص مصونیت نسبت به SARS-CoV-2 است، شرکتهای مختلف واکسنسازی جهت ارزیابی کارایی ایمنیزایی واکسن خود از ارزیابی این آنتـــیبادی پس از تزریق واکسن استفاده کردهاند (20-18).
از سوی دیگر مطالعات نشان دادهاند که افرادی که قبلاً به این بیماری مبتلا شدهاند و دارای IgG ضد RBD در سرم خود هستند تنها با تزریق یک دوز واکسن به پاسخ ایمنی برابر و یا بیشتر نسبت به تزریق دو دوز واکسن در افراد فاقد این آنتیبادی میرسند (23-21)، بنابراین با توجه شیوع بالای این بیماری در کشور و فشار فزاینده به سیستم سلامت کشور و در نتیجه لزوم برنامهریزی صحیح جهت تعیین اولویت تزریق واکسن در جمعیت عمومی، میتوان با غربالگری IgG ضد RBD در سرم افراد، افرادِ فاقد این آنتیبادی را در اولویت اول تزریق واکسن قرار داد و افراد دارای این آنتیبادی در اولویت بعدی تزریق واکسن قرار بگیرند.
شناسایی آنتیبادیهای ضد S-RBD به عنوان شاخصی جهت تعیین اثربخشی پلاسماهای اهدایی جهت پلاسمادرمانی در بیماران مبتلا به کووید 19
FDA در ماه آگوست 2020 استفاده از پلاسمای بیماران بهبودیافته از کووید 19 را به عنوان یکی از درمانهای اثربخش برای این بیماری تأیید کرد. با این حال جهت تعیین اهداکننده مناسب برای اهدای پلاسما برای پلاسمادرمانی، نیاز به وجود تیتر مناسبی از IgG ضد RBD در پلاسمای اهداکنــنده است (26-24) باشد؛ بنابراین با ارزیابی صحیح IgG ضد RBD در پلاسماهای اهدایی میتوان بهترین اهداکنندگان را به این منظور انتخاب کرد و نتایج قابل قبولی را در بیماران بدحال و غیر پاسخگو به درمانهای روتین به دست آورد.
شناسایی آنتیبادیهای ضد S-RBD به عنوان شاخصی جهت تعیین پیشآگهی بیماری کووید 19
مطالعهای که اخیراً در نشریهی Cell منتشر شده، نشاندهندهی این است که سطح بالای آنتیبادیهای ضد RBD نشاندهندهی پاسخ شدید سیستم ایمنی و پیشآگهی ضعیف و بیماری شدید در افراد است (27)، بنابراین سنجش سطح این آنتیبادی مخصوصاً در افراد پرخطر میتواند به عنوان شاخصی جهت پیشآگهی بیمار مورد استفاده قرار بگیرد و در صورت نیاز درمانهای پیشگیرانه و تهاجمیتر برای بیمار اعمال شود.
سه رویکرد اساسی در تشخیص آنتیبادیهای ضد پروتئین Spike وجود دارد:
۱- تشخیص آنتیبادی ها بر ضد پروتئین کامل Spike( شامل S1 و S2):
این روش اگرچه حساسیت تشخیصی بالایی داشته( به علت جذب طیف وسیعی از آنتیبادیهای ضد ویروس کرونا) اما به علت شباهت بسیار زیاد پروتئین اسپایک در بین انواع کروناویروسها اختصاصیت تشخیصی بسیار اندکی دارد. همچنین در این روش آنتیبادیهای خنثی کننده از آنتیبادیهای بایندینگ قابل تفکیک نیستند. مجموع این شواهد سبب شده است تا تشخیص آنتیبادی بر ضد پروتئین کامل Spike به حاشیه رانده شود.
۲- تشخیص آنتیبادی بر ضد قسمت S1 پروتئین Spike:
این رویکرد نسبت به روش قبلی یعنی تشخیص آنتیبادی بر ضد پروتئین کامل spike برتریهای بسیاری داشته اما همچنان توانایی تفکیک آنتیبادیهای بایندینگ از آنتیبادیهای خنثیکننده را ندارد.
۳- تشخیص آنتیبادی بر ضد قسمت RBD پروتئین Spike:
آنتیبادیهای ضد قسمت RBD به عنوان مهمترین آنتیبادیهای خنثیکنندهی ویروس شناخته شده و به عنوان یک ابزار کارآمد در تشخیص این نوع آنتیبادی معرفی شدهاند. قسمت RBD پروتئین اسپایک حدودا ۲۰۰ آمینواسید بوده که با ۸۰۰ آمینواسید از ACE2 واکنش میدهد. بنابراین اتصال آنتیبادی به RBD سبب ممانعت از اتصال ویروس به ACE2 میگردد. سایز بسیار کوچک قسمت RBD پروتئین اسپایک سبب میگردد تا هر آنتیبادی IgG بتواند تمام ساختار RBD را پوشش دهد.
از سوی دیگر ساختار بسیار کوچک پروتئین RBD سبب بروز مشکلاتی تکنیکی در تشخیص آنتیبادیهای ضد این پروتئین به روش الایزا شده است. کمپانیهای مختلف برای حل این مساله سه رویکرد عمده را در پیش گرفته اند:
۱- استفاده از روش رقابتی:
در این روش پروتئین ACE2 را به ته چاهک الایزا کوت کرده، سپس سرم بیمار و S-RBD کونژوگه شده با آنزیم به چاهکها اضافه میگردد. سپس ACE2 و آنتیبادی های بیمار(در صورت وجود) برای اتصال به S-RBD با یکدیگر رقابت میکنند(CPass, Genescript). در این روش میتوان S RBD را به کف چاهک ها اضافه کرده و ACE2 کونژوگه استفاده کرد(Euroimmune). در هر دو صورت رقابت بین آنتی بادی و ACE2 برای اتصال به S-RBD صورت می گیرد. این روش تمام انواع آنتیبادیها از هر کلاس(IgG، IgM و IgA) را شناسایی کرده و قادر به تفکیک کلاس آنتی بادی بر ضد آنتی ژن RBD نیست. این روش به علت تداخلات کوفاکتورهای اندوژنیک و اگزوژنیک با ACE2 میتواند مستعد موارد مثبت کاذب باشد که سبب کاهش اختصاصیت تشخیصی آن میگردد.
۲- استفاده از پروتئین فیوژن S RBD-Fc در روش الایزا غیر مستقیم
در این روش پروتئین S-RBD از طریق اتصال به FC به عنوان یک لینکر در دسترس آنتیبادیهای سرم قرار می گیرد.
۳- استفاده از پروتئین مهندسی شده در روش الایزا غیر مستقیم
در این روش پروتئین RBD از طریق واکنشهای شیمیایی به هم متصل شده و پروتئینها چندین واحدی( تا حداکثر ۱۰ واحد) ایجاد میکنند. استفاده از این روش سبب افزایش حساسیت تشخیصی به میزان بسیاری بالایی میگردد.
References:
- Organization WH, Organization WH. Naming the coronavirus disease (COVID-19) and the virus that causes it. 2020.
- World Health O. COVID-19 weekly epidemiological update, 16 March 2021. 2021 2021-03-16. Report No.
- Florindo HF, Kleiner R, Vaskovich-Koubi D, Acúrcio RC, Carreira B, Yeini E, et al. Immune-mediated approaches against COVID-19. Nature nanotechnology. 2020 Aug;15(8):630-45. PubMed PMID: 32661375. Pubmed Central PMCID: PMC7355525. Epub 2020/07/15. eng.
- Huang Y, Yang C, Xu XF, Xu W, Liu SW. Structural and functional properties of SARS-CoV-2 spike protein: potential antivirus drug development for COVID-19. Acta pharmacologica Sinica. 2020 Sep;41(9):1141-9. PubMed PMID: 32747721. Pubmed Central PMCID: PMC7396720. Epub 2020/08/05. eng.
- Tang T, Bidon M, Jaimes JA, Whittaker GR, Daniel S. Coronavirus membrane fusion mechanism offers a potential target for antiviral development. Antiviral research. 2020 Jun;178:104792. PubMed PMID: 32272173. Pubmed Central PMCID: PMC7194977. Epub 2020/04/10. eng.
- Li Z, Yi Y, Luo X, Xiong N, Liu Y, Li S, et al. Development and clinical application of a rapid IgM-IgG combined antibody test for SARS-CoV-2 infection diagnosis. Journal of medical virology. 2020 Sep;92(9):1518-24. PubMed PMID: 32104917. Pubmed Central PMCID: PMC7228300. Epub 2020/02/28. eng.
- Ripperger TJ, Uhrlaub JL, Watanabe M, Wong R, Castaneda Y, Pizzato HA, et al. Orthogonal SARS-CoV-2 Serological Assays Enable Surveillance of Low-Prevalence Communities and Reveal Durable Humoral Immunity. Immunity. 2020 Nov 17;53(5):925-33 e4. PubMed PMID: 33129373. Pubmed Central PMCID: PMC7554472. Epub 2020/11/02. eng.
- Tan Y, Liu F, Xu X, Ling Y, Huang W, Zhu Z, et al. Durability of neutralizing antibodies and T-cell response post SARS-CoV-2 infection. Frontiers of medicine. 2020 Dec;14(6):746-51. PubMed PMID: 33017040. Pubmed Central PMCID: PMC7533664. Epub 2020/10/06. eng.
- Addetia A, Crawford KHD, Dingens A, Zhu H, Roychoudhury P, Huang ML, et al. Neutralizing Antibodies Correlate with Protection from SARS-CoV-2 in Humans during a Fishery Vessel Outbreak with a High Attack Rate. Journal of clinical microbiology. 2020 Oct 21;58(11). PubMed PMID: 32826322. Pubmed Central PMCID: PMC7587101. Epub 2020/08/23. eng.
- Henss L, Scholz T, von Rhein C, Wieters I, Borgans F, Eberhardt FJ, et al. Analysis of Humoral Immune Responses in Patients With Severe Acute Respiratory Syndrome Coronavirus 2 Infection. The Journal of infectious diseases. 2021 Jan 4;223(1):56-61. PubMed PMID: 33128369. Pubmed Central PMCID: PMC7665662. Epub 2020/11/01. eng.
- Suthar MS, Zimmerman M, Kauffman R, Mantus G, Linderman S, Vanderheiden A, et al. Rapid generation of neutralizing antibody responses in COVID-19 patients. medRxiv : the preprint server for health sciences. 2020 May 8. PubMed PMID: 32511565. Pubmed Central PMCID: PMC7274246. Epub 2020/06/09. eng.
- Dan JM, Mateus J, Kato Y, Hastie KM, Yu ED, Faliti CE, et al. Immunological memory to SARS-CoV-2 assessed for up to 8 months after infection. Science (New York, NY). 2021 Feb 5;371(6529). PubMed PMID: 33408181. Pubmed Central PMCID: PMC7919858. Epub 2021/01/08. eng.
- Wheatley AK, Juno JA, Wang JJ, Selva KJ, Reynaldi A, Tan HX, et al. Evolution of immune responses to SARS-CoV-2 in mild-moderate COVID-19. Nature communications. 2021 Feb 19;12(1):1162. PubMed PMID: 33608522. Pubmed Central PMCID: PMC7896046. Epub 2021/02/21. eng.
- Figueiredo-Campos P, Blankenhaus B, Mota C, Gomes A, Serrano M, Ariotti S, et al. Seroprevalence of anti-SARS-CoV-2 antibodies in COVID-19 patients and healthy volunteers up to 6 months post disease onset. European journal of immunology. 2020 Dec;50(12):2025-40. PubMed PMID: 33084029. Pubmed Central PMCID: PMC7756220. Epub 2020/10/22. eng.
- Wajnberg A, Amanat F, Firpo A, Altman DR, Bailey MJ, Mansour M, et al. Robust neutralizing antibodies to SARS-CoV-2 infection persist for months. Science (New York, NY). 2020 Dec 4;370(6521):1227-30. PubMed PMID: 33115920. Pubmed Central PMCID: PMC7810037. Epub 2020/10/30. eng.
- Whitcombe AL, McGregor R, Craigie A, James A, Charlewood R, Lorenz N, et al. Comprehensive analysis of SARS-CoV-2 antibody dynamics in New Zealand. Clinical & translational immunology. 2021;10(3):e1261. PubMed PMID: 33747511. Pubmed Central PMCID: PMC7955949. Epub 2021/03/23. eng.
- Wu J, Liang B, Chen C, Wang H, Fang Y, Shen S, et al. SARS-CoV-2 infection induces sustained humoral immune responses in convalescent patients following symptomatic COVID-19. Nature communications. 2021 Mar 22;12(1):1813. PubMed PMID: 33753738. Epub 2021/03/24. eng.
- Logunov DY, Dolzhikova IV, Shcheblyakov DV, Tukhvatulin AI, Zubkova OV, Dzharullaeva AS, et al. Safety and efficacy of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine: an interim analysis of a randomised controlled phase 3 trial in Russia. Lancet (London, England). 2021 Feb 20;397(10275):671-81. PubMed PMID: 33545094. Pubmed Central PMCID: PMC7852454. Epub 2021/02/06. eng.
- Polack FP, Thomas SJ, Kitchin N, Absalon J, Gurtman A, Lockhart S, et al. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. The New England journal of medicine. 2020 Dec 31;383(27):2603-15. PubMed PMID: 33301246. Pubmed Central PMCID: PMC7745181. Epub 2020/12/11. eng.
- Baden LR, El Sahly HM, Essink B, Kotloff K, Frey S, Novak R, et al. Efficacy and Safety of the mRNA-1273 SARS-CoV-2 Vaccine. The New England journal of medicine. 2021 Feb 4;384(5):403-16. PubMed PMID: 33378609. Pubmed Central PMCID: PMC7787219 collaboration with Crucell/Janssen and Moderna; Dr. Rouphael, receiving grant support from Pfizer, Merck, Sanofi–Pasteur, Eli Lilly, and Quidel; Dr. Creech, receiving grant support from Merck, consulting fees from Horizon Pharma and GSK, and fees for serving on a data and safety monitoring board from Astellas; Dr. Neuzil, receiving grant support from Pfizer; Dr. Graham, holding pending patent WO/2018/081318 on prefusion coronavirus spike proteins and their use and pending patent 62/972,886 on 2019-nCoV vaccine; Dr. Bennett, being employed by and owning stock and stock options in Moderna; Dr. Pajon, being employed by and owning stock in Moderna; Dr. Knightly, being employed by and owning stock and stock options in Moderna; Drs. Leav, Deng, and Zhou being employees of Moderna; Dr. Han, being employed by and owning stock and stock options in Moderna; Dr. Ivarsson, being employed by and owning share options in Moderna; Dr. Miller, being employed by and owning stock and stock options in Moderna; and Dr. Zaks, being employed by and owning stock options in Moderna. No other potential conflict of interest relevant to this article was reported. Epub 2020/12/31. eng.
- Krammer F, Srivastava K, Simon V. Robust spike antibody responses and increased reactogenicity in seropositive individuals after a single dose of SARS-CoV-2 mRNA vaccine. medRxiv : the preprint server for health sciences. 2021:2021.01.29.21250653.
- Ebinger JE, Fert-Bober J, Printsev I, Wu M, Sun N, Figueiredo JC, et al. Prior COVID-19 Infection and Antibody Response to Single Versus Double Dose mRNA SARS-CoV-2 Vaccination. medRxiv : the preprint server for health sciences. 2021 Feb 26. PubMed PMID: 33655279. Pubmed Central PMCID: PMC7924304. Epub 2021/03/04. eng.
- Bradley T, Grundberg E, Selvarangan R. Antibody responses boosted in seropositive healthcare workers after single dose of SARS-CoV-2 mRNA vaccine. medRxiv : the preprint server for health sciences. 2021 Feb 5. PubMed PMID: 33564797. Pubmed Central PMCID: PMC7872392. Epub 2021/02/11. eng.
- Shen C, Wang Z, Zhao F, Yang Y, Li J, Yuan J, et al. Treatment of 5 Critically Ill Patients With COVID-19 With Convalescent Plasma. Jama. 2020 Apr 28;323(16):1582-9. PubMed PMID: 32219428. Pubmed Central PMCID: PMC7101507. Epub 2020/03/29. eng.
- Duan K, Liu B, Li C, Zhang H, Yu T, Qu J, et al. Effectiveness of convalescent plasma therapy in severe COVID-19 patients. Proceedings of the National Academy of Sciences of the United States of America. 2020 Apr 28;117(17):9490-6. PubMed PMID: 32253318. Pubmed Central PMCID: PMC7196837. Epub 2020/04/08. eng.
- Altuntas F, Ata N, Yigenoglu TN, Bascı S, Dal MS, Korkmaz S, et al. Convalescent plasma therapy in patients with COVID-19. Transfusion and apheresis science : official journal of the World Apheresis Association : official journal of the European Society for Haemapheresis. 2021 Feb;60(1):102955. PubMed PMID: 33011076. Pubmed Central PMCID: PMC7501849. Epub 2020/10/05. eng.
- Garcia-Beltran WF, Lam EC, Astudillo MG, Yang D, Miller TE, Feldman J, et al. COVID-19-neutralizing antibodies predict disease severity and survival. Cell. 2021 Jan 21;184(2):476-88 e11. PubMed PMID: 33412089. Pubmed Central PMCID: PMC7837114. Epub 2021/01/08. eng.
[1] coronavirus disease 2019
[2] receptor-binding domain
[3] COVID-19-neutralizing antibodies
[4][4] Virus Neutralization Test
بررسی سرواپیدمیولوژی آنتیبادیهای SARS-COV-2 IgG, IgM
https://www.frontiersin.org/articles/10.3389/fmolb.2021.671633/full
https://bmcmedicine.biomedcentral.com/articles/10.1186/s12916-021-02090-6
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام