نقش Quorum sensing در باکتریها
(قسمت دوم)
دکتر رضا میرنژاد (دانشیار دانشگاه) – وهاب پیرانفر (کارشناسی ارشد)
در مقاله قبلی در مورد Quorum sensing و نقش آن در بعضی از باکتریها مطالبی ارائه گشت. در این بخش به ادامه نقش این ترکیبات در باکتریها و سایر ویژگیها از جمله آنتاگونیستهای آنها اشارهای کوتاه خواهد شد.
Quorum sensing در سودوموناس آئروژینوزا
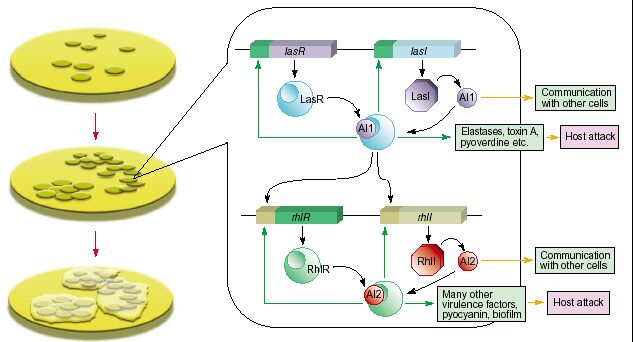
سودوموناس آئروژینوزا، باسیل گرم منفی است که بدلیل مقاومت بالا به آنتیبیوتیکها و تشکیل بیوفیلم، پراکندگی زیادی در طبیعت داشته و سبب عفونتهای بیمارستانی شدید در افراد بستری در بیمارستان میگردد. مطالعات نشان میدهد در این باکتری که یک پاتوژن فرصتطلب می باشد بیش از 600 ژن تحت کنترل Q.S قرار دارد. همچنین Q.S در تشکیل بیوفیلم و ایجاد مقاومت داروئی بالا در این باکتری نقش اساسی دارد؛ حال اگر با کمک Q.S و آنتاگونیستهای آن، از تشکیل بیوفیلم ممانعت شود ممکن است حالت عفونت مزمن و مقاومت دارویی بالا در این باکتری حل گردد. آئروژینوزا دارای دو سیستم Q.S بنامهای RhlR/I و LasR/Iمیباشد؛ سیستم LasR/I، رگولون rhl ژنهای بیماریزائی toxA،apr ، lasA و lasB را کنترل میکند و سیستم RhlR/I، تولید (قدرت شکستنIL-2 را دارد) را کنترل مینماید، همچنین این باکتری با کمک این دو سیستم، قدرت بقا و تکثیر در داخل سلول را پیدا میکند (شکل 1).
خودالقاها در سودومــــــــــــــــــــوناس آئروژینوزا شامل دو مولکول N-3-اکسودودیکانوئیل HSL (3-oxo-C12-HSL) و n بوتانوئیل-(C4-HSL) HSL میباشند که تفاوت آنها فقط در طول زنجیر جانبی و داشتن یک مولکول اکسیژن است. تولید این خودالقاها در انتهای مرحله لگاریتمی وقتی تعداد سلولها بالا میرود افزایش مییابد و باعث میشوند که ژنهای بیماریزا مانند اگزوتوکسین A، پروتئاز، همولیزین، الاستاز و غیره تولید گردند.
در سیستم LasR/I، مولکول 3-oxo-C12-HSL بهعنوان proI به LasR چسبیده و بیان ژنهای asA (پروتئاز)، apr (الکالین پروتئاز A)، lasB (الاستاز) و toxA (اگزوتوکسین A) را فعال میکند. در سیستم دیگر RhlR/I، مولکول (C4-HSL) بهعنوان (proI)AI به LasR چسبیده و رونویسی اپرون رامنوزیل ترانسفراز و فاکتور سیگما برای مرحله سکون را کد میکند. بدلیل اینکه LasR فعالکننده رونویسی در حضور خودالقای باکتری سودوموناس بنام PAI است و این PAI مانع اتصال C4-HSL به RhlR میگردد، لذا ابتدا سیستم LasR/I فعال شده و تولید ژنهای بیماریزایی را سبب میشود (در مرحله لگاریتمی) و در ادامه وقتی مقدار C4-HSL بالا رفت سیستم RhlR/I فعال شده و باکتری وارد مرحله سکون میگردد. در این مرحله بدلیل کمبود مواد غذایی و افزایش تنش به باکتری، پیام پاسخ به تنش ppGpp در باکتری تولید میشود که این پیام سبب رفتن باکتری در این مرحله و فعال شدن QS (سیستم Rhl) میگردد.
شکل (1): نحوه فعالیت Quorum sensing در سودوموناس آئروژینوزا
Quorum sensing در استافیلوکوکوس اورئوس
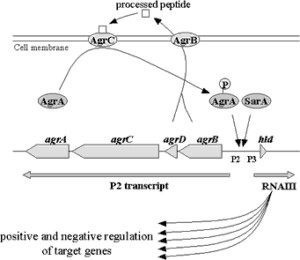
پروتئینهای سطحی (پروتئین A و ادهسینها) استافیلوکوک طلائی طی مرحله رشد تصاعدی و پروتئینهای ترشحی مانند سموم، طی مرحله استراحت تولید میگردند. این پروتئینها که در مراحل مختلف رشد باکتری تولید میشوند توسط Q.S کنترل شده و ممکن است مرحله ابتدایی و انتشار عفونت به بافتهای مجاور را نشان دهند. ژن تنظیمکننده عمومی فرعی agr دارای دو اپرون مهم بوده که یکی از این اپرونها یک مولکول RNA منحصربهفرد بنام RNAIII را کد کرده که باعث افزایش بیان پروتئینهای ترشحی و کاهش بیان پروتئینهای سطحی میگردد. در جهت مقابل RNAIII، یک ناحیه پیشبرنده مسئول بیان RNAII از یک اپرون چهار ژنی بنامagr BDCA وجود دارد که این ژنها برای بیان بهینه RNAIII ضروری میباشند. ژنهای agrD و agrB نوعی پپتید علامتدهنده کوچک (Q.S) یا فرمون (اکتاپپتیدی حلقوی تیولاکتون) را کد میکنند که تولید این مولکول وابسته به تراکم سلولی بوده و بیان ژن RNAIII و RNAII را کنترل مینماید.
شکل (2): نحوه فعالیت Quorum sensing در استافیلوکوکوس اورئوس
همانطورکه در بالا اشاره شد، ژن agr کنترلکننده بیان چند عامل بیماریزا مانند اگزوتوکسین، پروتئاز و کپسول پلیتیپ 5 است و این اعمال را با تولید مولکول اکتاپپتیدی انجام میدهد که با اتصال به ProR (agrC) سبب فعال شدن خاصیت اتوفسفریلاسیون agrC شده و agrC فسفریلهشده سبب فسفریله agrA شده و درنهایت agrA فسفریله هم روی بیان ژنهای agrBDCA و RNAIIIمؤثر است. وقتی تعداد سلول کم باشد هم RNAII و هم فرمون کم تولید میشود. با افزایش تعداد سلولها، تراکم agrD (فرمون) افزایش مییابد و باعث ادامه فعالیت و بیان ژنهای بیماریزا میگردد.
Quorum sensing و سیستم ایمنی بدن
یکی از نقشهای مهم Q.S این است که میکروبها از محیط اطراف خود آگاهی مییابند و میتوانند در آن بقا یابند، از اینرو وقتی میکروبها به داخل بدن وارد میشوند، Q.S در فرار از سیستم ایمنی بدن نقش دارد. در تحقیقات بهعملآمده در خصوص نقش Q.S در فرار از سیستم ایمنی بدن، مشخص شد که خودالقاها مانع عملکرد سیستم ایمنی میزبان میشوند. در مطالعهای که در موش انجام شد مشخص گردید که با افزایش تعداد باکتریها و تولید مقدار زیادی AHL، میزان تولید TNF از منوسیتها و تکثیر لنفوسیتها در حضور کانکاوالین (ConA)A کاهش مییابد و از این طریق سیستم ایمنی کنترل میگردد، همچنین مشخص شد که کاهش میزان TNF، رابطه عکس با افزایش میزان AHL دارد.
سنتز اسیل هموسرین بهعنوان یک خودالقای مهم
در باکتری ویبریو فیشری نشان داده شده است که محصول ژن LuxI (N اسیل هموسرین لاکتون سنتتاز) برای سنتز AHL ضروری است. این آنزیم از راه بیوسنتز اسیدهای چرب با استفاده از SAM (S آدنوزیل میتونین) بهعنوان تنها منبع اسیدآمینه و هگزونیل ACP (Acy1 carrier protein) بهعنوان منبع اسید چرب، اسیل هموسرین لاکتون را میسازد. بعضی از باکتریهای باسیلی شکل متحرک موجود در خاک مانند Variovorax paradoxus قادرند با تولید AHL اسیلاز، اسیل هموسرین لاکتون را تجزیه نموده و از آن بهعنوان منبع انرژی و ازت استفاده کنند.
تجزیه مولکولهای Q.S
مطالعات نشان میدهد که پروکاریوتها و یوکاریوتهای بزرگ (بهخصوص پستانداران) با تولید آنزیم هادی، قدرت تجزیه مولکولهای Q.S رادارند، لذا میتوانند با کمک این آنزیمها، بیماریزایی میکروبها را مهار نمایند. در باکتریهایی همچون باسیلوسها، اکروموباکتریوم توموفاسینس، گونه آرتروباکتر، کلبسیلا پنومونیه، سودوموناس آئروژینوزا، گونه رازتونیا، و راریووراکس پارادوکسوس آنزیمهای تخریبکننده AHL تولید میشود. آنزیمهای تولیدشده توسط این باکتریها در هر شاخه با همدیگر تا 40% تشابه داشته و تفاوت آنزیمها در باکتریهای متفاوت بدلیل جابجایی ترکیبات در مولکولهای آنها میباشد. آنزیمهای تجزیهکننده AHL شامل 4 نوع متفاوت میباشند که هرکدام از آنها منطقهای از این مولکول را برش داده و باعث غیرفعال شدن آن میشوند، مثلاً آنزیمهای لاکتوناز و دیکربوکسیلاز حلقه لاکتون را در منطقه 2 میشکنند، ولی آنزیمهای اسیلاز و دیآمیناز، زنجیره جانبی را از حلقه لاکتون در مکانهای مختلف جدا میکنند.
یکی از آنزیمهایی که در باکتریها مختلف موردمطالعه قرار گرفته است AHL– لاکتوناز میباشد که این آنزیم خاصیت Quorum-Quenching داشته و توسط ژنهای aiiA یا attM کد میشود. ژن aiiA در باسیلوس سرئوس سویه uw85 کد شده و باعث میشود که Q.S در باکتری کروموباکتریم ویولاسئوم مهار شود. لازم بذکر است آنزیمهای تولیدشده توسط این ژن در باسیلوسهای متفاوت با همدیگر تا 90% تشابه دارند.
ژن attM در اکروموباکتریم توموفاسینس، کلبسیلا پنومونیه و آرترباکتریها، آنزیمهای لاکتوناز را کد میکند که در توالی پپتیدی آنها حدود 58-30 درصد تشابه وجود دارد و همه آنها موتیف روی حاوی HXDH-H-D را که برای فعالیت AHL لاکتوناز لازم است، دارند. این آنزیم باعث میشوند که AHL به آلفاکتوبوتیرات و درنهایت به پروپیونات تجزیه شود. در یوکاریوتها هم آنزیمهای تخریبکننده AHL یافت شده است؛ مثلاً در خوک یک نوع اسیلاز تولید میشود که مولکولهای خودالقاء مانند C8-HSL و C4-HSL را به L هموسرین تبدیل میکند. همچنین این آنزیم سبب تجزیه AHL میشود. مشابه این آنزیم در موش، خرگوش و ماهی هم یافت شده است.
در انسان توسط سلولهای اپیتلیال راههای هوائی آنزیمهایی تولید میشود که 3-o-C12-HSL ,C6-HSL (اما نه C4-HSL) را تجزیه میکنند و بعضی از محققان عقیده دارند که این عمل ناشی از تولید آنزیم پاراکسیژناز (توسط ژن PoN کد میشوند) میباشد. لازم به توضیح است که در بدن انسان بیش از 30 نوع از این آنزیم تولید میشود که در فعالیتهای سمزدائی و متابولیسم داروهای عوامل عصبی دخالت دارند. مطالعات نشان داده است که در بین این تعداد آنزیمها تنها PoN3 و PoN1 حلقه لاکتون را میشکنند.
آنتاگونیستهای Q.S
امروزه برای کنترل بیماریزایی باکتریهای مختلف، راههای متفاوتی را در نظر میگیرند؛ یکی از این راهها کنترل Q.S در میکروبها است، بدین منظور محققان از آنتاگونیستهای طبیعی و مصنوعی مختلفی جهت کنترل Q.S استفاده کردهاند؛ یکی از آنتاگونیستهای طبیعی خودالقا، فورانوز هالوژنه است که توسط نوعی جلبک دریائی بنام Delissea pulchra تولید شده و برای جلوگیری از استقرار باکتری مورداستفاده قرار گرفته است. این ترکیب طبیعی مانع واکنش SwrR-C-HSL (سراشیا لیکوفاسینس) شده و بازدارنده واکنــــــــــــــــــــــشهای LuxR-3-Oxo-C6– HSL و CarR-3-oxo-C6– HSL در اروینیا کارتوورا و ویبریو فیشری میباشد، ولی بر روی LasR-oxo- C12– HSL سودوموناس آئروژینوزا کمتر مؤثر است. بعضی از آنتاگونیستهای مصنوعی که ناشی از تغییر در (3-Oxo- C12-D10) طول زنجیر اسیدهای چرب و حلقه فورانوز میباشند میتوانند مانع تشکیل بیوفیلم در سودوموناس آئروژینوزا شده و تعدادی عوامل بیماریزای آن را کاهش دهند. این آنتاگونیستها احتمالاً با جلوگیری از دایمر شدن LasR که برای رونویسی ضروری است مانع از نسخهبرداری و فعال شدن عوامل بیماریزا میشوند.
نتیجهگیری
Quorum sensing، روشی است که باکتریها از طریق آن با یکدیگر ارتباط برقرار میکنند و از این طریق میتوانند با سرعتی هماهنگ الگوهای بیان ژنومی خود را در برابر عوامل محیطی تغییر دهند. Quorum sensing در تمام باکتریها وابسته به تراکم سلولی بوده و در باکتریهای گرم منفی، مولکولهای مختلفی ازجمله AHL و در باکتریهای گرم مثبت پپتیدهای کوچک بنام فرمون نقش دارند. این مولکولها باعث میشوند که باکتری بفهمد که رشد کند یا رشد نکند و یا سم تولید نماید یا تولید نکند. استافیلوکوکوس اورئوس در حالت سکون و عامل و یا در حالت رشد لگاریتمی توکسین تولید میکند و مایکوباکتریوم توبرکلوزیس در مرحله رشد لگاریتمی مهاجم است که به نظر میرسد در تنظیم این مراحل،Q.S نقش مهمی دارد، همچنین مطالعات نشان میدهد که Q.S، با دخالت در استقرار و تولید بیوفیلم، تهاجم و تولید سم ارگانیسم را افزایش میدهد. تحقیقات نشان میدهد که پروکاریوتها و یوکاریوتهای بزرگ (بهخصوص پستانداران) با تولید آنزیمهایی، قدرت تجزیه مولکولهای Q.S را دارند، لذا امروزه با تولید آنتاگونیستها و آگونیستها بدنبال کاهش بیماریزایی بسیاری از عوامل عفونی مانند سودوموناس آئروژینوزا، ویبریو کلرا و استافیلوکوکوس اورئوس هستند، همچنین امروزه با کمک بازدارندههای Q.S، داروهای ضدباکتریال تولید کردهاند که در کنترل عفونتها در پزشکی، کشاورزی و صنعتی کاربرد دارند.
منابع:
- Wu H, Song Z, Givskov M, Doring G, Worlitzsh D and et.al: Pseudomonas aeruginosa mutations in lasI and rhlI quorum sensing systems result in milder chronic lung infection. Microbiol 2001, 147:1105-1113
- Rumbaugh KP, Griswold JA, Iglewski BH, Hamood AN:Contribution of quorum sensing to the virulence of Pseudomonas aeruginosa in burn wound infections. Infect Immun 1999, 67:5854-5862.
- Gov Y, Borovok I, Korem M, Singh VK, Jayaswal RK, Wilkinson BJ, et al. Quorum sensing in Staphylococci is regulated via phosphorylation of three conserved histidine residues. J Biol Chem 2004;279:14665–72.
- Yang G, Cheng HC, Liu C, Xue YN, Gao YP, Liu NL, et al. Inhibition of Staphylococcus aureus pathogensis in vitro and in vivo by RAP binding peptides. Peptides 2003;24:1823–8.
- Balaban N, Singh B, Goldkorn RT, Rasooly A, Rorres JV, Uziel O. Activation and inhibition of the Staphylococcal agr system. Science 2000;287:391a.
- More MI, Finger DL, Stryker JL, Fuqua C, Eberhard A, Winans SC: Enzymatic synthesis of a quorum-sensing autoinducer through use of defined substrates. Science 1996, 272:1655-1658.
- Hiroaki Suga_y and Kristina M Smithy. Molecular mechanisms of bacterial quorum sensing as a new drug target. Current Opinion in Chemical Biology 2003, 7:586–591.
- Yi-Hu Dong1 and Lian-Hui Zhang. Quorum Sensing and Quorum-Quenching Enzymes. The Journal of Microbiology,2005,43(5):101-109.
- Saghi H, Moradi F, Mohseni R, Abadi AH, Ataee RA, et al. Quorum Sensing in Bacterial Pathogenesis. Glob J Infect Dis Clin Res.2015;1(1): 004-009.
نقش Quorum sensing در باکتریها (قسمت اول)
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام