تولید آنتیبادی با استفاده از گیاهان (Plantibody)
آرزو گوهری شبگاه
دانشجوی دکترای ایمونولوژی
چکیده
از گذشته همواره استفاده از گیاهان بهعنوان یک منبع دارویی موردتوجه بوده است. باگذشت زمان استفاده از گیاهان بهعنوان یک منبع دارویی به سمت استفاده آنها بهعنوان یک میزبان برای تولید انواع واکسنها و عوامل درمانی مانند مونوکلونال آنتیبادیها سوق پیدا کرده است. فاکتورهایی مانند هزینهی کم، ایمنی در کار، توانایی تولید انبوه و انعطافپذیری در سایز محصولات محققان را برای استفادهی بیشتر از گیاهان راغبتر کرد. در این مقاله مروری مراحل تولید آنتیبادیهای مونوکلونال توسط گیاهان توضیح داده میشود و در آخر روشهای انسانی کردن قند بهکاررفته در این آنتیبادیها بیان میشود.
یکی از هدایای گرانبهای طبیعت به ما گیاهان هستند که سالهاست توسط انسانها کشت داده میشوند. گیاهان نه تنها بهعنوان منبع غذایی مورداستفاده قرار میگیرند، بلکه در پزشکی نیز دارای کاربرد هستند. اگرچه اسناد معتبر منتشر شده در مورد استفادههای پزشکی از گیاهان به 5000 سال قبل، زمان سومریها برمیگردد، اما استفاده از گیاهان یا بخشی از بدنهی آنها بهعنوان داروهای محلی به سالها قبل از این تاریخ برمیگردد.
امروزه در حدود یکچهارم داروهای تجویزی دارای منشأ گیاهی هستند [1].
به استفاده از گیاهان ترانسژنیک برای تولید محصولات پروتئینی باارزش درمانی میگویند. Biopharming بهعنوان molecular farmming نیز شناخته میشود.
نقاط عطف در مسیر تحقیقات در زمینهی Biopharming
در سال 1986 اولین پروتئین درمانی نوترکیب (هورمون رشد) از گیاه تنباکو و گل آفتابگردان ترانسژنیک شده بدست آمد.
در سال 1989 اولین آنتیبادی نوترکیب (IgG) از گیاه تنباکوی ترانسژنیک شده بدست آمد.
در سال 1990 اولین پروتئین انسانی بکر (Alb) از گیاه تنباکو و سیبزمینی ترانسژنیک شده بدست آمد.
در سال 1992 اولین واکسن نوترکیب (HBS Ag) با استفاده از گیاه تنباکوی ترانسژنیک شده بدست آمد.
در سال 1992 اولین آنزیم بهصورت صنعتی (آلفا آمیلاز) با استفاده از گیاه تنباکوی ترانسژنیک شده بدست آمد.
در سال 1995 آنتیبادی IgA ترشحی با استفاده از گیاه تنباکوی ترانسژنیک شده بدست آمد.
در سال 1996 پروتئین پلیمر الاستین با استفاده از گیاه ترانسژنیک شده بدست آمد.
در سال 1997 تولید تجاری آویدین با استفاده از گیاه ذرت ترانسژنیک شده بدست آمد.
در سال 2000 هورمون رشد انسانی در کلروپلاست تنباکو تولید شد.
در سال 2003 بیان و سرهمبندی آنتیبادی دارای عملکرد در جلبک ترانسژنیک شده مورد بررسی قرار گرفت.
در سال 2003 تریپسین گاوی در ذرت ترانسژنیک شده تولید شد.
در سال 2006 اولین گیاه ترانسژنیک شده بهصورت تجاری برای تولید آنتیبادی تولید شد.
در سال 2006 واکسن گیاهی که مورد تأیید USDA (United States Department of Agriculture) بود بهصورت تجاری ساخته شد.
این روند پیشرفت همچنان ادامه یافت تا محققان توانستند انواع مختلفی از پروتئینها را توسط گیاهان تولید کنند [2].
چرا از گیاهان بهعنوان میزبان برای تولید این محصولات استفاده میکنیم؟
- مطرح نبودن مسائل اخلاقی
- انتقال راحت محصولات به شکل دانه
- Folding & modification صحیح پروتئینها توسط شبکهی اندوپلاسمی گیاهان
- توانایی بیان دو ترانس ژن توسط آمیزش جنسی در گیاهان
- عدم آلودگی با عوامل میکروبی، توکسین ها و…
- انعطافپذیری در سایز محصولات (سایز ژن انتقالی میتواند بسیار بزرگ باشد)
- تولید محصولاتی با حجم بالا
- ذخیرهسازی محصولات در دمای محیط
- هزینهی کم تولید [3]
انواع محصولات تولید توسط گیاهان ترانسژنیک شده
- آنتیبادیها
- واکسنها
- سایتوکاینها، هورمون رشد و فاکتورهای رشد
- آنزیمهای درمانی مثل human glucocerebrosidase enzyme
- دیگر پروتئینهای درمانی[4]
به آنتیبادی ها و یا قطعات آنتیبادی که توسط گیاهان ترانسژنیک شده تولید میشوند، plantibody میگویند. گیاهان بهصورت طبیعی آنتیبادی تولید نمیکنند، اما در صورت تراریخت شدن و دریافت ژن آنتیبادی قابلیت تولید آن را پیدا میکنند که این آنتیبادی تولیدشده مانند آنتیبادی طبیعی تولیدشده در بدن جانوران عمل میکند. بعد از تولید اولین آنتیبادی نوترکیب توسط گیاه تنباکو در ســــال 1986، plantibodyها موردتوجه بسیاری از دانشمندان قرار گرفتند.
امروزه آنتیبادیها بزرگترین گروه پروتئینی موردتوجه توسط محققان برای تولید در گیاهان ترانسژنیک میباشند. گیاهان بهعنوان یک کارخانهی تولید آنتیبادی عمل میکنند [4]. تصویر شمارهی 1 انواع قطعات آنتیبادی تولیدشده توسط گیاهان را نشان میدهد. جدول شمارهی 1 نیز انواع آنتیبادیهای تولیدشده توسط گیاهان ترانسژنیک را نشان میدهد.
شکل 1: انواع قطعات آنتیبادی که توسط گیاهان ترانسژنیک شده تولید میشوند
جدول 1: انواع آنتیبادیهای تولیدشده توسط گیاهان
تولید واکسن توسط گیاهان ترانسژنیک شده
گیاهان بهعنوان یک هدف جذاب برای تولید واکسنهای نوترکیب موردتوجه قرار گرفتهاند. یکی از ویژگیهای منحصربهفرد گیاهان بهعنوان میزبانی برای تولید واکسن این است که کل گیاه حاوی واکسن تولیدشده قابلیت مصرف خوراکی داشته، در نتیجه هزینههای مرتبط با جداسازی و تخلیص کاهش پیدا میکند. واکسنهای تولیدی توسط گیاهان از لحاظ آلودگی با عوامل میکروبی بسیار امنتر از واکسنهای تولیدشدهی دیگر هستند .[5]
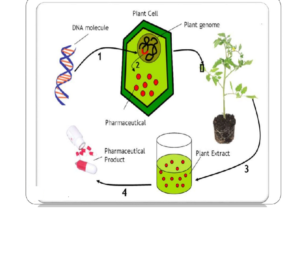
شکل 2: روند کلی تولید محصولات پروتئینی با استفاده از گیاهان ترانسژنیک شده
استراتژی کلی در تولید گیاهان ترانسژنیک
روند کلی تولید گیاهان ترانسژنیک ابتدا ساخت CDNA از ژن زنجیرهی سنگین و سبک آنتیبادی مونوکلونال است که در ادامه با روشهای مختلفی که در ادامه توضیح داده خواهد شد این ژن به مجموعهی ژنوم گیاه اضافه میشود و نهایتاً برحسب اینکه کل گیاه یا بخشی از بافت گیاه ترانس ژن را دریافت کردهاند تولید محصول را خواهیم داشت. محصول تولیدشده با استفاده از روشهای مختلف تخلیص میگردد و نهایتاً به شکل دارو وارد بازار میگردد. شکل 2 بهصورت شماتیک این روند را نشان میدهد.
ترانسژنیک کردن گیاهان در مورد تولید آنتیبادی
در مورد انتقال ژن آنتیبادی به گیاهان دو رویکرد کلی وجود دارد؛ در رویکرد اول میتوان هر دو ژن زنجیرهی سبک و سنگین را در دو وکتور جداگانه قرار داد و نهایتاً هر دو وکتور را وارد سلول گیاه کرد. گیاه در یکزمان میتواند هر دو وکتور را بیان کند و آنتیبادی موردنظر تولید گردد، اما مشکلی که این رویکرد دارد این است که در انتقال همزمان دو وکتور احتمال بیان کم یکی از وکتورها وجود دارد. حتی ممکن است در حین انتقال یکی از دو ژن در وکتورها خاموش شود و دیگر بیان نگردد.
رویکرد دوم انتقال هرکدام از ژنها به یک گیاه مجزا میباشد. در این صورت هر گیاه یک زنجیره را تولید میکند؛ که در مرحلهی بعد با القای تولیدمثل جنسی این دو گیاه، میتوانیم نسل بعدی این گیاهان را داشته باشیم که قادر به تولید هر دو زنجیره در خود میباشد. از قابلیت تولیدمثل جنسی میتوان در تحقق اهداف دیگری نیز استفاده کرد؛ به این صورت که گیاه نسل دوم که هر دو زنجیره آنتیبادی را تولید میکند را میتوان با گیاه ترانسژن شده که قابلیت تولید زنجیرهی SC در آنتیبادی IgA را دارد لقاح داد که در این صورت IgA ترشحی تولید میگردد.
انتخاب گونهی گیاهی بهعنوان میزبانی مناسب
گزینههای متعددی برای انتخاب یک گیاه یا بافت خاصی از یک گیاه برای تولید پروتئین نوترکیب وجود دارد. اگرچه تنباکو و یونجه به دلیل چرخهی زندگی کوتاهمدت و همچنین به دلیل تولید دانه گزینه خوبی بهحساب میآیند اما محصولات زراعی دیگر مانند ذرت، سیبزمینی، سویا، برنج و گندم نیز برای تولید محصولات نوترکیب موردتوجه هستند. گیاهان دانهدار و غدهدار نسبت به گیاهان برگدار دارای ارجحیت هستند زیرا محصولات نوترکیب را میتوان زمان طولانی ذخیره کرد. پروتئین با وزن مولکولی 6000 دالتون تا 272000 دالتون قابلیت تولید در گیاهان دانهدار را دارند.
بهترین دانهها، دانهی پنبه و دانههای روغنی هستند که سیستمهای خوبی برای بیان پروتئینهای خارجی میباشند. کاهو بهعنوان میزبانی برای تولید واکسن خوراکی برای هپاتیت B مورداستفاده قرار میگیرد. انتخاب سیبزمینی بهعنوان یک گیاه ترانسژن شده گزینهی خوبی است و امروزه از سیبزمینی ترانسژنیک شده برای درمان برخی بیماریها در فاز کلینیکال ترایال استفاده میشود.
موفقترین آنتیژنهای بیانشده در سیبزمینی زیرواحد B انتروتوکسین حساس به حرارت از باکتری Ecoli است که یک پروتئین الیگومر بوده و عامل اسهال مسافرتی است. این توکسین از دو زیرواحد A و B ساخته شده است که یک زیرواحد A توسط 5 زیرواحد B احاطه میشود. زیرواحد B مسئول اتصال باکتری به سلولهای روده است و توسط آن زیرواحد A وارد سلولها شده و میزان CAMP را افزایش میدهد در نتیجه آب از روده جذب نشده و اسهال ایجاد میگردد.
از زیرواحد B بهعنوان ادجوانت در شرایط invitro استفاده میشود، همچنین میتوان از این مولکول بهعنوان یک حامل برای انتقال آنتیژنهای دیگر در راستای ایجاد پاسخ آنتیبادی در موکوس یا ایجاد تحمل سیستماتیک استفاده کرد.
یکی دیگر از آنتیژنهای بیانشده در سیبزمینی norwalk virus capsid protein میباشد.
گوجهفرنگی نیز بهعنوان میزبان و گیاهی مناسب برای تولید واکسن هاری برای اولین بار مورداستفاده قرار گرفت.
از میان تمام گیاهان و میوهها، موز دارای خصوصیات مطلوب دیگری نیز هست، ازجمله فراوانی این میوه در مناطقِ حارهای و تحت حارهای و استفاده از آن بهعنوان وعدهی غذایی. یک موز میتواند ده دوز از یک واکسن را در خود جای دهد.
علاوه بر گیاهان و میوهها برای تولید پروتئینهای نوترکیب میتوان از کشت سلولهای گیاهی نیز بهره جست. این روش دارای مزایای متعددی است ازجمله کاهش هزینهها و تولید محصول سالمتر، دستکاری ژنتیکی راحتتر سلولها، جداسازی و تخلیص راحتتر محصول نوترکیب، عدم آلودگی با پاتوژنها به دلیل شرایط کنترل شدهی کشت و عدم قرارگیری تحتتأثیر حشرهکشها و سموم گیاهی. طیف وسیعی از آنتیبادیهای مونوکلونال با استفاده از سللاینهای گیاهی حاصل از گیاه تنباکو ازجمله NT-1 و BY-2 تولید میشوند [6].
میزان بیان ژن موردنظر در سلول گیاهی
انتقال ژن به سلول گیاهی میتواند بهصورت دائمی و موقت باشد.
برای بیان کوتاهمدت ژن موردنظر در گیاه استفاده میشود. از این روش برای بررسی ساختاری نحوهی بیان ژن، برای تولید محصول در مقدار کم جهت بررسی عملکرد و صحت محصول تولیدشده، برای جلوگیری از خاموش شدن ژن، برای جلوگیری از اثرات نامطلوب بیان طولانیمدت پروتئین خارجی بیانشده در گیاه و همچنین برای تولید یک گیاه ترانسژن دائمی میتوان استفاده کرد.
برای ایجاد یک گیاه ترانسژنیک شده نیازمند به انتقال دائمی ژن به ژنوم گیاه هستیم [6].
نحوهی انتقال ژن به سلولهای گیاهی
برای بیان پروتئین دریک گیاه ابتدا ژن موردنظر باید وارد سلول گیاهی شود. دو راه اصلی انتقال ژن به سلول وجود دارد:
- انتقال فیزیکی
- انتقال بیولوژیکی
روشهای متعددی برای انتقال فیزیکی ژن وجود دارد ازجمله:
- particle gun (biolistics)
- silicon-carbide whiskers
- coated nanoparticles
- PEG (polyethylene glycol)-mediated transformation
- Liposome
- electroporation
از معایب انتقال فیزیکی ژنها میتوان به خاموش شدن ژن قبل از ورود به سلول میزبان اشاره کرد، همچنین در این روش انتقال با توجه به اختصاصیت بافتی کاهش مییابد.
روشهای بیولوژیکی مرسومی برای انتقال ژن به سلول میزبان وجود دارد که از میان آنها میتوان به دو روش زیر اشاره کرد:
- انتقال با استفاده از وکتورهای باکتریایی
- انتقال با استفاده از وکتورهای ویروسی
انتقال با استفاده از وکتورهای باکتریایی
در این روش از باکتری Agrobacterium tumefaciens برای انتقال ترانسژن به گیاه یا به بخشی از یک گیاه استفاده میشود.
این باکتری یک پاتوژن است که در خاک یافت میشود و در صورت ایجاد آسیب در گیاه وارد آن شده و باعث ایجاد بیماری گال تاجی که نوعی تومور در بخش ساقهی جوانهزدهی گیاه است، میگردد. همهی سویههای این باکتری پاتوژن نیستند و تنها آنهایی قدرت بیماریزایی دارند که حاوی پلاسمید Ti باشند. انتقال ژن T از پلاسمید به ژنوم گیاه منجر به حساس شدن گیاه به عوامل محرک رشد، سایتوکاینها میگردد درنتیجه کنترل رشد گیاه از بین میرود و تومور سرطانی در گیاه در تشکیل میشود.
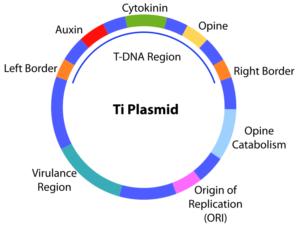
پلاسمید Ti در ساختمان خود داری بخشهای متعددی است که در بخش T DNA region ژن عامل بیماری قرار دارد و در بخش Virulence region ژنهای لازم برای انتقال ژن T به ژنوم اصلی گیاه وجود دارد. شکل 4 نمایی از پلاسمید Ti را نشان میدهد [7].
شکل 3: پلاسمید Ti
اما مشکل اصلی در انتقال ترانسژن به پلاسمید فقدان جایگاه برش توسط آنزیمهای محدودالاثر میباشد. برای حل این مشکل دو راه وجود دارد:ویژگی انتقال ژن بیماریزا توسط پلاسمید Ti محققان را بر آن داشت که از این پلاسمید برای انتقال ترانسژن مطلوب به سلولهای گیاهی استفاده کنند؛ به این صورت که اگر ترانسژن را در ناحیهی T DNA پلاسمید قرار دهند، با تولید عوامل پروتئینی کمککننده در ورود ژن انکوژن T، ترانسژن نیز به داخل ژنوم گیاه انتقال مییابد. اگر هدف بیان موقت ترانسژن باشد، محصول پروتئینی در تودههای سرطانی ایجادشده بیان میشود، اما اگر هدف بیان طولانیمدت ترانسژن باشد، باید ژن انکوژن از پلاسمید حذف شود و با ترانسژن جایگزین شود.
- روش حامل دوگانه
- روش دخول توأم
روش حامل دوگانه
این روش بر اساس مشاهداتی است که نشان میدهد اتصال فیزیکی ترانسژن به پلاسمید ضروری نمیباشد. در این صورت میتوان از یک سیستم دو پلاسمیدی استفاده کرد که ترانسژن روی یک پلاسمید کوچک قرار دارد و پلاسمید Ti بهصورت طبیعی یا حذف انکوژن است. پلاسمید حاوی ترانسژن حاوی جایگاه برش توسط آنزیمهای محدود الاثر است.
روش دخول توأم
در این روش از یک پلاسمید کوچک دیگر استفاده میشود که حاوی بخشی از T DNA است، اگر این پلاسمید همراه با پلاسمید Ti وارد باکتری شود نوترکیبی بین دو قطعهی TDNA میتواند منجر به ورود ترانسژن به پلاسمید Ti شود [7].
انتقال با استفاده از وکتورهای ویروسی
استفاده از ویروس بهعنوان حامل ترانسژن رویکردی دیگر در ترانسژنیک کردن گیاهان است. ویروس میتواند اغلب سلولها در گیاه را آلوده کند و RNA ویروسی قابلیت تکثیر و تولید پروتئین در سیتوپلاسم سلول بدون دخول در ژنوم گیاه را دارد، ازاینرو میتواند میزان زیادی محصول در مدتزمان کوتاهی برای ما تولید کند. وکتورهای ویروسی متعددی وجود دارد ولی شایعترین آنها شامل موارد زیر است:
Tobacco mosaic virus (TMV)
Cow pea mosaic virus (CPMV)
Tomato bushy stunt virus (TBSV)
دو روش برای استفاده از ویروس بهعنوان وکتور وجود دارد:
- Independent-virus vectors
- Minimal-virus vectors
Independent-virus vectors
در این روش از یک ویروس مستقل برای انتقال ترانسژن به میزبان استفاده میشود. ویروس بهصورت یک ذرهی کامل ویروسی یا بهتنهایی بهصورت ژنوم کامل به سلول میزبان منتقل میشود. (وکتور حاوی ترانسژن مطلوب ما است). پس از ورود وکتور به سلول میزبان این وکتور وارد ژنوم میزبان میشود و در کنار آن ترانسژن نیز وارد ژنوم میزبان میگردد. سلول به سنتز پروتئینهای خود و وکتور و ترانسژن میپردازد. در این حین پس از سنتز پروتئینها ویروس مجدداً خود را سرهمبندی میکند و وارد سلول دیگری میگردد. این امر منجر به آلوده شدن تمام سلولهای گیاهی با ترانسژن و وکتور میگردد. وکتورهای مورداستفاده در این روش از ویروسهای potexviruses, tobamoviruses, comoviruses بدست میآیند.
Minimal-virus vectors
این روش پیشتر از روش استفاده از وکتور کامل ویروسی ابداع شد. در این روش از بخشی از ژنوم ویروس بهعنوان حامل ترانسژن استفاده میشود؛ به این صورت که ترانسژن در ناحیهی کدکنندهی کپسید وارد ژنوم ویروس میشود، ازاینرو پس از ورود وکتور به سلول گیاهی دیگر امکان سنتز پروتئینهای لازم برای سرهمبندی ویروس وجود ندارد و درنتیجه ویروس قابلیت انتقال از یک سلول به سلول دیگر را نخواهد داشت.
بنابراین پروتئین نوترکیب تنها در بخشی از گیاه که وکتور وارد آن شده است بیان میشود. برای انتقال وکتور ویروسی به سلول میزبان از روش Agro-infiltration به روش دخول توأم استفاده میشود. دو پلاسمید که یکی پلاسمید Ti است و دیگری پلاسمید حاوی وکتور و ترانسژن با هم نوترکیبی میکنند و پلاسمید Ti بزرگتری را تشکیل میدهند. این پلاسمید وارد باکتری میشود و باکتری با گیاه جهت آلوده کردن آن تماس پیدا میکند. وکتور های مورداستفاده در این روش از ویروسهای potexviruses, tobamoviruses بدست میآیند [8].
بهینهسازی بیان ترانسژن در سلولهای گیاهی
برای بدست آوردن مقدار قابلتوجهی محصول یا بیان اختصاصی محصول در بخش خاصی از گیاه روشهای متعددی وجود دارد.
این روشها شامل موارد زیر میباشد:
- Optimization by Codon Usage
- Optimization of Promoters
- Protein Targeting
- Post Translational Modifications
بهینهسازی با استفاده از تغییرات کدونی (Optimization by Codon Usage)
Codon Usage به مفهوم فراوانی استفاده از کدونهای ژنتیکی هممعنی ولی فرعی برای یک اسیدآمینهی خاص اشاره میکند.
علاوه بر سرعت رونویسی عواملی دیگر همچون پایداری mRNA تأثیر مهمی در میزان بیان ژن دارند. انتخاب کدونهای ژنتیکی میتواند بر سرعت ترجمه تأثیر بگذارد. کدونهای مورداستفاده برای اسیدآمینهها در گونههای مختلف جانداران با هم متفاوت هستند بهطوریکه شاید در انسان برای یک اسیدآمینه یک کدون بیشتر مورداستفاده قرار بگیرد درحالیکه برای همان اسیدآمینه در گیاه کدونی با فراوانی کمتر مورد استفاده قرار بگیرد، ازاینرو به دلیل تغییر نوع جاندار فراوانی استفاده از کدونهای ژنتیکی با هم متفاوت میشود.
به همین دلیل مشاهده میشود که در حین ترجمهی یک ترانسژن انسانی در گیاه سرعت ترجمه کاهش مییابد؛ زیرا ریبوزوم در مواجهه با یک کدون فرعی تا زمان آمدن tRNA مرتبط صبر میکند و شارژ شدن tRNA نیز بهمراتب زمانبری خود را دارد، ازاینرو از بهینهسازی با استفاده از Codon Usage استفاده میشود؛ به این صورت که کدونهای ترانسژن را طوری تغییر میدهیم که همان اسیدآمینهی اولیه را کد کنند ولی از کدونی استفاده میکنیم که در گیاه با فراوانی بیشتری استفاده میشود [4].
بهینهسازی با استفاده از تغییر در پروموتر (Optimization of Promoters)
انتخاب یک پروموتر مناسب یک فاکتور مهم در بهینهسازی میزان بیان ترانسژن است؛ زیرا یک پروموتر قوی باعث افزایش بیان ژن میشود. در انتخاب یک پروموتر در پروتئینهای مولتیمر مثل آنتیبادیها دو فاکتور باید مدنظر قرار داده شود؛ ابتدا اینکه یک پروموتر قوی برای بیان بیشتر ژن به کار گرفته شود، دوم اینکه برای هر زنجیره یک پروموتور خاص تعبیه شود بهطوریکه هر دو زنجیرهی سبک و سنگین همزمان بیان شوند.
دو نوع پروموتر بهصورت مرسوم استفاده میشود:
- constitutive promoter
- Inducible promoters
این نوع پروموتر باعث بیان مداوم ترانسژن در گیاه میشود. این نوع پروموترها با منشأ ویروسی تمایل به بیان بیشتر ترانسژن دارند اما میتوانند اثرات مخرب مانند خاموش شدن ترانسژن نیز داشته باشند. از این دسته پروموترها با منشأ ویروسی میتوان به پروموتر cauliflower mosaic virus 35S (CaMV 35S) اشاره کرد. با استفاده از Constitutive promoter بیان دائمی ترانسژن را در همه جای گیاه خواهیم داشت درنتیجه محصول بیشتری از پروتئین نوترکیب را خواهیم داشت که این خود سبب تجمع پروتئین در گیاه و ایجاد اثرات سمی میشود. میتوان با تسهیل ترشح پروتئین به خارج از سلول بر این مشکل پیروز شد.
در چند سال اخیر بیشتر از این نوع پروموترها استفاده میشود. میتوان این پروموترها را با تحریک شیمیایی یا فیزیکی از محیط خارج روشن یا خاموش کرد. محرکهای خارجی شامل نور، استرس اکسیداتیو، فاکتورهای محیطی مانند دما، نمک، شکر، الکل، استروئیدها و ایجاد زخم میباشند.
برای بیشترین کارایی در این نوع از پروموترها باید هر دو جفت پروموتر و القاکننده اختصاصیت بالایی داشته باشند، پروموتر به القاکننده حساسیت زیادی داشته باشد تا در صورت حضور آن سریع روشن و در غیاب آن خاموش شود و نهایتاً پروموتر و القاکننده نباید برای گیاه سمی باشند [6].
هدفمند کردن پروتئینها (Protein Targeting)
یکی دیگر از روشهایی که باعث افزایش بیان ترانسژن میشود هدفمند کردن پروتئین تولیدی در یک مسیر خاص ترشحی یا ذخیرهای در داخل سلول است. بعد از ترجمه، پروتئین ساخته شده جهت داشتن بهترین عملکرد دچار تغییرات ساختمانی میشود و نهایتاً با کمک چاپرونها در یکی از ارگانلهای داخل سلولی ذخیره میشود. چاپرونها از تخریب پروتئین ساخته شده جلوگیری به عمل میآورند. پروتئینهای ترشحشده به سیتوزول معمولاً ناپایدارند زیرا توسط پروتئازهای سیتوزولی تخریب میشوند. از سویی دیگر برای گلیکولیزاسیون و ایجاد پیوند دیسولفیدی که برای عملکردی شدن پروتئین سنتز شده ضروری هستند، پروتئین باید به شبکهی اندوپلاسمی و دستگاه گلژی وارد شود. با ورود به این مسیر یا پروتئین نهایتاً در دستگاه گلیکولیزه میشود و از سلول خارج میگردد یا در شبکهی اندوپلاسمی باقی مانده و ذخیره میشود.
برای ورود پروتئین به شبکهی اندوپلاسمی و دستگاه گلژی پروتئین نیازمند داشتن سیگنال پپتید است، برای مثال اگر پروتئین دارای سیگنال پپتید kdel یا hdel باشد وارد شبکهی اندوپلاسمی میشود ولی دیگر وارد دستگاه گلژی نمیشود و در همان شبکهی اندپلاسمی ذخیره میشود. در صورت عدم حضور این پپتیدهای نشانه، پروتئین وارد گلژی شده و از آنجا از سلول خارج میشود. تحقیقات نشان داده است که جایگزینی پپتید نشانه انسانی با پپتید نشانهی گیاهی یا مخمری تأثیری بر انتقال پروتئین به بخش موردنظر ندارد. اضافه کردن سیگنال پپتید به ژن SCFV باعث باقی ماندن این پروتئین در شبکهی اندوپلاسمی میشود که نهایتاً باعث افزایش ظرفیت اتصال آن به آنتیژن و دوام بیشتر آن به مدت سه ماه بدون کاهش فعالیتش میشود [9].
تغییرات پس از ترجمه (Post Translational Modifications)
برای اینکه یک پروتئین دارای عملکرد درست باشد باید تحت تأثیر اصلاحات بعد از ترجمه قرار بگیرد. یکی از این اصلاحات گلیکولیزه شدن پروتئین است. گلیکولیزاسیون در شبکهی اندوپلاسمی و دستگاه گلژی رخ میدهد. بین گلیکولیزاسیون گیاهان و انسان تفاوت وجود دارد بهطوریکه در انسان در مرحلهی گلیکولیزاسیون در دستگاه گلژی قند آلفا 1-6 فوکوز به پروتئین اضافه میشود درحالیکه در گیــاهان در این مرحله قند
بتا 1-2 زایلوز و آلفا 1-3 فوکوز به پروتئین اضافه میشود. این تغییر قند منجر به ایمونوژن شدن آنتیبادی در پستانداران میگردد. چهار تکنیک مختلف برای حل این مشکل پیشنهاد شده است که شامل موارد زیر است:
در این روش با ایجاد جهش در توالی N-گلیکولیزاسیون (Asp-X-Ser/The) که برای شروع گلیکولیزاسیون ضروریست از گلیکولیزاسیون جلوگیری به عمل میآید. این روش در صورتی قابل استفاده است که برای کار با آنتیبادی بدون قند مشکلی ایجاد نکند و قابل استفاده باشد.
افزودن سیگنال پپتید KDEL به پروتئین
از آنجایی که گلیکولیزاسیون در شبکهی اندوپلاسمی جانوران و گیاهان تا حد زیادی شبیه هم است، میتوان کاری کرد که پروتئین وارد دستگاه گلژی نشود زیرا گلیکولیزاسیون در دستگاه گلژی در جانوران و گیاهان باهم متفاوت است. بهمنظور رسیدن به این هدف سیگنال پپتید KDEL به پروتئین متصل میشود، در نتیجه دیگر پروتئین قدرت خروج از شبکهی اندوپلاسمی را ندارد و تا از دست دادن این سیگنال در شبکهی اندوپلاسمی باقی میماند. آنتیبادیهای تولیدشده با این روش به دلیل اینکه بیشتر در شبکهی اندوپلاسمی باقی میمانند قند مانوز بیشتری جذب میکنند، به همین دلیل در هنگام استفاده از این آنتیبادیها در شرایط invivoسریع پاکسازی میشوند. به همین دلیل از این نوع آنتیبادیها برای اهداف خاصی استفاده میشود طوری که برای رسیدن به آن هدف نیاز به پاکسازی سریع آنتیبادی از بدن داریم.
حذف ژن آنزیم اضافه کنندهی قند در گیاهان
Knock out xylosidtransferase and fucosyltransferase in plant
در این روش با استفاده از نوترکیبی همولوگ ژن این دو آنزیم از سیستم خارج میشوند و ترانسژن به مجموعهی ژنوم اضافه میشود.
وارد کردن ژن اضافه کنندهی قند انسانی به گیاهان
Transferring the human 1,4-galactosyltransferase
در این روش قند بهکاررفته برای آنتیبادی را انسانی میکنیم؛ برای رسیدن به این هدف آنزیم بتا 1-4 گلاکتوزیل ترانسفراز را به ژنوم گیاهی اضافه میکنیم. در این صورت قند بهکاررفته در آنتیبادی مشابه قند بهکار گرفته شده در پستانداران است.
Downstream Processing of Recombinant Protein
استفاده از سیستمهای گیاهی برای تولید پروتئینهای نوترکیب نسبت به سایر سیستمها به دلیل هزینهی کم ارجحیت دارد، ولی همواره مرحلهی آخر که مرحلهی تخلیص و جداسازی پروتئین از گیاه است در حدود نیمی از کل هزینهی پروژه را به خود اختصاص میدهد. برای استخراج پروتئین، بافت گیاهی باید تخریب شود تا پروتئین از آن خارج شود، در نهایت پروتئین باید با استفاده از تکنیکهایی از میان بقایای سلولی گیاهی جدا شود. برای تخلیص تکنیکهای مختلفی وجود دارد که چهار تکنیک زیر بیشتر مورداستفاده قرار میگیرند.
Affinity purification protocol (pro A)
در این روش از تخلیص با استفاده از کروماتوگرافی استفاده میشود که در ستون کروماتوگرافی پروتئین A کد شده است و با عبور دادن سوسپانسیون سلولی از آن آنتیبادیها به پروتئین A متصل میشوند و باقی مواد از ستون عبور میکنند، اما یک مانع در این روش اتصال قطعات سلولی به ستون کروماتوگرافی است. ازاینرو از tagهای دیگری برای تخلیص استفاده شد مثل tag هیستیدین-اینتئین؛ اما بازهم در این حالت قطعات سلولی با اتصال به ستون منجر به ایجاد تداخل در تخلیص شدند.
oleosin fusion protein production
برای حل مشکل بالا محققان این بار از گیاهان تولیدکنندهی روغن بهعنوان میزبان استفاده کردند؛ زیرا روغن میتواند در تخلیص آنتیبادی به ما کمک کند. گیاهان ترانسژنیک که پروتئین A را بیان میکنند این پروتئین A از سویی به ذرات روغن متصل میشود و از سوی دیگر به آنتیبادی تولیدی متصل میشود، درنتیجه میتوان با یک سانتریفیوژ ساده ذرات روغنی حاوی آنتیبادی را از قطعات سلولی تخلیص کرد.
در این تکنیک از وزیکولهای بزرگی که حاوی پروتئینهای ذخیرهی گیاه مانند ذرت هستند استفاده میشود. به این وزیکولها پروتئینبادی هم گفته میشود که از شبکهی اندوپلاسمی منشأ میگیرند. اگر بتوانیم کاری کنیم که پروتئین نوترکیب ما در داخل این وزیکولها تجمع پیدا کند در ادامه میتوانیم با تکنیک ZERA این وزیکولها را از گیاه جدا کنیم. تکنیک ZERA باعث میشود این پروتئینبادیهای سنگین در شبکهی اندوپلاسمی تجمع پیدا کنند و سوپر مولکولها را ایجاد کنند و در ادامه با استفاده از فرایند هموژنیزه کردن و سپس سانتریفیوژ میشود این پروتئینبادیها را از باقی قطعات سلولی جدا کرد [8].
منابع:
- De Muynck, B., C. Navarre, and M. Boutry, Production of antibodies in plants: status after twenty years. Plant biotechnology journal, 2010. 8(5): p. 529-563.
- Virdi, V. and A. Depicker, Role of plant expression systems in antibody production for passive immunization. Int J Dev Biol, 2013. 57: p. 587-593.
- Xu, J. X. Ge, and M.C. Dolan, Towards high-yield production of pharmaceutical proteins with plant cell suspension cultures. Biotechnology advances, 2011. 29(3): p. 278-299.
- Hefferon, K.L. Plant virus expression vectors set the stage as production platforms for biopharmaceutical proteins. Virology, 2012. 433(1): p. 1-6.
- Stoger, E. et al. Plantibodies: applications, advantages and bottlenecks. Current Opinion in Biotechnology, 2002. 13(2): p. 161-166.
- Matsuo, K. et al. Development of Cucumber mosaic virus as a vector modifiable for different host species to produce therapeutic proteins. Planta, 2007. 225(2): p. 277-286.
- Jain, P. et al. PLANTIBODY: AN OVERVIEW. Asian journal of Pharmacy and Life Science, 2011. 1: p. 1.
- MAJUMDAR, D.D. PLANTS AS BIOFACTORIES FOR THE PRODUCTION OF BIOPHARMACEUTICALS: A BRIEF REVIEW.
- Lai, H. et al. Monoclonal antibody produced in plants efficiently treats West Nile virus infection in mice. Proceedings of the National Academy of Sciences, 2010. 107(6): p. 2419-2424.
بررسي نظاممند اثرات بيوشيميايي و درماني گياه نسترن
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4994546/
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام