نحوه گزارش آزمایشگاهی D-dimer
(بخش اول)
اکبر درگلاله1، حسن مروتی2
1- گروه هماتولوژی و طب انتقال خون، دانشگاه علوم پزشکی ایران
2- عضو هیئت علمی مرکز تحقیقات واکسن و سرمسازی رازی
D-dimer و کووید-19
با شیوع جهانی کووید-19 و اثر این بیماری بر روی سیستم هموستاز، هر روز بر اهمیت تستهای انعقادی برای ارزیابی وضعیت بالینی بیماران مبتلا به کووید-19 و نیز پیشآگهی بیماری افزوده شد. گزارشهای اولیه از وضعیت بیماران مبتلا به کووید-19 حاکی از این واقعیت بود که اختلالات انعقادی در بین بیماران مبتلا به کووید-19 شیوع بالایی دارد. بررسیهای بعدی نشان داد که درصد بالایی از بیماران بستری مبتلا به کووید-19 دارای تستهای انعقادی غیرطبیعی هستند. این تستها شامل زمان پروترومبین (PT)، زمان ترومبوپلاستین نسبی فعال (APTT)، محصولات تخریب فیبرین (FDP)، D-dimer و فیبرینوژن است. در این بین ارتباط بین D-dimer و شدت بیماری و مرگ و میر ناشی از کووید-19 از اهمیت بالایی برخوردار گردید. مطالعات متعدد حاکی از این موضوع بود که افرادی که در زمان بستری دارای D-dimer افزایشیافته هستند، احتمال مرگ و میر و نیز بروز فرم شدید بیماری در آنها بیشتر است. در مراحـــل بعدی به سرعت میزان بررسیهای مرتبط با D-dimer افزایش یافت و گزارشهای متعددی از وضعیت انعقادی بیماران مبتلا به کووید-19 گزارش شد. این گزارشها نشاندهنده این واقعیت بود که علت مرگ حدود 30 درصد بیماران مبتلا به کووید-19 ترومبوآمبولی وریدی (VTE) بوده و بیش از 50 درصد بیماران ترومبوز عمیق وریدی (DVT) را تجربه میکنند. بررسی گزارشهای آزمایشگاهی و بالینی تستهای انعقادی نشان داد که درصد بسیار بالایی از گزارشهای مربوط به D-dimer از واحدهای گزارشدهنده نامفهوم و گاه اشتباه استــــفاده میکنند؛ مسئلهای که در گزارش تست D-dimer نیز در کشور ما هم به کرات دیده میشود. پیش از اینکه به بررسی خطاهای گزارشدهی و تفسیر تست D-dimer بپردازیم، ابتدا در مورد مکانیسم کواگولوپاتی ناشی از کووید-19 توضیح مختصری ارائه میشود و سپس توضیحات لازم جهت اصلاح گزارشدهی این تست آورده خواهد شد.
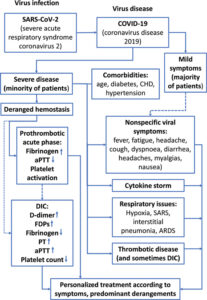
بر اساس دانشی فعلی، پس از آلودگی با ویروس SARS-CoV-2 و بروز بیماری COVID-19، علائم بیماری به دو صورت خفیف و یا شدید بروز خواهد کرد. در افراد با علائم خفیف که غالب بیماران را دربر میگیرد، ممکن است برخی از علائم غیر اختصاصی مانند تب، ضعف، سردرد و غیره بروز پیدا کنند. از سویی در بیماران مبتلا به نوع شدید بیماری که اغلب دارای ریسکفاکتورهای مانند چاقی، بیماری قلبی عروقی، دیابت و غیره هستند یافتههای آزمایشگاهی مختلفی ممکن است بروز پیدا کند که در این بین اختلال در سیستم هموستاز و بالطبع تستهای انعقادی جزء یافتههای شایع است. در مرحله نخست ممکن است با ایجاد حالت پیش ترومبوتیک و افزایش سطح فاکتورهای انعقادی که واکنشدهنده فاز حاد هستند مانند فاکتور هشت انعقادی و فیبرینوژن و حتی فاکتور پنج انعقادی (که البته جز فاکتورهای واکنشدهنده فاز حاد نیست) فرد دچار حالت پروترومبوتیک شود. در این مرحله، افزایش سطح فیبرینوژن و فاکتور هشت انعقادی اتفاق افتاده، پلاکتها فعال شده و APTT کوتاه میشود. همه این اتفاقات دال بر بروز حالت پروترومبوتیک در بیمار است. در ادامه این مرحله، فرد ممکن است انعقاد منتشر درون عروقی (DIC) را تجربه کند. با بروز DIC، افزایش سطح FDPs و D-dimer و کاهش سطح فیبرینوژن و شمارش پلاکت اتفاق میافتد. با وقوع انعقاد منتشر درون عروقی، تستهای PT و APTT طولانی میشوند (شکل 1).
شکل 1: فرضیه کنونی در مورد سیر بیماری کووید-19
در درصد کمی از بیماران که شکل شدید بیماری را تجربه میکنند، سیستم هموستاز دچار اختلال میشود. با اختلال در سیستم هموستاز و در راستای بیماری عفونی، واکنشدهندههای فاز حاد از جمله فاکتور هشت و فیبرینوژن افزایش مییابند و پلاکتها فعال میشوند. این حالت در واقع نشاندهنده بروز نوعی حالت پروترومبوتیک است که با کوتاه شدن زمان پروترومبین (PT) و زمان ترومبوپلاستین نسبی فعال (APTT) همراه است. در مرحله بعد ممکن است فرد به دنبال ایجاد حالت پروترومبوتیک یک، دچار انعقاد منتشر درون عروقی (DIC) شود که با با کاهش سطح فیبرینوژن و کاهش شمارش پلاکت و افزایش PT و APTT همراه است
ممکن است تمام این اتفاقات در اولین مراجعه بیمار و پیش از مشاهده و بروز حالت پروترومبوتیک اتفاق بیافتد، سپس بر اساس شرایط بیمار، درمان مناسب انتخاب و تجویز خواهد شد. بر اساس استانداردهای جامعه بینالمللی ترومبوز و هموستاز (ISTH)، تمام بیماران بستری مبتلا به کووید-19 باید درمان ضد انعقادی دریافت کنند. این درمان ترجیحاً هپارین با وزن ملکولی پایین (LMWH) است. هدف از تجویز هپارین تفکیکنشده یا LMWH، ممانعت از بروز رخدادهای ترومبوتیک و جلوگیری از تبدیل حالت پروترومبوتیک به وضعیت ترومبوتیک است. در این بین اندازهگیری D-dimer از جایگاه و اهمیت ویژهای برخوردار است و نحوه مدیریت بیماران دچار DIC با افراد فاقد این حالت کاملاً متفاوت است، به همیـــــــن دلیل دقت در گزارش D-dimer بسیار مهم است و میتواند درمان بیمار را شدیداً تحت تأثیر قرار دهد.
بررسیهای اولیه حاکی از این واقعیت بود که در گزارشهای علمی و بیمارستانی خطای زیادی در گزارش نتیجه این تست وجود داشت که میتوانست نتایج را تا چند هزار برابر پایین یا بالا نشان دهد. نگاهی به گزارش نتیجه تست D-dimer در آزمایشگاههای کشور نیز نشان میدهد که خطای زیادی در گزارش این تست وجود دارد. هدف از گزارش فعلی، کمک در راستای رفع این مشکل است.
D-dimers محصول تجزیه فیبرین تشکیل شده بوده و آزمایش D-dimer یک روش آزمایشگاهی رایج در آزمایشگاههای هموستاز است.
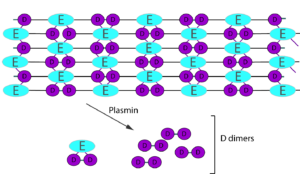
آزمایش D-dimer ممکن است در بیماران به عنوان ابزاری برای ارزیابی ترومبوآمبولی وریدی (VTE) از جمله ترومبوز عمیق وریدی (DVT) یا آمبولی ریوی (PE) درخواست شود که بهطور معمول همراه با سیستم اسکورینک (به عنوان مثال، اسکوره Well’s) برای ارزیابی و بررسی بالقوه انعقاد منتشر درون عروقی (DIC) استفاده میشود. تخریب فیبرین دارای اتصالات متقاطع توسط پلاسمین طی فرآیند فیبرینولیز باعث ایجاد قطعات مختلفی میشود که حاوی قطعات D و E هستند. یک قطعه D-dimer به دو دامین D دارای اتصال متقاطع دو منومر فیبرین مجاور هم گفته میشود که همراه آنها یک دامین E هم وجود دارد. آنتیبادیهای منوکلونال D-dimer، اختصاصی اپیتوپهایی در قطعات D-D است که در فیبرینوژن و قطعات فیبرین فاقد اتصالات متقاطع وجود ندارند. با این حال، قطعات حاصل از پروتئولیز فیبرینوژن و فیبرین توسط الاستاز و سایر آنزیمهای موجود در گردش خون میتوانند با این آزمایش بهویژه در سپسیس یا التهاب تداخل کنند. از آنجا که در سنجشهای مختلف D-dimer از آنتیبادیهای منوکلونال برای قطعات فیبرین استفاده میشود، تنوع در نتایج آزمون بین کیتهای مختلف بسیار محتمل است.
شکل 2: D-dimer حاصل تجزیه رشتههای فیبرینی دارای اتصالات متقاطع توسط پلاسمین طی فرآیند فیبرینولیز است. یک قطعه D-dimer به دو دامین D دارای اتصال متقاطع دو منومر فیبرین مجاور هم گفته میشود که همراه آنها یک دامین E هم وجود دارد
برای گزارش D-dimer میتوان از یکی از دو واحد معادل فیبرینوژن (FEU) و یا واحد D-dimer (DDU) استفاده کرد. یک واحد معادل فیبرینوژن (FEU)، جرم D-dimer را با فیبرینوژن و با استفاده از یک کالیبراتور که حاصل تخریب فیبرینوژن خالص توسط پلاسمین است مقایسه میکند. در حالی که DDU یک جرم تخمینزده شده از D-dimer با D-dimer خالص است که به عنوان کالیبراتور استفاده میشود (شکل 3).
شکل 3: یک واحد معادل فیبرینوژن (FEU)، جرم D-dimer را با فیبرینوژن و با استفاده از یک کالیبراتور که حاصل تخریب فیبرینوژن خالص توسط پلاسمین است، مقایسه میکند، در حالی که DDU یک جرم تخمینزده شده از D-dimer با D-dimer خالص است که به عنوان کالیبراتور استفاده میشود
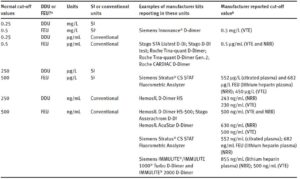
FEU تقریباً دو برابر بیشتر از DDU است. اگر پرسنل آزمایشگاه یا پزشکان از این تمایز آگاهی نداشته باشند، تفسیر نتایج میتواند نادرست باشد، به همین دلیل باید در جواب آزمایش علاوه بر عدد بهدست آمده حاصل از اندازهگیری D-dimer، گزارش تست بر اساس FEU و یا DDU نیز مشخص شود. بررسیها حاکی از این واقعیت است که 28 واحد مختلف برای گزارش نتیجه تست D-dimer استفاده میشود. با این وجود هشت شکل گزارش تست کاربرد بیشتری دارد (جدول 1).
- گزارش نتیجه تست بهصورت – mg/L (DDU)
- گزارش نتیجه تست بهصورت mg/L (FEU)
- گزارش نتیجه تست بهصورت μg/ mL (DDU)
- گزارش نتیجه تست بهصورت μg/mL (FEU)
- گزارش نتیجه تست بهصورت μg/L (DDU)
- گزارش نتیجه تست بهصورت μg/L (FEU)
- گزارش نتیجه تست بهصورت ng/mL (DDU)
- گزارش نتیجه تست بهصورت ng/mL (FEU)
جدول 1: هشت نوع گزارش رایج D-dimer و کیتهایی که از این واحدها استفاده میکنند
علاوه بر این، آزمایشگاههای مختلف از واحدهای متنوعی برای گزارش نتایج D-dimer استفاده میکنند که همین موضوع میتواند منشأ اختلاف بسیاری در درک و تفسیر نتایج این تست باشد. در واقع، آزمایشگاهها از نانوگرم در میلیلیتر، میکروگرم در میلیلیتر، میلیگرم در لیتر و میکروگرم در لیتر برای گزارش نتایج D dimer استفاده میکنند که میتواند باعث سردرگمی قابلتوجهی در بین پرسنل غیر آزمایشگاهی شود.D-dimer معمولاً برای کنار گذاشتن ترومبوآمبولی وریدی در بیماران با احتمال بالینی پایین استفاده میشود. یک آستانه یا cutoff میتواند برای کنار گذاشتن این اختلال بسیار بااهمیت باشد. کاربران D-dimer باید توجه داشته باشند که مقادیر cutoff بین روشهای مختلف و حتی بین مؤسسات مختلف قابل انتقال نیست. سنجش باید بهطور ایدهآل در مطالعات آیندهنگر تأیید شود یا حداقل با سنجشهای معتبر مقایسه گردد. دستورالعملهای کمیته استاندارد در خونشناسی انگلیس بیان میدارد که آزمایش حداقل 200 نفر باید قبل از تأیید محلی (Local) روش D-dimer انجام شود، اگرچه دستیابی به این مسئله برای همه آزمایشگاهها دشوار است.
منابع:
1COVID-19 Dashboard by the Center for Systems Science and Engineering (CSSE) at Johns Hopkins University (JHU). Available at: https://www.arcgis.com/apps/opsdashboard/index
- .html#/bda7594740fd40299423467b48e9ecf6 . Accessed September 4, 2020
- 2Favaloro EJ, Lippi G. Recommendations for minimal laboratory testing panels in patients with COVID-19: potential for prognostic monitoring. Semin Thromb Hemost 2020; 46 (03) 379-3827
- 3Gris JC, Quéré I, Pérez‐Martin A, et al. Uncertainties on the prognostic value of D‐dimers in COVID‐19 patients. J Thromb Haemost. 2020. https://doi.org/10.1111/jth.14876
- 4Schulman S. COVID-19, prothrombotic factors and venous thromboembolism. Semin Thromb Hemost 2020; 46 (07) 772-776
- 5Thachil J, Srivastava A. SARS-2 corona virus associated hemostatic lung abnormality in COVID-19: is it pulmonary thrombosis or pulmonary embolism?. Semin Thromb Hemost 2020; 46 (07) 777-780
- 6Levi M, Thachil J. COVID-19 coagulopathy: disseminated intravascular coagulation and thrombotic microangiopathy: either, neither or both. Semin Thromb Hemost 2020; 46 (07) 781-784
- 7Horowitz NA, Brenner B. Thrombosis and hemostasis issues in cancer patients with COVID-19. Semin Thromb Hemost 2020; 46 (07) 785-788
- 8Gaffney PJ, Lane DA, Kakkar VV, Brasher M. Characterisation of a soluble D dimer‐E complex in crosslinked fibrin digests. Thromb Res. 1975; 7(1): 89‐
- 9Rylatt DB, Blake AS, Cottis LE, et al. An immunoassay for human D dimer using monoclonal antibodies. Thromb Res. 1983; 31: 767‐
- 10Bikdeli B, Madhavan MV, Gupta A. et al; Global COVID-19 Thrombosis Collaborative Group. Pharmacological agents targeting thromboinflammation in COVID-19: review and implications for future research. Thromb Haemost 2020; 120 (07) 1004-1024
- 11Lindholm PF, Ramsey G, Kwaan HC. Passive immunity for COVID 19–a commentary on therapeutic aspects including convalescent plasma. Semin Thromb Hemost 2020; 46 (07) 796-803
- 12Franchini F, Del Fante C, Klersy C, Glingani C, Percivalle E, Baldanti F, Perotti C. Challenges in the production of convalescent hyperimmune plasma in the age of COVID-19. Semin Thromb Hemost 2020; 46 (07) 804-806
- 13Zadow EK, Wundersitz DWT, Hughes DL. et al. COVID-19, coagulopathy and exercise: Interactions that may influence health outcomes. Semin Thromb Hemost 2020; 46 (07) 807-814
- 14Henry BM, Vikse J, Benoit S, Favaloro EJ, Lippi G. Hyperinflammation and derangement of renin-angiotensin-aldosterone system in COVID-19: a novel hypothesis for clinically suspected hypercoagulopathy and microvascular immunothrombosis. Clin Chim Acta 2020; 507: 167-173
- 15Lippi G, Favaloro EJ. D-dimer is associated with severity of coronavirus disease 2019: a pooled analysis. Thromb Haemost 2020; 120 (05) 876-878
- 16Favaloro EJ, Thachil J. Reporting of D-dimer data in COVID-19: some confusion and potential for misinformation. Clin Chem Lab Med 2020; 58 (08) 1191-1199
- 17Thachil J, Longstaff C, Favaloro EJ, Lippi G, Urano T, Kim PY. SSC Subcommittee on Fibrinolysis of the International Society on Thrombosis and Haemostasis. The need for accurate D-dimer reporting in COVID-19: communication from the ISTH SSC on fibrinolysis. J Thromb Haemost 2020; 18 (09) 2408-2411
- 18Dorgalaleh A. Bleeding and bleeding risk in COVID-19. Semin Thromb Hemost 2020; 46 (07) 815-818
- 19Coppola A, Tagliaferri A, Rivolta GF, Quintavalle G, Franchini M. Confronting COVID-19: issues in hemophilia and congenital bleeding disorders. Semin Thromb Hemost 2020; 46 (07) 819-822
- 20Larsen JB, Pasalic L, Hvas A-M. Platelets in coronavirus disease 2019 (COVID-19). Semin Thromb Hemost 2020; 46 (07) 823-825
- 21Parra-Izquierdo I, Aslan JE. Perspectives on platelet heterogeneity and host immune response in COVID-19. Semin Thromb Hemost 2020; 46 (07) 826-830
- 22Thachil J, Lisman T. Pulmonary megakaryocytes in COVID-19–roles in thrombi and fibrosis. Semin Thromb Hemost 2020; 46 (07) 831-834
- 23de Maat S, de Mast Q, Danser AHJ, van de Veerdonk PL, Maas C. Impaired breakdown of bradykinin and its metabolites as a possible cause for pulmonary edema in COVID-19 infection. Semin Thromb Hemost 2020; 46 (07) 835-837
- 24Goodacre S, Sampson FC, Sutton AJ, et al. Variation in the diagnostic performance of D‐dimer for suspected deep vein thrombosis. QJM. 2005; 98: 513‐
- 25Kwaan HC. COVID-19: the role of fibrinolytic system from transmission to organ injury and sequelae. Semin Thromb Hemost 2020; 46 (07) 841-844
- 26Christensen B, Favaloro EJ, Lippi G, Van Cott EM. Hematology laboratory abnormalities in patients with coronavirus disease 2019 (COVID-19). Semin Thromb Hemost 2020; 46 (07) 845-849
- 27Padley GJ, Desai SS, Weaver C, Price LC, Arachchillage DJ, Ridge CA. Catheter-directed thrombolysis in a patient with severe COVID-19 pneumonia on extracorporeal membrane oxygenation. Semin Thromb Hemost 2020; 46 (07) 850-852
- 28Dorgalaleh A, Dabbagh A, Tabibian S. et al. Patients with congenital bleeding disorders appear to be less severely affected by SARS-CoV-2 — inherited hypocoagulability overcoming acquired hypercoagulability of COVID-19?. Semin Thromb Hemost 2020; 46 (07) 853-855
- 29Mattioli M, Benfaremo D, Fustini E, Gennarini S. Atypical spontaneous hematomas in a patient with severe COVID-19. Semin Thromb Hemost 2020; 46 (07) 856-858
- 30Henry BM, Benoit S, Hoehn J, Lippi G, Favaloro EJ, Benoit JL. Circulating plasminogen concentration at admission in patients with coronavirus disease 2019 (COVID-19). Semin Thromb Hemost 2020; 46 (07) 859-862
مارکرهای آزمایشگاهی COVID-19 خفیف و شدید
اختلالات خونریزیدهنده ارثی و کووید-19
گایدلاینهای موقت IFCC در مورد پایش بیوشیمیایی و هماتولوژیکال بیماران COVID-19
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام