|
بررسی میزان مقاومت آنتیبیوتیکی سویههای سودوموناس آئروژینوزا نسبت به آنتیبیوتیک کلسیتین و سایر آنتیبیوتیکها در ایران طی سالهای 2019-2012 مریم ارفع تبار*، فاطمه حسینی |
| چکیده:
مقدمه: سودوموناس آئروژینوزا یکی از شایعترین و مهمترین بیماریزاهای فرصتطلب گرم منفی است و عامل اصلی عفونت در افراد دچار سوختگی محسوب میشود. کلسیتین اغلب تنها آنتیبیوتیک مؤثر در برابر ارگانیسمهای مقاوم به چند دارو مانند سودو موناس آئروژینوزا است. مقاومت ذاتی سودوموناس آئروژینوزا نسبت به بسیاری از آنتیبیوتیکها، مشکلات درمانی مهمی ایجاد کرده است، همین امر باعث ایجاد چالشهایی در روند درمان باکتری سودوموناس آئروژینوزا شده است. مواد و روشها: این مطالعه مروری است بر 37 مطالعه که راجع به مقاومت سودوموناس آئروژینوزا به کلسیتین و سایر آنتیبیوتیکها شده است. مقاومت آنتیبیوتیکی مورد بررسی بر اساس سال انتشار و استان مورد مطالعه طبقهبندی شده است. مطالعاتی که به زبان انگلیسی بیان شده بود به زبان فارسی ترجمه شدند و در نگارش مقاله مورد استفاده قرار گرفتهاند. نتایج: در مطالعاتی که در ایران صورت گرفته است کلسیتین (3/76%) با کمترین میزان مقاومت آنتیبیوتیکی به عنوان آخرین خط دفاعی در درمان عفونتهای ناشی از سودوموناس آئروژینوزا در طی سالهای اخیر به کار برده شده است. نتیجهگیری: رشد سریع مقاومتهای آنتیبیوتیکی در باکتری سودوموناس آئروژینوزا به ویژه نسبت به آنتیبیوتیک کلسیتین دلیل بر تدوین برنامههای کنترلی و آموزشی مناسب و مبتنی بر شواهد جهت کاهش میزان شیوع عفونتهای بیمارستانی در ایران بایستی مد نظر سیاستگذاران امر قرار گیرد. واژگان کلیدی: سودوموناس آئروژینوزا، مقاومت، کلسیتین |
مقدمه:
سودوموناس آئروژینوزا یکی از شایعترین و مهمترین بیماریزاهای فرصتطلب گرم منفی است [1]. این ارگانیسم بهطور وسیع در طبیعت پراکنده بوده [2] و عامل اصلی عفونت در افراد دچار سوختگی محسوب میشود [3]. همچنین باعث عفونتهای تنفسی، ادراری، باکتریمی و سپتیسمی و پنومونی مرتبط با دستگاه ونتیلاتور در بخش مراقبتهای ویژه (ICU) است [2].
مقاومت ذاتی سودوموناس آئروژینوزا نسبت به بسیاری از آنتیبیوتیکها، مشکلات درمانی مهمی ایجاد کرده است [4]. میزان بالاي شیوع سودوموناس آئروژینوزا در نقاط مختلف جهان از جمله کشورهای هلند (68%) و تایوان (27/5%) و اتیوپی (25/7%) و کمترین مقدار از کشورهای نیوزلند (3/4%) و عربستان سعودی (6%) و آلمان (7/5%)گزارش شده است [5]. در کشور ایران شیوع سودوموناس آئروژینوزا (28/7%) گزارش گردیده است [6] که کمترین میزان شیوع در استان زاهدان (0%) و بیشترین میزان در تهران (45/8%) است [1]. بر این اساس، سازمان بهداشت جهانی (World Health Organization ,WHO) به تازگی سودوموناس آئروژینوزا را در میان بیماریزاهای با بالاترین اولویت براي توسعه آنتیبیوتیکهای جدید گروهبندی کرده است [1]. سودوموناس آئروژینوزا دارای مکانیسمهای مختلفی برای مقاومت به عوامل آنتی میکروبیال از جمله تولید بتالاکتام و وجود اینتگرونها و حضور پمپهای ترواشی (Efflux pump )در غشای خارجی باکتری و همچنین تشکیل بیوفیلم است [7].
بررسی الگوی مقاومت سودوموناس آئروژینوزا به آنتیبیوتیکهای آزمایش شده نشان میدهد که بیشترین مقاومت را نسبت به تیکارسیلین (98%)، آمیکاسین (97/2%)، جنتامایسین (95%)، ایمیپنم (95%)، سیپروفلوکساسین (94%)، پیپراسیلین (90%) و کمترین مقاومت را نسبت به کلسیتین (0%) از خود نشان میدهد [8].
کلسیتین اغلب تنها آنتیبیوتیک مؤثر در برابر ارگانیسم مقاوم به چند دارو است و فعالیت ضد باکتریایی قویای در مقابل باکتریهای گرم منفی مانند کلبسیلا، شیگلا، اسنتوباکتر بومانی و سودوموناس دارد. با توجه به اینکه اخیراً شیوع مقاومت در این آنتیبیوتیک گزارش شده است، همین امر باعث ایجاد چالشهایی در روند درمان باکتری سودوموناس آئروژینوزا گردیده [9] و [10] و از این رو به یک مشکل مهم در مراکز بالینی تبدیل شده است. امروزه با مصرف بیرویه آنتیبیوتیکها، سویههای سودوموناس آئروژینوزای دخیل در عفونتهای بیمارستانی دارای مقاومت چنددارویی به آنتیبیوتیکهای مختلف در تمام دنیا روز به روز در حال گسترش است [11].
هدف این مطالعه بررسی میزان مقاومت سودوموناس آئروژینوزا نسبت به آنتیبیوتیک کلسیتین و سایر آنتیبیوتیکهای مصرفی در درمان این پاتوژن باکتریایی در سراسر ایران طی سالهای 2012-2019 است.
مواد و روشها:
این مطالعه مروری است بر 37 مطالعه که در مورد مقاومت آنتیبیوتیکی سودوموناس آئروژینوزا نسبت به کلسیتین انجام شده است.
الف) برای جمعآوری مقالهها با استفاده از کلمات شیوع، سودوموناس آئروژینوزا، مقاومت، کلسیتین، ایران و همچنین این کلمات به زبان انگلیسی Prevalence, Pseudomonas aeruginosa, Resistant, Colsitin, Iran جستجو انجام شد.
این اطلاعات از بانکهای اطلاعاتی SID, Pup Med, Google Scholar جمعآوری شدهاند که به روش مستندات از سال 2019-2010 است.
ب) تعداد41 مقاله با جستجو در بانکهای اطلاعاتی ایران یافت شد که از این تعداد 2 مقاله به دلیل تکراری بودن نتایج بهدستآمده و 2 مقاله به دلیل اینکه مطالعه انجام شده بر روی نمونههای گیاهان و گلاب و سایر عرقیات (عرق کاسنی، نعناع و …) بود، حذف شدند و در نهایت 37 مقاله باقی ماند.
ج) اطلاعات بر اساس سال انتشار و محل مطالعه دسته بندی گردید.
ه) تمامی مقالات انتخابشده بهصورت کامل بررسی شد، همچنین مطالعاتی که به زبان انگلیسی بیان شده بودند به زبان فارسی ترجمه و در نگارش مقاله استفاده شدهاند.
نتایج:
نتایج حاصل از بررسی مقالات بهصورت خلاصه در جدول شماره 1 قرار داده شده است. (برگرفته از منابع [1, 3, 4, 8, 37-12]). در این مقالات میزان مقاومت به آنتیبیوتیک با روش دیسک دیفیــوژن و روش PCR و روش E – test بررسی شده است. لازم به ذکر است که تعداد 3 مقاله از روش PCR و یک مقاله از روش E-test استفاده کردهاند که در آنها نمونهها با روش دیسک دیفیوژن نیز بررسی شدند.
همچنين در مقالاتي كه ميزان مقاومت را در نمونههاي مختلف (نمونههای افراد مبتلا به سوختگی و افراد مبتلا به سیستیک فیبروز ) به طور جداگانه گزارش دادهاند، عدد نهايي موجود در نمودار (1) تقريبي و ميانگين آنها است.
با توجه به نمودار شماره (1) بیشترین میزان مقاومت آنتیبیوتیکی مربوط به کلسیتین در سودوموناس آئروژینوزا از بیمارستان فارابی استان تهران در سال 2017 با میزان (57/6%) و بعد از آن نیز بیمارستان سوانح سوختگی شهید مطهری استان تهران در سال 2018 با میزان (32/5%) گزارش شده است.
| جدول 1: اطلاعات بهدستآمده از مقالات بررسی شده در رابطه با میزان مقاومت سودوموناس در برابر آنتیبیوتیکها در ایران طی سالهای 2019-2012 |
با توجه به نمودار (2) این ارگانیسم بیشترین میزان مقاومت را نسبت به سفوتاکسیم با میانگین (83/8% ) و در مرتبهی بعدی نسبت به تیکارسیلین با میانگین (79/44%) نشان میدهد. این مقاومت بالا نسبت به آنتیبیوتیک سفوتاکسیم و تیکارسیلین در سودوموناس آئروژینوزا علت غیر مؤثر بودن آن در روند درمان به حساب میآید و متأسفانه استفاده وسیع از آنها منجر به افزایش مقاومت شده است.
همچنین این ارگانیسم کمترین میزان مقاومت را نسبت به کلسیتین با میانگین (3.76%) و در مرتبه بعد نسبت به پیپراسیلین تازوباکتام با میانگین (49.64%) نشان میدهد. با توجه به مستندات بهدستآمده از نمودار (2) کلسیتین با کمترین میزان مقاومت آنتیبیوتیکی به عنوان آخرین خط دفاعی در درمان عفونتهای ناشی از سودوموناس آئروژینوزا در طی سالهای اخیر به کار برده شده است [26].
مطابق دادههای جدول شماره (1) مشاهده میشود که بیشترین میزان سویههای سودوموناس جداشده مربوط به نمونههای زخم سوختگی و در مرتبه بعد مربوط به نمونههای ادرار و خون است.
نمودار 2
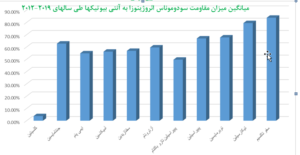
یافتههای این پژوهش نشان میدهد که بهترین برآورد از میزان مقاومتهای آنتیبیوتیکی سودوموناس آئروژینوزا در ایران طی سالهای 2012-2019 نسبت به کلسیتین با میزان (3/76%) بوده است.
در مطالعهای که توسط باقری و همکارانش صورت گرفت میزان شیوع عفونتهای بیمارستانی ناشی از باکتری سودوموناس آئروژینوزا در ایران (28/7%) گزارش شده است و با توجه به مطالعهای که توسط Babook در آمریکا صورت گرفت این میزان شیوع (25/2%) گزارش شده است [38]. بیشترین میزان شیوع عفونتهای مرتبط با سودوموناس آئروژینوزا طبق مطالعهیDinesh subedi و همکارانش از کشور هلند با میزان (68/2%) در سال 2018 گزارش شده است [5]. از طرفی تعداد ارگانیسمهای مقاوم به بسیاری از آنتیبیوتیکها در حال افزایش است.
علت عمدهی مقاومت آنتیبیوتیکی در سودوموناس آئروژینوزا حضور بتالاکتامازهای نوع Ampc است که در اواخر دههی 1970 ظاهر شده و مورد مطالعه قرار گرفتهاند. این آنزیمها، سفالوسپورینهای وسیعالطیف مانند سفتازدیم، سفتریاکسن، سفپیم و مونوباکتامهایی مانند آزترونام و سفامایسینها را هیدرولیز میکنند. این ژنهای کروموزومی قابل القا در اواخر دهه 1980 بر روی پلاسمیدها ظاهر و به باکتریهایی که فاقد این ژنها بودند متصل شدند[37]. با توجه به نمودار (2) که میانگین میزان مقاومت آنتیبیوتیکی سودوموناس آئروژینوزا طی سالهای 2012-2019 در ایران است، بیشترین میزان مقاومت به ترتیب مربوط به سفوتاکسیم (83/8%)، تیکارسیلین (79/44%)، توبرمایسین (67/75%)، پیپراسیلین (66/95%)، جنتامایسین (62/73%)، آزترو نام (59/67%)، آمیکاسین (56/20%)، سفتازیدیم (56/85%)، ایمیپنم (54/83%)، پیپراسیلین تازوباکتام (49/64%) و کلسیتین (3/76%) است.
به علت تنوع ژنتیکی سودوموناس آئروژینوزا نمیتوان نوع آنتیبیوتیکی مؤثر در درمان عفونتهای ناشی از این باکتری را بهطور قطعی در بیماران تعیین کرد، حتی الگوی مقاومت آنتیبیوتیکی برای یک پاتوژن در یک محدودهی جغرافیایی کوچک و در یک شهر هم متفاوت است، از این رو تعیین دقیق داروی مؤثر بر هر بیمار بر اساس نتایج آنتیبیوگرام آن امکانپذیر است [34].
با این حال طی مطالعاتی که صورت گرفته است همه مقالات مورد بررسی در میزان مقاومت آنتیبیوتیکی سودوموناس به کلسیتین همخوانی و اتفاق نظر یکسانی داشتند و کلسیتین را تحت عنوان حساسترین آنتیبیوتیک برای سودوموناس آئروژینوزا معرفی کردهاند. بهجز دادههای مقالاتی که توسط الف) محمود صفری و همکارانش، ب) مهسا جمشیدی گهر و همکارانش و ج) جلال مردانه و همکارانش گزارش شده است [37] و [28] و [26].
در مطالعهی محمود صفری و همکاران در سال 2017 که از نمونههای چشمی بیمارستان فارابی استان تهران انجام شد، میزان مقاومت بالایی (57/6%) نسبت به کلسیتین گزارش شده است که علت آن مربوط به نمونههای مورد بررسی این پژوهش است که فقط از نمونههای چشمی استفاده کردهاند و به دلیل افزایش استفادهی روزافزون از لنزهای تماسی پزشکی و زیبایی و در خانمها این نوع عفونت بیشتر شایع است [28].
در مطالعهی مهسا جمشیدی گهر و همکاران در سال 2018 که از نمونههای زخم سوختگی بیمارستان مطهری تهران انجام شد، میزان مقاومت بالایی (32/5%) نسبت به کلسیتین گزارش شده است و عدم وجود شباهت در نتایج بهدستآمده در این تحقیق با مطالعات دیگر را میتوان به تغییر سویه متناسب با موقعیت جغرافیایی نسبت داد؛ بهطوری که حتی در برخی موارد ممکن است گزارشهای ارائه شده از بیمارستانهای مختلف یک شهر نیز کاملاً با هم متفاوت باشند [37].
در مطالعهی جلال مردانه و همکاران در سال 2013 که در بیمارستان طالقانی استان اهواز صورت گرفت، میزان مقاومت (21/7%) گزارش شده است [35] که میتواند به دلیل متغیر زمان انجام مطالعات و همچنین عدم توسعه کمی و کیفی بهداشت در زمان مطالعه باشد.
یکی از مهمترین عوامل هتروژن در این مطالعه حجم نمونهها بوده است. یک نگاه اجمالی به تعداد نمونههای بکار گرفته شده در مطالعات منتخب، به روشنی و وضوح اختلاف بالای حجم نمونهها در مطالعات را نشان میدهد. این موضوع یک اصل است كه قدرت مطالعات با حجم بالاتر بیشتر از مطالعات با حجم كمتر است؛ بنابراین نتایج با حجم دادههای بیشتر مورد تأیید و قابل اعتمادتر نسبت به مطالعات در حجم نمونه کوچکتر هستند. این مطالعه نیز از این قضیه مستثنی نیست.
یکی دیگر از عوامل هتروژن در این پژوهش، متغیر زمان انجام مطالعات بوده است. به نظر میرسد شیوع انواع عفونتهای بیمارستانی باید در سالهای گذشته نسبت به سالهای اخیر بیشتر باشد، زیرا همانطور كه Malacarne نیز در مطالعه خود نتیجهگیری میکند، با توسعه كمی و كیفی سطح بهداشت بیمارستانها با گذشت زمان و پیشرفت فناوریها و اطلاعات بهداشتی در این زمینه انتظار میرود از وخامت این بحران كاسته شود .[38]
یکی از محدودیتهای مهم این مطالعه، عدم بررسی تأثیرات هتروژنسیتی فاكتورهایی مانند روش جمعآوری اطلاعات، سابقه عفونت، سطح تحصیلات و مدت زمان بستری بیماران به دلیل ناقص بودن مطالعات منتخب از این نظر است. متأسفانه در اكثر مطالعات مورد استفاده در این بررسی اطلاعات كاملی از این مشخصات توصیفی و دموگرافیک ذكر نگردید كه به نحوه جمعآوری اطلاعات و نگارش نویسندگان مقالات و همچنین نحوه بررسی داوران محترم مجلات برمیگردد. به نظر میرسد ترغیب و تأكید نویسندگان از سوی مجلات برای بررسی كافی و وافی اطلاعات دموگرافیک و پرداختن مناسب به جنبههای اپیدمیولوژیکی موضوع میتواند از بروز مشکلات مشابه در آینده جلوگیری به عمل آورد .[38]
تلاش برای ارتقای كیفی مراقبتهای پرستاری، آموزشهای كاربردی كادر درمانی، پایش مداوم عفونتهای بیمارستانی، تأمین امکانات موردنیاز، اجرای برنامههای كنترل عفونت، اولویتبندی بخشهای بیمارستانی برای اعمال دقیقتر موازین بهداشتی، تأكید به اقدامات پیشگیرانهای همچون شستشوی دستها و تدوین برنامههای آموزشی مناسب از طریق رسانههای جمعی از مهمترین اقداماتی هستند كه در این راستا پیشنهاد میگردند.
نتیجهگیری:
مرور سادهی مستندات مطالعه شده در این بررسی نشان میدهد که رشد سریع مقاومتهای آنتیبیوتیکی در باکتری سودوموناس آئروژینوزا به ویژه نسبت به آنتیبیوتیک کلسیتین، دلیل بر تدوین برنامههای کنترلی و آموزشی مناسب و مبتنی بر شواهد جهت کاهش میزان شیوع عفونتهای بیمارستانی در ایران است که باید مد نظر سیاستگذاران امر قرار گیرد.
تشکر و قدردانی:
با تشکر و سپاس فراوان از دانشکده علوم پزشکی دانشگاه آزاد اسلامی کاشان که ما را در این امر همراهی کردهاند.
منابع:
- 1. Derakhshan, S., et al., Prevalence rate of resistance to ciprofloxacin among clinical pseudomonas aeruginosa isolates in Kurdistan province, west of Iran. Scientific Journal of Kurdistan University of Medical Sciences, 2020. 24(6): p. 57-67.
- <بررسی پروفایل مقاومت آنتیبیوتیکی سویههای پسودوموناس آئروژینوزای جداشده از بیماران بستری. pdf>.
- 3. Izadi Pour Jahromi, S., et al., Occurrence of a Multidrug Resistant Pseudomonas aeruginosa Strains in Hospitalized Patients in Southwest of Iran: Characterization of Resistance Trends and Virulence Determinants. Jundishapur Journal of Microbiology, 2018. 11(4).
- 4. Mobaraki, S., et al., Prevalence of integrons 1, 2, 3 associated with antibiotic resistance in Pseudomonas aeruginosa isolates from Northwest of Iran. Biomedicine (Taipei), 2018. 8(1): p. 2.
- 5. Subedi, D., A.K. Vijay, and M. Willcox, Overview of mechanisms of antibiotic resistance in Pseudomonas aeruginosa: an ocular perspective. Clin Exp Optom, 2018. 101(2): p. 162-171.
- 6. <Iran J Med-v8n4p1-fa.pdf>.
- 7. <PHENOTYPIC SCREENING OF EXTENDED.pdf>.
- 8. Kashfi, M., et al., The Prevalence of Aminoglycoside-Modifying Enzyme Genes Among Pseudomonas aeruginosa Strains Isolated From Burn Patients. Archives of Clinical Infectious Diseases, 2016. 12(1).
- 9. Bialvaei, A. and H. Samadi Kafil, Colistin, mechanisms and prevalence of resistance. Curr Med Res Opin, 2015. 31(4): p. 707-21.
- 10. <IJM-8-62.pdf>.
- 11. <Tehran Uni-v76n8p517-fa.pdf>.
- 12. Aghapour, Z., et al., Molecular mechanisms related to colistin resistance in Infect Drug Resist, 2019. 12: p. 965-975.
- 13. Amirkamali, S., et al., Distribution of the bla OXA, bla VEB-1, and bla GES-1 genes and resistance patterns of ESBL-producing Pseudomonas aeruginosa isolated from hospitals in Tehran and Qazvin, Iran. Rev Soc Bras Med Trop, 2017. 50(3): p. 315-320.
- 14. Azimi, S., et al., Presence of exoY, exoS, exoU and exoT genes, antibiotic resistance and biofilm production among Pseudomonas aeruginosa isolates in Northwest Iran. GMS hygiene and infection control, 2016. 11.
- 15. Darabpour, E., et al., Antibacterial activity of different parts of Peganum harmala L. growing in Iran against multi-drug resistant bacteria. EXCLI journal, 2011. 10: p. 252.
- 16. Dogonchi, A.A., et al., Metallo-beta-lactamase-mediated resistance among clinical carbapenem-resistant Pseudomonas aeruginosa isolates in northern Iran: A potential threat to clinical therapeutics. Ci Ji Yi Xue Za Zhi, 2018. 30(2): p. 90-96.
- 17. Farajzadeh Sheikh, A., et al., Molecular epidemiology of colistin-resistant Pseudomonas aeruginosa producing NDM-1 from hospitalized patients in Iran. Iran J Basic Med Sci, 2019. 22(1): p. 38-42.
- 18. Ghamgosha, M., et al., Metallo-beta-Lactamase VIM-1, SPM-1, and IMP-1 Genes Among Clinical Pseudomonas aeruginosa Species Isolated in Zahedan, Iran. Jundishapur Journal of Microbiology, 2015. 8(4).
- 19. Goli, H.R., et al., Emergence of colistin resistant Pseudomonas aeruginosa at Tabriz hospitals, Iran. Iranian journal of microbiology, 2016. 8(1): p. 62.
- 20. Goli, H.R., et al., Role of MexAB-OprM and MexXY-OprM efflux pumps and class 1 integrons in resistance to antibiotics in burn and Intensive Care Unit isolates of Pseudomonas aeruginosa. J Infect Public Health, 2018. 11(3): p. 364-372.
- 21. Goli, H.R., et al., Contribution of mexAB-oprM and mexXY (-oprA) efflux operons in antibiotic resistance of clinical Pseudomonas aeruginosa isolates in Tabriz, Iran. Infect Genet Evol, 2016. 45: p. 75-82.
- 22. Jahromi, S.I.P., et al., Occurrence of a multidrug resistant pseudomonas aeruginosa strains in hospitalized patients in southwest of Iran: Characterization of resistance trends and virulence determinants. Jundishapur Journal of Microbiology, 2018. 11(4).
- 23. Karimzadeh, I., et al., Evaluating the resistance pattern of gram-negative bacteria during three years at the nephrology ward of a referral hospital in southwest of Iran. J Nephropathol, 2017. 6(3): p. 210-219.
- 24. Khalili, Y., et al., Characterization of carbapenem-resistant but cephalosporin-susceptible Pseudomonas aeruginosa. Acta Microbiol Immunol Hung, 2019. 66(4): p. 529-540.
- 25. Malekzadegan, Y., et al., In vitro activities of colistin, imipenem and ceftazidime against drug-resistant Pseudomonas aeruginosa and Acinetobacter baumannii isolates in the south of Iran. BMC Res Notes, 2019. 12(1): p. 301.
- 26. Mardaneh, J., K. Ahmadi, and A. Jahan Sepas, Determination antimicrobial resistance profile of Pseudomonas aeruginosa strains isolated from hospitalized patients in Taleghani Hospital (Ahvaz, Iran) from 2011-2012. Journal of Fasa University of Medical Sciences, 2013. 3(3): p. 188-193.
- 27. Roshani-Asl, P., et al., Relationship Among Antibiotic Resistance, Biofilm Formation and lasB Gene in Pseudomonas Aeruginosa Isolated from Burn Patients. Clin Lab, 2018. 64(9): p. 1477-1484.
- 28. Saffari, M., et al., Evaluation of biofilm-specific antimicrobial resistance genes in Pseudomonas aeruginosa isolates in Farabi Hospital. J Med Microbiol, 2017. 66(7): p. 905-909.
- 29. Talebi, G. and M. Hakemi-Vala, Survey on Some Carbapenems and Colistin Resistance Genes Among Pseudomonas aeruginosa Isolates from Burn and Cystic Fibrosis Patients, Tehran, Iran. Archives of Clinical Infectious Diseases, 2019. 14(5).
- 30. Vahdani, M., et al., Phenotypic screening of extended-spectrum ß-lactamase and metallo-ß-lactamase in multidrug-resistant Pseudomonas aeruginosa from infected burns. Annals of burns and fire disasters, 2012. 25(2): p. 78.
- 31. Vazin, A., et al., Evaluating Adherence of Health-Care Team to Standard Guideline of Colistin Use at Intensive Care Units of a Referral Hospital in Shiraz, Southwest of Iran. Adv Pharm Bull, 2017. 7(3): p. 391-397.
- آدابی, et al., بررسی و تعیین الگوی مقاومت آنتیبیوتیکی سویههای سودوموناس آئروژینوزای جداشده از زخم بیماران سوختگی. دانشگاه علوم پزشکی اردبیل, 2015. 15(1): p. 66-74.
- بدرالسادات, م.- ن.پ. سهراب, ژن Outer membrane protein D در ایزولههای باليني سودوموناس آئروژينوزا و نقش آن در مقاومت آنتیبیوتیکی.
- زاهدانی, ش.ش., م. جهانتیغ- ی. امینی, تعیین الگوي مقاومت آنتیبیوتیکی در ایزولههای بالینی سودوموناس آئروژینوزا. Tehran University Medical Journal, 2018. 76(8).
- زهرا, ر. and م. جلال, تعيين الگوي حساسيت آنتیبیوتیکی ایزولههای سودوموناس آئروژينوزا ایجادکننده عفونتها در بيمارستان شهيد فقيهي شيراز و شناسايي سویههای داراي ژن blaCTX.
- متقی, ب.
- مهسا, ج.گ.، ر.ف. ناهيد- ح.د. سيدرضا، تعيين الگوي مقاومت آنتیبیوتیکی جدايه هاي باليني Pseudomonas aeruginosa و رديابي ژن AmpC در آنها.
- 38. Bagheri, P. and M.r. Sepand, The Review Systematic and Meta Analysis of Prevalence and Causes of Nosocomial Infection in Iran. Iranian Journal of Medical Microbiology, 2015. 8(4): p. 1-12.
بیوفیلم باکتریایی
نقش Quorum sensing در باکتریها (2)
مکانیسمهای مقاومتهای آنتیبیوتیکی (2)
مکانیسمهای مقاومتهای آنتیبیوتیکی (1)
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام