راههای کنترل متابولیسم باکتریها
(بخش سوم)
دکتر رضا میرنژاد (دانشیار دانشگاه)، وهاب پیرانفر (کارشناس ارشد)
همانطور که در بخشهای گذشته اشاره شد، برای درک اعمال باکتریها، دینامیک و درمان عفونتهای ناشی از باکتریها، فهمیدن نحوه کنترل متابولیسم باکتریها ضروری میباشد. در این بخش به ادامه بحث نحوه کنترل متابولیسم در باکتریها با تأکید بروری شبکههای تنظیم یکنواخت در باکتریها اشاره میگردد.
شبکههای تنظيم یکنواخت:
شبكههایي كه توسط تنظیمکنندههای مشابه، کنترل ميشوند و به روش یکنواختی به تغييرات شرايط محيطي پاسخ ميدهند را شبكه تنظيم یکنواخت[1] ميگويند. حداقل چهار نوع پاسخ در يك شبكه وجود دارد:
- مهار و فعال کردن اپرونهای کاتابولیکی:
مقدار cAMP برروي فعاليت اپرونهاي كاتابوليكي مختلف اثرگذار میباشد. همانطورکه قبلاً در بخش اول بحث شد، این پروسهها در اپرون لاكتوز بهخوبی رخ میدهد.
- جایگزینی فاکتورهای سیگما[2]:
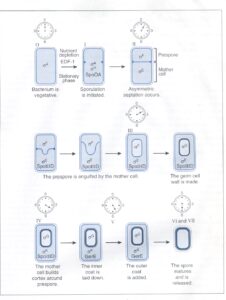
در پاسخ به تغييرات محيطي نظير از دست دادن منبع انرژي، فاكتورهای سيگمای متفاوتی با RNA پلیمراز مرحله رشد واکنش میدهند. در طی تشکیل اسپور، یک یا چندین فاكتور سيگما كه دستجات بخصوصي از اپرونها را تشخيص ميدهند، بجای یکدیگر جایگزین میشوند (شکل 1).
شكل 1: تغييرات مورفولوژي به همراه كنترل ژنتيكي اين تغييرات که در طي اسپورلاسیون رخ ميدهد، نشان داده شده است
ساعتها، زمان نهفتگی (بهصورت ساعت) در مراحل مختلف را همانگونه كه يك باسيلوس واحد بهصورت نامتقارن تقسيم ميشود و سپس بهصورت اسپور تكامل یافته و به يك سلول مادر تغيير شكل ميدهد، نشان میدهد. اعداد رومی بالاي باكتري مراحل تكامل را نشان ميدهد. داخل هر سلول، نام فاكتور سيگما و پروتئين باندكننده به DNA كه بيان ژنهاي اسپورلاسیون در هر مرحله تكامل را كنترل ميكنند، نشان داده شده است.EDF-1: فاكتور تمايز خارج سلولي. (برگرفته شده از Microbiology, T. Stuart Walker).
- تشکیل عامل Stringent :
وقتي سطح اسیدهای آمينه به ميزان خطرناكي پايين میافتد، بعضي از باکتریها جهت هماهنگ شدن با کاهش اسيدآمينه پاسخهايStringent را بیان میکنند. هنگامی که میزان اسیدآمینه کاهش مییابد، tRNAی بدون اسیدآمینه به ماشين ترجمه متصل شده و سبب تشكيل آنزيمي به نام عامل Stringentی ميشود. این عامل سبب میگردد که گوانوزين َ3– ديفسفات َ5- ديفسفات (ppGpp) در باكتري تجمع یافته و سنتز tRNA و rRNA کاهش یابد. بعلاوه، پروتئینها برای تأمین اسیدآمینه، شکسته شده و سنتز اسيدهای آمينه تحريك میشود. وقتي سطح اسيدهاي آمينه به مقدار قابل قبولي رسيد، محصول ژن spoT، معمولاً ppGpp را تخریب کرده و فعالیتهای سلول به حالت طبیعی برمیگردد.
- انتقال پیام[3]:
سيستم انتقال پیام، با فسفوريله كردن پروتئينها، در مقابل تغييرات محيطي عكسالعمل نشان ميدهد. يك مولكول حسگر تغييرات محيطي (مثل فقدان نيتروژن يا فسفات) را درک ميكند و پروتئینهای خاصی را فسفوريله مینماید. این پروتئين افكتور فسفوريله شده، نسخهبرداري از رگولون[4] خود را فعال ميكند. مثلاً ژنهايي كه در اشریشیا کلی و سالمونلا تيفيموريم سنتز تاژک را كد ميكنند، در چهار ناحيه كروموزوم قرار دارند و بهصورت يك رگولون بيان ميشوند، به همين خاطر اين ژنها بهصورت اپرون و تحت يك مجموعه از پیامها عمل ميكنند. اپرون تاژک بهصورت آبشاری بيان ميشود، يعني براي خواندن يك مجموعه از اپرون و بيان mRNA و پروتئينهاي آن، ابتدا بايد يك دسته ديگر اپرون خوانده شوند. اولين ژني كه خوانده ميشود متعلق به اپرون master (كه ژنهاي كلاس I را بيان ميكند) ميباشد.RNA پلیمراز نمیتواند این اپرون را بخواند، مگر اينكه اول هم به cAMP و هم به پروتئین باندکننده به cAMP [5] متصل شود، بنابراين مثل اپرون لاكتوز (بخش اول چاپ شده در شمارههای قبل ملاحظه شود)، سنتز تاژک هم تحت كنترل مهار كاتابوليك قرار دارد. همانطورکه در بخش انتقال گروهی رخ میدهد، وقتي گلوكز توسط سيستم فسفوترانسفراز منتقل ميشود، سطح cAMP به علت فقدان EIIA فسفوريله بسيار پايين است، بنابراين وقتي اشریشیا کلی در يك محيط حاوي گلوكز در حال رشد است، اپرون master فلاژلي خوانده نميشود و سنتز تاژک متوقف میگردد. وقتي مقادير زيادي گلوكز در دسترس است (شرايط مناسب) باكتري نميخواهد آن محوطه را ترك كند. ژنهاي در حال استراحت تاژک به صورتي خوانده ميشوند كه ژنهای early و late تاژک رونویسی ميشوند. RNA پليمراز وابسته به DNA دارای يك سابيونيت است كه سيگما نام دارد و به پليمراز امكان تشخيص سايتهاي اختصاصي (پروموتورها) را كه سنتز RNA بايد از آنجا شروع شود، ميدهد. خواندن آخرين دسته ژنهاي تاژک به توليد يك فاكتور سيگماي جديد مربوط است كه در طي بیان مجموعههای اپرون قبلي سنتز ميشود. در بخش قبل وقتی کنترل ژنتیکی اسپورلاسیون بحث شد، به اين نوع كنترل سنتز RNA بواسط فاكتورهاي متفاوت سيگما، اشاره گردید.
كنترل نسخهبرداري متابوليسم بهوسیله پروتئين تنظیمکننده فومارات– نيترات:
هنگامی که باكتريهاي بيهوازي اختياري در شرايط بيهوازي رشد ميكنند، یک تنظيمكننده نسخهبرداري به نام پروتئين تنظیمکننده فومارات- نيترات[6]، بیان ژنهای موردنیاز در طی رشد بيهوازي را كنترل ميكند. پروتئين FNR دارای پنج ریشه سيستئينی متصل به آهن و حساس به اكسيژن میباشد كه چهارتاي آنها در يك دسته قرار دارند. در غياب اكسيژن، پروتئين FNR، يك سري از آنزيمهاي اختصاصي بيهوازي را با مهار آنزیمهای موردنیاز در شرايط هوازي، فعال ميسازد.
كنترل ترجمه در سنتز پروتئين:
اگرچه سنتز پروتئين اغلب در سطح نسخهبرداري كنترل ميشود، ولی نشان داده شد كه چندین پروتئين باکتریها در سطح ترجمه كنترل میشوند. در اين مورد سه مثال زیر وجود دارد:
سنتز پروتئين ريبوزومي:
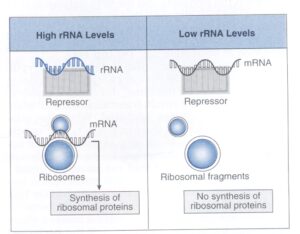
سنتز پروتئين ريبوزومي در برخی از باكتريها تحت كنترل اپرون ميباشد. هر اپرون پروتئينی را كد ميكند كه براي اپرون دیگر، مهارکننده ترجمه[7] ميباشد. همانگونه که در شکل 2 نشان داده شده، هنگامی که rRNA به مقدار زیاد موجود است، مهارکننده با اتصال به يك بخش از آن غیرفعال شده و پروتئینهای ریبوزومی سنتز میشوند. در مقابل، وقتي rRNA به مقدار خیلی کم وجود دارد، مهارکننده به بخشی از mRNA كه پروتئينهاي ريبوزومي را كد ميكند، متصل شده و مانع سنتز پروتئينهاي ريبوزومي میگردد. نكتة اصلي در این سيستم اين است كه mRNA و rRNA در اتصال به مهارکننده با یکدیگر رقابت ميكنند. اگر rRNA بر حريف خود غلبه كند، پروتئين ساخته ميشود.
شكل 2: كنترل نسخهبرداري سنتز پروتئين ريبوزومي
هنگامي که مقدار بالايي RNA ريبوزومي (rRNA) وجود دارد، مهارکننده با اتصال به يك بخش rRNA غيرفعال ميشود. در اين صورت سنتز پروتئين ريبوزومي ادامه پيدا ميكند. هنگامي كه ميزان rRNA به مقدار خيلي زياد پايين آمد، مهارکننده با اتصال به يك بخش mRNA كه پروتئينهاي ريبوزومي را كد ميكنند، مانع سنتز پروتئينهاي ريبوزومي ميشود. (برگرفته شده از Microbiology, T. Stuart Walker).
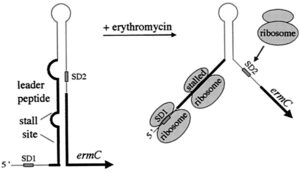
مقاومت القايي نسبت به اريترومايسين:
mRNAيي كه براي مقاومت به اريترومايسين كد ميكند، ساختمان مشابه کنترل تخفیف دهنده[8] دارد. در غیاب اريترومايسين که دليلي بر خوانده شدن ژن مقاومت (ermC) وجود ندارد، ساختمانی مشابه کنترل تخفیف دهنده در mRNA تشكيل شده و ژنهاي مقاومت به اريترومايسين ترجمه نميشوند. در حضور اريترومايسين، ريبوزوم در ناحيه راهنما متوقف شده و با تشکیل نشدن ساختمان کنترل تخفیفدهنده، mRNA ترجمه ميشود. توجه داشته باشید كه اين اثر تخفيف حدت بر روي ترجمه است، نه بر روي نسخهبرداري (شکل 3).
شکل 3: نحوه بروز مقاومت القائی به اریترمایسین
RNA آنتیسنس[9]:
باسیل رودهای اشریشیا کلی در دو محيط كاملاً متفاوت ميتواند زندگي كند. هنگامی که این باکتری در مجاري گوارشي با دماي 37 درجه سلسیوس و اسمولاريته خیلی بالا قرار میگیرد، ترجيحاً OmpC (پورين کوچکتر) را میسازد. به نظر میرسد که OmpC، علاوه بر حفظ باکتری از اثرات سمي نمكهاي صفراوي درون بدن، به مواد غذائی اجازه ورود به باکتری را میدهد. وقتی كه اشریشیا کلی در آبی با دما و اسمولاريته پائین، نبود مواد توكسيك و مواد غذايي، رشد ميكند، ترجيحاً OmpF را میسازد.
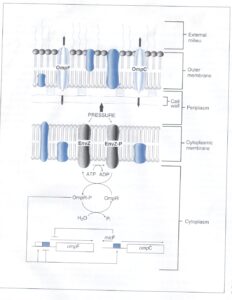
كليد اين بیان متفاوت در ميان پورينها، قابلیت حسگر فشار اسمزی به نام EnvZ میباشد كه در غشاء سيتوپلاسمي قرار دارد و سبب تنظيم نسخهبرداري ژنهای پورين و ترجمه mRNA مربوطه ميشود. شکل 4 نشان میدهد که فشار اسمزي سبب فسفریله شدن وابسته به ATP ي EnvZ شده كه این فرم در مرحله بعد سبب فسفريله شدن پروتئين سيتوپلاسمي به نام پروتئین OmpR میگردد. هنگامی که فشار اسمزی محيط خارج كم است، مقدار كمي OmpR فسفوريله شده (OmpR-P) با افینیتی بالا به بالادست DNA ژن OmpF اتصال مییابد تا ژن ترجمه شود. وقتي غلظت محلولهاي محيط خارج زياد است، فسفوريله شدن EnvZ و OmpR افزايش مييابد. حالا چون OmpR-P زياد در دسترس است به سايتهاي بالادست ژنهاي OmpF و OmpC با افینیتی كم ميچسبد. اين اتصالات سبب توقف نسخهبرداري ژن OmpF و تحریک نسخهبرداري از ژن OmpC میشود. بهعلاوه قطعهاي از DNA متصل به ژن OmpC، در جهت مخالف بیان و منجر به توليد mRNA از روي ژن micF ميشود. mRNA مربوط به آنتی سنس mRNA ompF (micF) بهعنوان يك سرکوبگر ترجمه عمل كرده و به قطعهاي از mRNA مربوط به ژن OmpF متصل و مانع از ترجمة آن میگردد.
شكل 4: تنظيم سنتز پورينهاي OmpF و OmpC در اشریشیا كلي
Envz يك پروتئين حسگر اسمولاريته ميباشد كه در غشاء سيتوپلاسمي قرار دارد. در اسمولاريته پائين، Evnz با بکارگیری ATP، خودش را فسفریله میکند و در نتیجه EnvZ-P پروتئین تنظیمی سیتوپلاسمی به نام OmpR را فسفريله مينماید. OmpR-P به سايت تنظيمي با افینیتی بالا در بالادست ژن OmpF متصل و سبب بیان آن میشود. با افزایش اسمولاریته، میزان فسفریله شدن Evnz و OmpR هم افزايش مييابد و به دنبال آن OmpR-P به سايت تنظيمي با افینیتی پايينتر روي كروموزوم در ناحية بالادست OmpF و OmpC متصل میشود. این سایتها نسخهبرداری از OmpF را متوقف و نسخهبرداری OmpC را افزايش ميدهند. بعلاوه باند شدن OmpR-P نزديك OmpC سبب نسخهبرداري micF در جهت مخالف ميشود. اين قطعهی mRNA به mRNA، OmpF موجود، متصل و نسخهبرداري آن را متوقف ميكند. (برگرفته شده از Microbiology, T. Stuart Walker).
[1] -Global regulatory Network
[2] -Replacement of sigma factors
[3] -Signal transduction
[4] -Regulon
[5] -CAMP-Binding Protein(CAP)
[6] -Fumarate-Nitrate Regulator(FNR)
[7] -Translational repressor
[8] -Attenuator
[9] -Antisense
نقش ترانسپوزونها در پروکاریوتها (1)
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام