CAR T cell therapy
محمدحسین مبلغ حسینی (کارشناس علوم آزمایشگاهی، کارشناس ارشد ژنتیک مولوکولی)
ویدا وحدانی ( دانشجوی دکترای ژنتیک مولکولی)
یکی از روشهای نوین درمان تعدادی از سرطانها که بهتازگی مورد استفاده قرار گرفته و نتایج خوبی هم نشان داده، استفاده از T cellهای کایمر است (chimeric T cell). این نوع درمان بر پایه مهندسی ژنتیک و ایمنولوژی است. نظریه استفاده از T cell در بیماران سرطانی اولین بار در سال 1988 توسط rosenberg مطرح شــــــــد. او T cellهای موجود در تومور بنام tumor infiltrating lymphocyte (TIL) را جدا کرد و توسط IL-2 تکثیر و فعالسازی انجام داد و بعداً به خود بیمار تزریق کرد. او مشاهده کرد که این T cell ها باعث نابودی تومور میشوند. این روش دقت و توانایی بالایی داشت و سمیت بافتی نداشت و بر سلولهای نرمال تأثیر نداشت.
سال 2017 یک تاریخ به یاد ماندنی در علم اونکولوژی است. چون مجوز تأیید درمان با CAR T cell (chimeric antigen receptor) توسط FDA صادر شد.
kymriah برای درمان لوسمی BALL (B cell acute lymphoblastic leukemia) در کودکان و بزرگسالان کمتر از 25 سال آن را بکار گرفت. ظرف سه ماه پس از تزریق، شمارش سلولهای خونی، در تعدادی از بیماران بهصورت صد در صد و در تعدادی از بیماران، 83 درصد نرمال شد که یکی از موفقترین درمانها در زمینه سرطانهای خونی بود. دومین مورد توسط yeskarta انجام گرفت که FDA آن را تأییــــد کرد و برای درمــــــــــــــــــــان انواع B cell lymphoma بزرگسالان مثل DLBCL (diffuse large B cell lymphoma) استفاده شد و نتایج مطلوبی حاصل شد.
طرز ساخت T cell کایمر:
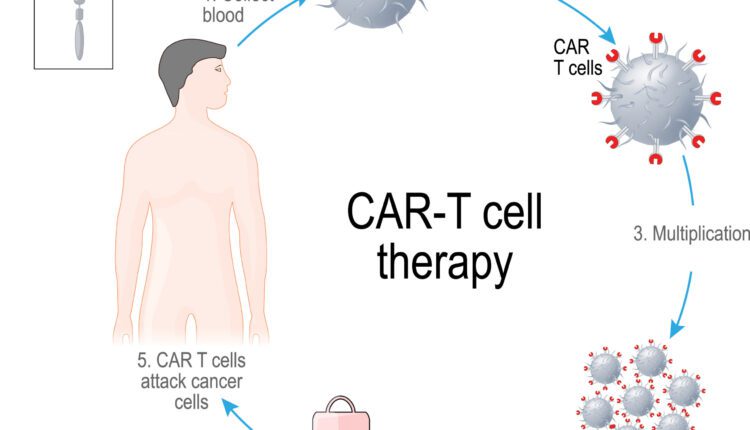
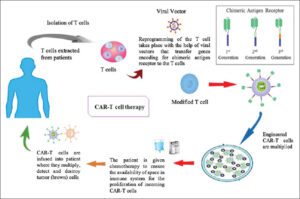
ابتدا T cellهای خود فرد (اتولوگ) را توسط عمل apheresis جدا میکنند سپس با استفاده از وکتورهایی مثل لنتی ویروسها، رتروویروسها و تراسپوزونها قطعات موردنظر را تولید و تکثیر میکنند. حالا ما صدها میلیون T cell داریم که مهندسی شدهاند و حاوی گیرندههایی هستند که اختصاصی آنتیژنهای توموری هستند و فقط آن آنتیژن را شناسایی میکنند. در بعضی از موارد، تغییرات ژنتیکی را توسط تکنیک CRISPR/CAS9 انجام میدهند (شکل 1).
شکل 1. مراحل apheresis و تولید CARs در In vitro تزریق آنها به بدن بیمار
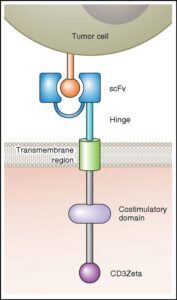
ساختمان گیرنده CARs:
گیرنده CARs حاوی سه دومین است (شکل 2)؛ دومیــــن خارج سلـــــــــولی ScFv (single chqin fragment variable)، دومین داخل غشایی و دومین سیتوپلاسمی. دومین خارج سلولی از اتصال دو قطعه VH و VL که توسط یک متصلکننده پپتیدی به هم متصل هستند تشکیل شده و در ادامه یک بازوی خارج سلولی فضاساز (spacer) وجود دارد که منتهی به دومین داخل غشایی میشود. این گیرنده ویژه، توانایی شناسایی یک نوع آنتیژن اختصاصی سطح تومور را دارد. دومین خارج سلولی بخش متغیر را تشکیل میدهد که بهطور اختصاصی به قسمت لولا مانند متصل میشود. دومینهای سیتوپلاسمی به عنوان انتقال پیام میباشند و دو نوع هستند: فعالکنندهها و کمک محرکها.
زنجیره ζ (زتا) به عنوان فعالکننده است که حاوی قطعه ITAM است و نقش انتقال پیام را به عهده دارد. این زنجیره به عنوان اولین انتقالدهنده پیام محسوب میشود. از مولکولهای کمک محرک (co-stimulatory) میتوان به CD28، OX40 (CD134) و 4-1BB (CD137) اشاره کرد.
شکل 2. اجزاء و دومینهای یک گیرنده CAR بهطور شماتیک
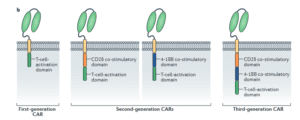
طبقهبندی انواع CARsها:
نسل اول: در این نوع T cell فقط از CD3 / زنجیره زتا به عنوان انتقال پیام استفاده میشود. این سلولها نمیتوانند سایتوکاین تولید کنند ولی پاسخ ضد توموری پایداری دارند.
نسل دوم: با گذشت زمان و کافی نبودن عملکرد نسل اول، نسل دوم در ابتدای دهه 1990 طراحــی گردید. در این T cell، مولکول CD28 جهت تقویت ترشح IL-2 و بهبود فعالیت CARs بکار گرفته شده است.
نسل سوم: در جهت افزایش عملکرد مولکولهای CD3 / زنجیره زتا و CD28، دانشمندان دومینهای تحریکی دیگری مثل OX40 و 4-1BB را هم اضافه کردند که باعث میشود ظرفیت انتقالهای پیام بیشتر شود.
نسل چهارم: بر روی CARsهای نسل دوم، IL-12 اضافه کردند و این سلولها را TRUCK (زرهپوش) نامگـــــــــذاری کردند (T cell redirected for universal cytokine- mediated killing).
CARs نسل چهارم باعث افزایش فعالیت T cellها و نیز فعال شدن سلولهای ایمنی ذاتی میشوند و همچنین موجب کشتن سلولهای سرطانی در محل ضایعه میگردند. TRUCKs همچنین در درمان عفونتهای ویروسی و اختلالات متابولیکی و بیماریهای خود ایمنی نیز مورد استفاده قرار میگیرند (شکل 3).
شکل 3. تفاوتها و تشابههای انواع CARs
کنترل عملکرد CARs:
دانشمندان جهت تنظیم و کنترل فعالیت این سلولها از کاسپاز 9 القایی (icaspase9) استفاده کردند. اگر زمانی CARs بهطور نامناسب فعال شوند، این مولکول باعث حذف آن سلول میشود. مکانیسم عمل به این ترتیب است که با تجویز یک دارو بنام AP1903 موجب دایمر شدن کاسپاز 9 میشود سپس باعث القای سریع آپوپتوز در سلول موردنظر خواهد شد.
CARs، آنتیژنها را بهصورت هدفمند و اختصاصی شناسایی میکنند. پس از شناسایی آنتیژنهای توموری، این سلولها فعال میشوند و تکثیر و تمایز انجام گرفته و سیتولیز سلولهای تومورال را سبب میشوند. به این ترتیب که سلولهای تومورال بیان MHC را کاهش میدهند تا از دست سیستم ایمنی میزبان فرار کنند، ولی نمیتوانند از دست CARs ها فرار کنند. چون این سلولها میتوانند آنتیژنهای غیرپروتئینی تومورال را هم شناسایی کرده و پاسخ دهند، در نتیجه سلولهای تومورال، هدف CARs قرار میگیرند.
مزایا:
- CARs جهت شناسایی آنتیژن، نیازی به MHC ندارند؛ در واقع این T cellهای مهندسیشده مزیت خاصی نسبت به T cellهای معمولی دارند که دارای رسپتور TCR هستند، پس بیماران با هر نوع HLA میتوانند توسط این روش درمان شوند. مزیت بعدی این است که برخلاف T cellهای معمولی که TCRهای آنها فقط پپتیدهای منشأ گرفته از پروتئینها را شناسایی میکنند، CARs، پروتئینها، کربوهیدراتها، گلیکولیپیدها را هم میتوانند شناسایی کنند.
- شانس درمان در بعضی موارد تا 90 درصد است، البته این نتایج در مورد سرطانهای خونی است و در مورد سرطانهای توپر چالشهایی وجود دارد. در پیوند مغز استخوان، احتمال ایجاد GVHD (پاسخ بافت پیوندی علیه میزبان) وجود دارد ولی در ایمنوتراپی با CAR T cell این وضعیت حادث نخواهد شد.
تا قبل از سال 2017 در ایالات متحده سالانه 30000 مورد ابتلا به مولتیپل میلوما گزارش میشد که تقریباً 12000 هم منجر به مرگ میشد ولی با ظهور پدیده CAR T cell therapy نتایج امیدوارکنندهای به دست آمد.
عوارض جانبی درمان با CAR T cell:
- از آنجایی که T cellها انواعی از سایتوکاینها را ترشح میکنند، احتمال ایجاد سندرم انتشار سایتـــــوکاین CRS (cytokine release syndrom) وجود دارد. در این سندرم، افت فشارخون (تاکیکاردی سینوسی)، تب بالا، هیپوکسی و در موارد محدودتر ایجاد تشنج و ادم مغزی مشاهده شده است. در بعضی موارد ایجاد لنفوپنی شدید هم گزارش گردیده است. در اکثر موارد، تاکیکاردی چند ساعت و یا چند روز قبل از بروز تب به وجود میآید.
- عارضه جانبی مهم دیگری که در بعضی موارد گزارش شده است، B cell aplasia است.
- مشاهده سندرم آنسفالوپاتی مرتبط با CAR T cell (CRES) هم در بعضی از موار%
برای دانلود باید وارد سایت شوید.
ورود / ثبت نام

دیدگاه برای این مطلب بسته شده است.