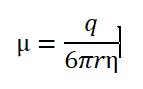الکتـروفــورز
مهندس احسان درخشاننیا
الکتروفورز از شناختهشدهترین روشهای آزمایشگاهی برای جداسازی بیوملکولها میباشد و عبارت است از حرکت یک جسم باردار در یک میدان الکتریکی در PH معین. در این روش حرکت ذرات (نمونههای دارای بار الکتریکی) در داخل مایعی تحت تأثیر یک میدان الکتریکی یکنواخت از میان شبکهای متخلخل یا مشبک بررسی میشود.
تاریخچه
در سال 1907 دو دانشمند انگلیسی به نامهای Field و Teague زهر و پادزهر دیفتری را روی ژل آگار بر اساس اختلاف در جابجا شدن آنها بهوسیله الکتریسیته جدا نمودند. در سال 1950 تیسلیوس Tiselius با وضع بهتر و دامنه وسیعتری از الکتروفورز استفاده نمود. دستگاه او لولهای U شکل بود که در آن محلول تامپون ریخته و محلول مورد آزمایش نیز بر روی این تامپون قرار میگرفت و بعد فراکسیونهای مختلف پروتئینی که پس از انجام الکتروفورز جدا میشود، با چشم غیرمسلح مشاهده میگردید. چون انجام الکتروفورز بهتدریج جزء کارهای روزمره آزمایشگاه قرار گرفت، پیدا کردن یک روش ساده الکتروفورز الزامآور بود. ازاینجهت بعداً دانشمندان الکتروفورز ساده بر روی اجسام غیرمایع مثل کاغذ را ابداع نمودند. بعدها برای جداسازی پروتئینهای سرم از دو گروه محیط حامل استفاده گردید.
گروه اول شامل کاغذ، اگارژل و استاتسلولز
چون این مواد دارای منافذ گشادی هستند مولکولهای پروتئین به آسانی در آنها حرکت میکنند. در این روش بین 4 تا 7 فراکسیون شبیه به جداسازی اولیه توسط تیسلیوس به دست میآید.
گروه دوم شامل ژل نشاسته، آکریلامیدژل
که دارای منفذی با قطر باریک هستند که مانند صافی مولکولی عمل میکنند. این محیطها مولکولهای پروتئینی را بر حسب حجم و بار الکتریکی تقریباً به 20 فراکسیون جدا میکنند.
اغلب این دانشمندان آزمایشهای خود را بر روی پروتئینهای سرم پیریزی نمودند و ثابت کردند که الکتروفورز برای جدا کردن مولکولهای درشت بر کروماتوگرافی روی کاغذ که برای مطالعه اجسام با مولکولهای کوچکتر انجام میشود مزیت دارد.
Tiselius در سال 1930 دکتری خود را در زمینه مطالعه روشهای الکتروفورز پروتئین دریافت نمود و در سال 1948 برنده جایزه نوبل شیمی برای فعالیت در زمینه الکتروفورز و آنالیز جذبی شد و از این رو او را پدر الکتروفورز مینامند. تیسلیوس در سال 1950 اطلاعات جدیدی در مورد اجزاء پروتئینی سرم و پلاسما به دست آورد. Durrum در سال 1956 روش الکتروفورز بر روی کاغذ را برای جداسازی پروتئینها ابداع کرد. در سال 1970 الکتروفورز دوبعدی با کمک ژل پلی آکریلامید، برحسب اندازه مولکول در یک جهت و تمرکز ایزوالکتریک در جهت دیگر نقش زیادی در تحول روشهای جستجوی پروتئین ایفا کرد.
شکل 1. Arne Tiselius
ضمن اینکه لازم به ذکر است ژلهای استفادهشده در آن زمان به علت بزرگ بودن منافذ نمیتوانستند پروتئینها را بر حسب اندازهشان به تفکیک جداسازی کنند، لذا بهتدریج ژلهایی چون آگارز تولید و بکار گرفته شد.
اجزاء دستگاه الکتروفورز
سیستم الکتروفورز از بخشهای زیر تشکیل شده است:
- محفظه (تانک): محفظه الکتروفورز از دو سلول مجزا تشکیل شده که در یکی آند (الکترود مثبت) و در دیگری کاتد (الکترود منفی) قرار دارد. جنس الکترودهای بکار رفته معمولاً گرافیت (کربن) یا پلاتین است.
- منبع تغذیه الکتریکی
بايد دستگاه يك ولتاژ ثابت جريان مستقيم داشته باشد و داراي اتصال زمين باشد تا مانع شوك به کاربر شود. مجهز به تايمر 60-0 دقیقه، قادر به تأمين ولتاژ 450 و كليد قطع و وصل اتوماتيك باشد، بهطوریکه تا قطع کامل جریان برق امکان باز نمودن درب مخزن وجود نداشته باشد.
- محیط پشتیبان یا محیط پایه الکتروفورزي
- معرف شیمیایی
- گرمکن (انکوباتور)
- غلظت سنج
کاربرد و اصول کار دستگاه الکتروفورز
این روش معمولاً برای جدا کردن مولکولهای باردار در یک میدان الکتریکی بهمنظور تجزیهوتحلیل آنها بکار میرود. به دلیل اینکه ماکرومولکولهای زیستی دارای بار الکتریکی هستند میتوان با استفاده از یک میدان الکتریکی، آنها را بر اساس خواص فیزیکی مانند شکل فضایی، وزن مولکولی و بار الکتریکی تفکیک نمود. نمونههایی که بار الکتریکی دارند تحت تأثیر یک میدان الکتریکی از میان شبکهای متخلخل یا مشبک عبور داده میشوند. تحت این شرایط پروتئینها که در PH ایزوالکتریک خود دارای بارهای منفی و مثبت برابر میباشند در PH قلیایی دارای بار منفی شده و بهطرف قطب مثبت حرکت میکنند و در طیِ این حرکت جداسازی صورت میگیرد.
سرعت حرکت مولکولها در این شرایط تحت تأثیر عواملی مانند وزن مولکولی، اندازه، شکل فضایی مولکول، بار الکتریکی و شدت میدان الکتریکی قرار میگیرد. همچنین اثرات عوامل محیطی نظیر نوع و نحوه استفاده از بافرها و حرارت ایجادشده در حین کار نیز از عوامل مؤثر بر جداسازی مولکولهای نمونه هستند. معمولاً الکتروفورز برای تفکیک مولکولهای بزرگی چون پروتئینها و اسیدهای نوکلئیک، تشخیص هویت DNA در علوم ژنتیک، جدا نمودن ایمونوگلوبولینهای سرم، جدا نمودن ایزوآنزیمهای یک آنزیم مانند CPK، جدا نمودن هموگلوبینهای خون و در مواردی نیز برای جداسازی مولکولهای باردار کوچکتر نظیر قندها، اسیدهای آمینه، پپتیدها و حتی یونهای ساده مورداستفاده قرار میگیرد.
بررسی چند مورد الکتروفورز
- الکتروفورز پروتئین سرم
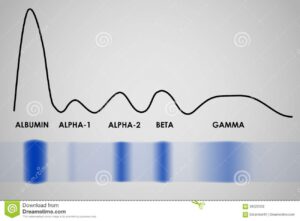
سلولهای پارانشیم کبد مسئول ساختن پروتئینهای آلبومین، فیبرینوژن، سایر فاکتورهای انعقادی و قسمت عمده گلوبولین های آلفا و بتا هستند. پروتئینهای پلاسما اعمال زیر را انجام میدهند:
- حفظ فشار انکوتیک در داخل عروق خونی
- تأمین منبع ذخیرهای از پروتئین برای رشد و ترمیم بافتها
- تأمین ناقل برای چربیها، مواد محلول در چربی، آهن، مس و..
- عمل بهعنوان فاکتورهای ایمنی
- تأمین فاکتورهای انعقادی، هورمونها و هموگلوبین
- تأمین آنزیمهای متعدد برای فعالیتهای مختلف
الکتروفورز سرم پروتئین یک تکنیک آزمایشگاهی جهت بررسی پروتئینهای خونی میباشد. بیماریهایی همچون میلوم متعدد (Multiple myeloma) و پروتئینوری (وجود مقادیرغیرطبیعی پروتئین در ادرار)، را میتوان با استفاده از این تکنیک بررسی نمود.
معمولاً خون را ابتدا در یک سرنگ جمع میکنند و سپس بر روی یک غشای استات خیسخورده در بافر الکتروفورز مینمایند. در این نوع الکتروفورز پروتئینها در وسط صفحه بارگزاری میشوند و بر اساس بار خالص خود به سمت قطب مثبت و یا قطب منفی حرکت میکنند. آلبومین دارای بیشترین بار منفی است و بنابراین بیشترین حرکت را به سمت قطب مثبت خواهد داشت. در روند الکتروفورز از یک میدان الکتریکی برای جدا کردن اجزاء پروتئینهای سرم و اندازهگیری مقدار هر یک از آنها استفاده میشود. پروتئین تام (Total Protein) سرم کمتر از 4 g/dL همراه با سطح پایین آلبومین سرم سبب ایجاد ادم میشود.
- الکتروفورز ایمونوگلوبولین خون
همانطور که اشاره شد پروتئینهای خون از آلبومین و گلوبولین تشکیل شدهاند. گلوبولینها انواع مختلفی دارند که یکی از آنها گاماگلوبولین است. آنتیبادیها از گاماگلوبولین ساخته شدهاند و ایمونوگلوبولین (Ig) نامیده میشوند. ایمونوگلوبولینهای مختلفی وجود دارند. ایمونوگلوبولین G یا IgG تقریباً 75 درصد ایمونوگلوبولینهای سرم را تشکیل میدهد؛ بنابراین IgG قسمت عمده آنتیبادیهای موجود در جریان خون را تشکیل میدهد. این ایمنوگلوبولین تنها پادتنی (آنتیبادی) است که توانایی عبور از جفت و تأمین ایمنی جنین را دارا میباشد.
IgA تقرییبا 15 درصد ایمونوگلوبولینهای داخل بدن را تشکیل میدهد اغلب در ترشحات تنفسی و دستگاه گوارش، بزاق، اشک و.. وجود دارد. IgM ایمونوگلوبولینی است که در ابتدا مسئول گروههای خونی ABO و فاکتور روماتوئید است. این آنتیبادی در واکنشهای ایمنی مربوط به عفونتهای مختلف مثل هپاتیت، سپسیس گرم منفی هم درگیر میشود.IgM از جفت عبور نمیکند.IgE اغلب یک پاسخ آلرژی را واسطهگری میکند و برای کشف بیماریهای آلرژیک اندازهگیری میشود. IgD، که کمترین ایمونوگلوبولین است بهندرت ارزیابی میشود.
الکتروفورز سرم برای کشف و کنترل سیر بیماریها، از جمله بیماریهای ازدیاد حساسیت، نقصهای ایمنی، بیماریهای خودایمنی، عفونتهای مزمن و ویروسی و عفونتهای جنینی داخل رحمی به کار میرود. برای انجام این آزمایش، سرم روی یک لام حاوی ژل آگار قرار داده میشود و یک جریان الکتریکی از این ژل عبورداده میشود. ایمونوگلوبولینها بر اساس میزان و اختلاف بار الکتریکی از همدیگر جدا میشوند. همچنین ضد سرمهای خاصی در کنار لام قرار داده میشوند تا انواع ایمونوگلوبولینهای موجود مشخص گردند.
- الکتروفورز هموگلوبین
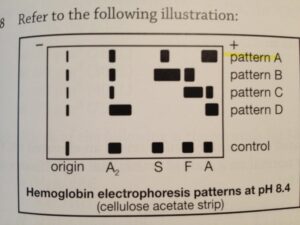
در بالغین طبیعی، سه نوع هموگلوبین در اریتروسیت ها وجود دارد که عبارتاند از: HbA، HbA2 و HbF. هموگلوبینهای غیرطبیعی در اثر جابجایی یک اسیدآمینه واحد در یکی از زنجیرههای پلی پپتیدی در قسمت گلوبین مولکول هموگلوبین تولید میشوند.
بیش از 400 نوع هموگلوبین مختلف با حروفی غیر از A، A2 و F مشخص میشوند. برای تقسیمات فرعی هموگلوبینهای مختلف، نام آن ممکن است شامل ناحیه جغرافیایی، شهر یا محل کشف مثل
HbM-بوستون باشد. در بین انواع مختلف هموگلوبینهای غیرطبیعی HbS یا هموگلوبین سلول داسی از مهمترین آنهاست.
هموگلوبینوپاتی واژهایست عمومی که هموگلوبینِ تغییریافته و بعضی از اشکال کمخونیهای همولیتیک را توصیف میکند. در افراد با یک نقص هموگلوبین خاص طیفی از شدت کمخونی میتواند وجود داشته باشد. اختلالات شامل یک تغییر عمومی در مولکول گلوبین، یک وضعیت هموزیگوت (خالص) که بیماری ایجاد میکند و یک وضعیت هتروزیگوت (مختلط) که صفت-Trait بیماری را ایجاد میکند ولی بیماری را ایجاد نمیکند، میباشند. هموگلوبینهای عمده درجات مختلفی از شارژ الکتریکی را دارا میباشند. وقتیکه هموگلوبین از RBCهای لیز شده روی کاغذ الکتروفورز قرار میگیرد و در یک میدان الکتریکی واقع میشود، انواع هموگلوبینها، بر اساس شارژ الکتریکی، از هم جدا میشوند و باندهایی را روی کاغذ تشکیل میدهند. الگوی باندها با الگوهای طبیعی و غیرطبیعی شناختهشده مقایسه میشوند.
الکتروفورز هموگلوبین برای کشف هموگلوبینوپاتی، کمک به تائید تشخیص تالاسمی، ارزیابی کمخونی همولیتیک، تعیین وجود HbC، تشخیص هموگلوبین سلول داسی شکل و تمایز بین سلول داسی شکل هموزیگوت و هتروزیگوت به کار میرود.
- الکتروفورز پروتئین ادرار 24 ساعته
در حالت طبیعی، مقدار کمی پروتئین در ادرار وجود دارد، تقریباً یک سوم آن آلبومین و بقیه شامل پروتئینهای پلاسما، از جمله گلوبولینهای کوچک هستند. وقتیکه پروتئینهای زیادی در ادرار ظاهر شود بهطورکلی علل آن بهصورت اختلالات گلومرولی، اختلالات لولهای و Overflow proteinuria یا پروتئینوری لبریزی تقسیمبندی میشود. در دو گروه اول، مشکلات به آسیب کلیوی مربوط میشوند. گروه سوم با تولید پروتئین زیاد بهوسیله بیماری غیرکلیوی مشخص میگردد. پروتئینها بهوسیله گلومرولها تصفیه میشوند، ولی وقتی مقدار آن خیلی زیاد باشد امکان بازجذب بهوسیله لولههای کلیوی وجود ندارد و درنتیجه پروتئین به داخل ادرار سرریز میشود.
الکتروفورز پروتئین یک روش آزمایشگاهی است که برای تشخیص پروتئین غالب در ادرار مورداستفاده قرار میگیرد.
پروتئین بنس جونز (Bence Jones) یکی از پروتئینهای پروتئینوری لبریزی است. وجود آن در ادرار با میلوم متعدد، ماکروگلوبولینمی و لنفوم بدخیم همراه است. الکتروفورز، پروتئین گاماپاتی منوکلونال (پروتئین M) را هم مشخص میکند. در الگوی الکتروفورز، پروتئین M با یک برجستگی در ناحیه گلوبولین مشخص میشود.
الکتروفورز پروتئین ادرار برای تشخیص انواع مختلف دفع پروتئین از ادرار و ارزیابی بیماران با میلوم متعدد شناختهشده یا مشکوک به کار میرود.
روش انجام تست الکتروفورز
برای انجام این تست ابتدا نمونه مورد نظر را که ادرار یا سرم، بنا به درخواست پزشکان به دمای اتاق رسانده و سپس مراحل انجام کار را به دقت دنبال میکنیم. مراحل به ترتیب زیر هستند:
- کاغذ استاتسلولز که به صورت ژلهایی هستند که برای ۸ نمونه اغلب کاربرد دارند در بافر مخصوص به مدت ۱۰ دقیقه خیسانده میشود.
- بعد از ۱۰ دقیقه این کاغذ را از محلول در آورده و بین ۲ کاغذ خشککن آرام قرار داده میشود تا نمگیری مختصری انجام شود ولی کاغذ نباید خشک شود.
- در این مرحله نمونه توسط اپلیکاتور خاصی که به منظور نمونه گذاری استفاده میشود بر روی کاغذ منتقل میشود. لازم است که نمونهها 1/5 سانتیمتر از لبه کاغذ و حداقل ۱ سانتیمتر از کنارهها فاصله داشته باشند.
- سپس ژل را برگردانده و از پشت داخل تانک الکتروفورز که حاوی بافر مخصوص است قرار داده میشود بهطوریکه نمونه در سمت کاتد باشد.
- بهوسیله ۲ لام تمیز و کاغذ صافی پلیبرای ارتباط بهتر بافر با ژل تهیه میشود.
- تانک را به منبع تغذیه متصل کرده و با تنظیم دستگاه روی ولتاژ مناسب (۱۶۰ ولت) که شدت جریانی حدود ۶-۴ آمپر را فراهم کند جریان الکتریکی برقرار میشود. بعد از چند بار مصرف بافر جریان افزایش مییابد که در این زمان بافر تانک باید تعویضشده و از بافر تازه استفاده نمود.
- بعد از طی زمانی حدود ۲۰ دقیقه، دستگاه را خاموش کرده و مراحل رنگآمیزی، رنگ بری، آبگیری و شفافسازی انجام میشود.
- در نهایت باندها بهوسیله اسکنر و برنامه مخصوصخوانده میشوند.
رنگآمیزی ژلها جهت آشکار شدن جایگاه باندهاي پروتئین و … صورت میگیرد. انتخاب رنگها با توجه به نوع ژل و نوع ترکیب، مورد جداسازي صورت میگیرد. میزان رنگ هر باند با میزان پروتئین موجود در آن باند ارتباط دارد ولی این میزان تحت تأثیر عوامل دیگري نظیر نوع پروتئین و میزان دناتوراسیون آن قرار میگیرد. وقتی از رنگآمیزی پروتئینها استفاده میشود بخش لیپیدي لیپوپروتئینها یا کربوهیدراتی گلیکوپروتئینها رنگ نمیشود. لذا مقادیر آنها کمتر از میزان واقعی برآورد خواهد شد. براي رنگآمیزی پروتئینها از رنگهای آمیدوبلاك (Amido black)، کوماسی بریلیانت بلو (Coomassie Brilliant Blue)، پانسو S (Panseau S) و نیترات نقره استفاده میشود.
روشهای مختلف الکتروفورز
برای تفکیک و مطالعه بیومولکولها اعم از اسیدهای نوکلئیک یا پروتئینها روشهای مختلف الکتروفورز ابداع شده است که در ادامه به معرفی انواع متداول آن میپردازیم.
1: الکتروفورز سطحی
از یک نوار کاغذی یا استات سلولزی مشبک ترموپلاستیکی با طول 10 تا 20 سانتیمتر که از سلولز و اسید استیک و همچنین ژل پلیمر بهعنوان فاز ثابت تشکیل شده استفاده میشود.
2: الکتروفورز ژل
این نوع الکتروفورز بر حسب نوع ژل مورداستفاده بهعنوان فاز ثابت، به دو نوعِ الکتروفورز ژل پلیآکریلامید و الکتروفورز ژل آگارز تقسیم میشوند.
- الکتروفورز ژل پلیآکریلامید
در حال حاضر ژل پلیآکریلامید متداولترین و پرکاربردترین ماده بهعنوان واسط در الکتروفورز ژلی محسوب میشود بهطوریکه ژل تنها واسطه در عبور جریان الکتریسیته بین دو محفظه میباشد. الکتروفورز ژل پلیآکریلامید دارای قدرت تفکیک بسیار بالایی بوده و برای تفکیک پروتئینها و اسیدهای نوکلئیک استفاده میشود. در این روش از تفاوت وزن مولکولی و بار الکتریکی پروتئینها بهطور همزمان برای تفکیک آنها از یکدیگر استفاده میشود. با توجه به اینکه پروتئینها دارای بار الکتریکی متفاوتی میباشند، بهمنظور بررسی پروتئینها بر اساس وزن مولکولی با استفاده از ژل پلیآکریلامید به بافر ماده شیمیایی سدیمدودسیل سولفات (SDS) اضافه میشود.
سدیمدودسیلسولفات مولکولی بزرگ با بار منفی میباشد که ضمن القاء بار منفی متناسب با وزن مولکولی به پروتئین، باعث گسستن سرشت پروتئینها شده و به آنها متصل میشود (به ازای هر دو اسیدآمینه، یک مولکول سدیم دودسیل سولفات به پروتئین متصل میشود). هرچه غلظت پلیآکریلامید بیشتر باشد قدرت تفکیک ژل بیشتر خواهد شد و مولکولهای دارای وزن مولکولی نزدیک به هم را بهتر تفکیک مینماید.
محدوده وسیعی از فعالیتهای آزمایشگاهی تحقیقاتی و کلینیکی مانند تسلسل ژنها، بررسی موتاسیون و تعیین توالی DNA، تفکیک قطعات کوچک DNA دو رشتهای و قطعات DNA تکرشتهای، جداسازی کروموزومها، جداسازی و تعیین خصوصیات پروتئینها توسط این روش و با استفاده از ژل پلیآکریلامید انجام میشود.
- الکتروفورز ژل آگارز
الکتروفورز ژل آگارز را میتوان برای جداسازی مولکولها بر مبنای بار یا وزن مولکولیشان استفاده نمود. مولکولهایی که بار الکتریکی بیشتری دارند، تحرک یا حرکت الکتروفورزی بیشتری از خود نشان میدهند و سریعتر منتقل میشوند.
برحسب تعریف، حرکت الکتروفورزی عبارت است از میزان حرکت ذرات در واحد میدان الکتریکی که با μ نشان داده میشود:
که μ: حرکت الکتروفورزي،q: بار الکتریکی خالص یون،r: شعاع یون و η: ویسکوزیته محیط (بافر) است. با توجه به معادله بالا مشخص میگردد که حرکت الکتروفورزي ارتباط مستقیم با بار خالص یون (q) و ارتباط معکوس با اندازه مولکول (r) و ویسکوزیته محیط الکتروفورزي (η) دارد. هنگامیکه الکتروفورز در حال انجام میباشد بهمرور دماي محیط پایه و بافرها افزایش مییابد که منتج به تبخیر حلال میگردد، این اثر سبب صعود بافر از هر دو بخش بافري (درون دو تانک بافري) به درون محیط پایه میگردد، این جریان دوطرفه بر حرکت یونها تأثیر میگذارد.
معمولاً برای تفکیک قطعات بزرگ DNA (بزرگتر از 500 جفت باز) درصورتیکه هدف صرفاً بررسی کیفی و تفکیک باشد، استفاده از ژل آگارز انتخاب اول است.
جداسازی برمبنای بار، به ژلی نیاز دارد که مانند آگارز دارای منافذ بزرگتری باشد. تهیه ژل آگارز بهمراتب سریعتر و آسانتر و کمهزینهتر از ژل پلیآکریلامید میباشد. یکی از مهمترین کاربردهای الکتروفورز ژل آگارز جداسازی بخشهای حاصل از برش DNA با آنزیمهای محدودکننده است. آگارز برای جداسازی اسید نوکلئیکها و پروتئینهای خیلی بزرگ استفاده میشود.
3: الکتروفورز در میدان الکتریکی ضربان دار
با توجه به اینکه هرچه غلظت ژل کمتر باشد مولکولهای بزرگتری را میتوان بهوسیله الکتروفورز تفکیک نمود ولی میزان این رقت دارای محدودیت میباشد بطوریکه حتی با رقیقترین ژلهای آگارز هم نمیتوان مولکولهای DNA بزرگتر از 100 کیلو جفت باز (kilo base pair = kbp) را تفکیک نمود. لذا برای این منظور از روشهای الکتروفورز در میدان الکتریکی ضرباندار استفاده میشود که دارای انواع مختلفی میباشد:
- الکتروفورز در میدان الکتریکی ضرباندار تک-جهتی
یکی از سادهترین روشهای الکتروفورز در میدان الکتریکی ضرباندار، روش میدان الکتریکی ضرباندار تک جهتی با استفاده از یک دستگاه ژل الکتروفورز افقی معمولی میباشد. با استفاده از میدان الکتریکی ضرباندار تک جهتی میتوان مولکولهایی بهاندازه 400 کیلو جفت باز را از هم تفکیک نمود. در این روش میدان الکتریکی در فواصل زمانی معین قطع شده و مجدداً برقرار میگردد. هنگامیکه میدان برقرار است مولکول DNA در جهت میدان حرکت نموده و بهصورت گسترده در میآید. با قطع جریان الکتریکی، حرکت DNA متوقف شده و در این حالت مولکول فرصت مییابد تا به حالت شکل فضایی خاص خود برگردد ولی با برقراری مجدد جریان حرکت مولکول مجدداً آغاز میشود.
با اعمال چنین میدان الکتریکی همه مولکولها فرصت نمییابند تا بهطور کامل به شکل فضایی خود درآیند. البته هر چه مولکول کوچکتر باشد سریعتر میتواند به شکل فضایی خود برگردد و یا از آن خارج شود این در حالی است که مولکولهای بزرگتر نمیتوانند و بر این اساس میتوان مولکولهای نسبتاً بزرگ را از هم تفکیک نمود. این روشِ الکتروفورز در آنالیز ژنهای بزرگ نظیر ژن کد کننده پروتئین دیستروفین که در پیدایش بیماری دیستروفی عضلانی نقش دارد، مورداستفاده قرار میگیرد.
- ژل الکتروفورز در میدان الکتریکی معکوس
با این روش میتوان مولکولهایی تا اندازه 800 کیلو جفت باز را تفکیک نمود. در این روش، جهت میدان الکتریکی در فواصل زمانی معین معکوس میشود. به این صورت که برای تفکیک مولکولهای کوچک از دامنههای زمانی کمِ میدان الکتریکی یعنی 0.5 ثانیه در جهت مستقیم و 0.25 ثانیه در جهت مخالف و در مورد مولکولهای بزرگتر از دامنه زمانی بیشتر یعنی 3 ثانیه در جهت مستقیم و 1 ثانیه در جهت مخالف بهطور متناوب استفاده میشود.
- ژل الکتروفورز در میدان الکتریکی ضربان دار
ژل الکتروفورز در میدان الکتریکی ضربان دار یکی از متداولترین روشهای الکتروفورز در میدان الکتریکی ضرباندار میباشد. با استفاده از روش ژل الکتروفورز در میدان الکتریکی ضرباندار میتوان مولکولهای بسیار بزرگی در اندازههای بین 20 هزار تا 2 میلیون جفت باز را تفکیک نمود. در این روش از دو میدان الکتریکی که نسبت به هم بهصورت عمود قرار گرفتهاند در فواصل زمانی معین و بهطور متناوب استفاده میشود. یکی از این میدانها در جهت بالا به پایین و دیگری در جهت چپ به راست برقرار میشود. مولکولهای DNA تحت تأثیر میدان اول به حرکت درآمده و پسازآن تحت تأثیر میدان دوم 90 درجه تغییر جهت میدهند. با این روش مولکولهای DNA با حرکت چرخشی خود در طول ژل بهصورت زیگزاگ به حرکت درمیآیند.
4: الکتروفورز موئین
الکتروفورز موئین تکنیکی است که عمدهترین کاربرد آن در شیمیدارویی یا درمانی میباشد. این تکنیک برای جداسازی مولکولهای درشت و ریز توسط مجاری بسیار نازک (با قطر داخلی 20 تا 200 میکرومتر و با طول 0.5 تا 1 میلیمتر) استفاده میشود. الکتروفورز موئین بیشتر زمانی مطرح میشود که با آنالیتهای باردار با پلاریته و قطبیت زیاد سروکار داریم. در این روش جداسازی با ولتاژ بالا (حدود 20 تا 30 کیلوولت) امکانپذیر میشود. از محاسن الکتروفورز موئین میتوان به افزایش سرعت دستیابی به نتایج در آنالیز یونها اشاره نمود. این تکنولوژی در علوم بیوتکنولوژی جایگاه ویژهای پیدا کرده و در آنالیز ماکروملکولهایی چون پروتئینها و کربوهیدراتها و همچنین در زمینه رشد علم ژنتیک و علوم تحلیلی بخصوص در زمینه دارویی و زهرشناسی رشد بسیاری داشته است.
نکات مهم هنگام کار با دستگاه الکتروفورز
در طی انجام الکتروفورز مهمترین موضوع ثابت نگه داشتن حرارت میباشد. بهعنوانمثال پُلیمریزه شدن آکریلامید یک واکنش گرمازا میباشد و گرمای حاصله بخصوص در مورد ژلهای غلیظتر، ممکن است باعث بروز بینظمی در اندازه منافذ ژل شود. بالا رفتن دما میتواند موجب بروز مشکلات دیگری مانند شکستن شیشههای الکتروفورز و آسیب رساندن به دستگاه شود.
کنترل کیفیت و نگهداری
جهت کنترل کیفی نمونههای انجامشده بهعنوانمثال الکتروفورز هموگلوبین میتوان Hb-A2 و Hb-F را به روشهای زیر اندازهگیری نمود و با نتایج حاصل از الکتروفورز مقایسه کرد.
- HbA2 را با روش میکروستونی (کیتهای تجاری)
- HbF با روش شیمیایی (کیتهای تجاری)
کیتهای کالیبراسیونی نیز موجود هستند که مشتمل بر 7 نوع پروتئین خالص لیوفیلیزه شده میباشند که از این کیتها برای کنترل کیفی الکتروفورز مولکولهای با وزن مولکولی کم به روش ژل پلیآکریلامید همراه سدیم دودسیل سولفات استفاده میکنند. میزان حرکت پروتئین اندازهگیری شده توسط دستگاه را پس از رنگآمیزی با محلول کوماسی بریلیانت بلو تعیین نموده و با مقدار حرکت پروتئین کیت ارائه شده توسط سازنده مقایسه میکنند. مقدار حرکت شاخص رنگی را نیز اندازهگیری میکنیم. حال با استفاده از مقادیر بهدستآمده منحنی کالیبراسیون را برحسب لگاریتم وزن مولکولی رسم نموده و توسط آن مقادیر اندازهگیری شده را با توجه به منحنی به دست میآوریم.
برخی از مراجع
- دکتر محسن کثیری، الکتروفورز و کاربرد آن در تشخیص بیماریها، پایاننامه تخصصی در رشته آسیبشناسی بیماریها، دانشگاه علوم پزشکی تهران
- حسین پیری، اصول کلی روش الکتروفورز، گروه بیوشیمی و ژنتیک دانشکده پزشکی شهید بابایی
- کتاب اصول فنی و نگهداری و روشهای کنترل کیفی تجهیزات آزمایشگاهی تألیف مهندس سید علیخانی
- کتاب تفسیر بالینی آزمایشهای پزشکی تألیف دکتر ایوب ابراهیمی چاپ دوم
نکتههای کلیدی آزمایشگاهی در الکتروفورز هموگلوبین، پروتئین و CSF
https://en.wikipedia.org/wiki/Electrophoresis
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام