پیشرفتهای اخیر در تستهای تشخیصی عفونتهای ویروسی
حسن دیانت مقدم
چکیده
مرگ سالانه هزاران نفر در اثر بیماریهای عفونی ویروسی نگرانیهای سلامتی عمومی جهانی را در پی داشته است. از پاندمیهای وخیم و عفونتهای بسیار مسری تا موارد معمول آنفلوانزا، در اغلب موارد پیشآگهی بالینی متکی برتشخیص زودهنگام عامل عفونی میباشد، بنابراین شناسایی مؤثر پاتوژنهای ویروسی برای کمک به مهار انتقال، ایجاد درمان مناسب و نظارت بر پاسخ به درمان، موردنیاز بوده و منجر به مدیریت و کنترل مؤثر بیماری میشوند. هدف از این مقاله مروری، تشریح برخی از پیشرفتهای اخیر تکنولوژی در شناسایی ویروسها از جمله واکنش زنجیره ای پلیمراز، اسپکترومتری جرمی و توالییابی نسل بعد است و اینکه چگونه این تکنولوژیها در تشخیص و مدیریت عفونتهای ویروسی بکار گرفته میشوند. این ابزارهای قوی سرعت و کارایی در تشخیص پاتوژنهای ویروسی را ترکیب کرده و انقلابی در حوزهی تشخیص بالینی ایجاد کرده اند، اما بههرحال، این ابزارها ایرادهای مخصوص به خود را دارند که در این بین میتوان به هزینهبر بودن آنها اشاره کرد که استفادهی آنها را در بسیاری از آزمایشگاهها بخصوص در مواردی که با کمبود منابع مالی مواجه هستند، با محدودیت روبرو ساخته است. برعکس، ظهور و پیشرفت تکنولوژی میکروفلوئیدس علاقه زیادی را در گروههای تحقیقاتی بیومدیکال به خود جلب کرده است و توانسته یک جایگزین چالشبرانگیز برای تشخیص عفونتهای ویروسی با هزینهی کمتر را ارائه دهد.
کلمات کلیدی: عفونتهای ویروسی، تستهای آزمایشگاهی، ایمنی سنجی، واکنش زنجیرهای پلیمراز، اسپکترومتری جرمی، توالی یابی نسل بعد
مقدمه
پاندمیهای جهانی خطراتی جدی برای زندگی انسان هستند. درحالیکه ویروسهای معین و شناختهشدهای از جمله ویروس نقص ایمنی انسان (HIV) و هپاتیت همچنان باعث مرگ میلیونها نفر میشوند، ویروسهای نوظهور مشکلزا بوده و چندین شیوع شدید در سالهای اخیر داشتهاند؛ برای مثال در سال 2002 الی 2003 سندرم حاد تنفسی شدید ناشی از کوروناویروس (SARS-CoV)، در سال 2009 آنفلوانزای خوکی A(H1N1) و در سال 2014 تب خونریزی دهنده ی ابولا، مرگ هزاران نفر را در شرق آفریقا رقم زده اند.
شیوع بیماری و مرگومیر ناشی از عفونتهای ویروسی بهطور چشمگیری بالا است. تعداد 35 میلیون نفر در سال 2013 به HIV آلوده شده و 350 الی 400 میلیون نفر حامل مزمن ویروس هپاتیت B هستند. طبق گزارشهای سال 2014 سازمان جهانی بهداشت (WHO)، بیش از 780000 نفر هر سال در اثر هپاتیت B میمیرند و مرگ ناشی از بیماریهای کبدی مرتبط با هپاتیت C به بالای 500000 نفر میرسد. شیوع بالای این بیماریها باعث افزایش تلاشها در راستای بهبود تشخیصهای بالینی شده است.
مهار مؤثر و مدیریت بالینی بیماریهای عفونی بهطور دقیق به غربالگری زودهنگام و دقیق پاتوژنها بستگی دارد. غربالگری شامل تشخیص اولیهی ذرات عفونی در ارگانیسم و سپس تعیین عواملی (از جمله جهشها و تنوع ژنتیکی) است که مقاومت به درمان و فرار ایمنی پاتوژن را باعث میشوند، بنابراین، تشخیص سریع عامل عفونتزا سود بیمار را از طریق درمان بهموقع و جلوگیری از عوارض بیماری تضمین کرده و همچنین سلامت عمومی را از طریق جمعآوری داده ها برای مطالعات اپیدمیولوژیکی در راستای مهار شیوع و گسترش بیماریها تأمین میکند. در این زمینه، سازمان بهداشت جهانی برنامه های نظارتی زیادی برای کنترل بیماریها از جمله استراتژی جهانی برای کنترل و ارزیابی مقاومت دارویی به HIV، نظارت جهانی آنفلوانزا و سیستم پاسخگو به کنترل و نظارت آنفلوانزا و سیاست جهانی روی هپاتیتهای ویروسی، تدوین نموده است.
در مقیاس کوچکتر، آزمایشگاههای بالینی نقطه ی حیاتی تشخیص بیماری ویروسی با استفاده از طیف وسیعی از ابزارها و ماشینهای متنوع از لحاظ قیمت و کارایی هستند.
در دنیای رشد سریع تکنولوژی، صنعت بهطور مداوم ابزارهای بهروز را ارائه میدهد، اما چندین فاکتور، استفاده از آنها رادر حوزه ی مراقبتهای بهداشتی در جوامع کم درآمد، محدود کرده است، که این متأسفانه منافع جهانی را به تأخیر میاندازد. این مقاله مروری به شرح برخی از این روشهای ارزیابی پیشرفته پرداخته؛ اینکه چگونه با ویژگیهای خاص خود، انقلابی در زمینه تشخیص آزمایشگاهی ایجاد کرده اند و چه کارهایی برای غلبه بر محدودیتهای آنها میتوان انجام داد.
اصول عمومی یک تست آزمایشگاهی مناسب
تفسیر دقیق و جدی نتایج آزمایشگاهی، مدیریت بالینی و کنترل انتشار یک بیماری را با کارایی بالا تضمین میکند، بااینحال، تشخیص اشتباه میتواند منجر به از دست دادن منابع مالی و انسانی شود.
نکتهی مهم در تستهای بالینی بیماریهای عفونی، تعیین دقیق وجود یا عدم وجود عامل عفونی یا آنتیبادیهای مربوطه (برای تعیین اینکه فرد اخیراً یا در گذشته در معرض عامل عفونی قرار گرفته) است. بنابراین، توانایی تشخیص دقیق آلودگی یا عدم آلودگی فرد و تعیین روند عفونت، تأثیر مثبتی بر انتخاب روشهای درمانی دارد.
سودمندی و قابل اطمینان بودن نتایج آزمایشگاهی به پارامترهای عملکردی و عملی تست موردنظر بستگی دارد. پارامترهای عملکردی بهطور مستقیم در ارتباط با برآورد نتایج صحت، دقت، حساسیت و اختصاصیت یک تست هستند. اگرچه این پارامترها بهصورت مقادیر آماری (درصد) هستند، ولی دارای توضیحات مختلف بوده و شامل مقایسه با روش مرجع یا “استاندارد طلایی” برای تست موردنظر میباشند.
صحت، نزدیکی نتایج یک تست را به نتایج حاصل از روش مرجع یا واقعی توصیف کرده و به صورت درصدی از نتایج صحیح بیان میشود. دقت به نتایج قابلاعتماد و تکرارپذیر یک آزمون روی نمونه های یکسان اشاره میکند و نتایج مشابهی را بدست میآورد.
برای حفظ قابل اطمینان بودن یک آزمون، دو پارامتر صحت و دقت باید بهطور منظم با استفاده از روشهای کنترل کیفیت (QC) و تضمین کیفیت (QA) تأییدشده در آزمایشگاه، تحت نظارت قرار گیرند. در شرایط مطلوب، یک تست ایدهآل باید دقت و صحت 100٪ داشته باشد، بااینحال، فاکتورهای خارجی و روشهای متفاوت انجام آزمایش میتوانند تداخلات کوچکی را ایجاد نمایند.
حساسیت (همچنین نرخ مثبت واقعی نامیده میشود) درصد تأییدشده از بیماران مبتلا به عفونت (با روش استاندارد طلایی) تعریف میشود که نتایج تست مثبت داشته اند. حساسیت معمولاً با استفاده از حد پایین تشخیص یک آنالیت با نتیجه ی مثبت بدست میآید.
ويژگي یا اختصاصیت (كه بهعنوان نرخ منفي واقعی ناميده ميشود) يك ارزيابي كيفي است كه نشاندهنده توانايي یک آزمون براي تشخيص آناليت هدف از نوع غيرهدف است. اين معيار بهصورت درصدي از بيماران عاری از عفونت با نتيجه منفي تعریف ميشود. هرچه مقادیر بدستآمده از نمونه ی تست به نمونه ی مرجع نزدیکتر باشد، حساسیت و اختصاصیت آزمون بالاتر است.
برعکس پارامترهای عملکردی، انواع عملی در ارتباط با سادگی و سهولت در انجام آزمایش مانند دوره کاری کامل یا زمان چرخش (TAT) میباشند. زمان چرخش، یک شاخص کلیدی عملکردی است که بهعنوان فاصله زمانی بین ثبت نمونه تا گزارش نتیجه تعریف میشود. آماده سازی نمونه و تمام مراحل انجامشده قبل از اندازه گیری (پرهآنالیتی) در فاصله زمانی گفتهشده قرار میگیرند. یک آزمایش ایدهآل در کمتر از 60 دقیقه تمام میشود، در نتیجه تولیدکنندگان قصد ساخت ابزارهای تشخیصی با زمان چرخش کوتاهتر را دارند که یک فاکتور اختصاصی مفید برای ایجاد مراقبتهای ویژه است.
سازمان جهانی بهداشت برای برقراری تشخیص در مراکز مراقبتی با منابع محدود، معیارهایی شامل مقرون بهصرفه، حساس، اختصاصی، کاربرپسند، سریع و قوی، بی نیاز از تجهیزات و قابل دستیابی برای کاربر نهایی را تدوین کرده است. هدف، تدارک بهتر مدیریت بیماری، از جمله تحویل فوری نتایج، ثبت سریع وضعیت بیماری و در نهایت بهبود اتخاذ تصمیمگیریهای بالینی است.
روشهای قدیمی آزمایشگاهی برای تشخیص عفونتهای ویروسی
خیلی وقت است که تشخیص عفونتهای ویروسی با استفاده از طیف وسیعی از تکنیکها در آزمایشگاههای بالینی انجام میشود. برای مدت زمان طولانی است که در کشورهای توسعهیافته، میکروسکوپ الکترونی بهعنوان یک ابزار کارآمد برای تشخیص مستقیم ویروسها با مشاهده و شمارش ذرات ویروسی در مایعات بدن، مدفوع یا نمونه های پاتولوژیک بافتی بکار گرفته میشود. شناسایی ویروس توسط میکروسکوپ الکترونی بر پایه ی ویژگیهای مورفولوژیکی خاص برای هر خانواده از ویروسها صورت گرفته و نیاز به مقدار معینی از ذرات ویروسی (تا 106 ذره/ میلیلیتر) دارد، بااینوجود آمادهسازی نمونه قبل از انجام آزمایش ممکن است غلظت ویروسها را کاهش داده که بهنوبهی خود تجزیهوتحلیل را سختتر میکند. علاوه بر این، از آنجا که ممکن است وجود ساختارهای غیرمعمول یا مشابه مانند بقایای اندامکهای سلولی و خود سلولها توسط میکروسکوپ الکترونی به اشتباه اشکال ویروسی تلقی شود، لذا کار با میکروسکوپ الکترونی نیاز به مهارتهای فنی و تخصصی زیادی دارد.
ترکیب روشهای میکروسکوپ الکترونی، روشهای مبتنی بر کشت و تستهای سرولوژی کمک بزرگی در تشخیص عفونتهای ویروسی و همچنین تشخیص آنتیبادیهای هدف علیه این ویروسها کرده است. سه روش مذکور هنوز در بسیاری از آزمایشگاههای بیمارستانی اساس تشخیص عفونت ویروسی میباشند.
یکی از محبوبترین روشها برای جداسازی ویروسها، کشت ردههای سلولی متفاوت است. انتخاب روش کشت با توجه به نوع ویروس انتخابشده متفاوت است (بهعنوان مثال، سلولهای کلیه میمون رزوس برای جداسازی ویروس آنفلوانزا A استفاده میشوند).
رشد یک ویروس در کشت سلولی از طریق مشاهدهی اثر سیتوپاتیک که ویژگیهای اختصاصی و تغییرات سلولی را نشان میدهد، انجام میگیرد. شناسایی قطعی ویروس با استفاده از رنگآمیزی ایمونوفلورسانس (IF) انجام میشود. البته استفاده از کشت سلولی برای جداسازی در مورد ویروسهایی که قادر به رشد در رده های سلولی (نوروویروس، ویروس هپاتیت) یا تولید اثر سیتوپاتیک نیستند، ایدهآل نیست.
علاوه بر این، اگر حجم کوچکی از نمونه داشته باشیم، تلقیح کافی ویروس به انواع سلولهای کشت دادهشده صورت نگرفته و این باعث پیچیده تر شدن نتیجه ی کشت میشود؛ بهعنوان مثال تلقیح استاندارد نمونه مایع مغزی نخاعی (CSF) به محیط کشت سلولی نیازمند حداقل 0/2 میلیلیتر نمونه است، بااینحال برای تلقیح به سلولهای مختلف، نیاز به نمونه بیشتری بوده که ممکن است منجر به تهاجمی بودن روش و در نتیجه آسیب رسانی به بیمار شود.
زمان لازم برای جداسازی ویروسها از طریق کشت سلولی بسیار طولانی (چندین هفته) است، بنابراین زمانی که تشخیص سریع موردنیاز است، یک ایراد بهحساب میآید. کشت سلولی نیاز به پرسنل مجرب و ماهر جهت تفسیر دقیق اثر سایتوپاتیک ویروس داشته و کار کردن با رده های مختلف سلولهای پستانداران یا ویروسهای بسیار بیماریزا، نیازمند امکانات کافی است.
یکی از روشهای کشت سریع، تکنیک shell vial است که سلولهای تلقیحشده، سانتریفیوژ، انکوبه و سپس توسط آنتیبادیهای اختصاصی مونوکلونال علیه ویروسهای مشکوک به ایجاد عفونت از جمله ویروسهای تنفسی، ویروس هرپس سیمپلکس یا ویروس واریلا زوستر، جهت انجام ایمونوفلورسانس رنگآمیزی میشوند. آنتیژنهای تولیدشدهی ویروسی 2 الی 4 روز بعد از انجام کشت سریع تشخیص داده میشوند. محدودیت روش کشت سریع ناشی از عدم شناسایی طیف گسترده ای از ویروسها و همچنین حساسیت پایین آن است.
یکی از قدیمیترین روشها در تاریخ ویروس شناسی بالینی، تست فیکساسیون کمپلمان (CFT) است. در این تست کمپلمان فقط بهصورت غیراختصاصی با ترکیبات آنتیژن– آنتیبادی واکنش میدهد، در نتیجه، در حضور مجموعه آنتیژن- آنتیبادی، کمپلمان آزاد نبوده تا با گلبولهای قرمز گوسفند حساسشده که بهعنوان یک شاخص استفاده میشود، واکنش دهد، بنابراین گلبولهای قرمز در واکنش مصرف نمیشوند که نشاندهنده ی مثبت بودن تست است.
تست فیکساسیون کمپلمان ظاهراً آسان و راحت بوده و نیاز به مواد ارزان قیمت دارد. بااینحال، این تکنیک طاقتفرسا و فاقد حساسیت لازم است. یک نکتهی مهم در انجام این تکنیک برای دستیابی نتیجه ی مؤثر، اعمال استانداردسازی طی تیتراسیون مواد واکنشدهنده و تهیه نمونه ی کنترل است.
معمولاً تشخیص آربوویروسها، زیرگونه های آنفلوانزا و انواع پاراآنفلوانزا، توسط تست نسبتاً کمی مهار هماگلوتیناسیون انجام میشود. اساس این تست بر توانایی اتصال یک پروتئین پوششی ویروس به نام هماگلوتینین (HA) به اریتروسیتها و درنتیجه تشکیل یک الگوی شبکه مانند بنام آگلوتیناسیون است. در این تست، رقتهای متوالی از نمونه سرم به مقدار ثابت هماگلوتینین ویروسی و اریتروسیتهای با قابلیت تشکیل آگلوتیناسیون اضافه میشود. اگر آنتیبادیهای آنفلوانزا در سرم وجود داشته باشند، فرایند آگلوتیناسیون مهار میشود. میزان رقیق شدن مربوطه تا جایی که در آن هماگلوتیناسیون کامل مشاهده شود، ادامه پیدا میکند. اگرچه این تست از نظر کنترل کیفی وقتگیر است، اما علاوه بر آنفلوانزا، طیف وسیعتری از بیماریهای ویروسی توسط روشهای مختلف آگلوتیناسیون تشخیص داده میشوند.
این فهرست از تکنیکهای متداول جامع نبوده و تنها مواردی که بیشتر مورد استفاده قرار میگیرند، ذکر شده است. در ادامه تحولات اخیر که جایگزین شیوه های معمول شده اند و اجازه غربالگری (آزمون کیفی)، نظارت (آزمون کمی) و تأییدیه تشخیص را میدهند، مورد بحث قرار خواهد گرفت.
روشهای جدید تشخیص عفونتهای ویروسی
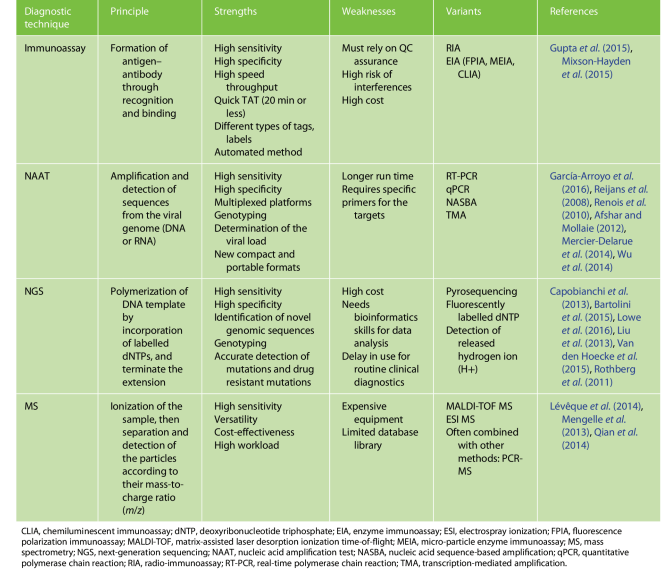
همانطور که قبلاً ذکر شد، این مقاله تنها برخی از پیشرفتهای اصلی در تکنولوژیهای تشخیصی که دوره جدید ویروسشناسی بالینی را رقم زدهاند را مورد بحث قرار میدهد و در جدول 1 بهطور خلاصه، به ارائه مزایا و محدودیتهای کلیدی آنها پرداخته است.
تستهای ایمنیسنجی
تولید و فعال شدن آنتیبادی علیه یک ماده خارجی در مواردی مانند عفونت اولیه، عود عفونت و یا طی فعال شدن مجدد عفونت، صورت میگیرد، بنابراین اندازهگیری سطح ایمونوگلوبولینها بهعنوان یک رویکرد گسترده برای تشخیص عفونتهای ویروسی در نظر گرفته شده است.
کارایی مؤثر نشأت گرفته از اختصاصیت و تمایل اتصالی بالا بین آنتیژن و آنتیبادی، روشهای ایمنیسنجی خودکار را به یکی از رایجترین روشهای موجود در آزمایشگاهها تبدیل کرده است. اساس این روشها متکی بر تشکیل یک کمپلکس ایمنی بین آنتی بادی موجود در نمونه بیمار و آنتیژن مصنوعی موجود در واکنش یا برعکس، برای تولید یک سیگنال قابل اندازه گیری است.
در تستهای ایمنیسنجی، آنتیبادی یا آنتیژنهای مصنوعی نشاندار که بر روی یک سطح جامد متصل شدهاند بهوسیلهی آنتیژن یا آنتیبادی موجود در نمونههای سرم جذب میشوند. این نشانها میتوانند ایزوتوپهای رادیواکتیو یا آنزیمهایی باشند که سبب تغییر در رنگ یا مواد تولیدکننده نور میشوند. در نتیجه، این اصل روشهای متعددی را برای انجام آزمایش ایجاد کرده است.
ایمنیسنجی رادیواکتیو (RIA) احتمالاً جزء روشهای اولیه (دهه 1960) است که در آن از رادیوایزوتوپها (مانند ید 125) برای نشانه گذاری آنتیژن یا آنتیبادی استفاده میکنند. مقدار مواد آنالیز شده، از روی مقدار رادیواکتیویته تولیدشده تعیین میشود. RIA یک روش بسیار حساس است اما اشکال اصلی استفاده و دفع مواد رادیواکتیو خطرناک است.
در روشی جایگزین، نشانهگذاری آنزیمها با استفاده از آلکالین فســــــــــــــفاتاز یا HRP (horseradish peroxidase) صورت میگیرد، که مدتها بع عنوان روش مرجع در نظر گرفته میشد. این آنزیمها باعث انتشار سیگنالها یا تغییر رنگ شده و در نتیجه مقدار آنالایت موردنظر را اندازه گیری میکنند. چنین روشی ایمنیسنجی مرتبط با آنزیم (EIA) (enzyme-linked immunoassay) نامیده میشود. EIA دارای انواع مختلفی از جمله الایزا است و تفاوت آنها در آنزیم مورد استفاده و اساس تشخیص سیگنال تولیدی است.
جدول 1. خلاصهای از روشهای اصلی تشخیص عفونت ویروسی
واریانتهای اصلی EIA عبارتند از:
- ایمنیسنجی پلاریزاسیون فلورسانس (FPIA) (Fluorescence polarization immunoassay): استفاده از برچسب فلورسنت و نور دارای قطبیت
- ایمنیسنجی آنزیمی میکروذرات (MEIA) (Micro-particle enzyme immunoassay): استفاده وسیعی داشته و بر مبنای آنزیم الکالین فسفاتاز و مواد سوبسترای پشتیبان است.
- ایمنیسنجی کمیلومینسنت (CLIA) (Chemiluminescent immunoassay) که از برچسبهای کمیلومینسنت یا پراکنشگر نور استفاده میکند. شرکتهایی مانند ROCHE یا Abbot در حال بهره برداری از این روش هستند. تکنولوژی CLIA دارای مزایایی مانند سرعت بالا و سهولت در اندازه گیری است، در نتیجه بهتدریج در آزمایشگاههای با حجم نمونه ی بالا، جایگزین روش MEIA شده است.
مطالعات سرولوژی هپاتیت B در بالین، از ایمنیسنجی بهعنوان یک ابزار کلیدی برای تشخیص مارکرهای ویروس هپاتیت B (HBV) استفاده میکند. نسخه های بهروز شده از روشهای ایمنیسنجی، قادر به شناسایی پایینترین سطوح مارکر اصلی HBVبنام HBsAg هستند، درحالیکه روشهای معمولی قادر به تشخیص این مارکر، بهویژه در نمونه های سرم بیماران بدون علامت نیستند. آخرین روش غربالگری ایمنیسنجی قادر به تشخیص کمترین میزان IU/ml0/05 نمونه است. این مقدار معادل 2/ 0 نانوگرم در میلیلیتر آنتیژن ویروسی با حساسیت بالا (> 99٪) بوده که در مراحل مختلف بیماری یا حتی در بیماران با سرم عاری از ویروس مشاهده میشود.
دستیابی به حساسیت بالا در اندازهگیری و اطلاعات کافی از ژنوتیپهای ویروس هپاتیت B توسط تکنولوژی جدید پیشرفته ی CLIA مقدور شده است. تکنولوژی CLIA قادر به دناچوره کردن ذرات ویروس هپاتیت B بوده و از آنتیبادیهای مونوکلونال علیه اپیتوپ های ساختاری داخلی و خارجی این پاتوژن استفاده میکند.
تشخیص ویروسها با استفاده از انواع اتوماتیک تکنیکهای ایمنیسنجی بر برخی از محدودیتهای روشهای مرسوم، بهویژه تأخیر در پاسخدهی، فائق آمده است.
محدودیتها
علیرغم محبوبیت ایمنیسنجی در آزمایشهای بالینی، به دلایل گوناگونی گاهی نتایج نادرست تحویل میدهد که این مقدمهی اختلافنظر در انتخاب این نوع از تستها است.
- ایمنیسنجی بیشتر از سایر روشها مستعد به عوامل مداخلهکننده است که منجر به نتایج مثبت یا منفی کاذب میشود. در اغلب موارد، تداخلات ناشی از حضور عوامل با شباهت ساختاری به مواد واکنشدهنده بوده و بسته به غلظت این عوامل و آنالیت هدف، میزان تداخل متغیر خواهد بود. در اغلب موارد عامل اصلی این تداخلات، آنتیبادیهای اندوژن (آنتیبادیهای خودی، آنتیبادیهای ناسازگار یا آنتیبادی انسانی ضدحیوانی) هستند. معمولاً این عوامل به آنتیبادیهای نمونه متصل میشوند و در غیاب آنتیژن (آنالیت) هدف باعث نتیجهی مثبت کاذب تست میشوند.
- کنترل کیفی صحیح ، نتایج قابل اطمینان را تضمین کرده و فرض را براین میگذارد که آزمایش خوب انجام شده است، بنابراین اندازه گیریهای با کنترل کیفی ضعیف منجر به پایین آمدن دقت و صحت میشوند. در ایمنیسنجی، تضمین کنترل کیفی طی انجام کالیبراسیون منظم و همچنین کنترل مواد مصرفی با استفاده از راه حلهای استانداردشده که توسط تولیدکنندگان تدوین شده است، حاصل میشود.
- با توجه به اینکه تستهای ایمنیسنجی جزء دقیقترین و حساسترین روشهای خودکار هستند، در نتیجه، یکی دیگر از معایب این روشها هزینه ی بالای مواد و تجهیزات، بهویژه برای آزمایشگاههای با منابع محدود است.
سنجشهای مبتنی بر تکثیر
انقلاب در زمینه ی تشخیص مولکولی توسط مولیس و فلونا در سال 1987 از طریق ایجاد تکثیر اسید نوکلئیک طی واکنش زنجیرهای پلیمریزاسیون (PCR) به وجود آمده است. اساس این روش استخراج و تخلیص نوکلئیک اسید، تکثیر تصاعدی توالی هدف با استفاده از آنزیم پلیمراز مقاوم به دما و پرایمرهای اختصاصی است. در نهایت آمپلیکون حاصل با استفاده از سیستم تشخیصی فلورسانس محور، شناسایی و نتیجه بر مبنای واحد بینالمللی IU/ml گزارش داده میشود.
بلافاصله پس از اختراع PCR، بهمنظور بهبود قابلیتهای آن تغییرات جدیدی روی این تکنیک آزمایش و ثبت اختراع شد. برای این طیف از واریانتهای جدید، اصطلاح تستهای تکثیر نوکلئیک اسیدی
(NAAT) nucleic acid amplification tests بکار گرفته میشود.
توانایی تستهای تکثیر نوکلئیک اسیدی در تعیین لود ویروسی باعث محبوبیت بسیار آنها در تشخیص و مدیریت عفونتهای ویروسی (مانند HBV، HCV، HIV، ویروسهای آنفلوانزا و …) شده است، به عبارت دیگر، این روش توانسته است طی تکثیر توالی هدف اسیدنوکلئیک ویروسی، مقدار کمی سازی را تا هزاران برابر افزایش دهد. امروزه در اغلب موارد، روشهای PCR محور بهعنوان روش مرجع یا”استاندارد طلایی” تشخیص از جمله هنگام غربالگری خون اهداشده از نظر انتقال ویروسهای منتقلشده از راه خون (CMV، HIV، HCV و …) در نظر گرفته میشوند.
رایجترین نوع روشهای تکثیری مرسوم عبارتند از: PCR در زمان واقعی (real-time PCR) (PCR کمی) و PCR رونویسی معکوس (RT-PCR). در حال حاضر هر دو تکنیک به معیارهای ارزیابی لود ویروسی تبدیل شدهاند. درحالیکه روش اول، DNA را در تمام واکنشها در زمان واقعی اندازه میگیرد، در روش دوم، آنزیم ترانسکریپتاز معکوس ابتدا mRNA را تبدیل به cDNA کرده و با ساخت رشته ی مکمل، DNA حاصل را تکثیر میدهد. این روش همچنین مقدار RNA را اندازهگیری میکند. ترکیبی از هر دو تکنیک باعث افزایش حساسیت در شناسایی ویروسها، بهویژه ویروسهای آنفلوانزا میشود. پس از گزارش اولین مرگ ناشی از عفونت سندرم کرونای تنفسی در خاورمیانه (MERS-CoV) در سال 2012، سازمان بهداشت جهانی اخیراً یک روش پیشرفته و جدید از RT-PCR را تأیید کرده است.
تشخیص مناسب RNA ویروسها توسط دیگر تستهای مبتنی بر تکثیر مانند تکثیر مبتنی بر توالی نوکلئیک اسید (NASBA) و تکثیر بهواسطهی رونویسی (TMA) صورت گرفته که بدون تبدیل شدن به cDNA، خود mRNA مستقیماً تکثیر و اندازهگیری میشود.
در طراحی آخرین پیشرفتهای سیستم PCR، مراحل استخراج، تکثیر و تشخیص در یک واحد ترکیب شده اند، بهعنوان مثال، تکنولوژی BioFire Film Array با بکارگیری دو تکثیر متوالی، شناسایی یک پنل از ویروسهای تنفسی را با حساسیت بالا در مدت 1 ساعت و تنها توسط یک دستگاه انجام میدهد.
از طرف دیگر، تکنولوژی میکروفلوئیدیس نیز از سیستمهای مبتنی بر PCR سود میبرد و کاهش زمان (تا 15 دقیقه)، افزایش حساسیت و مقرون بهصرفهتر بودن تشخیص، را میسر میسازد. در اپیدمی 2009 ویروس آنفلوانزا H1N1، بهجای استفاده از روشهای لوله ای، انواع تراشهای real-time PCR بیشتر برای تشخیص بکار گرفته شدند. فرمت قابلحمل چنین سیستمهایی باعث شده است بهراحتی طی همهگیریها و شیوع بیماریها استفاده شوند.
انواع مولتیپلکس (چندگانه ی) تستهای تکثیر نوکلئیک اسیدی، برای شناسایی چندین گونه یا زیرگونه ویروسی در یک دورهی کاری طراحی شده است. با استفاده از پنلهای متنوع میتوان سیستمهای تشخیص آنها را تا 20 ویروس افزایش داد، برای مثال تشخیص همزمان عفونتهای HAV، HBV و HCV و نیز عفونتهای توامان ممکن میباشد.
طی عفونت هپاتیت B، تکنیک PCR روش استاندارد طلایی و با دقت بالا برای ارزیابی سطح DNA مربوط به HBV است و آزمونها بر اساس استاندارد بینالمللی سازمان بهداشت جهانی برای ویروس هپاتیت B(NIBSC)، مانند تست مرجع Roche Cobas TaqMan HBV، استانداردسازی میشوند. این تست با حد تشخیص IU /ml 10/2، اولین آزمایش تأییدشده توسط سازمان غذا و دارو میباشد. سیستم ترکیبی با Cobas AmpliPrep دارای پروسهی استخراج نمونه خودکار و تشخیص بسیار حساس برای تمام ژنوتیپهای HBV است.
در افراد مبتلا به HIV تحت درمان داروهای ضد رتروویروسی، آزمایشهای فوقحساس، قابلیت سنجش کمی مقادیر نسخهی کم زیرگونه های HIV (کمتر از 50 نسخه در میلیلیتر) را دارند. همچنین وجود تکرارهای طویل انتهایی ژنوم ویروس در مخازن مخفی و لیزاتهای سلولی، باعث عدم نیاز به مرحله استخراج اسید نوکلئیک شده است. چنین آزمایشهایی میتوانند ابزار ارزشمندی در مطالعات بزرگ همگروهی یا هنگام وقوع بیماریهای همه گیر باشند.
محدودیتها
اگرچه PCR یک تکنیک مقرون بهصرفه و قابل اطمینان در تشخیص عفونتهای ویروسی است، اما در نظر گرفتن محدودیتهای آن نیز حائز اهمیت است؛ ریسک آلودگی بالایی هنگام کار کردن با آن، بهخصوص در مرحله آمادهسازی نمونه، وجود دارد. علاوه بر این، دوره کاری real-time PCR در مقایسه با سایر تکنیکها زمان طولانیتری (2 تا 5 ساعت) را به خود اختصاص میدهد.
در مورد آنفلوانزا، بسیاری از آزمایشات مبتنی بر PCR تنها برای شناسایی یک زیرگونهی خاص از ویروس که مسئول پاندمیهای مهم است طراحی و انجام میشود، از طرفی چون تکنیک PCR مستعد نتایج مثبت کاذب است، هنگام طراحی پرایمرهای مخصوص توالی هدف، داشتن اپراتورهای مجرب جهت شناسایی خطاها یک امر ضروری است، همچنین نرخ بالای جهش در برخی از ویروسها بخصوص در مناطقی از ژنوم که پرایمر علیه آن طراحی شده است موجب عدمتشخیص ویروس با تکنیک PCR میشود.
توالی یابی نسل بعد (NGS)
یکی از بزرگترین دستاوردهای عصر نوین، تکنیک NGS است. علاوه بر توالی یابی ژنوم موجودات شناختهشده، از کاربردهای این تکنیک میتوان کشف ویروسهای جدید مسئول بیماریهای ناشناخته انسان، ردیابی شیوع و پاندمی بیماریهایی مانند آنفلوانزا در راستای درک نحوه ی پیدایش و انتقال آنها را نام برد.
کشف توالی یابی در دهه 1970 توسط سنجر و برل آغاز و سپس توسط ماکسام و گیلبرت، ادامه پیدا کرد. ماکسام و گیلبرت برای اولین بار قادر به توالییابی الیگونوکلئوتیدها به روش پلیمریزاسون آنزیمی با استفاده از پرایمرهای نشانهگذاری شده توسط مواد رادیواکتیو شدند. آنها هنگام انجام توالییابی، از دیدئوکسی نوکلئوتید (ddN) برای پایان دادن به مرحلهی گسترش پلیمریزاسون استفاده کردند، در نتیجه روش خاتمه زنجیره یا دیدئوکسی نوکلئوتید نامگذاری شد.
اگرچه از آن زمان تاکنون توالییابیها بر همین اصل استوار ماندهاند، اما در مقایسه با توالی یابی دیدئوکسی نوکلئوتید، در انواع جدید با توجه به ارائه حداکثر حجم داده، بهینهسازی و اتومات شدن، سرعت و دقت را بهطور چشمگیری افزایش داده است. از لحاظ فنی، NGS شامل سه مرحله اصلی است: آمادهسازی نمونه، توالییابی و آنالیز داده ها. سیستمهای موجود در بازار اغلب از دیدگاه توالییابی یا خوانش توالی، تکنیکهای متفاوتی را دارا هستند. در راستای ارائه دقیق خوانش توالی های طویلتر در کوتاهترین زمان و با هزینه کمتر، امروزه تشخیص بالینی عفونت ویروسی با استفاده از NGS بهطور چشمگیری با کارآمدی بالاتر و دقت بیشتری عرضه میشود. سیستمهای بیوانفورماتیک جزء اصلی فرآیند توالی یابی هستند. بیوانفورماتیک، خروجی توالی را از طریق تجزیهوتحلیل محاسبات تفسیر کرده و سپس آن را تبدیل به اطلاعات مفید در مورد گونه ها، ژنوتیپ ها و وقوع جهشهایی که موجب بیماری یا مقاومت در برابر داروهای ضدویروسی میشود، میکند.
در حال حاضر روش Pyrosequencing روش منتخب در بین روشهای NGS به حساب میآید. اساس این روش بدین گونه است که هنگام ورود نوکلئوتیدها به فرآیند پلیمریزاسیون DNA، مولکولهای پیرو فسفات (PPi) تولید و رها میشوند. در ادامه PPi با کاتالیزور نوری لوسیفراز ترکیب و تولید نور کرده و در نهایت نور جمعآوریشده ثبت میشود. اگرچه پلت فرم Illumina بهعنوان رایجترین نوع این روش مورد استفاده قرار میگیرد، اما FLX454 تولیدی شرکت Roche، اولین تحلیلگر قابلعرضه با کارایی جامع در بازار بوده است و برای تعیین گونهها، زیرگونه ها و واریانتهای ویروس پاپیلومای انسانی (HPV) موجود در نمونههای دهانه رحم استفاده شده است. انواع دیگر سیستمها، یونهای هیدروژن آزادشده طی ورود نوکلئوتیدها به واکنش را شناسایی میکنند.
درک تغییرات ژنتیکی ویروسها با استفاده از تولید حجم بالای داده های توالی یابی، امکان جمعآوری پایگاه داده های نوکلئوتید ویروسی و کسب توالیهای جدید، فراهم شده است. اولویت جهانی ایدز بهعنوان یک عامل اندمیک خطرناک و نرخ بالای جهش در این ویروس، باعث شده است تا بیشترین توالی یابیهای انجامشده مربوط به این پاتوژن باشد.
برخلاف PCR و یا آزمایشهای سرولوژیکی رایج، تاکنون تنها روشهای توالی یابی ژنی قادر به انجام ژنوتیپ HBV شده اند، بنابراین توالییابی به مدیریت بالینی بهتر عفونت HBV و عوارض مرتبط با آن کمک زیادی میکند.
با توجه به اینکه در اکثر مطالعات تئوری و بالینی، جهشهای مقاوم در برابر داروها مطرح و موردتوجه است، لذا در رویکردهای فنی اخیر تجزیهوتحلیل دادهها و تنظیم سیستمهای خوانش نرمافزار بر اساس تشخیص همزمان ژنوتیپها و جهشهای پراهمیت بالینی و توالییابی نسبی ژن HBV S با حساسیت بالای (98/64٪)، صورت میگیرد. بااینوجود، NGS در آزمایشگاههای بالینی بهخصوص برای تشخیص الگوهای مقاومت دارویی با شیوع کمتر مانند HIV و HCV استفاده زیادی دارد. توالی یابی نوکلئوتیدهای مناطق جزئی ژنوم HCV اکنون گزینه ی انتخابی برای انجام تایپ بندی ژنوم این پاتوژن است.
محدودیتها
در کنار سیستمهای مدیریتی مناسب برای ذخیرهسازی دادههای تولیدشده، انجام NGS مستلزم دسترسی به دستگاه توالیخوان و مهارتهای قابلتوجه در بیوانفورماتیک و تخصص در تجزیهوتحلیل دادهها است، علاوه بر این، علیرغم نتایج برجسته ای که توسط نمونه های اولیه در آزمایشگاهها ارائه شده است، بسیاری از آنها هنوز در سطح تحقیقاتی قرار دارند و برای استفاده ی روزمره در بالین مجوز ندارند.
مسلماً NGS یک تکنولوژی کلیدی در آزمایشگاههای بالینی تخصصی است، اما هنوز به دلایل محدودیت منابع در تهیه دستگاه آنالیزور توالی، آمادهسازی آزمایشگاه و نمونه و همچنین عدم توانایی پرداخت هزینه ی تست توسط مردم، اجرای NGS در بسیاری از کشورها با مشکل مواجه شده است.
اسپکترومتری جرمی (MS)
اسپکترومتری جرمی در حال حاضر یک معیار مهم در بررسی آزمایشگاهی کیفی و کمی، بهویژه در حوزهی باکتریشناسی است. اساس اسپکترومتری جرمی مبتنی بر تبدیل نمونه به ذرات باردار (یون) توسط فرآیند یونیزاسیون است، در ادامه این یونها بر اساس نسبت جرم به بار (m/z) جداسازی و توسط یک آشکارساز آنالیز میشوند. نتیجه بهدستآمده با پایگاه داده مرجع (کتابخانه) موجود در سیستم، مقایسه شده و در قالب یک طیف (نمودار) قابل تفسیر عرضه میشود.
در آزمایشگاههای بالینی، روشهای (MALDI) matrix-assisted laser desorption ionization و (ES) electroscopy به دلیل پردازش مقادیر قابلتوجهی از آنالیت، بیشترین موارد استفاده را در بین روشهای یونیزاسیون دارند. جهت افزایش حساسیت، این روشهای تجربی بهتنهایی یا همراه با روشهای مولکولی دیگر مانند PCR بهطور وسیع مورد بررسی قرار گرفته و نتایج بسیار خوبی را ارائه دادهاند. ترکیب این روشها (RT-PCR /ESI-MS) قادر به تشخیص پاتوژنهای ویروسی است که معمولاً با روشهای معمول آزمایشگاهی شناسایی نمیشوند. این روشها همچنین داده های سریع و دقیق (گونه و زیرگونهها) را در یک زمان کوتاه تولید میکنند.
یک ابزار کلیدی در مدیریت شیوع بیماری آنفلوانزا A، تشخیص تغییرات ژنتیکی یا جهشها با استفاده از MALDI-TOF بوده است. کاربرد اسپکترومتری جرمی در تحقیقات ساختاری بیومولکولها نشاندهنده کارآیی بالای MALDI-TOF-MS همراه با نانوذرات مغناطیسی آنتیبادی در تشخیص ویروسهای آنفلوانزا میباشد. نتایج بدست آمده از این روش ترکیبی همانند روش استاندارد طلایی مبتنی بر PCR است. سنجش چندگانه با استفاده از ترکیب دو ماشین قدرتمند (PCR-MS)، تشخیص مقاومت دارویی طی درمان ضدویروسی، وجود چندین ویروس در یک نمونه و همچنین عفونتهای همزمان را ممکن میسازد.
علاقه شدید به MS MALDI-TOF در ویروسشناسی بالینی منجر به پیشرفتهای تحقیقاتی در تشخیص هپاتیت B شده است. این روش نهتنها توانایی تشخیص سطوح نسبتاً پایین HBV (100 نسخه DNA در میلیلیتر) را داشته است، بلکه امکان تشخیص جامع تا 60 واریانت و ژنوتیپ HBV با هزینه پایینتر از 10 دلار به ازای هر نمونه را نیز دارد. این روش برای تایپبندی ژنوتیپ مورد استفاده قرار گرفته و هشت ژنوتیپ HBV و همچنین ژنوتیپهای جزئی HCV را که در سطح بسیار پایین بودند، بهطور دقیق شناسایی کرده است.
روشهای مبتنی بر اسپکترومتری جرمی چندمنظوره، حساس، سریع و مقرون بهصرفه هستند و نیازی به نرمافزار تفسیر تجزیهوتحلیل دادهها ندارند. اتوماتیک بودن ماشینآلات، این تکنیک آماده سازی نمونهها را آسان نموده و در نتیجه به اپراتورهای کمتری نیاز است. ظرفیت آنالیز میتواند به 960 نمونه در روز برسد که برای تشخیص روزمره در آزمایشگاههای بزرگ و مطالعات گسترده مناسب میباشد. همچنین میتوان آزمایشها را با کارایی مؤثر بر روی نمونههای بایگانیشده انجام داد.
محدودیتها
محدودیت اصلی اسپکترومتری جرمی، هزینههای بالای آن بهویژه در مناطق پاندمیک بالا که معمولاً افراد تهیدست هستند، بوده، در نتیجه همه آزمایشگاهها نمیتوانند یک آنالیزور جرمی برای فعالیتهایشان داشته باشند. دومین اشکال مهم این روش در کتابخانه مرجع است. شناسایی تنها محدود به داده های معین از ارگانیسمهای شناختهشده است، بنابراین، اگر توالیهای هدف در پلتفرم خوانش وجود نداشته باشند، جهشهای نادر را نمیتوان تشخیص داد. اما اینکه کتابخانه های پایگاه داده اسپکترومتری جرمی بهسرعت در حال گسترش هستند، امیدوارکننده است.
مزایای روشهای جدید
- حساسیت و اختصاصیت تستها نزدیک به 100% است.
- امکان افزایش قابلیت تشخیص و صحت، طی ترکیب روشهای مختلف در یک آزمایش (PCR-MS، PCR مبتنی بر تکنولوژی تراشه های میکروفلوئیدیسی و …)
- اتومات شدن تستها، تعداد اپراتورها و حجم کارهای دستی را کاهش میدهد.
- حجم کوچکی از نمونه موردنیاز است، بنابراین هنوز تستها میتوانند روی نمونه های خاص انجام شوند (CSF، نوزادان و غیره)
- بعضی از تستها مانند اسپکترومتری جرمی حتی پس از چندین مرتبه فریز و ذوب کردن نمونه ها (نمونه های آرشیوشده) باز هم کارایی خود را حفظ میکنند.
- دوره کاری سریع: حداقل زمان لازم برای جمعآوری نمونه تا گزارش نتایج 30 دقیقه است و ابزارهای ریزآرایه قادر به پاسخگویی نتایج در عرض چند ثانیه هستند.
- حد تشخیص پایین: PCR قادر به تشخیص 10 الی 100 نسخه از توالی هدف به ازای هر میلیلیتر از نمونه است.
- واکنشهای چندگانه: تشخیص طیف گسترده ای از پاتوژنها در یک دوره ی کاری، صرفهجویی در وقت را به دنبال دارد.
- امکان تشخیص موارد نادر مقاوم در برابر داروها وجود دارد.
- NGS مقدار زیادی داده توالییابی را در هر دورهی کاری تولید کرده و قابلیت خوانش توالیهای طویل را دارد.
- هزینه ی کم تست هنگام استفاده از تراشه های میکروفلوئیدس و درنتیجه سهولت استفاده از آنها در تأسیس مراکز مراقبتهای ویژه
- کاهش خطر آلودگی با استفاده از انجام چندین تست در یک لوله ی آزمایش
آخرین تکنولوژیها در جوامع با منابع محدود
روشهای شرح دادهشده در فوق، عملکرد قابلتوجهی در نجات زندگی هزاران نفر در کشورهای توسعهیافته داشتهاند، بااینحال، مشکل در تهیه ی این تجهیزات و تجربه های فنی برای تشخیص دقیق در مراکز با منابع محدود، همچنان پابرجا است. درحالیکه ابزارهای گرانقیمت مانند سیستمهای PCR محور یا آنالیزورهای جرمی فقط در آزمایشگاههای مرجع یا در مراکز نظامی وجود دارند، دسترسی به دستگاههای تست در مراکز مراقبتهای ویژه یا درمانگاههای نزدیک به محل زندگی بیماران که بیش از 80 درصد از جمعیت فقیر را در اختیار دارند، با مشکل مواجه است، بهعنوان مثال، سازمان بهداشت جهانی دستورالعملهایی را برای نظارت بر اثربخشی داروهای ضد رتروویروس در بیماران مبتلا به HIV-1 در کشورهای در حال توسعه تنها با اکتفا به شمارش تعداد سلولهای +CD4 و آزمایش ELISA بهعنوان جایگزین تستهای گرانقیمت ایجاد کرده است. بهجای سنجش میزان لود ویروسی، مقدار آنتیژن p24 و فعالیت ترانسکریپتاز معکوس بهترتیب توسط روش فوقحساس p24 و آزمون ExaVir اندازه گیری میشود. متأسفانه عدم حساسیت آنها باعث درمان ناموفق و پیدایش سويه های مقاوم شده است.
یکی دیگر از موارد هزینه بر مدیریتی در کشورهای فقیر، بیماری هپاتیت بوده که انجام ارزیابی دقیق مشخصات اپیدمیولوژیک آن مشکل است. در مورد HBV، بیشتر مراکز مراقبتهای ویژه تنها به غربالگری HBsAg با استفاده از تستهای تشخیص سریع اکتفا میکنند. چنین دستگاههای کمهزینهای، توانایی تعیین روند بیماری برای اطلاع از اینکه آیا شروع یک درمان ضدویروس لازم است یا خیر، را ندارند.
اتوماسیون، میکروفلوئیدس و چشماندازهای آینده
ارائه نظارت اپیدمیولوژیک در سطح بالا روی بیماریهای ویروسی، بیتردید یک خواسته سلامت عمومی جهانی است. در سالهای اخیر با وجود پیشرفت سریع در توسعه روشهای تشخیصی، همچنان نیاز به بهبود هزینه ها، اندازه ها و زمان دوره ی کاری حس میشود.
بعد از تب خونریزی دهندهی ابولا در سال 2014، وزارت انرژی ایالات متحده آمریکا به توسعه یک تست نوآورانه سریع و قابلحمل برای شناسایی اختصاصی ویروس ابولا در عرض چند ثانیه پرداخته است. این تست سایر RNA و اگزوتیک ویروسها مانند Dengue و West Nile را هم هدف گرفته است. نمونه های دیگر شامل سیستمهای کاملاً وابسته به تستهای تکثیر نوکلئیک اسیدی و همچنین بکار گرفتن تکنولوژی نانومنفذ در دستگاههای کوچک برای انجام توالییابی DNA تکمولکولی است.
میکروفلوئیدس بهعنوان یک تکنولوژی امیدوارکننده، برای مدیریت بیماریهای عفونی طی درمان بهموقع در نظر گرفته شده است. تکنولوژی میکروفلوئیدسیک راه حل کلیدی بالقوه برای مناطق دورافتاده و مراکز خدماتی نزدیک به بیماران بدون نیاز به رفتوآمد بیماران بین درمانگاه و آزمایشگاه است. استفاده از این تکنولوژی در صورت حیاتی بودن مؤلفه ی زمان یا در مواردی که فضای فیزیکی کافی برای راهاندازی روشهای مرسوم وجود ندارد، سودمند است.
آزمایش روی تراشه (LOC) یک دستگاه بسیار کوچک است که فرآیندهای آزمایشگاهی را در چند سانتیمتر مربع ممکن میسازد. این دستگاه از حجم بسیار کمی از نمونهها برای انجام واکنش سریع در داخل تراشه یا یک دستگاه قابلحمل استفاده میکند. ازآنجاکه واکنشها با انواع تکثیر و تشخیص اسید نوکلئیک، شمارش سلولی و ایمنیسنجی متفاوت است، انجام تستهای آزمایشگاهی تشخیص میکروفلوئیدیسی در مقایسه با ابزارهای بزرگ، هزینهی کمتری لازم دارد و به نفع تأسیس مراکز کمدرآمد و مناطق دورافتاده است.
طیف گستردهای از دستگاههای LOC توسط سازمان غذا و دارو در تشخیص عفونتهای ویروسی مانند آنفلوانزا، HIV و HBV تأیید شده و توسعه ی بیشتر آنها در حال انجام است، بهعنوان مثال در کشورهای در حال توسعه، روش تشخیصی Daktari از کروماتوگرافی جذبی برای شمارش سلولهای CD4 + T بهعنوان جایگزین فلوسایتومتری برای ردیابی HIV استفاده میکند. آنالایزور رومیزی GeneXpert ساختهشده توسط Cepheid یک سیستم یکپارچه حاوی آمادهسازی نمونه و PCR برای تشخیص مولکولی آنفلوانزا و سایر عفونتهای باکتریایی است که در فرمت بسیار سبک و قابلحمل طراحی شده است.
الزامات درستی یک تشخیص، شامل بهبود برنامه های کنترل و تضمین کیفیت و استانداردسازی آزمونها، کیتها و واکنشها است. قبل از تأیید آزمایشهای بیشتر، مرکز کنترل و پیشگیری از بیماریها (CDC) بهطور پیوسته دستورالعملهای تستهای آزمایشگاهی را مخصوصاً برای HIV تدوین و پیادهسازی میکند.
مؤسسات سازمان بهداشت جهانی و سازمانهای غیرانتفاعی از جمله بنیاد تشخیصهای ابتکاری جدید (FIND)، هدف خود را بر مبنای به حداکثر رساندن تلاش در اجرای برنامههای نظارتی، کنترل بیماریهای مسری، ایجاد سیاستهای جدید و بهبود خدمات تشخیصی در مراکز با منابع محدود گذاشتهاند.
نتیجه گیری
امروزه روشهای تشخیص ویروسی، تغییراتی را در زمینه میکروبشناسی بالینی ایجاد کرده و میتواند به کاهش شیوع بیماریهای شدید عفونی کمک کند، بااینحال تواناییهای فنی بهتنهایی کافی نبوده و حمایت استراتژیهای ارتقاء سلامت بهمنظور افزایش آگاهی در مورد اهمیت تشخیص زودهنگام و غربالگری منظم افرادی که در معرض خطر هستند، الزامی است.
در نهایت، تشخیص با کیفیت خوب نیازمند هزینه است که فقط کشورهای توسعهیافته قادر به تأمین روزمرهی آن هستند، بنابراین کمبود هزینه باعث به تأخیر افتادن اجرای روشهای جدید در کشورهای در حال توسعه و مناطق اندمیک شده است. بااینحال این امید وجود دارد که همچنان تلاشها برای توسعه تستهای جدید با کیفیت خوب و قیمتهای پایین در کشورهای کمدرآمد ادامه پیدا کند که این امر بهنوبهی خود تقویت تدریجی راهکارهای کنترل بیماری را در این کشورها به دنبال خواهد داشت.
این مقاله ترجمهای است از:
Recent advances in diagnostic testing for viral Infections
Selma Souf
Bioscience Horizons • Volume 9 2016
بررسی آماری ویروس آنفلوانزا (1397-1391)
مقدمهای بر عفونتهای ویروسی دستگاه گوارش
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام