اختلالات خونریزیدهنده ارثی و کووید-19
اکبر درگلاله1، حسن مروتی2
1- گروه هماتولوژی و طب انتقال خون، دانشگاه علوم پزشکی ایران
2- عضو هیئت علمی موسسه تحقیقات واکسن و سرمسازی رازی
مقدمه
همهگیری کنونی بیماری کرونا ویروس -19 (COVID-19)، با بیش از 100 میلیون بیمار و بیش از دو میلیون مرگومیر، بزرگترین چالش فعلی کره خاکی است که سلامت، معیشت و اقتصاد مردم را شدیداً تحت تأثیر قرار داده است. بیماران درگیر، علاوه بر علائم بالینی معمول از جمله تب، سرفه، درد بدن و بسیاری علائم شناخته شده دیگر، علائم و عوارض طولانی مدت ناشی از آلودگی به کووید-19 را ممکن است تجربه کنند. این علائم ممکن است تا ماهها بعد از بهبودی اولیه بیمار در وی باقی مانده و بیمار را آزار دهند. بیماران مبتلا به کووید-19 در کنار بسیاری از علائم و یافتههای بالینی، یافتههای آزمایشگاهی مهمی دارند که ارتباط مستقیم با سیر بیماری و وضعیت بیمار دارد. از جمله مهمترین یافتههای هماتولوژیک بیماران مبتلا به کووید-19، لکوپنی، لنفوپنی، ترومبوسیتوپنی و حتی اریتروسیتوز است. هرچند ممکن است بسیاری از یافتههای آزمایشگاهی بهخصوص یافتههای مربوط به لکوسیتها تغییرات نسبی باشند، اما معمولاً این تغییرات با وضعیت بالینی بیمار و پیشآگهی بیماری ارتباط مستقیم دارند. اختلال در سیستم هموستاز و به تبع آن تستهای هموستاز از جمله طولانی شدن زمان پروترومبین (PT)، زمان رومبوپلاستین نسبی فعالشده (APTT)، افزایش D-dimer، FDP و فیبرینوژن از دیگر یافتههای شایع هماتولوژیک در بیماران درگیر است. در کنار بیماران عمومی مبتلا به کووید-19، مشکلات بیماری برای بسیاری از بیماران خاص از جمله تالاسمی و یا بیماریهای اتوایمیون و مبتلا به بدخیمی بسیار چالشبرانگیزتر بوده و در بسیاری از موارد، این بیماران از ترس ناشی از ابتلا به کووید-19، برای دریافت درمان مناسب هم مراجعه منظمی نداشتهاند. به همین دلیل مرگومیر بالای بیماران ممکن است ناشی از فاکتورهای متعددی از جمله شدت بالاتر بیماری در این افراد باشد. از آنجا که بیماران مبتلا به کووید-19 اغلب دچار اختلال در سیستم ترومبوز و هموستاز میباشند، یکی از نگرانیهای مهم، مربوط به بیماران با اختلالات ارثی انعقادی از جمله بیماران مبتلا به اختلالات خونریزی دهنده بوده است. هرچند انتظار میرفت این بیماران بیماری شدیدتری را تجربه کنند، اما مشاهدههای اولیه حاکی از این واقعیت است که احتمالاً این بیماران فرم خفیفتری از کووید-19 را تجربه خواهند کرد. با وجود احتمال این امر، نمیتوان این موضوع را بدون انجام مطالعات تکمیلی تأیید یا رد کرد و ممکن است این اثر حفاظتی اندک بوده و یا اصلاً وجود نداشته باشد. در این مبحث ما به تشریح مکانیسم احتمالی اثر حفاظتی بیماریهای خونریزی دهنده ارثی در برابر کووید-19 خواهیم پرداخت.
اختلالات خونریزیدهنده ارثی و کووید-19
همانطور که بسیاری از مطالعات نشان دادند یکی از عوارض جدی و مرگبار کووید-19، وقوع عوارض ترومبوتیک در بیماران مبتلا بود. همانطور که پیش از این نیز گفته شد، اختلال در سیستم انعقاد خون یکی از ویژگیهای برجسته COVID-19 است. حدود یک سوم مرگها در کووید-19 مستقیماً به آمبولی ریوی (PE) نسبت داده میشود، بیش از 50٪ بیماران DVT را تجربه میکنند و افزایش D-dimer، یافته رایج و پیشبینیکننده قوی برای شکل شدیدتر بیماری است. همه این یافتهها وجود یک حالت انعقادیپذیری افزایشیافته در بیماران آلوده به ویروس مسبب بیماری یعنی SARS-CoV-2 را نشان میدهند. فرضیه ما این است که بیماران مبتلا به کاهش انعقادپذیری ارثی در برابر انعقادپذیری مرتبط با COVID-19 و مرگومیر ناشی از آن نوعی اثر حفاطتی خواهند داشت. در واقع میتوان به زبان سادهتر گفت که احتمال وقوع رخدادهای ترومبوتیک که یکی از یافتههای شایع کووید-19 است، در بیماران با کاهش انعقادپذیری ارثی یا همان اختلالات خونریزیدهنده کمتر خواهد بود و در نتیجه مرگومیر ناشی از بیماری نیز در این بیماران باید کمتر باشد. مشاهدات اولیه و پیگیریهای اولیه نیز حاکی از همین واقعیت بود، هرچند نیاز به بررسیها و مطالعات تکمیلی است. با این وجود این اثر حفاظتی تا حدود زیادی در این بیماران قابل مشاهده است. به نظر میرسد این اثر حفاظتی در صورت تأیید صرفاً در اختلالات خونریزیدهنده ارثی متوسط یا شدید رخ دهد و در اختلالات خونریزی خفیف که سیستم هموستاز آنها با جمعیت عمومی تفاوت چندانی ندارد، وجود نداشته باشد یا بسیار ضعیف باشد. ترومبوآمبولی وریدی یک رویداد چند فاکتوری است که تحت تأثیر بسیاری از فاکتورها از جمله عوامل ژنتیکی و اکتسابی قرار میگیرد. عوامل خطر اکتسابی شایع بوده و شامل چاقی، سرطان و جراحیهای ماژور است. برخلاف ترومبوز شریانی که توسط عوامل ضد پلاکتی کنترل میشود، ترومبوز وریدی توسط داروهای ضد انعقاد که فاکتورهای انعقادی را هدف قرار میدهند، درمان میشود. آنتاگونیستهای ویتامین K (VKA)، هپارین و ضد انعقادهای خوراکی با اثر مستقیم (DOAC) برای مدیریت ترومبوآمبولی وریدی مورد استفاده قرار میگیرند (14، 15)، بنابراین فاکتورهای انعقادی نقش مهمی در بروز ترومبوزهای وریدی دارند. در COVID-19، افزایش قابلتوجهی در سطح فاکتورهای انعقادی که واکنشدهنده فاز حاد و غیر حاد میباشند مشاهده شده است (4، 10، 11). افزایش سطح فاکتور هشت انعقادی، ونویلبراند فاکتور در COVID-19 نسبتاً شایع است که مستقیماً با وقوع ترومبوز مرتبط میباشند (11).
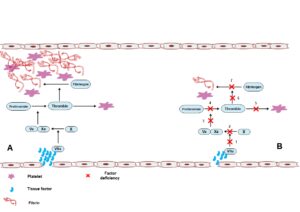
افزایش قابلتوجهی از سطح فاکتور پنج انعقادی نیز در بیماران مبتلا به کووید-19 مشاهده شده است که ارتباط مستقیمی با وقوع رخدادهای ترومبوتیک دارد (10). افزایش سطح فاکتورهای انعقادی، کوتاه شدن PT و APTT و بروز ترومبوآمبولی ریوی نقش اساسی عوامل انعقادی را در وقوع ترومبوز مرتبط با COVID-19 نشان میدهد. آسیب به سلولهای اندوتلیال و آزاد شدن فاکتورهای پروکواگولانت میتواند آبشار انعقادی را تحریک کرده و پلاکتها را فعال کند و در نتیجه منجر به ترومبوز شود، پدیدهای که در کاهش انعقادپذیری ارثی احتمال کمتری دارد (شکل 1).
شکل 1) الف) سلولهای اندوتلیال آسیبدیده میتوانند مواد پروکواگولانت مانند فاکتور بافتی که یک فعالکننده قوی آبشار انعقادی است را آزاد کرده و در نتیجه فاکتورهای انعقادی و آبشار انعقادی را فعال کنند. در افراد عادی، آسیب گسترده سلولهای اندوتلیال، همانطور که در بیماری ویروس کرونا -19 (COVID-19) دیده میشود، میتواند منجر به فعال شدن گسترده مسیر انعقادی خارجی و تشکیل مقدار زیادی فیبرین و در نتیجه وقوع ترومبوز شود. ترومبین به عنوان یک آگونیست قوی پلاکتی که در هنگام فعال شدن آبشار انعقادی تولید میشود، منجر به فعال شدن پلاکت و ترومبوز میشود. ب) در بیماران با کمبود فاکتورهای انعقادی به چند علت وقوع این رخدادها کاهش مییابد. کمبود 1) فاکتور بافتی یا فاکتور VII و 2) فاکتور X و 3) فاکتور V و 6، 5، 4) پروترومبین، 7) فیبرینوژن، میتواند مسیر فعال سازی فاکتور انعقاد را مختل کرده و فعالسازی آبشار انعقادی را نیز دچار اختلال کرده و در نتیجه خطر ترومبوز میتواند بهطور قابلتوجهی کاهش یابد.
اگرچه در شرایط عادی، اندوتلیوم با مکانیسمهای متعددی از وقوع ترومبوز جلوگیری میکند، سلولهای اندوتلیال آسیبدیده با آزادسازی VWF، فاکتور پنج انعقادی، فاکتور بافتی (TF) و مهارکننده فعالکننده پلاسمینوژن 1 -(PAI) باعث ایجاد ترومبوز میشوند. افزایش سطح همه این عوامل در COVID-19 گزارش شده است (10، 11، 16). ترومبوز ممکن اســـت در COVID-19 در نتیجه آسیب دیواره عروق رخ دهد. این آسیب منجر به آزاد شدن TF میشود که به فعال شدن مسیر خارجی آبشار انعقادی منتج شده و نقش مهمی در بروز ترومبوز دارد. فاکتور بافتی، فاکتور هفت انعقادی، فاکتور ده انعقادی، پروترومبین و فیبرینوژن برای شروع و پیشروی فرآیند انعقاد ضروری هستند. کمبود این عوامل، حتی TF، باعث بروز اختلالات خونریزیدهنده میشود (17، 18)؛ بنابراین آسیب دیواره رگ، در بیماران با کمبود یک یا چند عامل از عوامل و فاکتورهای انعقادی، به دلیل قطع شدن چرخه آبشار انعقاد، با احتمال کمتری میتواند باعث ایجاد ترومبوز شود. این اختلال در مسیر انعقاد همچنین احتمال وقوع انعقاد درون عروقی منتشر (DIC) و افزایش سطح D-dimer را نیز کاهش میدهد؛ دو عاملی که بهصورت مکرر در کووید-19 گزارش شده و از عوامل اصلی مرگومیر در این بیماران میباشند. نقص در آبشار انعقادی باعتث تولید کمتر آنتاگونیستهای پلاکتی مانند ترومبین شده و در نتیجه احتمال وقوع ترومبوز کمتر خواهد بود. میزان پایینتر ترومبوز در بیمارانی که دارای کمبود فاکتورهای انعقادی هستند، شاهدی قوی بر این فرضیه است (19).
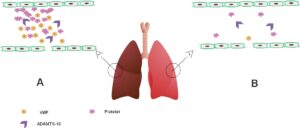
شایان ذکر است که میزان ترومبوز در بیماران مبتلا به کمبود فاکتور انعقادی نوع 2 از جمله دیسپروترومبینمی، دیسفیبرینوژنمی، هیپودیسفیبرینوژنمی و غیره بیشتر است، به همین دلیل ممکن است در این اختلال وقوع ترومبوز ناشی از کووید-19 نیز بیشتر از سایر بیماریهای خونریزیدهنده ارثی باشد (19). ترومبوآمبولی وریدی به عنوان علت اصلی مرگومیر در COVID-19، در بیماران با کمبود فاکتور انعقادی ارثی مانند فیبرینوژن، پروترومبین، فاکتور پنج، فاکتور هفت و فاکتور ده انعقادی کمتر است. از آنجا که افزایش سطح فاکتور هشت انعقادی یک یافته شایع مربوط به ترومبوز در COVID-19 است، بیماران با کمبود شدید این فاکتور انعقادی (هموفیلی A)، احتمالاً کمتر دچار ترومبوز میشوند. به دلیل نقش محافظتی/ حامل VWF برای فاکتور هشت انعقادی، بیماران مبتلا به بیماری ون ویلبراند، بهویژه نوع III، سطح گردش خون پایینتری از فاکتور هشت داشته و تمایل به خونریزی در آنها شبیه به هموفیلی است و به همین دلیل احتمالاً این بیماران نیز ترومبوز ناشی از کووید-19 را کمتر تجربه خواهند کرد. هرچند دلایل دیگری نیز برای کاهش احتمال ترومبوز در این بیماران وجود دارد. به همین دلیل احتمال وقوع ترومبوز ناشی از افزایش سطح فاکتور هشت نیز در این بیماران احتمالاً کمتر خواهد بود. از طرفی دیگر، سلولهای اندوتلیال آسیبدیده در COVID-19 میتوانند مقدار زیادی VWF آزاد کنند که از مکانیسم تجزیه در اثر ADAMTS-13 میتوانند بگریزند و باعث تجمع پلاکتها و در نتیجه آن ترومبوز ریوی/ آمبولی ریوی شوند. از آنجا که به نظر میرسد VWF نقش مهمی در ترومبوز ریوی و نه آمبولی ریوی دارد، بیماران با کمبود شدید فاکتور ون ویلبراند ممکن است یک اثر محافظتی را در برابر این رویداد تجربه کنند که به عنوان یک عارضه مهم COVID-19 پیشنهاد شده است (شکل 2) (20).
شکل 2) ترومبوز ریوی در بیماری کرونا ویروس 2019 (COVID-19) الف) ویروس SARS-CoV-2 میتواند به سلولهای اندوتلیال ریوی آسیب برساند، در نتیجه باعث آزاد شدن گسترده مواد پیش انعقادی مانند فاکتور ویلبراند با وزن مولکولی بالا (VWF) شود. VWF با خاصیت پروترومبوتیک بسیار بالای خود وقتی در مقادیر بالا ترشح شود، میتواند از تجزیه توسط ADAMTS-13 گریخته و به VWF با وزن مولکولی کم و متوسط که کمتر پروترومبوتیک هستند، تبدیل نشود و در نتیجه خطر ترومبوز افزایش یابد. انتشار گسترده HMW VWF منجر به فعال شدن و تجمع پلاکتها و به دنبال آن ترومبوز ریوی میشود. ب) در بیماران مبــتلا به بیماری ون ویلبراند (VWD)، بهویژه نوع III، کاهش شدید در آزادسازی VWF از سلولهای اندوتلیال آسیبدیده ممکن است دیده شده و در نتیجه خطر ترومبوز ریوی که ارتباط شدیدی با میزان آزادسازی ون ویلبراند از سلولهای اندوتلیال دارد، کاهش مییابد.
از آنجایی که بیماران مبتلا به VWD نوع I احتمال ترومبوز بالاتری دارند، ممکن است حوادث ترومبوتیک را با مشابه جمعیت عمومی تجربه کنند (21).
در بیماری ون ویلبراند علاوه بر کاهش سطح VWF، فاکتور هشت انعقادی نیز کاهش مییابد که همین مسئله ممکن است با چندین روش از بروز ترومبوز در کووید-19 جلوگیری کند:
1) کاهش دو واکنشدهنده حاد میتواند باعث کاهش ترومبوز مرتبط شود.
2) به دلیل اختلال در آبشار انعقادی، میتواند از بروز ترومبوز جلوگیری کند.
3) از ترومبوز ریوی به دلیل نقش مهم فاکتور ون ویلبراند در این امر جلوگیری میشود.
با در نظر گرفتن تمام عوامل فوق میتوان گفت که به دلیل اینکه در اختلالات خونریزیدهنده ارثی، بسیاری از عوامل که مسبب اصلی وقوع ترمبوز ناشی از کووید-19 هستند کاهش مییابند، بنابراین بروز ترومبوز در این بیماران کاهش قابلتوجهی خواهد داشت. کاهش ترومبوز با کاهش مرگومیر همراه خواهد بود، چرا که ترومبوز یکی از عوامل اصلی مرگومیر در کووید-19 است. علاوه بر این، با مشاهده این مکانیسم میتوان ادعا کرد که ترومبوز از عوامل اصلی مرگومیر در کووید-19 نیست بلکه علت اصلی مرگومیر در این بیماران است و شاید با مدیریت درست ترومبوز بتوان از بسیاری از مرگومیرهای ناشی از کووید-19 جلوگیری کرد.
References:
- Center for Systems Science and Engineering (CSSE) at Johns Hopkins University. 16 (JHU). Coronavirus COVID-19 Global Available 17 at: www.arcgis.com/apps/opsdashboard/index.html#/bda7594740fd40299423467b48e9ecf6 .
- Wang, C. Sun, S. Sylvia, S. Rozelle, H. Raat, H. Zhou Epidemiology, causes, clinical manifestation and diagnosis, prevention and control of coronavirus disease (COVID-19) during the early outbreak period: a scoping review Infect. Dis. Poverty, 17 (9) (2020), p. 29
- Dorgalaleh A, Baghaipour Mr, Tabibian Sh, Dabbagh A, Jazebi M, et al. Gastrointestinal Bleeding in a Newborn Infant with Congenital Factor X Deficiency and COVID-19 ─ A Common Clinical Feature between a Rare Disorder and a New, Common Infection, Int J Lab Hematol. 2020 Dec;42(6):e277-e279.
- Tang N, Li D, Wang X and Sun Z. Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia. J Thromb Haemost. 2020;18:844-847.
- Panigada M, Bottino N, Tagliabue P., et al. Hypercoagulability of COVID-19 patients in intensive care unit. A report of thromboelastography findings and other parameters of hemostasis. J Thromb Haemost 2020 . Doi: 10.1111/jth.14850
- Wichmann D, Sperhake JP, Lütgehetmann M., et al. Autopsy findings and venous thromboembolism in patients with COVID-19. Ann Intern Med 2020; (e-pub ahead of print) DOI: 7326/M20-2003.
- Dorgalaleh A, Dabbagh A, Tabibian Sh, Baghaipou MR, Jazebi M, et al., Patients with congenital bleeding disorders appear to be less severely affected by SARS- CoV-2 ─ Inherited hypocoagulability overcoming acquired hypercoagulability of COVID-19?. Semin Thromb Hemost . 2020 Oct;46(7):853-855.
- Dorgalaleh A, Dabbagh A, Tabibian Sh, Baghaipou MR, Jazebi M, et al., Do congenital bleeding disorders have a protective effect against COVID-19? A prospective study, Int J Lab Hematol. 2020, DOI: 10.1111/ijlh.13413.
- Álvarez R, N Butta Coll, S García Barcenilla, L Pérez González, et al, Registry of patients with
congenital bleeding and COVID‐19 in madrid. Haemophilia. 2020 Jun 10 : 10.1111/hae.14089.
- Stefely, JA, Christensen, BB, Gogakos, T, et al. Marked factor V activity elevation in severe COVID‐19 is associated with venous thromboembolism. Am J Hematol. 2020; 1– 9. https://doi.org/10.1002/ajh.25979
- Ladikou EE, Sivaloganathan H, Milne KM et al. Von Willebrand factor (vWF): marker of endothelial damage and thrombotic risk in COVID-19? Clin Med 2020;20:e178–82.
- Karimi M, Haghpanah S, Azarkeivan A, Zahedi Z, Zarei T, Akhavan Tavakoli M, Bazrafshan A, Shirkavand A, de Sanctis V (2020) Prevalence and mortality due to outbreak of novel coronavirus disease (COVID-19) in β-Thalassemias: the nationwide Iranian experience. Br J Haematol, DOI: 1111/bjh.16911.
- Martinelli I, De Stefano V, Mannucci PM. Inherited risk factors for venous thromboembolism. Nat Rev Cardiol 2014; 11: 140–156.
- Piran, S., Schulman, S. Management of venous thromboembolism: an update. Thrombosis J 14, 23 (2016). https://doi.org/10.1186/s12959-016-0107-z
- Franchini M, Mannucci PM (2016) Direct oral anticoagulants and venous thromboembolism. Eur Respir Rev 25:295–302.
- Zuo Y, Warnock M, Harbaugh A, Yalavarthi S, Gockman K, Zuo M, Madison JA. et al. Plasma tissue plasminogen activator and plasminogen activator inhibitor-1 in hospitalized COVID-19 patients. medRxiv. 2020 doi: 10.1101/2020.08.29.20184358
- Schulman S, El-Darzi E, Florido MHC, et al. A coagulation defect arising from heterozygous premature termination of tissue factor. Journal of Clinical Investigation. 2020;130(10):5302-5312.
- Dorgalaleh A, Tabibian SH, Hosseini MS, Shams M. Pharmacological management of rare coagulation factor deficiencies besides hemophilia. Exp Rev Hematol. 2020;13(8):811–834.
- Ruiz-Saez A. Occurrence of thrombosis in rare bleeding disorders. Semin Thromb Hemost. 2013 Sep;39(6):684-92. doi: 10.1055/s-0033-1353391. Epub 2013 Aug 8. PMID: 23929306.
- Thachil J, Srivastava A. SARS-2 corona virus associated hemostatic lung abnormality in COVID-19: is it pulmonary thrombosis or pulmonary embolism?. Semin Thromb Hemost 2020; 46 (07) 777-780.
- Girolami A, Tezza F, Scapin M, Vettore S, Casonato A. Arterial and venous thrombosis in patients with von Willebrand’s disease: a critical review of the literature. J Thromb Thrombolysis 2006; 21 (02) 175-178.
microRNAها در هموستاز و ترومبوز
بررسی سرواپیدمیولوژی آنتیبادیهای SARS-COV-2 IgG, IgM
پایش آزمایشگاهی مقاومت دارویی به داروهای رایج ضدلختگی در بیماران قلبی و عروقی
روشهای آزمایشگاهی و استانداردهای بینالمللی در تشخیص اختلالات انعقادی (بخش اول)
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام