روشهای ژنوتایپینگ
دکتر میرنژاد
در سالهای اخیر تکنیکهای مولکولی یا ژنتیکی توجهات زیادی را برای بررسیهای اپیدمیولوژیکی به خود معطوف کرده است. روشهای مختلف ژنوتایپینگ براساس آمپلی کردن یا نکردن اسید نوکلئیک و مراحل بعد از آمپلی کردن به سه دسته تقسیم بندی میشوند.
1- روشهائی مانند RELP (Restriction Fragment Length Polymorphisms) و PFGE (Pulsed field gel electrophoresis)، پروفایل پلاسمید، ریبوتایپینگ و ساترن بلاتینگ بدون انجام آمپلی کردن اسید نوکلئیک برای تیپبندی باکتریها و سایر میکروبها استفاده میشوند.
2- روشهائی مانند Rep-PCR، RAPD-PCR، RFLP-PCR، AP-PCR، Multiplex-PCR، Nested-PCR، VNTR تایپینگ که براساس آمپلی کردن اسید نوکلئیک میباشند و برای تیپبندی باکتریها و سایر میکروبها استفاده میشوند.
3- تکنیکهائی مانند PFGE، MLST (از MLEE)، PAGE که بعد از آنالیز روی ژن و آمپلی کردن اسید نوکلئیک برای تایپینگ باکتریها بکار میروند.
RFLP:
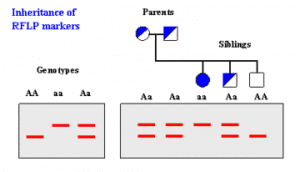
آنالیز برش DNA ژنومی یا آنالیز پلیمورفیسم طول قطعات برش خورده (RFLP) و نشاندار کردن هترولوکوس برای آللها قابل تغییر در ژنوم پستانداران برای افراد مجرم و جمعیت ها کاربرد دارد (شکل 1). اخیراً آنزیم برش دهنده کرموزم کامل باکتری منجر به ایجاد روش قابل تکرارپذیری حساس برای جداسازی تغییرات سکانس DNA و برای تمایز سویههای باکتریها شده است. این تکنیک تمایز دهنده براساس این اصل میباشد که DNA دو سویه باکتری متفاوت دارای سکانسهای نوکلئوئیدی متفاوت میباشند که بدنبال برش با یک نوع آنزیم مجموعهای متفاوت از قطعات ایجاد میشود. بدلیل اینکه ژنوم باکتریها یک هزارم اندازه ژنوم انسان میباشد این امکان محدود به یک کروموزم کامل در یک واکنش تکی و بطور الکتروفورتیک قطعات حاصل بدون نیاز به پروپهای نشاندار با آنزیم یا رادیواکتیو که تنها نواحی خاصی از ژنوم را مشخص میکنند، شد.
این روش برای بررسی تغییرات سکانس بسیار حساس میباشد و قادر به شناسائی ردههای کلون تکی یوباکتریها در گونههائی مانند اروینیا، آکروباکتروم، سودوموناس و گزانتوموناس میباشد.
در این روش نیاز به کلون کردن DNA خاص (برخلاف تکنیک هیبریداسیون) نمیباشد و توالی تکراری روی کروموزم هیچ تاثیری روی روش ندارد (در هیبریداسیون چون پروپ نشاندار بکار میبریم اگر این توالی تکراری زیاد باشد روی نتایج اثر میگذارند).
سویههای خاص باکتریها دارای عناصر اپیرزومال یا سیگمانتهای از DNA هستند که روی کروموزم اصلی قرار ندارند و جزء ترکیبات DNA هسته نمیباشند. این DNA داخل سلولی در فرم پلاسمید یا باکتریوفاژ لیزوژنیک وجود دارد. سویههائی که اینگونه DNA را با خود حمل میکنند ممکن است دارای الگوهای RFLP متفاوت در مقایسه با سویههایی که فاقد این عناصر هستند باشند. بطور کلی سویههايی که دارای DNA خارج کروموزمی هستند یک یا دو قطعه اضافی روی ژل نشان میدهند که این قطعات به ضخامت باندهای کروموزمی نمیباشند. اگر در مطالعات اینگونه باندها مشاهده شد بایستی سویه از نظر داشتن پلاسمیدهای نامشخص یا ویروسها بررسی شوند.
برای انتخاب آنزیم برشدهنده باید موارد زیر را در نظر گرفت: سویه یا گونههاي مورد نظر چه میباشند، اندازه کروموزم خاص، میزان CG% کروموزم و قیمت آنزیم.
برای اجرا، بعد از انتخاب آنزیم ابتدا باید DNA کروموزمی را استخراج کرد و بعد از استخراج باید آنزیم را به آن اضافه و در بن ماری در 37 درجه سلسیوس به مدت 48 ساعت انکوبه کرد. بعد از این مدت الکترفورز انجام میشود و باندها با همدیگر مقایسه میگردند.
شکل (1): نتایج تست RFLP نمونه یوکاریوتی
آنالیز AFLP (Amplified fragment length polymorphism)
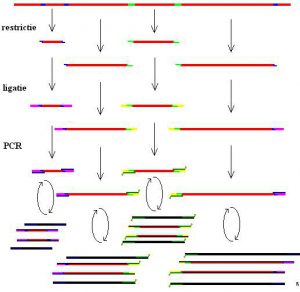
آنالیز روشهای انگشتنگاری ژنومیک با دقت بالا است. این تکنیک در سال 1990 آغاز شد که این روش در حقیقت، روش انگشت نگاری DNA با حساسیت بالا میباشد که در این روش، DNA توسط آنزیم محدود کننده هضم میشود و متعاقب آن تکثیر انتخابی صورت میگیرد. سپس قطعات به وسیلهی الکتروفورز جدا شده و در نهایت قابل مشاهده میشوند (شکل 2). این روش طاقتفرسا و گران قیمت میباشد و معمولا توسط سیستمهای نیمه اتوماتیک انجام میگیرد. در این روش شناسائی قطعات در جایگاه تعیین توالی، توسط لیزر صورت میگیرد که نمودار مجموعه جواب بدست آمده به صورت رقم در آمده و معمولا با نرم افزارهای مناسب مورد بررسی قرار میگیرد. جدا از اینکه این روش ابزار قدرتمندی در تعیین طبقهبندی باکتریایی میباشد، برای تعیین ویژگیهای سویههای اسینتوباکتر بومانی تا حد زیرگونه و اگرچه آنالیز AFLP روشی محکم و مستدل میباشد ولی نیازمند درجه بالائی از استانداردسازی و تجربیات گستردهای در زمینهی تفسیر الگوهای باندها میباشد حتی در زمانیکه برنامههای کامپیوتری پیشرفته برای کمک به آنالیز الگوها در دسترس باشد. به علاوه، این دادهها به راحتی در بین آزمایشگاهها قابل انتقال نیستند. اگرچه گروههای بدست آمده به روش AFLP به خوبی قابل مقایسه با گروههای مشتق شده از روش PFGE در مقیاسهای کوچک میباشند، ولی جزئیات و مقایسه دقیق این دو روش تایپینگ هنوز صورت نگرفته است.
شکل (2): نمائی از اجرای روش AFLP
آنالیز پلاسمید:
تایپینگ پلاسمیدی اولین روش مولکولی به عنوان ابزار تایپینگ باکتریها مورد استفاده قرار گرفت. پلاسمیدها عناصر DNA خارج کروموزمی هستند که اغلب قابل انتقال و خود تکثیر شونده میباشند و در سیتوپلاسم پروکاریوتها و بعضی یوکاریوتها (مانند مخمر) قرار دارند. تایپینگ از طریق جداسازی DNA پلاسمید و مقایسه تعداد و اندازه پلاسمید روی ژل الکتروفورزیس انجام میشود. بعضی باکتریها دارای پلاسمیدهای بزرگ در حدود 100 تا 150 کیلوباز میباشند که جداسازی آنها مشکل است، لذا برای این سویهها، اضافه کردن آنزیمهای محدودالاثر بعد از جداسازی پلاسمید کمک در تایپینگ باکتریها میکند. برش پلاسمید اغلب برای آنالیز استافیلوککها و انتروککها که پلاسمیدهای کمتر از kb50 دارند، انجام میشود. برش آنزیمی قدرت تمایز آنالیزهای پلاسمیدی را افزایش میدهد.
اندازهگیری مقدار پلاسمید عموماً در تعیین ارتباط سویهها مفید نیست. همچنین آنالیز پلاسمید در موقعیتهای بالینی در تعیین تکامل و انتشار مقاومت آنتیبیوتیکی در میان ایزولهها با پروفایل PFGE متفاوت یا در میان گونههای متفاوت ارگانیزمها در یک بیمارستان کاربرد دارد. پلاسمیدها عموماً در تمایز بین سویههای اندمیک و اپیدمیک کمک کننده نمیباشند، چرا که پلاسمیدها عناصر قابل انتقال میباشند و ممکن است یک سویه آن را کسب یا از دست بدهد. بنابراین یک سویه میتواند پروفایلهای مختلفی از پلاسمید را نشان بدهد. بطورکلی آنالیز مقدار پلاسمید، محدود به تحقیقاتی میشود که در آن بررسی اپیدمی پلاسمید، انتشار خصوصیات مقاومت را توضیح میدهد.
ریبوتایپینگ
ریبوتایپینگ برای اولین بار جهت مشخص کردن اسینتوباکترها به ویژه کمپلکس A. calcoaceticus و A. boumannii تا حد سویهها بکار رفت. در این روش از آنزیمهای محدودالاثر مانند EcoRI ، ClaI، برای برش DNA کروموزومی خالص شده از روش هیبریداسیون با پروب cDNA به همراه الکتروفورز و رنگآمیزی استفاده میشود. پروب cDNA با digoxigenin-11-UTP نشان دار شده و ازrRNA مشتق شده از E. coli بدست آمده بود. با استفاده از سیستم ریبوتایپینگ نتایج دقیقتری از تایپینگ با قدرت تشخیصی بالا که قابل مقایسه با PFGE میباشد، بدست میآید. ریبوتایپینگ با سیستمهای اتوماتیک، نتایج را سریعتر از PFGE مشخص میکند، ولی این سیستمها گران قیمت است و نیازمند تجهیزات تخصصی میباشد که تنها در چندین آزمایشگاه که تحقیقات گستردهای بر روی اپیدمیولوژی مولکولی انجام میدهند یافت میشود.
پروب ژنی
برای شناسایی میکروارگانیسم (نامشخص) میتوان از تمایل تک رشتهDNA (نامشخص) برای باند شدن با تک رشتهDNA مکمل (مشخص) استفاده کرد. در این روش تک رشته DNA از باکتری مشخص به عنوان پروب در مجاورت رشتهDNA (نامشخص) قرار گرفته و با باند شدن این دو رشته و نشاندار کردن رشته مشخص میتوان میکروارگانیسم را شناسایی کرد.
PEGE:
الکترفورز ژن در محیط ضرباندار یک تکنیک الکتروفورزی میباشد که برای جداسازی قطعات DNA خطی بالای 10 میلیون باز طول طراحی میگردد. این DNA معمولاً در هنگام برش با آنزیمها قطعات مختلفی ایجاد میکند. PFGE با آنزیمهای برش دهنده نادر خاصی که برشهای محدودی ایجاد میکنند، انجام میشود. اصولاً در این روش از آنزیمی که حساسیتهای برش زیادی دارند، استفاده میشود. در PFGE نتیجه برش ایجاد قطعات بزرگ میباشد که با الکتروفورز معمولی نمیتوان آنها را جدا کرد از این رو بایستی از الکتروفورزهای محیط ضرباندار استفاده کرد. در الکتروفورز معمولی مولکولهایی که بیش از 40 تا 50 کیلوباز اندازه دارند، به راحتی جدا میشوند، ولی در الکتروفورز محیط ضرباندار به طور متناوب در جهت جریان الکتریسیته تغییر ایجاد میشود و این باعث میگردد که مولکولهای DNA بالای 1000 کیلو جفت باز از هم جدا شوند. تغییر در خصوصیات حرکت قطعات در ژن بستگی به درجه حرارت ران کردن، زاویهاي که جریان الکترویکی وارد میشود، زمان پالس (فاصله معین عوض شدن جریان الکتریکی)، ساختمان اولیه و ثانویه DNA و دیگر عوامل بستگی دارد. یکی از مهمترین فاکتورها، غلظت ژل میباشد. هرچه غلظت آگاروز افزایش یابد حرکت قطعات کاهش مییابد، ولی مشاهده باند راحتتر میگردد. روش PFGE یک روش ساده در اجرا میباشد، ولی تفسیر نتایج آن بسیار مشکل است، بطوریکه این موضوع باعث شده که از این روش در تایپینگ مولکولی باکتریها در آزمایشگاهها و بیمارستانها کمتر استفاده شود. همچنین همانند RFLP در PFGE میزان DNA ژنومی مورد نیاز کار بالا میباشد که این یکی از معایب این دو روش میباشد. در مقالات آتی در مورد این تکنیک بیشتر توضیح داده خواهد شد.
روشهای عملی در Time PCR – Real قسمت5
آنتیبیوتیکهای موثر بر روی سنتز و ساختمان اسید نوکلئیک
روشهای عملی در Time PCR – Real قسمت6
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام