پیشرفتهای جدید در درک مکانیسمهای بیماریزایی قارچهای فرصت طلب
قسمت دوم
دکتر محمد قهری
دكتراي علوم آزمايشگاهي
Ph.D قارچشناسي پزشكي
آزمایشگاه تشخیص طبی رسالت
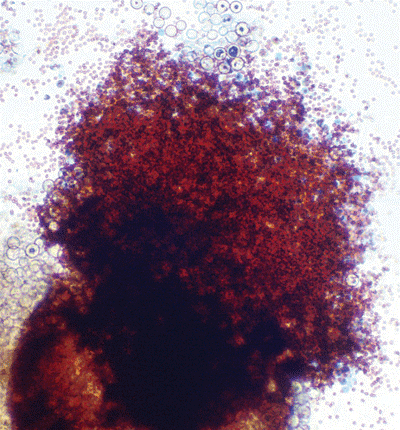
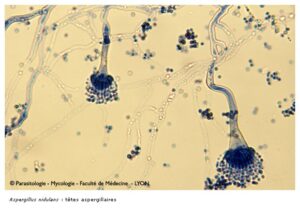
منظره میکروسکپی آسپرجیلوس فومیگاتوس
رشد و نمو
اخیراً این فرضیه مطرح شده است که موفقیت آسپرژیلوس فومیگاتوس به عنوان یک پاتوژن، به طور مستقیم مربوط به افزایش سرعت رشد آن در آزمایشگاه میباشد. شاهد دیگری بر این فرضیه، تجزیه و تحلیل ژنهای دخیل در رشد و نمو آسپرژیلوس فومیگاتوس است. Steinbach و همکاران دریافتند که سرین- ترئونین پروتئین کلسینورین فسفاتازی که وابسته به کلسیم-کالمودولین است، برای رشد و نمو آسپرژیلوس فومیگاتوس ضروری است. سویهای از آسپرژیلوس فومیگاتوس که یک دومین کاتالیتیکی از کلسینورین آن با یک مارکر قابل انتخاب جایگزین شده بود دچار نقص شدیدی در رشد خود شد، از جمله آنکه رشد قطبی در آن رخ نداد و تغییراتی در رشد و مورفولوژی کنیدیها به وجود آمد. جالب اینکه این سویهی دارای جهش در کلسینورین توانایی ایجاد بیماری در مدلهای موشی آسپرجیلوزیس تهاجمی را نداشت و در نتیجه ثابت کرد که مهار رشد هایفی آسپرژیلوس فومیگاتوس در شرايط آزمایشگاهی با ناتوانی در ایجاد بیماری در ارتباط است. این نتایج همچنین توسط Ferriera و همکارانش در یک مدل موشی دیگر برای آسپرجیلوز و با یک سویهی جهش یافته دیگر به اثبات رسید.
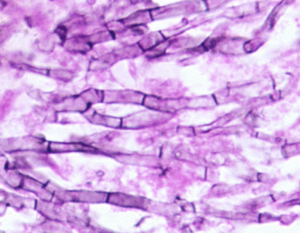
هایفیهای با انشعاب دو شاخهای و دارای تیغهی میانی آسپرجیلوس نیدولانس
تجزیه و تحلیل مسیر سیگنالینگ میانجی شده به وسیله کلسینورین در آسپرژیلوس فومیگاتوس در حال حاضر در حال بررسی است، اگرچه این نتایج اولیه میتواند ژنهای دخیل در رشد و توسعه قارچی را هدفهای خوبی برای داروهای ضد قارچی قرار دهد. دو گروه مهم از مهار کنندههای کلسینورین هماکنون وجود دارند که عبارت از سیکلوسپورین A و FK506 (تاکرولیموس) میباشند. این مهار کنندهها به ترتیب به گیرندههای خود یعنی ایمونوفیلینهای سیکلوفیلین و FKBP12 متصل میشوند و در نهایت کمپلس ایمونوفیلین- دارو عملکرد کلسینورین را مهار میکند، بنابراین اضافه کردن این داروها به داروهای ضد قارچی رایج ممکن است پیامد درمان بیماران مبتلا به آسپرژیلوزیس را بهبود بخشد. اگرچه با درنظر گرفتن طبیعت بسیار حفاظت شدهی مسیر سیگنالینگ کلسینورین (این مسیر در یوکاریوتهای عاليتر از قبیل انسان محافظت شده است) ممکن است که انتخاب مسیر کلسینورین دشوار باشد زیرا باید به نحوی این ناحیه انتخاب شود که بر روی مسیرهای مشابه مربوطه در میزبان اثرات جانبی نامناسبی نداشته باشد. مهار مسیر سیگنالینگ کلسینورین در انسان منجر به افزایش سرکوب ایمنی میشود که خود میتواند عاملی برای بدتر شدن عفونتهای قارچی باشد. واکاویهای بیشتر در مسیر سیگنالینگ کلسینورین در آسپرژیلوس فومیگاتوس ممکن است هدفهای اختصاصی قارچی را آشکار کند که میتواند نسبت به خود کلسینورین هدفهای ضد قارچی بسیار مؤثرتری باشند.
مسیر سیگنالینگ بسیار حفاظت شدهی دیگری که اخیراً در آسپرژیلوس فومیگاتوس کشف شده و ثابت شده است که در پاتوژنز قارچ نقش دارد، سیستمی موسوم به سیستم کنترلی است که بیوسنتز آمینواسیدهای قارچی را تنظیم و تعدیل میکند. Karppaman و همکاران در آسپرژیلوس فومیگاتوس برای پروتئین فعال کننده رونویسی مخمری Gcn4p، یک ارتولوگ را تشخیص دادند و آن را cpcA نامیدند. سویههای جهش یافته آسپرژیلوس فومیگاتوس که فاقد لوکوس cpcA بودند، نسبت به یکی از آنالوگهای تریپتوفان یعنی آنالوگ 5- متیل تریپتوفان حساسیت بیشتری نشان میدادند که در نتیجه به نوعی سبب تحریک پاسخ نیازمندی (گرسنگی) میشد و به دنبال آن رشد سویه جهش یافته کاهش مییافت، اگرچه سویههای جهش یافته در cpcA نهایتاً هیچ نیاز تغذیهای خاصی نداشتند و بنابراین نسبت به هر دو نوع آمینواسیدهای پورینی و پیریمیدینی ابراز تمایل میکردند. جالب اینکه در یک مدل نوتروپنیک آسپرژیلوزیس تهاجمی داخل بینی، سویههای جهش یافته cpcA در حدود 50% کمتر قدرت بیماریزائی و در نتیجه مرگ و میر کمتری داشتند. نویسندگان این مقاله این فرضیه را مطرح کردهاند که کاهش در ویرولانس قارچی میتواند به دلیل عدم بالانس در منبع اسیدآمینههای در دسترس در محیط زنده باشد و یا اینکه cpcA برای رونویسی یک فاکتور ویرولانس شناسائی نشده در آسپرژیلوس فومیگاتوس لازم است. برای روشن کردن نقش دقیق cpcA در آسپرژیلوس فومیگاتوس مطالعات بیشتری مورد نیاز است. این مطالعات این پتانسیل را دارند که اطلاعات مهم در مورد محیط درون ریههای پستانداران که آسپرژیلوس فومیگاتوس را احاطه میکند، آشکار نماید. همچنین نقش سیستم کنترلی در بیماریزائی، مطرح کنندهی این موضوع است که رشد ساپروفیتی و سازگاری میکروبی برای ایفای نقش در پاتوژنز قارچی اهمیت دارد.
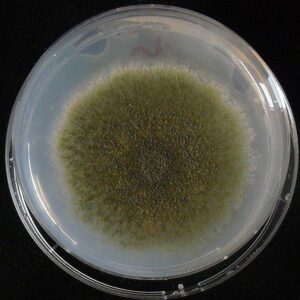
کلنی آسپرجیلوس نیدولانس
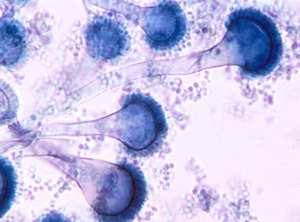
منظره میکروسکپی آسپرجیلوس نیدولانس (کونیدیوفورهای کوتاه)
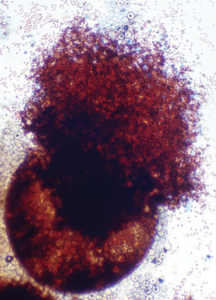
کلیستوتشیوم امرسیلا نیدولانس (آنامورف آسپرژیلوس نیدولانس): آسکوسپورهای فراوان به رنگ قرمز مایل به قهوهای
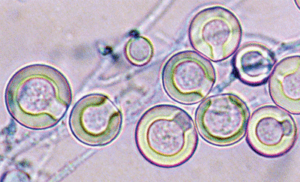
کلیستوتشیاهای آسپرجیلوس نیدولانس، اغلب توسط تودهای از سلولهای Hulle که تا 25 میکرون قطر دارند احاطه شدهاند
متابولیتهای ثانویه
بسیاری از قارچها از جمله گونههای آسپرژیلوسی طیف وسیعی از متابولیتهای فعال زیستی با وزن ملکولی پایین را تولید میکنند. مجموعهی این متابولیتها، متابولیتهای ثانویه نامیده میشوند. از جمله این متابولیتهای نام آشنا، سیکلوسپورین و پنیسیلین را میتوان نام برد. در بسیاری از واکنشهای بین قارچ و گیاه، متابولیتهای ثانویه از عوامل اولیه در بیماریزایی قارچها بشمار میآیند. آسپرژیلوس فومیگاتوس قارچی است که متابولیتهای ثانویه متعددی تولید میکند که بعنوان عوامل سرکوبگر سیستم ایمنی شناخته میشوند و اینطور بیان میشود که این متابولیتهای ثانویه جزء ویژگیهای ویرولانسی بارز این قارچ محسوب میشوند. مطالعات فیلوژنتیک و تجزیه و تحلیل کل سکانسهای ژنومی آسپرژیلوس فومیگاتوس بیانگر توانایی این قارچ در ایجاد متابولیتهای ثانویه متنوع است.
تأئید نقش متابولیتهای ثانویه در پاتوژنز آسپرژیلوس فومیگاتوس را میتوان در سویههایی مشاهده کرد که فاقد فاکتور رونویسی laeA هستند. سویههای جهش یافته laeA یا فاقد گیلوتوکسین، هلولیک اسید، فوماگیلین و یا سایر متابولیتهای ثانویه ناشناخته هستند و یا مقدار گیلوتوکسین، هلولیک اسید (Helvolic acid)، فوماگیلین و یا سایرین در آنها بطور قابل توجهی کم تولید شده است. آنالیز سکانسهای پروتئینی laeA شباهتی با پروتئینهای شناخته شده نداشته است اما بیانگر این موضوع است که laeA ممکن است یک پروتئین متیل ترانسفرازی باشد که در تغییر ساختمان کروماتین دخیل است. از این مهمتر اینکه مشاهده شد که یک سویه از آسپرژیلوس فومیگاتوس فاقد laeA توانایی ایجاد بیماری در مدل آسپرژیلوزیس تهاجمی داخل بینی موشی را نداشتند. این نتایج بیانگر نقش متابولیتهای ثانویه در ایجاد بیماری توسط گونههای آسپرژیلوس داخل بینی است، اما با توجه به نقش دوگانهی laeA اثبات این قضیه به طور قطعی امکان پذیر نیست، اگرچه نویسندگان این فرضیه را مطرح کردهاند که با توجه به خواص سرکوبگری سیستم ایمنی مربوط به گیلوتوکسین، کاهش چشمگیر میزان تولید گیلوتوکسین در سویههای موتان یافتهی laeA میتواند منجر به تولید فنوتیپ غیرویرولان شود.
نقش مستقیم گیلوتوکسین در ایجاد بیماریزایی با ایجاد جهش در gliP که یک پپتید سنتتاز غیر ریبوزومی (مسئول تولید گیلوتوکسین) است مورد آزمایش قرار گرفت. دو آزمایشگاه مستقل با سویههای آسپرژیلوسی و نیز با مدلهای حیوانی متفاوت نتایج یکسانی دربارهی سویههای جهش یافتهgliP به دست آوردند. سویههای جهش یافتهgliP رشد و مورفولوژی نرمالی در شرایط آزمایشگاهی از خود نشان دادند، همچنین نسبت به سویههای وحشی مرتبط، در مدلهای آسپرژیلوزیس تهاجمی به طور مساوی ایجاد مرگ و میر کردند. این نتایج نشان داد که گیلوتوکسین برای پیشرفت بیماری در این مدلهای موشی مورد نیاز نیست.
اگرچه گیلوتوکسین یک سرکوبگر ایمنی قوی در این مدلهای موشی بود، اما همانند طیف وسیع بیماران آسپرژیلوسی که قبل از عفونت قارچی نقص ایمنی شدید در آنها وجود دارد، تنها فعالیت اضافی گیلوتوکسین برای ایجاد سرکوب ایمنی و در نتیجه شکل گیری بیماری ضروری نیست. با این وجود این، نتایج به دست آمده نمیتواند نفی کنندهی تأثیرگذاری گیلوتوکسین در فرم مزمن آسپرژیلوزیس همانند آسپرژیلوز برونکوپولمونری آلرژیک باشد و یا حتی نقش گیلوتوکسین در ایجاد نقص ایمنی هرچند به صورت خفیف در بیماران را نمیتوان منتفی دانست. در واقع عصاره محیط کشت سویههای جهش یافته gilP که فاقد گیلوتوکسین بودند قادر به مهار دگرانولاسیون ماستسلها به واسطه ionomycin نبود و این موضوع بیانگر این مسئله بود که گیلوتوکسین میتواند در ایجاد تعادل ایمنی در فرم مزمن آسپرژیلوزیس دخیل باشد، علاوه بر آن گیلوتوکسین میتواند توانایی بازسازی سیستم ایمنی پس از پیوند عضوکامل و یا پیوند مغز استخوان را تحت تأثیر قرار دهد. به هر حال نقش دقیق تولید گیلوتوکسین در آسپرژیلوزیس هنوز بطور کامل درک نشده است.
یکی دیگر از مکانیسمهای تعدیل ایمنی در آسپرژیلوس فومیگاتوس و سایر گونههای آسپرژیلوسی تولید پروستاگلاندینها است. پروستاگلاندینها، ایکوزانوئید هستند و شامل زیرکلاس C20 اکسیلیپینها میباشند. ایکوزانوئیدها به عنوان موادی که در فعالیتهای مختلف سیستم ایمنی همانند تنظیم التهاب، درد و پاسخهای آلرژیک نقش دارند شناخته میشوند. این فرضیه مطرح است که تولید ایکوزانوئیدها و سایر اکسیلیپینها در درمان عفونتهای قارچی میتواند بکار گرفته شود. در یک تحقیق از روش RNA silencing برای خاموش کردن سه ژن سیکلواکسیژناز (ppoA,ppoB,ppoC) که گمان میشد در تولید پروستاگلاندینها در آسپرژیلوس فومیگاتوس نقش دارند، استفاده شد. این خاموش کردن منجر به عدم آشکارسازی پروستاگلاندین در عصاره محیط کشت شد و جالبتر اینکه افزایش ویرولانس در یک مدل موشی آسپرژیلوزیس مهاجمی پارانازال مشاهده شد. البته برای درک بهتر نقش ملکولهای کوچک در روابط میزبان و قارچ نیاز به انجام تحقیقات بیشتر بر روی مدلهای حیوانی است.
محیط میزبان نقش مهمی در تعیین پیامدهای مربوط به عفونتهای میکروبی دارد. یکی از نیازهای تغذیهای باکتریها و قارچها که در بدن انسان به آسانی در دسترس نیست، آهن است. قارچها و باکتریها هر دو متابولیتهایی با وزن ملکولی پایین به نام سیدروفور تولید میکنند که با میل ترکیب بالایی به آهن سه ظرفیتی متصل میشوند. نقش آهن در بیماریزایی باکتریها به طور کامل و وسیعی تأئید شده و اخیراً هم مشاهده شده است که تولید سیدروفورها در آسپرژیلوس فومیگاتوس برای ایجاد عفونت ضروری است. آسپرژیلوس فومیگاتوس قادر به رشد در سرم انسانی با مقادیر کم آهن است و این مسئله اینطور توجیه میشود که این زنده ماندن به سبب تولید سیدروفورها میباشد. اثبات این قضیه با ایجاد جهش در ژن تولید کننده سیدروفور در آسپرژیلوس فومیگاتوس یعنی ژن sidA انجام پذیرفت. ژن sidA، ال- اورنیتین (N-5 اکسیژناز) را که اولین قدم در بیوسنتز سیدروفور هیدروگزامات است را کد میکند. حذف ژن sidA سبب نقص شدید در رشد قارچ در محیط کشت و سرمی که غلظت پایینی از آهن دارد، میشود. مشاهده شد که سویههای فاقد ژن sidA توانایی تولید موادی همچون تری استیل فوزارین C و یا سیدروفورهای فریکروسین را ندارند و مهمتر اینکه سویههای جهش یافته فاقد sidA توانایی ایجاد بیماری در مدل موشی آسپرژیلوزیس تهاجمی داخل بینی را دارا نیستند. در واقع این موضوع که موشهایی که با سویههای موتانت فاقد sidA دچار عفونت شده بودند در نمونههای بافت ریهی آنها هیچ اثری از اسپور و یا هایف قارچی دیده نشد و یا اینکه کم و پراکنده بود، بیانگر این موضوع بود که سویههای جهش یافته فاقدsidA در محیط بدن نمیتوانند رشد کنند، بنابراین توانایی جارو کردن آهن از درون ریه افراد دچار نقص ایمنی یکی از ویژگیهای ویرولانسی مهم برای زنده ماندن آسپرژیلوس فومیگاتوس در محیط بدن میزبان است. افراد دارای بدخیمیهای خونی که در معرض ریسک بالای ابتلاء به آسپرژیلوزیس تهاجمی هستند همواره مقادیر بالایی از خون دریافت میکنند که آهن اگزوژن را برای ارگانیسم فراهم میکند، بنابراین ارائه یک راهکار درمانی که بتواند توانایی برداشت آهن آسپرژیلوس فومیگاتوس را کاهش دهد میتواند نتایج حاصل از درمان را افزایش دهد.
مقاومت دمایی
توانایی آسپرژیلوس فومیگاتوس در زنده ماندن در دمای 70 درجه سانتیگراد در میان خانواده آسپرژیلوسها و بطور کلی در سلسله قارچها یکی از ویژگیهای منحصر به فرد این قارچ میباشد. این فنوتیپ مقاوم نسبت به دمای بالا به نظر میرسد که یکی از نشانهای ویرولانس برای آسپرژیلوس فومیگاتوس باشد. بررسی ملکولی ژنهای دخیل در ویژگی تحمل دمایی اخیراً این فرضیه را روشن کرده است.
برای رشد در دمای 42 درجه سانتیگراد وجود یک ژن ضروری است، این مطلب بوسیله عدم رشد سویهای که فاقد این ژن است نیز نشان داده شده است. ژن THTA عملکرد شناخته شدهای ندارد اما حذف این ژن در یک سویهی وحشی آسپرژیلوس فومیگاتوس نقش آن را در رشد ترموتولرانت تأئید میکند، اگرچه ویرولانس سویههای فاقد ژن THTA در مدل موشی آسپرژیلوزیس مهاجم تحت تأثیر قرار نگرفته است که این نشان دهندهی این موضوع است که رشد در دمای فیزیولوژیک بوسیلهی از دست دادن THTA تحت تأثیر قرار نمیگیرد، بنابراین با وجود اینکه توانایی رشد در دماهای فیزیولوژیک برای ایجاد بیماری مؤثر است، اما در حالیکه رشد در دماهای فیزیولوژیک به وضوح برای ایجاد بیماری ضروری است، رشد ترموتولرانت ممکن است یک نشان ویرولانت مربوط به این ارگانیسم نباشد. اهمیت رشد در دماهای فیزیولوژیک با ایجاد جهش در یک ژن مسئول در بیوژنز ریبوزومی تأئید شد. حذف ژن cgrA سبب تأخیر در ژرمیناسیون میشود و رشد در دمای 37 درجه سانتیگراد را هم کاهش میدهد. سویههای فاقد ژنcgrA کاهش بسیار چشمگیری در ایجاد بیماری در مدلهای موشی آسپرژیلوزیس مهاجم و مدلهای مگس میوه Drosophila فاقد TLR داشتند. کاهش ویرولانس در مدل دروزوفیلا که در دمای 25 درجه نشان داده شده همچنین به اهمیت ژرمیناسیون کونیدیال در زمان مناسب در پاتوژنز آسپرجیلوس فومیگاتوس اشاره میکند. به طور مشخص ژنهای مورد نیاز در زنده ماندن قارچ و یا میزانهای رشد مطلوب، در دماهای فیزیولوژیک هدفهای بسیار خوبی برای طراحی داروهای ضد قارچی هستند.
استرس اکسیداتیو
این یک قضیه کاملاً مشخصی است که بسیاری از ارگانیسمهای پاتوژن برای پستانداران در مراحل بیماریزایی خود در معرض استرس اکسیداتیو نیز هستند و آسپرژیلوس فومیگاتوس نیز از این قضیه مستثنی نیست. کنیدیهای قارچی استنشاق شده به وسیله ماکروفاژهای آلوئولاری که متابولیتهای فعال اکسیژنی (ROS) را تولید میکنند که توانایی کشتن کنیدیهای قارچی را دارند، مورد حمله قرار گرفته و بلعیده میشود. هایفهای قارچی رشد یافته در پستانداران نیز به وسیله نوتروفیلهایی که متابولیتهای فعال اکسیژن (ROS) تولید میکنند مورد حمله قرار میگیرند؛ برای مثال در بیماری گرانولوماتوز مزمن (CGD) که با نقص انفجار تنفسی در سلولهای ایمنی شناخته میشود، بیشتر افراد به عفونتهای ناشی از آسپرژیلوس نیدولانس مبتلا میشوند تا آسپرژیلوس فومیگاتوس و این بیانگر این مسئله است که توانایی آسپرژیلوس فومیگاتوس برای تحمل شرایط استرس اکسیداتیو نسبت به آسپرژیلوس نیدولانس بیشتر است.
بررسیهای ملکولی ژنهای دخیل در تحمل شرایط استرس اکسیداتیو در آسپرژیلوس فومیگاتوس بیانگر نقش مهم این ویژگی ویرولانسی در ایجاد پاتوژنز قارچی است؛ برای مثال مشخص شده است که ژنهای دخیل در سیگنالینگ cAMP برای بیماریزایی این قارچ حائز اهمیت هستند و در مثالهای دیگر کنیدیهای سویههای جهش یافته فاقد آدنیلات سیکلاز و یا سویههای فاقد زیرواحد آلفا G پروتئین (gpaB) توسط مونوسیتهای مشتق شده از ماکروفاژهای انسانی راحتتر کشته میشدند. یکی از توضیحات قابل قبول برای این موضوع میتواند این باشد که مسیر سیگنالینگ cAMP در تنظیم بیان ژن pksP دخیل است و از قضا این ژن نیز وظیفهی کد کردن یک پلیکتاید (polyketide) را به عهده دارد که این پلیکتاید خود در سنتز ملانین مؤثر است. سویههای جهش یافته فاقد ژن pksP کنیدیهای سفیدتری نسبت به کنیدیهای خاکستری رنگ سویههای وحشی دارند و همچنین این سویههای جهش یافته نسبت به استرس اکسیداتیو حساستر هستند. اینطور گمان میشود که ملانین، قارچها را در برابر استرس اکسیداتیو، اشعه uv و استرس ناشی از آنزیمها محافظت میکند، بنابراین تنظیم تولید ملانین به وسیله مسیر سیگنالینگ وابسته به cAMP برای پاتوژنز قارچی لازم است. اگرچه تولید ملانین در طیف وسیعی از قارچهای ساپروفیت مشاهده میشود و نقشی که ملانین در مراحل بیماریزایی در موجود زنده بازی میکند برای داشتن زندگی ساپروفیتی در محیط نیز نسبتاً ضروری است. مسیر آبشاری سیگنالینگ cAMP بیانگر این موضوع است که برای ایجاد یک بیماری شبکه گستردهای از این فاکتورهای تنظیمی با همدیگر همساز میشوند تا یک بیماری را به وجود آورند و با توجه به اینکه قارچ در محیط بدن یک فرد مبتلا به نقص ایمنی قرار گرفته و یا اینکه درون یک کمپوست است فعل و انفعالات پیچیده ی ژنتیکی رخ میدهد تا ارگانیسم قارچی بتواند در آن شرایط بحرانی زنده بماند.
ویژگیهای ویرولانسی آسپرژیلوس فومیگاتوس از کجا نشأت میگیرند؟
آزمایش ویژگیهای ویرولانسی آسپرژیلوس فومیگاتوس و همچنین ژنهای دخیل در این ویرولانس این سؤال مهم را مطرح ميكند که آیا این ویژگیهای ویرولانسی در طول دورهی تکاملی جاندار به سبب فشارهای انتخابی که در تعامل با میزبان پستاندار بوده است به وجود آمدهاند و یا اینکه این ویژگیهای ویرولانسی ناشی از فشارهای انتخابی محیطی است که هم برای انجام ویرولانس قارچی کمک کننده هستند و هم به صورت ترکیبی اجازه میدهند که آسپرژیلوس فومیگاتوس در میزبان نقص ایمنی ایجاد عفونت کند؟ اگرچه مطالعات مستقیمی که به این سؤال پاسخ بدهد هنوز دربارهی آسپرژیلوس فومیگاتوس در حال انجام است اما میتوان این استدلال را مطرح کرد که هیچیک از ژنهای موجود در جدول 2 فاکتورهای ویرولانس کلاسیک نیستند. در عوض برای توضیح این موضوع که علت بیان این ژنها چیست میتوان به فشارهای انتخابی ناشی از خاستگاه طبیعی آسپرژیلوس فومیگاتوس یعنی خاک رجوع کرد. در نهایت فشارهای انتخابی ناشی از این محیط به خصوص کمپوستی که آسپرژیلوس فومیگاتوس مکرراً در آن یافت میشود بیان میکند که یک بیان منحصر به فرد و همزمان این ویژگیهای ویرولانسی به آسپرژیلوس فومیگاتوس این اجازه را میدهد که در میزبان داراي نقص ایمنی بتواند زندگی کند. منبع ممکن برای این فشارهای انتخابی میتواند استرس دمایی موجود در کمپوست، رقابت با سایر میکروارگانیسمها برای دستیابی به منابع محدود غذا، شکار به وسیله تک یاختهها و نماتودهای موجود در خاک و در معرض قرار گرفتن در برابر نورuv باشد. این مسئله است که میتواند بیان کند که چگونه این فشارهای محیطی می تواند علت پیدایش بسیاری (نه همه) از ویژگیهای ویرولانسی آسپرژیلوس فومیگاتوس باشد که تاکنون کشف شده است.
پیشرفتهای جدید در درک مکانیسمهای بیماریزایی قارچهای فرصت طلب
پیشرفتهای جدید در درک مکانیسمهای بیماریزایی قارچهای فرصت طلب (3)
پیشرفتهای جدید در درک مکانیسمهای بیماریزایی قارچهای فرصت طلب (4)
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام