تولید پلاستیک زیستی (پلیهیدروکسی آلکانوات) بهوسیله میکروارگانیسمها
(قسمت چهارم)
وهاب پیرانفر (کارشناس ارشد)، محمد عرفانی (کارشناس ارشد)، دکتر رضا میرنژاد (دانشیار دانشگاه)
در قسمتهای قبل در خصوص پلاستیک زیستی (پلیهیدروکسی آلکانوات) ازجمله ساختار، ویژگیها، خصوصیات فیزیکی و راههای سنتز این ماده و تولید توسط بعضی از میکروارگانیسمها مطالبی ارائه شد که در این بخش به ادامه تولید آن از طریق نوترکیب و استخراج بیوپلاستیک از توده زیستی اشارهای کوتاه میگردد.
تولید پلیهیدروکسی آلکانوات بهوسیله اشریشیاکلی نوترکیب
اشریشیاکلی کاربردهای فراوانی ازجمله آنالیز سریع مولکولی بیوسنتز پلیهیدروکسی آلکانوات، سنتز بیوپلیمر داخل سلولی در سطح بالا و جوابگو بودن در استراتژیهای ژنتیکی را دارا میباشد. مطالعات نشان داده است که سنتز پلیهیدروکسی بوتیرات بهوسیله اشریشیاکلی نوترکیب نیاز به محدودیت غذایی خاصی ندارد، ولی وابسته به مقدار استیلکوآنزیمآ موجود میباشد. از مزایای استفاده از اشریشیاکلی نوترکیب برای تولید پلیهیدروکسی آلکانوات میتوان به رشد سریع، چگالی بالای سلولی، قابلیت استفاده از منابع ارزان و خالصسازی آسان اشاره کرد. با توجه به گستردگی دانش در رابطه با ژنتیک اشریشیاکلی، افزایش مقدار معلومات مرتبط با وقایع متابولیکی سنتز پلیهیدروکسی آلکانوات ضروری است، بهطورکلی اشریشیاکلی نقش قابلتوجه خود را در تعیین و تشخیص مکانیسمهای سنتز پلیهیدروکسی آلکانوات و احتمالاً تولید تجاری آن ادامه خواهد داد.
در مطالعات مختلفی تولید پلیهیدروکسی آلکانوات بهوسیله اشریشیاکلی نوترکیب حامل ژنهای بیوسنتزکننده پلیهیدروکسی آلکانوات از باکتری رالستونیا اتروفا بررسی گردید. این مطالعات نشان دادند که این اشریشیاکلی نوترکیب میتواند ۸۰ تا ۹۰ درصد از وزن خشک خود را در پایان کشت به پلیهیدروکسی بوتیرات اختصاص دهد. غلظت پلیهیـدروکسی بوتیرات بیش از ۸۰ گرم در لیتر با بهرهوری بیش از ۲ گرم در ساعت در کشت فید-بتچ مشاهده شد، ولی درعینحال مشکل نیاز بالا به اکسیژن در طی تخمیر باید حل گردد تا اجازه بدهد که این فرآیند مفید، و جایگزین خوبی برای روش امروزی واقع شود. از مولاز[1] اغلب برای تولید پلیهیدروکسی بوتیرات از اشریشیاکلی نوترکیب HMS174/pTZ18u-PHB که حاوی پلاسمید TZ18u-PHB میباشد، استفاده میشود. این پلاسمید حاوی ژنهای بیوسنتزکنندهی پلیهیدروکسی آلکانوات رالستونیا اتروفا و ژن مقاومت به آمپیسیلین[2] میباشد. وزن خشک نهایی و محتوای پلیهیدروکسی بوتیرات بعد از ۳۵ ساعت تخمیر به ترتیب 5/39 گرم در لیتر و ۸۰ درصد بدست آمد. با دستکاری اشریشیاکلیXL1-Blue حاوی پلاسمید pKSSE5.3 باعث تولید هوموپلیاستر پلی4-هیدروکسی بوتیریک اسید با استفاده از محیط معدنی حاوی گلوکز و
4-هیدروکسی بوتیریک اسید بهعنوان منبع کربن و در pH ثابت طی تخمیر فید-بتچ میگردد. در این صورت وزن خشک سلول نهایی و پلی4-هیدروکسی بوتیریک بعد از ۶۰ ساعت به ترتیب 12/6 و 4/4 گرم در لیتر حاصل میگردد.
اشریشیاکلی نوترکیب حاوی ژنهای بیوسنتزکننده پلیهیدروکسی آلکانوات در ائروموناس، تولید تریپلیمری پلی3-هیدروکسی بوتیرات-کو-3-هیدروکسی والرات-کو-3-هیدروکسی هگزانوات با استفاده از دوکانوئیک اسید همراه با اسیدهای چرب با زنجیره کربنی فرد را سبب میشود. سویهای از اشریشیاکلی نوترکیب گزارش شده است که کوپلیمرپلی 3-هیدروکسی بوتیرات-کو-4-هیدروکسی بوتیرات را به هنگام رشد بر روی محیط مرکب حاوی گلوکز تولید میکند. این فرآیند بهوسیله اشریشیاکلی DH5α با پلاسمیدهای جداگانه انجام شد. این پلاسمیدها به ترتیب حاوی ژنهای بیوسنتزکننده پلیهیدروکسی آلکانوات رالستونیا اتروفا و ژنهای تخریب سوکسینات[3] از باکتری کلستریدیوم کلایوری[4] بودند.
در یک مطالعه قطعهای از DNA باکتری استرپتومایسس ائروفاسینس[5] NRRL 2209 را در وکتور پلاسمیدی کلون و پس از آن وارد اشریشیاکلی کردند. اشریشیاکلی نوترکیب حاصله پلیهیدروکسی بوتیرات را بهصورت انکلوزیونهای سیتوپلاسمی با وزن مولکولی ۲۸ کیلو دالتون ذخیره کردد. این اشریشیاکلی نوترکیب ۲۵ تا ۲۸ برابر بیشتر نسبت به استرپتومایسس ائروفاسینس بومی[6] که بر روی گلیسیرول رشد کرده بود، پلیهیدروکسی بوتیرات ذخیرهسازی کرد.
در یک تحقیق سویه جدید اشریشیاکلی نوترکیب VG1- pTU14 بهوسیله کلونینگ ژن گلوبین ویتروسیلا[7] از باکتری ویتروسیلا[8] به داخل اشریشیاکلی حاصل شد. داخل کردن این نهتنها سبب کاهش غلظت اکسیژن بحرانی میشود، بلکه بر ضریب انتقال حجمی اکسیژن در سویه نوترکیب اثر میگذارد. در ابتدا kLa بسیار بالا بود و با رشد سلولهای VG1- pTU14، سریعاً کاهش پیدا کرد و اکسیژن نامحلول را به کمتر از ۵۰ درصد رساند؛ بنابراین چگالی بالای سلول و ذخیره پلیهیدروکسی بوتیرات با هزینه تولید پایین در غلظت پایین اکسیژن نامحلول، بدست آمد.
علاوه بر میکروارگانیسمهای فوقالذکر تولید پلیهیدروکسی بوتیرات بهوسیله تایوسفرا پنتوتروفا[9]، کالوباکتر کریسنتوس[10] DSM 4727، گونه ازتوباکتر سویه FA8، گونه سینکوکوکوس[11] MA19، سینکوسیتس[12] PCC6803، رودوموناس پالوستیریس[13] 42OL، باسیلوس سرئوس UW85، گونه زوگلوا Z5 GII، متیلوباکتریوم رودوسیانوم[14] MB 126، متیلوباکتریوم اکستورکوئنس[15] P14، باسیلوس مایکوئیدز[16] RLJ B-017، آزوسپیریلوم برازیلینس[17] و آمریکوکوکوس کاپلیسنسیس[18] هم صورت میگیرد، هرچندکه تاکنون هیچ گزارشی از تولید انبوه پلیهیدروکسی بوتیرات توسط کشتهای این میکروارگانیسمها وجود ندارد.
استخراج پلیهیدروکسی آلکانوات
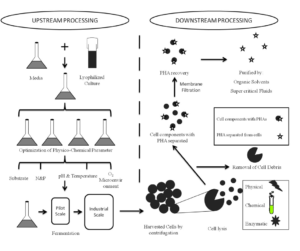
استخراج بیوپلاستیک از توده زیستی یکی دیگر از چالشهای تولید این ماده بشمار میآید. یک سیستم استخراج کارآمد به معنی کاهش هزینه تولید میباشد. بهترین زمان برای استخراج پلیهیدروکسی آلکانوات بلافاصله بعد از اتمام منبع کربن و قبل از شروع تجزیه آن بهوسیله آنزیم دپلیمراز میباشد. در حال حاضر چندین روش برای استخراج پلیهیدروکسی آلکانوات از میکروارگانیسمها وجود دارد که دو روش زیر رایجتر میباشند (جدول و شکل 1):
روش اول بر اساس حلالیت پلیهیدروکسی آلکانوات در کلروفرم و نامحلولی در متانول میباشد. لیپیدها و دیگر اجزای چربیدوست در سلول باکتری بهوسیله فرورفتن در متانول داغ و به دنبال آن حل شدن پلیهیدروکسی آلکانوات در کلروفرم گرم از سلول جدا میشوند. پلیهیدروکسی آلکانوات محلول در کلروفرم را میتوان به روش تبخیر حلال و یا رسوب دادن آن بهوسیله متانول بازیافت کرد. البته استفاده از استون برای استخراج پلیهیدروکسی آلکانوات نیز گزارش شده است. اگرچه خلوص بالایی از پلیهیدروکسی آلکانوات بهواسطه این روش تهیه میشود، اما استفاده از این محلولها بسیار خطرناک بوده و نیاز به تکرار دارد، ازاینرو این روش نه سازگار با محیطزیست و نه برای تولید بیوپلاستیک مقرونبهصرفه است (شکل و جدول 1).
دومین روش برای جلوگیری از مصرف حلالهای آلی طراحی شده است. سلولهای باکتریایی بهوسیله ترکیبی از آنزیمها (پروتئازها، نوکلئازها و لیزوزیمها) و دترجنت[19]ها برای خارجسازی پروتئین، اسیدنوکلئیک و دیواره سلولی باکتری، تیمار میشوند و درنهایت پلیهیدروکسی آلکانوات دستنخورده باقی میماند.
باکتری باسیلوس مگاتریوم[20] دارای یک سیستم خودتخریبی میباشد. در این باکتری یک کاست ژنی، سیستم لیز سلولی را حمل میکند. این کاست بهوسیله شاتل وکتور[21] باسیلوس سوبتیلیس در باکتری اشریشیا کلی قرار میگیرد. در بیان این کاست، ژنهای xylA و xylR، ژنهای هدف میباشند که بهوسیله زایلوز[22] تحریک و بهوسیله گلوکز محدود میشوند. همزمان با لیز خودبخودی سلولی و اتمام سوبسترا، پلیهیدروکسی آلکانوات ذخیرهشده، رها میشود. بهرهوری از این فرآیند تنظیمی میتواند بهوسیله دستکاری YoeB که یک پروتئین وابسته به دیواره سلولی است، افزایش پیدا کند.
شکل 1: شمای تولید و روشهای مختلف استخراج بیوپلاستیک
جدول 1: روشهای استخراج بیوپلاستیک در میکروارگانیسمهای مختلف
| Classes | Techniques | Acting Principle | Microorganism |
|
Physical/ Mechanical Disruption |
Thermolysis | Disruption of Cell wall by the affect of ionic strength, pH and temperature with chelating agent | |
| Ultrasonication | Ultrasonic waves, followed by centrifugation | Bacillus flexus | |
| Bead Mill | Grinding cylinder containing beads made of wear resistant materials like glass, alumina, titanium carbide, zirconium oxide and zirconium silicate is driven by motor | Alcaligenes latus | |
|
High Pressure Homogenizer
|
Disrupter fitted with a displacement pump monitors the pressure and a discharge valve to homogenize the solution pushed through pump | Gram Negative Bacteria | |
| Chemical Disruption | Alkali Treatment | Exposure to basic pH (mild alkaline hydrolysis) | Bacillus flexus |
| Detergent Solubilization | Detergents like SDS, CTAB, Triton X 100, Saponins, Tween 20 and Tween 80 etc, are used | Ralstonia eutropha | |
| Cell Wall Permeabilisation |
Organic solvents like toluene, acetone, chloroform and ethylene carbonate are used, followed by non-solvent precipitation |
Bacillus cereus SPV and Cupriavidus necator, respectively.
|
|
| Enzymatic Disruption | Lytic enzymes in medium with detergent or chelating agent | Cupriavidus necator | |
منابع:
- Shilpi, K. Ashok, K.S. 2005, Recent advances in microbial polyhydroxyalkanoates. Process Biochemistry(40), 607–619.
- Pornpa, S. Randall, W. Suresh, N. Maurice, M. Saleh, S. 2007, Biotechnological approaches for the production of polyhydroxyalkanoates in microorganisms and plants — A review. Biotechnology Advances (25), 148–175.
- Mamtesh, S. Sanjay, K.P. Vipin, C.K. 2009, Bacillus subtilis as potential producer for polyhydroxyalkanoates. Microbial Cell Factories (8), 1-11.
- Huimin, Y. Yue, S. Yanping, Z. Shengli, Y. Zhongyao, S. 2002, E¡ect of Vitreoscilla hemoglobin biosynthesis in Escherichia coli on production of poly (β-hydroxybutyrate) and fermentative parameters. FEMS Microbiology Letters (214), 223-227.
- Xuan, J. Juliana, A.R. Bruce, A.R. 2006, Acetone extraction of mcl-PHA from Pseudomonas putida Journal of Microbiological Methods(67), 212–219.
- Girdhar A, Bhatia M, Nagpal S, Kanampalliwar A, Tiwari A.2013. Process Parameters for Influencing Polyhydroxyalkanoate Producing Bacterial Factories: An Overview. J Phylogenetics Evol Biol 4:155.
[1] Molasse
[2] Ampicillin
[3] Succinate
[4] Clostridium kluyveri
[5] Streptomyces aureofaciens
[6] Native S. aureofaciens
[7] Vitreoscilla globin gene (vgb)
[8] Vitreoscilla
[9] Thiosphaera pantotropha
[10] Caulobacter crescentus
[11] Synechococcus
[12] Synechocystis
[13] Rhodopseudomonas palustris
[14] Methylobacterium rhodesianum
[15] Methylobacterium extorquens
[16] Bacillus mycoides
[17] Azospirillum brasilense
[18] Americoccus kaplicenses
[19] Detergent
[20] Bacillus megaterium
[21] Shuttle Vector
[22] Xylose
تولید پلاستیک زیستی (پلیهیدروکسی آلکانوات) بهوسیله میکروارگانیسمها (1)
تولید پلاستیک زیستی (پلیهیدروکسی آلکانوات) بهوسیله میکروارگانیسمها (2)
تولید پلاستیک زیستی (پلیهیدروکسی آلکانوات)(3)
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام