اساس کار و انواع روشهای وسترن بلات (Western Blotting)
داود قاسمی1، نوشین زمانپور2
1- دانشجوی کارشناسی ارشد ایمونولوژی پزشکی، مرکز تحقیقات آلرژی و بیماریهای آلرژیک، دانشگاه علوم پزشکی مشهد
2-دانشجوی کارشناسی ارشد زیست فناوری میکروبی، گروه زیستشناسی دانشکده علوم، دانشگاه فردوسی مشهد
چکیده:
وسترن بلات (پروتئین بلات، ایمونوبلات) روشی نیرومند برای آشکارسازی پروتئینها پس از الکتروفورز میباشد که به ویژه در مورد پروتئینهای با غلظت پایین مناسب است. این تکنیک در سال 1979 توسط توبین[1] و همکاران ابداع گردید. این مقاله مروری انواع مختلفی از روشها که برای انتقال پروتئین از ژل به غشا وجود دارد، مانند: انتشار ساده[2]، جریان حلال وابسته به خلأ[3] و جداسازی الکتروفورتیک[4] را معرفی میکند و در نهایت مختصری دربارهی روشهایی که به منظور آشکارسازی آنتیژنها استفاده میشود بیان میگردد.
واژگان کلیدی: وسترن بلات، سدیم دو دسیل سولفات پلیآکریل آمید ژل الکتروفورزیس[5]، نیتروسلولوز؛ غشاء پلیوینیلیدین دیفلوراید[6]؛ روشهای آشکارسازی.
مقدمه:
استفاده از توان حلکنندگی بالای الکتروفورز برای اهداف محدودی بود، به این دلیل که جداسازی پروتئینها در ماتریکس ژل بخاطر عدم دسترسی به جستجوگرهای مولکولی محدود و البته سخت بود، تا اینکه تکنیکی معرفی گردید که اجازه میداد پروتئینها از ژل به غشای جاذب منتقل گردند. ساترن[7] در سال 1975 روش DNA بلاتینگ را ابداع کرد و آن را ساترن بلات[8] نامید (1) و سپس الوین[9] و کمپ[10] در سال 1977 RNA Blotting را ابداع کردند و آن را نوترن بلات[11] نامیدند (2) و پس از آن توبین در سال 1979 پروتئین بلاتینگ را ابداع کرد (3).
به منظور حفظ نامگذاری جغرافیایی که به وسیله ساترن صورت گرفته بود، بورنت[12] واژه وسترن بلات را برای آنچه که توبین ابداع کرده بود برگزید (4).این روش ابزاری نیرومند برای ردیابی پروتئینهای چندگانه بود، بویژه در مورد پروتئینهایی که فراوانی کمتری دارند. این روش شامل انتقال پروتئینهای جداشده بر روی SDS-PAGE بر روی یک غشا یا فاز جامد دیگر است (3).
جدا نمودن پروتئینها بر روی یک فاز جامد امکان انجام آزمایشات متعدد را بر روی این پروتئینها فراهم میآورد. قدم بعدی طراحی Ab برضد پروتئینهای چسب شده به نیتروسلولوز میباشد که موجب انقلابی در علم ایمونولوژی شد.
- راندمان بلاتینگ پروتئین:
دو فاکتور اصلی بر روی کارایی پروتئین اثرگذار است:
- کارایی الوت کردن پروتئین به خارج از ماتریکس ژل
- کارایی اتصال پروتئین به غشا
1.1.1) کارایی الوت کردن پروتئین به خارج از ماتریکس ژل:
همه تکنیکهای بلاتینگ نیازمند انتقال موفقیتآمیز پروتئین از ژل به یک فاز جامد هستند، بنابراین بیشتر ملاحظات میبایست بر روی ماهیت ژل مورد استفاده باشد. به طور کلی پایینترین درصد از آکریلآمید و اتصال متقاطع[13] موجب انتقال آسانتر از ژل به فاز جامد میشود. در صورت استفاده از ژلهای نازک، انتقال آسانتر و کاملتر خواهد بود اما ممکن است موجب مشکلاتی در جابجایی گردد. استفاده از ژلهای خیلی نازک[14] میتواند موجب مشکلات انتقالی گردد و غشاهای با ضخامت کمتر از 0.4mm دارای محدودیتهای کاربردی هستند (5).
بلات کردن پروتئینها با وزن مولکولی بالا روی SDS-PAGE ضعیف بوده و منجر به میزان پایینی از ایمونوبلاتینگ[15] میشود، بنابراين محققاني كه بر روي پروتئينهاي بزرگ كار ميكنند به دنبال افزايش راندمان انتقال پروتئين به وسيله افزايش ميزان مهاجرت پروتئيني از ژل به غشا به وسيله روشهايي كه دامنه آنها از تكهتكه كردن ژل تا تجزيه پروتئوليتيكي جزئي پروتئينها پيش از انتقال ميباشند، هستند (8-6).
1.1.2) كارايي اتصال به غشا (5)
در این قسمت نوع و ماهیت غشای مورد استفاده بسیار تأثیرگذار است که در زیر انواع غشاهای استفاده شده در روش وسترن بلاتینگ بیان میشود.
نيتروسلولوز، پليوينيليدين ديفلورايد (PVDF) که يك كاغذ فعال شده يا نايلون فعال شده است كه به صورت موفقيتآميزي براي اتصال به پروتيئنهاي انتقاليافته استفاده ميشود (9،7،3). بيشترين غشای استفاده شده نيتروسلولوز است كه البته داراي معايبي نيز ميباشد؛ براي نمونه به صورت كووالان به پروتئينها چسب نميشود، هنگام خشك شدن بسيار شكننده است، پروتئينهاي كوچك تمايل دارند به سرعت از ميان غشای نيتروسلولوزي عبور كنند و تنها قطعات كوچكي از مقدار كل پروتئينها متصل باقي ميمانند. اين مشكل ميتواند با استفاده از غشاهايي با سوراخهاي كوچكتر برطرف گردد.
در مورد نيتروسلولوز فشار مكانيكي روي غشا نشان داده است كه ميتواند باعث بهبود ترتيب شبكه پلياستري غشا شود كه به موجب آن باعث جابجایی[16] راحتتر ميشود. يكي از مزاياي الكتروبلاتينگ پروتئينها بر روي غشا PVDF اين است كه اين غشا را ميتوان با رنگ CBB (Coomassie Brilliant Blue) رنگ كرد اما غشای نيتروسلولوزي را نميتوان با آن رنگ كرد.
غشاهاي فعال شده (با گروههاي ديازو) موجب ميشوند كه پروتئينها به صورت كووالان به آنها چسب شوند اما نقطه ضعف اساسی آنها اين است كه پيوند با آمين آغازي برقرار ميكنند و بنابراين براي الكتروفورز نيازمند بافری ویژه هستيم و بنابراین گروههای بدون آمين آزاد ميبايست با اين غشاها الكتروبلاتينگ شوند. علاوه براين، اين غشاها گران بوده و گروههاي واكنشگر نيز داراي نيمه عمر پاييني هستند.
2) روشهايي براي انتقال پروتئينها از ژل به غشا:
انتقال پروتئينها از ژل SDS-PAGE به غشا از 3 راه مختلف امكانپذير است:
- انتشار ساده (Simple diffusion)
- جريان حلال وابسته به خلأ (vacuum blotting)
- وسترن بلاتينگ (Electro blotting)
2.1) انتشار ساده (10،6)
لكهگذاري انتشاري نخستين بار به عنوان روشي براي انتقال پروتئينهاي جداسازي شده به وسيله ايزوالكتريك فوكوسينگ روي ژلهاي نازك بر روي غشا توسعه يافت (11،10). اين روش نيازمند خشك كردن غشا با كاغذ فيلتري كه روي غشا قرار ميگيرد ميباشد. همچنین يك صفحهی شيشهاي و يك جسم با وزن مخصوص (تامین فشار لازم) روي مجموعهی مذکور به منظور سهولت انتشار قرار داده ميشود. در سال 1997 کورین[17] و اسکوفید[18] روش جديدي را ابداع كردند؛ آنها ژل را بين دو غشا قرار دادند كه اين غشاها همراه با فيلتر و ظرف شيشهاي بود و در نتيجه لكهگذاري روي دو غشا ايجاد ميشد (شکل 1) (10).
اما اين پروتوكل به دليل اينكه انتقال كمي[19] از پروتئين نبود با اقبال مواجه نشد تا اينكه از تكنيك ايمونوبلاتينگ چندگانه استفاده نمودند و موجب شد كه علاقه قابل ملاحظهاي در انتقال پروتئين با واسطه اين روش فراهم شود. بزرگترین برتری لکهگذاری با انتشار ساده در مقایسه با الکتروبلاتینگ این است که انتقالهای چندتایی یا نقشهگذاری را میتوان از یک ژل بدست آورد و آنتیسرمهای مختلف را روی یک نقشه آزمایش نمود.
شکل 1: انتشار ساده دوطرفه، انتقال غیرالکتروفورتیک پروتئین از ژل SDS-PAGE
2.2). جريان حلال وابسته به خلأ (vacuum blotting):
پفرون[20] و همکارانش در سال 1982 یک روش بلاتینگ ساده را بعنوان یک آلترناتیو برای لکهگذاری با انتشار ساده و الکتروبلاتینگ معرفی کردند (12). آنها از قدرت مکش یک پمپ متصل به یک سیستم خشککن ژل ورقهای برای جدا کردن قطعات پلیپپتیدی از ژل به غشا استفاده کردند. این روش امکان جدا کردن پروتئینهای با وزن مولکولی بالا و پایین را فراهم میآورد؛ موقعی که پروتئینهای با وزن مولکولی پایین استفاده میشود نویسنده پیشنهاد میکند که غشای نیتروسلولوزی با اندازه سوراخهای کوچک (μm0/1-0/2) استفاده شود.
اما نقطهی ضعف این روش آن است که اگر پروسه جدا کردن پروتئینها بیشتر از 45 دقیقه طول بکشد ژل خشک میشود و بنابراین در این گونه موارد میبایست بافر کافی استفاده شود. همچنین در بعضی از موارد غلظت پایینی از پلیآکریلآمید به صورت چسبیده به غشا باقی میماند که در این گونه موارد نویسنده پیشنهاد میکند که ژل را دوباره آبدهی کنیم که این کار موجب تورم شده و غشای نیتروسلولوژی به آسانی از ژل جدا میشود.
2.3) وسترن بلاتينگ (Electro blotting)
الکتروبلاتینگ یا وسترن بلات رایجترین روش استفاده شده برای انتقال پروتئینها از یک ژل به غشا میباشد. مزایای آن عبارت از سرعت و انتقال کامل در مقایسه با Simple diffusion و Vacuum blotting است. الکتروبلاتینگ را میتوان از 2 طریق به انجام رساند:
2.3.1) Wet transfer
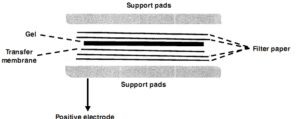
در انتقال مرطوب، ساندویچ ژل و غشا در تانک بافر به همراه الکترودهای پلاتینیوم قرار داده میشوند (شکل 2)
شکل 2: غشای انتقالی بین ژل و کاغذهای صافی به صورت ساندویچ قرار گرفته. غشای انتقالی به سمت آند میباشد
2.3.2) Semi-dry transfer:
در مورد انتقال نیمهخشک ساندویچ ژل- غشا بین صفحات الکترود کربنی قرار داده میشوند. بلاتینگ نیمهخشک یا افقی[23] از دو صفحه الکترودی (استیل ضدخش یا صفحات کربن/گرافیکی) تشکیل شده که به منظور یکنواخت کردن جریان الکتریکی در یک برهه زمانی کوتاه استفاده میشود و ساندویچ ژل- غشا بین آنها قرار داده میشوند.
3) تغییرات الکتروبلاتینگ:
تمام تغییرات انجام شده بر روی پروتوکول اولیهی الکتروبلاتینگ به منظور افزایش میزان انتقال پروتئینها از ژل به روی غشا صورت میگیرد. در زیر به نمونههایی از این تغییرات صورت گرفته اشاره میشود.
3.1) لکهگذاری دوگانه[24]:
این پروتوکل به منظور کاهش نتایج مثبت کاذب به دلیل اتصال غیراختصاصی آنتیبادیهای ثانویه توسعه یافت (13). در این روش، الکتروبلاتینگ یا لکهگذاری نقطهای[25] به وسیله شیرخشک بدون چربی متوقف شده که این کار موجب میشود که تنها آنتیبادیهای اولیه یا اصلی در طول انکوباسیون به پروتئین متصل شوند و پس از آن عمل شستشو انجام میگیرد.
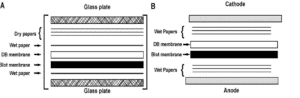
اصول بلاتینگ دوگانه انتقال آنتیبادیهای اولیه بطور جداگانه از غشای لکه[26] به یک پشتیبان جدید که غشای Double blot نامیده میشود، اســـت (شکل3 ).
دو گونه از لکهگذاری دوگانه با موفقیت ایجاد شده است:
Pressure double blot: که از الکتروفورزیس استفاده نمیشود و تنها از اصول انتشار ساده بهره میبرد.
Electro double blot: که در این روش الکتروفورزیس نیز صورت میگیرد.
3.1.1) Pressure double blot:
در این روش، غشای PVDF دوم که غشای DB نیز نامیده میشود به اندازه غشای Dot-blot بریده میشود و سپس با متانول و محلول گلیسین/HCL0.1M که دارای PH=2.5 است مرطوب میشود. غشا Blot در زیر غشای DB قرار گرفته و به وسیله یک کاغذ فیلتری مرطوب شده با مقداری بافر پوشیده شده است. این مجموعه بین دو صفحه شیشهای قرار گرفته و به وسیله دو گیره محکم شده است (شکل 3A).
3.1.2) Electro double blot:
غشای DB در محلول 0.7% استیک اسید قرار میگیرد و سپس غشای Blot آن را همراهی میکند. این دو بین دو دسته از کاغذهای فیلتر مرطوب شده با مقداری محلول بافری قرار میگیرند. در این مورد نیز PH پایین به جداسازی Ab از Ag کمک میکند. با این روش میتوان آنتیبادی اولیه را از غشای اولیه به غشای Capture منتقل کرد، بنابراین آنتیبادیهای اولیه از آنتیژن اختصاصی خود جدا شده و به غشای DB منتقل میشوند (شکل 3B ).
3.2) Slice blotting:
لو[27] و همکاران در سال 1999 یک روش ساده از بلاتینگ یا لکهگذاری را توسعه دادند که میتوانست نحوه آزاد شدن سایتوکاینها، فاکتورهای رشد، جاذبهای شیمیایی، آنزیمها و دیگر سیگنالها را در سیستمهای خاص مانند بافت مغزی و زیر شرایط خاص ترسیم کند (14). در این روش یک تکه از بافت در یک غشای انتقالی قرار داده میشود و سپس مواد درون تکه بافتی مانند نوروترانسمیترها، پروتئینها و پپتیدها آزاد شده و مولکولها به غشا انتشار مییابند.
3.3) Tissue printing (چاپ بافت)
چندین محقق ثابت کردند که انتقال پروتئینها به غشای نیتروسلولوزی صورت خواهد گرفت در صورتی که یک قطعه بریده شده از بافت بر روی سطح غشا فشار داده شود. این پروسه بعنوان چاپ بافتی نامیده میشود (16،15).
3.4) Native electrophoresis and western blot analysis:
در این روش به هیچ عنوان از SDS استفاده نمیشود که در این صورت پروتئینها ساختار و عملکرد خود را حفظ میکنند. در این روش Sample buffer عاری از SDS یا DTT میباشد. پروتئینها بسیاری از فاکتورهای خود از قبیل اندازه، شکل و ماهیت بار خود را حفظ میکنند. البته کیفیت الکتروفورزیس با این روش قابل مقایسه با SDS-PAGE نیست، اما این تکنیک زمانی مفید خواهد بود که ساختار بکر و یا فعالیت آنزیمی یک پروتئین قرار باشد ارزیابی شود.
3.5) Grid-immunoblotting:
این روش به وسیله Reese و همکاران در سال 2001 توسعه یافت که روشی است که امکان آزمایش بیش از 20 نمونه مختلف برای آنتیبادیهای اختصاصی بر ضد بیش از 20 آنتیژن مختلف یا آلرژن را تنها بر روی یک ورقه کاغذی از نیتروســـلولوز فراهم میآورد (17). در این روش تنها حــدود 200-150 میکرولیتر از نمونه موردنیاز است که این میزان از نمونه قابل قیاس با حجم موردنیاز برای ELISA[28] نیست.
این روش شامل سه مرحله است:
- پروتئینها روی غشا ثابت میشوند.
- لکه برای اتصال با آنتیبادی اختصاصی انکوبه میشود.
- اتصالات اختصاصی ارزیابی میشود.
4) آشکار ساختن آنتیژنها (Antigen detection)
4.1) آشکارسازی آنتیژن بوسیله رنگآمیزی پروتئینها
پروتئینهایی که پس از ایمونوبلاتینگ بر روی غشا قرار گرفتهاند را میتوان بوسیله رنگهای ارگانیک مانند پانسو رد، آمینوبلاک، fast green، CBB، و همچنین با استفاده از مارکرهای فلورسنت و انواعی از روشهای رنگآمیزی نقره و ذرات کلوئیدی مانند طلا، نقره، مس، آهن یا مرکب چین شناسایی کرد (18).
4.2)Immunodetection of Ag:
دو روش رایج برای شناسایی پروتئینها پس از اضافه کردن آنتیبادی اولیه به لکه پروتئینی که بلاک شده است استفاده میشود:
- رادیواکتیو
- نشانگرهای وابسته به آنزیم
4.2.1) رادیواکتیو:
برهمکنش Ag-Ab میتواند با پروتئین A استاف اورئوس متصل شده به I125 (19) یا پروتئین استرپتوکوک G متصل به I125 (20) و سپس اوتورادیوگرافی آن متصور شود. پروتئین A رادیولیبل شده به Ab اولیه متصل میشود و این Ab به آنتیژن اختصاصی خود که روی غشا، بلات شده متصل میشود.
4.2.2) نشانگرهای وابسته به آنزیم:
آشکارسازی با استفاده از آنتیبادیهای لیبل شده با آنزیم تا پیش از ظهور روشهای کمیلومینسانس یک روش پرطرفدار بوده است. معمولاً Horseradish peroxidase یا Alkalin phosphatase متصل شده به آنتیبادی (21) با رنجی از سوبستراهای محلول که تولید محصولات رنگی نامحلول را میکنند استفاده میشود. نقطه ضعف این روش آن است که نمیتوان نتایج کمی (quantity) را به دست آورد و همچنین نقطه ضعف دیگر آن کنتراست پایین بین رنگ و غشاء میباشد.
4.2.3) آشکارسازی با طلا:
پروتئین A متصل به ذرات طلا بمنظور آشکارسازی کمپلکسهای ایمنی روی Western blot استفاده میشود (22)، بنابراین به آن Golden blot میگویند. آشکارسازی با این روش قابل مقایسه با روش Radiolabeling است.
:References
- M. Southern, J. Mol. Biol. 98 (1975) 503–517.
- C. Alwine, D.J. Kemp, G.R. Stark, Proc. Natl. Acad. Sci. USA 74(1977) 5350–5354.
- Towbin, T. Staehelin, J. Gordon, Proc. Natl. Acad. Sci. USA (1979) 4350–4354.
- N. Burnette, Anal. Biochem. 112 (1981) 195–203.
- Harlow, D. Lane, Immunoblotting, in: Antibodies: A Laboratory Manual, Cold Spring Harbor, New York, 1988.pp.471-510.
- Renart, J. Reiser, G.R. Stark, Proc. Natl. Acad. Sci. USA 76 (1979)3116–3120.
- B. Elkon, P.W. Jankowski, J.L. Chu, Anal. Biochem. 140 (1984)208–213.
- Gibson, Anal. Biochem. 118 (1981) 1–3.
- M. Gershoni, G.E. Palade, Anal. Biochem. 131 (1983) 1–15.
- T. Kurien, R.H. ScoWeld, J. Immunol. Methods 205 (1997) 91–94.
- Chen, G.D. Chang, Electrophoresis 22 (2001) 1894–1899.
- Peferoen, R. Huybrechts, A. De Loof, FEBS Lett. 145 (1982) 369–372.
- Lasne, J. Immunol. Methods 253 (2001) 125–131.
- Lowe, J. Neurosci. Methods 90 (1999) 117–127.
- I. Cassab, J.E. Varner, J. Cell Biol. 105 (1987) 2581–2588.
- F. Pont-Lezica, J.E. Varner, Anal. Biochem. 182 (1989) 334–337.
- Reese, D. Schmechel, R. Ayuso, S.B. Lehrer, J. Chromatogr. B. Biomed. Sci. Appl. 756 (2001) 151–156.
- Merril, in: A. Chrambach, M. Dunn, B. Radola (Eds.), Advances in Electrophoresis, vol. 1, VCH, Weinheim, Germany, 1987, pp. 111, 2000.
- L. Dimond, W.F. Loomis, J. Biol. Chem. 25 (1976) 2680–2687.
- R. Harper, H.O. Kangro, R.B. Heath, J. Med. Virol. 25 (1988)387–398
- A. Knecht, R.L. Dimond, Anal. Biochem. 136 (1984) 180–184.
- Brada, J. Roth, Anal. Biochem. 142 (1984) 79–83.
[1] Towbin
[2] simple diffusion
[3] vacuum-assisted solvent flow
[4] electrophoreticelution
[5] Sodium dodecyl sulfate–polyacrylamide gel electrophoresis
[6] Polyvinylidene difluoride
[7] Southern
[8] Southern blot
[9] Alwine
[10] Kemp
[11] Northernblot
[12] Burnette
[13] Cross-linker
[14] Ultra-thin
[15] Immunoblotting
[16] Handeling
[17] Kurien
[18] Scofield
[19] quantity
[20]Peferoen
[21] Wet transfer
[22] Semi _ dry transfer
[23] Horizontal
[24] Double blotting
[25] Dot blotting
[26] Blot membrane
[27] Lowe
[28] Enzyme linke Immuno Sorbent Assay
روشهاي شناسايي سریع عوامل میکروبی
(PFGE (Pulsed Field Gel Electrophoresis
تکنیکهای بررسی برهمکنشهای پروتئین- پروتئین در تحقیقات پروتئومیکس
فیوژن پروتئینها با پایه آنتیبادی (Fc-Fusion Proteins)
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3456489/
https://anatomypubs.onlinelibrary.wiley.com/doi/10.1002/ar.22424
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام