مکانیسمهای بیماریزایی موکورمایکوزیس در بیماران کووید-19
دکتر صادق خداویسی
استادیار قارچشناسی پزشکی، گروه انگلشناسی و قارچشناسی پزشکی، دانشگاه علوم پزشکی تهران
ریحانه سادات کیائی
دانشجوی کارشناسی ارشد قارچشناسی پزشکی، گروه انگلشناسی و قارچشناسی پزشکی، دانشگاه علوم پزشکی تهران
موکورمایکوزیس مرتبط با بیماری کووید-19 (CAM)، یک تهدید در حال ظهور در سطح جهانی است. ظهور موارد CAM در کشورهایی از جمله هند و ایران به عوامل محیطی و فاکتورهای مستعدکننده میزبان بستگی دارد. قارچهای موکورال در سراسر جهان بخصوص در کشورهای با آب و هوای گرمسیری از جمله هند و ایران وجود دارند که این عامل با افزایش شیوع موارد CAM مرتبط است. قبل از همهگیری کووید-19، بیماران با دیابت، بدخیمیهای خون، پیوند اعضا و تحت درمان با کورتیکواستروئید و نوتروپنی بیشتر مستعد موکورمایکوزیس بودند در حالی که در بیماران کووید-19، اختلال عملکرد اندوتلیال ناشی از ویروس، افزایش قند خون و اختلال عملکرد ایمنی بدن پس از استفاده از کورتیکواستروئیدها خطر ابتلا به موکورمایکوزیس را افزایش میدهد. آسیب به اندوتلیال و افزایش بیان گیرندههای اندوتلیال ناشی از عفونت کووید-19 ممکن است بیماران را مستعد ابتلا به CAM کند. عفونت کووید-19 ممکن است مستقیماً باعث افزایش قند خون با آسیب رساندن به سلولهای بتای پانکراس یا با درمان کورتیکواستروئید شده و به پاتوژنز CAM کمک کند. از ویژگیهای مهم ویرولانس موکورالها به جذب آهن از میزبان، به ویژه در کتواسیدوز دیابتی یا درمان با دفروکسامین میتوان اشاره کرد و هایپرفریتینمی ناشی از COVID-19 ممکن است به عنوان منبع آهن برای رشد و تهاجم موکورالها عمل کند. علاوه بر این، درمان با کورتیکواستروئیدها منجر به کاهش عملکردهای ایمنی ذاتی سلولهای فاگوسیتیک میشود.
مقدمه
موکورمایکوزیس یک عفونت تهاجمی عروقی است که با نکروز بافت و تهاجم به رگهای خونی مشخص میشود (1). موکورمایکوزیس توسط قارچهای ساپروفیت متعلق به راسته موکورالها ایجاد میشود (2, 3). یک مطالعه چند کشوری در مورد موکومایکوزیس مرتبط با کووید-19 (CAM)[1] گزارش داد که 53 درصد موارد مربوط به هند است و به دنبال آن ایالات متحده آمریکا (10٪)، پاکستان (6.3٪)، فرانسه (5٪)، مکزیک (5٪)، ایران (5٪) و روسیه (2.5٪) قرار دارند (4). در طی همهگیری کووید-19، تعداد موارد موکورمایکوزیس به میزان قابل توجهی در هند (بیش از 40،000 مورد) و ایران افزایش یافت و مقامات بهداشتی را بر آن داشت تا موکورمایکوزیس را به عنوان یک بیماری قابل اطلاع اعلام کنند (5). وضعیت به دلیل محدودیت در دسترس بودن داروهای ضد قارچی خط اول مانند لیپوزومال آمفوتریسین B وخیمتر شده است (5). قبل از همهگیری کووید-19، دیابت به عنوان شایعترین و به دنبال آن بدخیمیهای خونی و گیرندگان پیوند اعضاء بهعنوان عوامل خطر برای موکورمایکوزیس گزارش شدهاند. هر چند که موکورمایکوزیس در بیمارانی که بیماری زمینهای ندارند نیز گزارش شده است (6, 7). یک مطالعه چند مرکزی در هند در سال 2020، دیابت، درمان استروئید نامناسب (6 میلیگرم دگزامتازون در روز به مدت 7 تا 10 روز توصیه میشود؛ دوز بالاتر و طول درمان طولانیتر نامناسب تلقی میشود) و ویروس کووید-19 را به عنوان عوامل خطر برای افزایش موارد موکورمایکوزیس در موج اول کووید-19 تعیین کرده است. در طی این شیوع، موکورمیکوز رینواوربیتو سربرال (ROCM)[2] و به دنبال آن موکورمایکوزیس ریوی شایعترین تظاهرات را داشتند (5). دلایل شیوع CAM در بیماران مبتلا به کووید-19 میتواند ناشی از بار بالای اسپورهای موکورال در محیط، دیابت ملیتوس کنترل نشده، درمان استروئیدی نامناسب، افزایش تجمع آهن و صدمات ناشی از ویروس باشد (8-10).
انتشار محیطی موکورالها
اسپورانژیوسپورهای موکورالها در محیط از طریق استنشاق، بلع یا تلقیح تروماتیک در انسانها باعث موکورمایکوزیس میشوند (2, 3). موکورالها در همه جا وجود دارند؛ با این حال، بار اسپور در کشورهای گرمسیری بیشتر است (3, 11). اسپورهای موکورالها از هوای محیطهای داخلی و خارجی جدا شدهاند (11, 12). Rhizopus arrhizus، گونه اصلی بیماریزا، همان گونه غالب جداشده از محیط است (3, 6, 11, 13). تعداد موارد CAM در هند و ایران در مقایسه با سایر نقاط جهان در طول بیماری همهگیری کووید-19 بسیار زیاد است (4, 9) و این عدد بالا ممکن است با بار بالای اسپور موکورالهای بیماریزا در محیط مرتبط باشد. یک مطالعه، جداسازی گونههای کمیاب مانند Apophysomyces variabilis و Rhizopus homothallicus را در هند گزارش کرد (3) و عفونتهای ناشی از این گونههای کمیاب نیز رایج است (6, 7).Rhizopus homothallicus از نمونههای بالینی در مراکز متعدد حتی در طول شیوع فعلی در کنار گونههای رایج R. arrhizus جدا شده است. انجام مطالعات سیستماتیک زیستمحیطی در طول این شیوع ضروری است، مقایسه بیشتر جدایههای محیطی و بالینی ممکن است توضیح موجهی برای ظهور CAM ارائه دهد. بار زیاد CAM نیز ممکن است با گونههای ویرولانس راسته موکورالها مرتبط باشد. تجزیه و تحلیل ژنوم موکورالهای جداشده در دوران قبل از کووید-19 و دوره همهگیری، همراه با آزمایشها بر روی حیوانات، ممکن است نقش احتمالی عوامل خطرناک موکورالها در ظهور CAM را نشان دهد.
شرایط میزبان در پاتوژنز CAM
شرایط میزبان به احتمال زیاد نقش بیشتری در افزایش موارد CAM دارد. در دوران قبل از کووید-19، بیماران مبتلا به دیابت ملیتوس و بدخیمیهای خونی و دریافتکنندگان پیوند در معرض خطر بالا برای ابتلا به موکورمایکوزیس بودند (7, 14, 15). در مقایسه، بیماران مبتلا به دیابت و افرادی که مصرف دوزهای نامناسب بالای کورتیکواستروئیدها را دارند در معرض خطر فزاینده ابتلا به موکورمایکوزیس در همهگیری کووید-19 هستند. افزایش قند خون در افراد مبتلا به کووید-19 ممکن است به چهار دلیل باشد (4, 8, 9, 16):
1) دیابت شیرین قبلی
2) آسیب سلولهای بتای پانکراس به دلیل کووید-19 منجر به کاهش تولید انسولین (17, 18)
3) درمان با کورتیکواستروئید (19, 20)
4) استرس مرتبط با افزایش سطح کورتیزول (21, 22)
افزایش قند خون و درمان با گلوکوکورتیکوئیدها باعث اختلال در عملکرد فاگوسیتیک و ناتوانی در متوقف کردن جوانهزنی و رشد اسپور شده و منجر به پیشرفت بیماری میشود (23, 24). به علاوه، در بیماران مبتلا به دیابت و کووید-19 سطح فریتین افزایش (هایپرفریتینمی) پیدا میکند که منجر به تغییر هموستاز آهن میشود (25, 26). به علاوه، آسیب به اندوتلیال و افزایش بیان گیرندههای اندوتلیال در بیماران کووید-19 مشاهده شده است؛ بنابراین، عوامل ذکرشده در بالا مانند آسیب اندوتلیال قبلی و تنظیم گیرندههای اندوتلیال، درمان با گلوکوکورتیکوئیدها، افزایش قند خون مرتبط با عوارضی مانند هایپرفریتینمی و اختلال عملکرد سلولهای سیستم ایمنی ذاتی، به احتمال زیاد در پاتوژنز CAM نقش دارند.
سلولهای اندوتلیال و گیرندههای آنها: یک رابط بین بیماری کووید -19 و موکورمایکوزیس
اختلال در عملکرد سلولهای اندوتلیال نقش مهمی در پاتوژنز عفونتهای کووید-19 ایفا میکند (27, 28). ویروس کرونا به گیرنده آنزیم مبدل آنژیوتانسین 2 [3](ACE2) موجود بر روی سلولهای اندوتلیال متصل میشود، سپس با داخلی سازی ذرات ویروسی منجر به انعقاد، اندوتلیت و مرگ درون سلولی سلولهای اندوتلیال میشود (28, 29). به غیر از گیرنده ACE2، پروتئین تنظیمکننده گلوکز 78 (GRP78)[4] به عنوان گیرنده مشترک برای شناسایی SARS-CoV-2 spike protein و افزایش ورود ویروس به درون سلول عمل میکند. (شکل 1A) (30, 31). GRP78 یک پروتئین شوک حرارتی با وزن مولکولی 78 کیلو دالتون است که به عنوان پروتئین شوک حرارتی (HSPA5)[5] A5نیز شناخته میشود GRP78 .یک چاپرون مولکولی است که در شبکه آندوپلاسمی قرار دارد و نقش قابل توجهی در تنظیم پاسخ پروتئین باز نشده(UPR)[6] ، پایداری پروتئین، هموستاز کلسیم و اتوفاژی دارد (32, 33). در بیماران مبتلا به کووید-19 افزایش سطح سرمی GRP78 در مقایسه با افراد سالم (گروه کنترل) وجود دارد (34)؛ بنابراین مهار گیرنده GRP78 با کاهش بیان گیرندههای ACE2 میتواند داخلی سازی SARS-CoV-2 را کاهش دهد که منجر به کاهش اتصال ویروس و شدت عفونت میشود (30, 35, 36). مشابه گیرنده ACE2، GRP78 همچنین باعث ایجاد اختلال در سد سلولهای اندوتلیال و التهاب میشود (36).
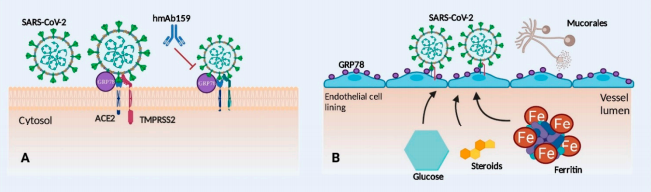
شکل 1: نقش پروتئین تنظیمکننده گلوکز (GRP78) در بیماریزایی موکورمایکوزیس مرتبط با کووید-19
A – ممکن است GRP78 به عنوان گیرنده مشترک یا تثبیتکننده عملکردACE2 spike protein عمل کند. درمان قبلی با مونوکلونال آنتیبادی انسانی hmAb159 علیه GRP78 ممکن است این برهمکنش را مختل کند.
B– افزایش بیان سطحی GRP78 روی پوشش سلولهای اندوتلیال و/یا مشکلات متابولیک ممکن است شرایط را برای بیماریزایی موکورمایکوزیس بیشتر فراهم کند.
گیرنده ACE2 و گیرنده GRP78 واسطه ویروس کرونا هستند و با اتصال و داخلی سازی ویروس در سلولهای اندوتلیال منجر به آسیب اندوتلیال میشوند. پروتئاز غشایی سرین 2 (TMPRSS2) واسطه
spike protein priming ویروسی است. مهار GRP78 توسط آنتیبادیهای مونوکلونال (hmAb159)، اتصال ویروس به سلولهای اندوتلیال را در طول عفونت کووید-19 کاهش میدهد. افزایش بیان سطحی GRP78 در سلولهای اندوتلیال و اپیتلیال در بیماران مبتلا به دیابت ملیتوس، مشکلات آهن اضافی و بعد از درمان با کورتیکواستروئید دیده میشود. افزایش بیان GRP78 ممکن است بیماران مبتلا به کووید -19 را مستعد ابتلا به موکورمایکوزیس با افزایش اتصال اسپورهای آن به رسپتور GRP78 کند. آسیب اندوتلیال در کووید-19 با فعال شدن پاسخ التهابی باعث افزایش غیرطبیعی سایتوکاینهای پیشالتهابی (اینترلوکین IL (1β، IL-6، IL-8)) و فاکتور نکروز تومور (TNF -α)[7]که فاکتورهای انعقادی خون را تغییر میدهند، میشود.
D-dimer، فاکتور ون ویلبراند (VWF)[8] و فیبرینوژن که منجر به ترومبوز وریدی، واسکولیت سیستمیک، آپوپتوز سلولهای اندوتلیال، انعقاد عروقی و التهاب در اندامهای مختلف میشود، منجر به نارسایی چند عضو میگردند (37, 38). آسیب اندوتلیال موجود در بیماران مبتلا به کووید-19 ممکن است به عنوان یک عامل خطر مهم برای موکورمایکوزیس عمل کند. تهاجم به سلولهای اندوتلیال مرحله مهمی در پاتوژنز موکورمایکوزیس است و این اندوتلیوم آسیب دیده و افزایش بیان گیرندههای اندوتلیال مانند GRP78 در بیماران مبتلا به کووید-19 ممکن است شانس تهاجم عروقی و نکروز بافت را افزایش دهند (1). گیرندههای GRP78 نه تنها در پاتوژنز عفونتهای کووید -19 نقش دارند، بلکه برای پاتوژنز موکورمایکوزیس، به ویژه در نوع ROCM بسیار مهم هستند (39, 40). گیرنده GRP78 روی سلولهای اپیتلیال بینی و اندوتلیال قرار دارد و گیرندههای اینتگرین β1[9] و EGFR[10] روی سلولهای اپیتلیال راههای هوایی برای چسبندگی سلولی و تهاجم بافتی توسط موکورالها ضروری هستند. در مدل موشی DKA موکورمایکوزیس، بیان بیش از حد گیرنده GRP78 در سینوسها، بافتهای ریه و مغز دیده میشود و با افزایش چسبندگی و اندوسیتوز جوانههای Rhizopus arrhizus به سلولهای اپیتلیال و اندوتلیال مرتبط است (41, 42). CotH3 (پروتئین پوشش اسپور) در سطح سلول R. arrhizus مشخصاً به عنوان یک لیگاند قارچی برای گیرنده GRP78 عمل میکند (43). اتصال CotH3 -GRP78 ورود قارچ به سلولهای اندوتلیال و اپیتلیال بینی را کنترل میکند و افزایش موارد ROCM در CAM را منجر میشود. پروتئینهای CotH3 به عنوان اینوزین عمل میکنند و اتصال پروتئین CotH3 به گیرندههای GRP78 واسطه حمله سلولهای اپیتلیال و آسیب اندوتلیال است و منجر به افزایش ویرولانس میشود (40, 43). پس از اتصال به سلولهای اندوتلیال، اسپورها به هایفها تبدیل میشوند که توسط مسیر کلسینورین که واسطه حمله عروقی است، تعدیل میشود (44, 45). در بیماران کووید-19، افزایش بیان گیرنده GRP78 ممکن است اتصال اسپورهای موکورالها را افزایش دهد که منجر به افزایش تهاجم و آسیب اندوتلیال میشود (شکل 1B). ممانعت از گیرنده GRP78 یا آنتیبادی علیه پروتئینهای CotH3 میتواند تهاجم اندوتلیالی توسط اسپورهای موکورالها را لغو کند (39, 43).
آهن: ارتباط احتمالی بین عفونتهای کووید -19 و موکورمایکوزیس
افزایش قند خون مهمترین عامل خطر برای موکورومایکوزیس است. در بیماران مبتلا به دیابت کنترلنشده و کنترل ضعیف قند خون، غلظت کتون در خون افزایش مییابد که منجر به اسیدوز میشود. این وضعیت به نام کتواسیدوز دیابتی [11](DKA) شناخته میشود (39, 46). پروتئینهای متصل به آهن مانند ترانسفرین، فریتین و لاکتوفرین آزادسازی آهن آزاد در خون را محدود کرده و هموستاز آهن را حفظ میکنند (47). در اختلالات متابولیک مانند DKA، آزاد شدن آهن آزاد در خون افزایش مییابد و هموستاز آهن مختل میشود. در بیماران مبتلا به دیابت، سطح فریتین سرم افزایش داشته که منجر به افزایش ذخایر آهن میشود (25, 48). به طور مشابه، کووید-19 با مولکول هموگلوبین تداخل میکند و باعث ازهمگسیختگی آهن از مولکولهای هم میشود که منجر به هایپرفریتینمی در بیماران کووید-19 میگردد. هایپرفریتینمی، هموستاز آهن را تغییر داده و منجر به اضافه بار آهن در بدن میشود (26, 49). افزایش سطح فریتین سرم، IL-6 و D-dimer با مرگومیر بالا در بیماران مبتلا به کووید-19 مرتبط است (50). هایپرفریتینمی در بیماران مبتلا به کووید -19 در درجه اول به سلولهای التهابی در محل عفونت مانند ماکروفاژها و افزایش ترشح سیتوکینهای پیشالتهابی از جمله IL-6 نسبت داده میشود. این عوامل باعث افزایش التهاب ریه و فیبروز ریه و منجر به بیماری شدید میشوند (51). هر دو فاکتور هیپرگلیسمی و کووید-19 باعث هایپرفریتینمی میشوند و فریتین زیاد در داخل سلولها باعث آزاد شدن رادیکالهای بدون اکسیژن میشود که به بافت آسیب میرساند و آهن آزاد را در خون ترشح میکند. آهن آزاد موجود در خون به رشد موکورالها کمک میکند و تهاجم به رگهای خونی ، باعث ترومبوز عروق و نکروز بافت میشود. دریافت آهن از میزبان یکی از ویژگیهای مهم ویرولانس موکورالها است (52). حضور ژنهایی مانند (FTR1) the high-affinity iron permease ، multi-copper oxidase و ferric reductase که دریافت آهن را از طریق مسیرهای کاهشدهنده تعدیل میکنند در ژنوم موکورالهای مهم پزشکی اثبات شدهاند (53, 54). موکورالها همچنین دارای ژنهای دیگر جذب آهن مانند انتقالدهندههای سیدروفور و هماکسیژناز (جذب آهن از همین) هستند (53, 54). علاوه بر این، موکورالها میتوانند آهن بهدستآمده را به شکل فریتین در سلولهای خود ذخیره کنند. سه نوع فریتین گزارش شده در موکورالها شامل mycoferritin, bacterioferritin و zygoferritin هستند (55).
درمان با کورتیکواستروئید
سازمان بهداشت جهانی (WHO) استفاده از داروهای کورتیکواستروئید سیستمیک (6 میلیگرم دگزامتازون به صورت خوراکی/ وریدی روزانه یا 50 میلیگرم هیدروکورتیزون به صورت وریدی هر 8 ساعت) به مدت 7 تا 10 روز را در بیماران مبتلا به عفونت کووید-19 شدید و بحرانی توصیه میکند. علاوه بر این، به طور مشروط توصیه میشود که در بیماران بستری مبتلا به کووید-19 غیر شدید و بدون اشباع اکسیژن، از درمان با کورتیکواستروئید استفاده نشود. گلوکوکورتیکوئیدها به دلیل خواص ضد التهابی و سرکوبکننده سیستم ایمنی بدن به طور گستردهای مورد استفاده قرار میگیرند (56). با این حال، استفاده طولانی مدت از استروئیدها بر سیستم ایمنی بدن تأثیر میگذارد و منجر به عوارض جانبی شدید مانند فشارخون بالا، دیابت و پوکی استخوان میشود (56). افزایش قند خون شایعترین عوارض بعد از درمان با گلوکوکورتیکوئید است و به طور مشابه در بیماران دیابتی که قبلاً تشخیص داده شده بودند (20)، استفاده از گلوکوکورتیکوئیدها به دلیل خطر ایجاد اختلال در متابولیسم گلوکز و احتمال شانس مقاومت به انسولین محدود میشود (20, 57). در این گروه از بیماران، مصرف طولانی مدت و نامناسب استروئیدها میتواند منجر به سرکوب شدید سیستم ایمنی و تغییر سطح گلوکز خون شود (19, 20). استفاده نادرست از استروئیدها یک عامل خطر مهم برای موارد CAM است (4, 8, 9). درمان با کورتیکواستروئیدها، عملکرد سلولهای ایمنی مانند ماکروفاژها، نوتروفیلها، پلاکتها و سلولهای T را سرکوب میکند (20). در ایمنی علیه موکور، نوتروفیلها و ماکروفاژها نقش اصلی را ایفا میکنند و سلولهای تحت درمان با گلوکوکورتیکوئید در چسبندگی، کموتاکسی، ترکیدگی اکسیداتیو و تولید اکسید نیتریک معیوب هستند (20, 58)؛ بنابراین نقص ایمنی ذاتی در سلولهای فاگوسیتی پس از درمان با گلوکوکورتیکوئید افراد را به شدت مستعد ابتلا به موکورمایکوزیس میکند. علاوه بر این، شواهد تجربی گزارش دادند که درمان با گلوکوکورتیکوئید بیان سطحی گیرنده GRP78 را افزایش میدهد (59, 60)؛ بنابراین استفاده اولیه از دگزامتازون در بیماران کووید-19 ممکن است سطح GRP78 را افزایش دهد که به واسطه افزایش چسبندگی و تکثیر ویروسی منجر به عفونتهای شدید میشود. به طور مشابه، نقص ایمنی ناشی از گلوکوکورتیکوئیدها و تغییر بیان گیرنده ممکن است باعث افزایش بیماریزایی CAM شود.
شکل 2: اختلال عملکرد ایمنی ناشی از درمان با کورتیکواستروئیدها در موکورمایکوزیس مرتبط با کووید- 19
درمان با کورتیکواستروئید و دیابت باعث تضعیف عملکرد فاگوسیتی سلولهای ایمنی میشود که اجازه جوانهزنی اسپورهای موکورالها را میدهد و منجر به تهاجم عروقی و نکروز بافت میشود. درمان با کورتیکواستروئیدها چسبندگی، کموتاکسی، فاگوسیتوز و تولید گونههای فعال اکسیژن (ROS) را مختل میکند، عدم توقف جوانهزنی اسپور منجر به تهاجم به اندوتلیال بهواسطه هایفها و آسیب میشود.
نتیجهگیری
شیوع CAM یک چالش مهم در طول همهگیری کووید-19 است. ظهور موکورمایکوزیس در بیماران مبتلا به کووید-19 به عوامل محیطی، میزبان و ایاتروژنیک نسبت داده میشود. برای یافتن دلیل جهش بیسابقه موارد CAM، نقش عوامل محیطی باید مورد ارزیابی قرار گیرد. یکی دیگر از دلایل احتمالی این افزایش میتواند دیابت کنترلنشده و پیامدهای خود کووید-19 باشد. آسیب اندوتلیال قبلی به دلیل عفونت SARS-CoV-2 میتواند پتانسیل بیماریزایی موکورالها را تحریک کند. تعامل سلولهای اپیتلیال و تهاجم اندوتلیال واسطه پاتوژنز موکورمایکوزیس است و آسیب اندوتلیال در کووید-19 میتواند اتصال اسپورهای موکورالها را افزایش داده و باعث تهاجم بافت به میزبان شود. بیان بیش از حد گیرندههای میزبان مانند GRP78 با پاتوژنز عفونتهای کووید-19 همراه است، زیرا برای اتصال، داخلیسازی و تکثیر ویروسی ضروری است. گیرنده GRP78 روی سلولهای اپیتلیال بینی و اندوتلیال قرار دارد و گیرندههای اینتگرین β1 و EGFR روی سلولهای اپیتلیال راههای هوایی برای چسبندگی سلولی و تهاجم بافتی توسط موکورالها ضروری هستند. پروتئینهای CotH بر روی اسپورهای موکورالها بسته به محل عفونت با گیرندههای میزبان مختلف تعامل دارند (CotH3 – GRP78 در نوع ROCM و CotH7 – integrin β1 – EGFR در موکورمایکوزیس ریوی) که باعث پیشرفت بیماری میشود. به دست آوردن آهن از میزبان یکی از ویژگیهای مهم ویرولانس موکورالها است. بیماران با افزایش قند خون و التهاب ناشی از کووید-19 اغلب با افزایش آهن آزاد در خون همراه هستند که آنها را مستعد ابتلا به موکورمایکوزیس میکند. موکورالها با استفاده از ژنهای احیاکننده آهن مانند FTR1 از آهن آزاد استفاده میکنند. استفاده از عوامل کلاتکننده آهن مانند دفروکسامین برای درمان هایپرفریتینمی در عفونتهای کووید-19 همچنین ممکن است آنها را مستعد ابتلا به موکورومایکوزیس کند. اسپورهای موکورالها با استفاده از پروتئینهای Fob1/Fob2 بر سطح سلول خود به دفروکسامین متصل میشوند، از طریق مسیر ردوکتاز/پرماز آهن را از دفروکسامین به دست میآورند و فرآیند بیماریزایی را آغاز میکنند. علاوه بر این، در بیماران کووید-19، دوزهای نامناسب استروئیدها آنها را مستعد به موکورمایکوزیس میکند. استفاده طولانی مدت از استروئیدها یا دوز نامناسب استروئیدها سیستم ایمنی بدن را سرکوب میکند و منجر به عوارضی مانند دیابت ناشی از استروئید میشود. علاوه بر این، عملکرد ماکروفاژها و نوتروفیلها پس از درمان با استروئید بهواسطه کاهش انفجار اکسیداتیو و شکست در کشتن اسپورهای قارچی مهاجم دچار اختلال میشود و منجر به پیشرفت بیماری میگردد. این تداخل بین عوامل تعیینکننده بیماریزا در عفونت کووید-19 و موکورمایکوزیس ممکن است دلیل احتمالی ظهور CAM باشد. با این حال، مطالعات دقیقتری برای درک بیماریزایی CAM ضروری است.
منابع:
- Spellberg B, Edwards J, Ibrahim A. Novel Perspectives on Mucormycosis: Pathophysiology, Presentation, and Management. Clinical Microbiology Reviews. 2005;18(3):556-69.
- Richardson M. The ecology of the Zygomycetes and its impact on environmental exposure. Clin Microbiol Infect. 2009;15 Suppl 5:2-9.
- Prakash H, Ghosh AK, Rudramurthy SM, Paul RA, Gupta S, Negi V, et al. The environmental source of emerging Apophysomyces variabilis infection in India. Med Mycol. 2016;54(6):567-75.
- Hoenigl M, Danila S, Carvalho A, Rudramurthy S, A A, Gangneux J-P, et al. The emergence of COVID-19 associated mucormycosis: Analysis of cases from 18 countries2021.
- Rudramurthy SM, Hoenigl M, Meis JF, Cornely OA, Muthu V, Gangneux JP, et al. ECMM/ISHAM recommendations for clinical management of COVID-19 associated mucormycosis in low- and middle-income countries. Mycoses. 2021;64(9):1028-37.
- Prakash H, Chakrabarti A. Global Epidemiology of Mucormycosis. J Fungi (Basel). 2019;5(1):26.
- Prakash H, Chakrabarti A. Epidemiology of Mucormycosis in India. Microorganisms. 2021;9(3).
- Patel A, Agarwal R, Rudramurthy SM, Shevkani M, Xess I, Sharma R, et al. Multicenter Epidemiologic Study of Coronavirus Disease-Associated Mucormycosis, India. Emerg Infect Dis. 2021;27(9):2349-59.
- Singh AK, Singh R, Joshi SR, Misra A. Mucormycosis in COVID-19: A systematic review of cases reported worldwide and in India. Diabetes Metab Syndr. 2021;15(4):102146-.
- Jose A, Singh S, Roychoudhury A, Kholakiya Y, Arya S, Roychoudhury S. Current Understanding in the Pathophysiology of SARS-CoV-2-Associated Rhino-Orbito-Cerebral Mucormycosis: A Comprehensive Review. J Maxillofac Oral Surg. 2021;20(3):1-8.
- Richardson MD, Rautemaa-Richardson R. Biotic Environments Supporting the Persistence of Clinically Relevant Mucormycetes. J Fungi (Basel). 2019;6(1).
- Prakash H, Singh S, Rudramurthy SM, Singh P, Mehta N, Shaw D, et al. An aero mycological analysis of Mucormycetes in indoor and outdoor environments of northern India. Med Mycol. 2020;58(1):118-23.
- Jeong W, Keighley C, Wolfe R, Lee WL, Slavin MA, Kong DCM, et al. The epidemiology and clinical manifestations of mucormycosis: a systematic review and meta-analysis of case reports. Clin Microbiol Infect. 2019;25(1):26-34.
- Patel A, Kaur H, Xess I, Michael JS, Savio J, Rudramurthy S, et al. A multicentre observational study on the epidemiology, risk factors, management and outcomes of mucormycosis in India. Clin Microbiol Infect. 2020;26(7):944.e9-.e15.
- Prakash H, Ghosh AK, Rudramurthy SM, Singh P, Xess I, Savio J, et al. A prospective multicenter study on mucormycosis in India: Epidemiology, diagnosis, and treatment. Med Mycol. 2019;57(4):395-402.
- John TM, Jacob CN, Kontoyiannis DP. When Uncontrolled Diabetes Mellitus and Severe COVID-19 Converge: The Perfect Storm for Mucormycosis. J Fungi (Basel). 2021;7(4).
- Müller JA, Groß R, Conzelmann C, Krüger J, Merle U, Steinhart J, et al. SARS-CoV-2 infects and replicates in cells of the human endocrine and exocrine pancreas. Nat Metab. 2021;3(2):149-65.
- Wu C-T, Lidsky PV, Xiao Y, Lee IT, Cheng R, Nakayama T, et al. SARS-CoV-2 infects human pancreatic β cells and elicits β cell impairment. Cell Metab. 2021;33(8):1565-76.e5.
- Hwang JL, Weiss RE. Steroid-induced diabetes: a clinical and molecular approach to understanding and treatment. Diabetes Metab Res Rev. 2014;30(2):96-102.
- Suh S, Park MK. Glucocorticoid-Induced Diabetes Mellitus: An Important but Overlooked Problem. Endocrinol Metab (Seoul). 2017;32(2):180-9.
- Tan T, Khoo B, Mills EG, Phylactou M, Patel B, Eng PC, et al. Association between high serum total cortisol concentrations and mortality from COVID-19. Lancet Diabetes Endocrinol. 2020;8(8):659-60.
- Dias JP, Joseph JJ, Kluwe B, Zhao S, Shardell M, Seeman T, et al. The longitudinal association of changes in diurnal cortisol features with fasting glucose: MESA. Psychoneuroendocrinology. 2020;119:104698.
- Geerlings SE, Hoepelman AI. Immune dysfunction in patients with diabetes mellitus (DM). FEMS Immunol Med Microbiol. 1999;26(3-4):259-65.
- Lionakis MS, Kontoyiannis DP. Glucocorticoids and invasive fungal infections. Lancet. 2003;362(9398):1828-38.
- Canturk Z, Cetinarslan B, Tarkun I, Canturk NZ. Serum ferritin levels in poorly- and well-controlled diabetes mellitus. Endocr Res. 2003;29(3):299-306.
- Cavezzi A, Troiani E, Corrao S. COVID-19: hemoglobin, iron, and hypoxia beyond inflammation. A narrative review. Clin Pract. 2020;10(2):1271-.
- Gavriilaki E, Anyfanti P, Gavriilaki M, Lazaridis A, Douma S, Gkaliagkousi E. Endothelial Dysfunction in COVID-19: Lessons Learned from Coronaviruses. Curr Hypertens Rep. 2020;22(9):63.
- Jin Y, Ji W, Yang H, Chen S, Zhang W, Duan G. Endothelial activation and dysfunction in COVID-19: from basic mechanisms to potential therapeutic approaches. Signal Transduct Target Ther. 2020;5(1):293.
- Thacker VV, Sharma K, Dhar N, Mancini G-F, Sordet-Dessimoz J, McKinney JD. Rapid endotheliitis and vascular damage characterize SARS-CoV-2 infection in a human lung-on-chip model. EMBO Rep. 2021;22(6):e52744-e.
- Carlos A, Ha D, Yeh D-W, Vankrieken R, Tseng C-C, Zhang P, et al. The chaperone GRP78 is a host auxiliary factor for SARS-CoV-2 and GRP78 depleting antibody blocks viral entry and infection. Journal of Biological Chemistry. 2021;296:100759.
- Ibrahim IM, Abdelmalek DH, Elshahat ME, Elfiky AA. COVID-19 spike-host cell receptor GRP78 binding site prediction. J Infect. 2020;80(5):554-62.
- Girona J, Rodríguez-Borjabad C, Ibarretxe D, Vallvé J-C, Ferré R, Heras M, et al. The Circulating GRP78/BiP Is a Marker of Metabolic Diseases and Atherosclerosis: Bringing Endoplasmic Reticulum Stress into the Clinical Scenario. J Clin Med. 2019;8(11):1793.
- Farshbaf M, Khosroushahi AY, Mojarad-Jabali S, Zarebkohan A, Valizadeh H, Walker PR. Cell surface GRP78: An emerging imaging marker and therapeutic target for cancer. J Control Release. 2020;328:932-41.
- Sabirli R, Koseler A, Goren T, Turkcuer I, Kurt O. High GRP78 levels in Covid-19 infection: A case-control study. Life Sci. 2021;265:118781.
- Rayner JO, Roberts RA, Kim J, Poklepovic A, Roberts JL, Booth L, et al. AR12 (OSU-03012) suppresses GRP78 expression and inhibits SARS-CoV-2 replication. Biochem Pharmacol. 2020;182:114227-.
- Leonard A, Grose V, Paton AW, Paton JC, Yule DI, Rahman A, et al. Selective Inactivation of Intracellular BiP/GRP78 Attenuates Endothelial Inflammation and Permeability in Acute Lung Injury. Sci Rep. 2019;9(1):2096-.
- Calabretta E, Moraleda JM, Iacobelli M, Jara R, Vlodavsky I, O’Gorman P, et al. COVID-19-induced endotheliitis: emerging evidence and possible therapeutic strategies. British Journal of Haematology. 2021;193(1):43-51.
- Iba T, Connors JM, Levy JH. The coagulopathy, endotheliopathy, and vasculitis of COVID-19. Inflamm Res. 2020;69(12):1181-9.
- Liu M, Spellberg B, Phan QT, Fu Y, Fu Y, Lee AS, et al. The endothelial cell receptor GRP78 is required for mucormycosis pathogenesis in diabetic mice. J Clin Invest. 2010;120(6):1914-24.
- Alqarihi A, Gebremariam T, Gu Y, Swidergall M, Alkhazraji S, Soliman SSM, et al. GRP78 and Integrins Play Different Roles in Host Cell Invasion during Mucormycosis. mBio. 2020;11(3):e01087-20.
- Venkataraman T, Coleman CM, Frieman MB. Overactive Epidermal Growth Factor Receptor Signaling Leads to Increased Fibrosis after Severe Acute Respiratory Syndrome Coronavirus Infection. Journal of virology. 2017;91(12):e00182-17.
- Venkataraman T, Frieman MB. The role of epidermal growth factor receptor (EGFR) signaling in SARS coronavirus-induced pulmonary fibrosis. Antiviral Res. 2017;143:142-50.
- Gebremariam T, Liu M, Luo G, Bruno V, Phan QT, Waring AJ, et al. CotH3 mediates fungal invasion of host cells during mucormycosis. The Journal of clinical investigation. 2014;124(1):237-50.
- Lee SC, Li A, Calo S, Heitman J. Calcineurin plays key roles in the dimorphic transition and virulence of the human pathogenic zygomycete Mucor circinelloides. PLoS Pathog. 2013;9(9):e1003625.
- Vellanki S, Billmyre RB, Lorenzen A, Campbell M, Turner B, Huh EY, et al. A Novel Resistance Pathway for Calcineurin Inhibitors in the Human-Pathogenic Mucorales Mucor circinelloides. mBio. 2020;11(1).
- Ibrahim AS, Spellberg B, Walsh TJ, Kontoyiannis DP. Pathogenesis of mucormycosis. Clin Infect Dis. 2012;54 Suppl 1(Suppl 1):S16-22.
- Stanford FA, Voigt K. Iron Assimilation during Emerging Infections Caused by Opportunistic Fungi with emphasis on Mucorales and the Development of Antifungal Resistance. Genes (Basel). 2020;11(11).
- Lecube A, Hernández C, Genescà J, Esteban JI, Jardí R, García L, et al. Diabetes is the main factor accounting for the high ferritin levels detected in chronic hepatitis C virus infection. Diabetes Care. 2004;27(11):2669-75.
- Habib HM, Ibrahim S, Zaim A, Ibrahim WH. The role of iron in the pathogenesis of COVID-19 and possible treatment with lactoferrin and other iron chelators. Biomed Pharmacother. 2021;136:111228.
- Zhou F, Yu T, Du R, Fan G, Liu Y, Liu Z, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet. 2020;395(10229):1054-62.
- Sonnweber T, Boehm A, Sahanic S, Pizzini A, Aichner M, Sonnweber B, et al. Persisting alterations of iron homeostasis in COVID-19 are associated with non-resolving lung pathologies and poor patients’ performance: a prospective observational cohort study. Respir Res. 2020;21(1):276.
- Ibrahim AS. Host cell invasion in mucormycosis: role of iron. Curr Opin Microbiol. 2011;14(4):406-11.
- Prakash H, Rudramurthy SM, Gandham PS, Ghosh AK, Kumar MM, Badapanda C, et al. Apophysomyces variabilis: draft genome sequence and comparison of predictive virulence determinants with other medically important Mucorales. BMC Genomics. 2017;18(1):736.
- Ma LJ, Ibrahim AS, Skory C, Grabherr MG, Burger G, Butler M, et al. Genomic analysis of the basal lineage fungus Rhizopus oryzae reveals a whole-genome duplication. PLoS Genet. 2009;5(7):e1000549.
- Ibrahim AS, Spellberg B, Edwards J, Jr. Iron acquisition: a novel perspective on mucormycosis pathogenesis and treatment. Curr Opin Infect Dis. 2008;21(6):620-5.
- Coutinho AE, Chapman KE. The anti-inflammatory and immunosuppressive effects of glucocorticoids, recent developments and mechanistic insights. Mol Cell Endocrinol. 2011;335(1):2-13.
- Alessi J, de Oliveira GB, Schaan BD, Telo GH. Dexamethasone in the era of COVID-19: friend or foe? An essay on the effects of dexamethasone and the potential risks of its inadvertent use in patients with diabetes. Diabetol Metab Syndr. 2020;12:80.
- Andrianaki AM, Kyrmizi I, Thanopoulou K, Baldin C, Drakos E, Soliman SSM, et al. Iron restriction inside macrophages regulates pulmonary host defense against Rhizopus species. Nat Commun [Internet]. 2018 2018/08//; 9(1):[3333 p.]. Available from: http://europepmc.org/abstract/MED/30127354
https://doi.org/10.1038/s41467-018-05820-2
https://europepmc.org/articles/PMC6102248
https://europepmc.org/articles/PMC6102248?pdf=render.
- Duzgun A, Bedir A, Ozdemir T, Nar R, Kilinc V, Salis O, et al. Effect of dexamethasone on unfolded protein response genes (MTJ1, Grp78, Grp94, CHOP, HMOX-1) in HEp2 cell line. Indian J Biochem Biophys. 2013;50(6):505-10.
- Ulatowski LM, Lam M, Vanderburg G, Stallcup MR, Distelhorst CW. Relationship between defective mouse mammary tumor virus envelope glycoprotein synthesis and GRP78 synthesis in glucocorticoid-treated mouse lymphoma cells. Evidence for translational control of GRP78 synthesis. J Biol Chem. 1993;268(10):7482-8.
[1] COVID-19-associated mucormycosis
[2] Rhino-orbital-cerebral mucormycosis
[3] Angiotensin-converting enzyme 2
[4] Glucose Regulated Protein 78
[5] Heat Shock Protein
[6] Unfolded protein response
[7] Tumour necrosis factor
[8] von Willebrand factor
[9] integrin β1
[10] Epidermal growth factor receptor
[11] Diabetic ketoacidosis
پاتوفیزیولوژی و یافتههای آزمایشگاهی کواگولوپاتی ناشی از کووید-19
دانستنیهای اساسی درباره آزمایشهای کووید-19
اختلالات خونریزیدهنده ارثی و کووید-19
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام


خیلی خوب