کاهش تداخل مواد اندوژن در آزمایشگاه هماتولوژی و بیوشیمی بالینی
دکتر حبیبالله گلافشان، عضو هیئت علمی دانشکده پیراپزشکی شیراز
سارا کهن مظفری، کارشناس ارشد ژنتیک پزشکی
محمد اسماعیل خدمتی، کارشناس ارشد بیوشیمی
روشهای گوناگونی برای شمارش و طبقهبندی گلبولهای قرمز و گلبولهای سفید و پلاکت از قبیل تغییرات هدایت الکتریکی در محلول هادی جریان الکتریسیته با عبور سلول از روزنهای که در دو طرف آن الکترود قرار گرفته و یا از طریق رسانایی سلول از طریق تابش امواج الکترومگنتیک با فرکانس بالا و یا از طریق پراکنش نور و یا روشهای بر پایه فلورسانس در فلوسایتومتری وجود دارد.
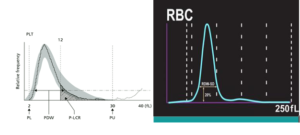
سلول با حجم ۲ تا ۳۰ فیمبتولیتر بهعنوان پلاکت و بین ۴۰ تا ۲۵۰ فمتولیتر بهعنوان گلبول قرمز شمارش گردیده و هیستوگرامهای پلاکتی و گلبول قرمز از دادههای کانال شمارش گلبول قرمز و پلاکت ترسیم میگردد.
رسم خط میانه در هیستوگرام حجمی گلبولهای قرمز، محور X را در میانگین حجم یا اندکس MCV و رسم خط میانه در هیستوگرام حجمی پلاکتی محور ایکس در اندکس MPV یا حجم متوسط پلاکتی قطع میکند.
پهنای خطی که از ۲۰ درصد فراوانی هیستوگرامهای گلبولهای قرمز و پلاکت را قطع کند به ترتیب معادل RDW-SD وPDW-SD است که پارامتری برای تغییرات اندازه است.
با ترسیم دادههای حجم گلبولهای قرمز شمارششده روی محور X و فراوانی گلبولها روی محور Y هیستوگرام حجمی گلبولهای قرمز شکل میگیرد. رسم خط میانه محور X را در پارامتر MCV و پهنای خطی که از 20 درصد فراوانی هیستوگرام حجم را قطع کند با پارامتر RDW-SD مشخص میشود. با سازوکاری مشابه در هیستوگرام پلاکتی ،
پارامتر های PDW و MPV محاسبه میشود.
گلبولهای سفید در دامنهی حجمی ۳۰ تا ۴۰۰ فمتولیتر شمرده شده و هیستوگرام بر مبنای حجم و فراوانی ترسیم میگردد.
غلظت هموگلوبین در طولموج ۵۴۰ نانومتر با تشکیل سیانومتهموگلوبین اندازهگیری میشود و مواردی از قبیل هایپرلیپیدمی، هایپرگاماگلوبولینمی، کرایوگلوبولینمی، تزریق وریدی لیپیدها، گلبولهای داسی و گلبولهای تارگت آغشته به چربی در بیماری کبدی همه موجب کدورت و افزایش کاذب هموگلوبین میگردند. افزایش بیشتر از ۳۰۰۰۰ گلبول سفید نیز موجب کدورت محلول هموگلوبین شده و کربوکسی هموگلوبین در افراد سیگاری بهطور کاذب هموگلوبین را افزایش میدهد. توجه داشته باشید که پلاکتهای ژیانت در کانال شمارش گلبول قرمز بهعنوان گلبول قرمز و در کانال شمارش گلبول سفید بهعنوان لنفوسیت شمرده میشوند و نهتنها موجب کاهش کاذب شمارش پلاکتی میشوند، بلکه موجب افزایش کاذب گلبولهای قرمز و سفید نیز میگردند.
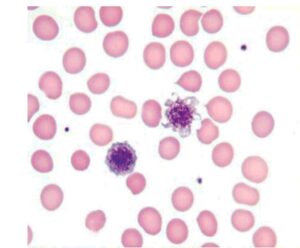
پلاکتهای درشت در ترومبوسیتوپنی ایمونولوژیک، اختلالات میلوپرولیفراتیو، سندرم برنارد سولیر و جهشهای MYH9 شایع است. توجه داشته باشید که تودههای بههم چسبیده پلاکتی ناشی از EDTA که در حرارت اتاق و با زمان شکل میگیرند با کاهش شدید پلاکتی و افزایش شمارش گلبولهای سفید همراه میگردند. تودههای پلاکتی ضمن عبور از دستگاه بهعنوان گلبول سفید شمرده میشوند.
پلاکتهای درشت و ژیانت در آنالیزورهای خونشناسی بهجای لنفوسیت شمرده شده و موجب کاهش کاذب پلاکت میشوند
در مواردی، دیابت ملیتوس کنترلنشده، هایپرناترمی و دهیدراسیون شدید منجر به هایپراسمولار شدن سیتوپلاسم گلبولهای قرمز شده که با ورود آب از محلولهای ایزوتونیک آنالیزور به سیتوپلاسم هایپرتونیک موجب پدیده تورم حاد و افزایش کاذب MCV میگردند.
آگلوتیناسیون سرد با تولید تودههای بههم چسبیده گلبولهای قرمز با افزایش MCV، MCH وMCHC نمای ماکروسیتیک میدهد، درحالیکه در کمخونی مگالوبلاستیک افزایش MCV و MCH با مقدار نرمال MCHC مشاهده میگردد.
افزایش کاذب شمارش گلبولهای سفید در حضور گلبولهای قرمز هستهدار، لایز نشدن گلبولهای قرمز تارگت و گاهی گلبول نوزادان، تجمع پلاکتی و کرایوگلوبولین رخ میدهند. لکوپنی کاذب گاهی به علت لکوآگلوتینین است که در حضور EDTA و دمای اتاق شکل میگیرد. گفتنی است که در سیستمهای امپدانس پلاکتهای ژیانت، گلبولهای قرمز لیزنشده در برخی از هموگلوبینوپاتیها، گلبولهای قرمز آلوده به انگل مالاریا، نوتروفیلهای کمگرانول و هایپولوبوله که در سندرمهای میلودیسپلاستیک مشاهده میشود، همه موجب لنفوسیتوز کاذب میگردند و در آستانه شمارش لنفوسیت در سیستمهای امپدانس قرار میگیرند. گاهی گلبولهای قرمز آلوده به انگل مالاریا بهجای ائوزینوفیل شمرده میشوند.
لنفوسیتهای آتیپیک به علت حجیم شدن سیتوپلاسم گاهی بهعنوان مونوسیت و گاهی در رده گرانولوسیتی شمرده میشوند و در این حالت هیستوگرام سه قسمتی گلبول سفید ایجاد موج افزایش در ناحیه سلولهای میکسد (MIXED) میکند. سلولهای نارس گلبول سفید هم در همین ناحیه موجب افزایش میشوند. گلبولهای قرمز شکسته و یا تکههای شکسته از گلبولهای سفید و جوانههای جداشده از سلولهای بلاست مانند مونوبلاست و مگاکاریوبلاست همه بهعنوان پلاکت شمرده شده و در مواردی از قبیل شمرده شدن جوانههای سلولی بهجای پلاکت، عوارض وخیمی دربر دارد که چنانچه شمارش با گستره محیطی کنترل نگردد موجب از دست رفتن حیات بیمار به دلیل خونریزی میگردد.
شمارش جوانههای سیتوپلاسمی رهاشده از سیتوپلاسم سلولهای سرطانی و پارههای سیتوپلاسمی گلبولهای سفید در آستانهی شمارش پلاکت قرار گرفته و موجب افزایش کاذب شمارش پلاکت در بیمار مبتلا به ترومبوسیتوپنی میگردد که عوارض خطرناکی مثل خونریزی و مرگ را به همراه دارد و تنها با مشاهدهی گسترهی خون محیطی است که میتوان این خطا را شناسایی کرد.
آگلوتیناسیون سرد با چسبیدن تودههای بههم چسبیده گلبول قرمز موجب افزایش MCV، MCH و MCHC میگردد. پارامتر صحیح در این مورد هموگلوبین است که با تعداد کم گلبولهای قرمز در تناقض آشکار است. چنانکه با گرم کردن نمونه آگلوتیناسیون به قوت خود باقی است میتوان همحجم پلاسما را با سالین گرم جایگزین کرد و سپس خون را به آنالیزور داد.
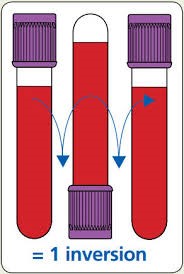
قبل از انجام آزمایش CBC بایستی نمونهی خون را حداقل 8 بار با عمل واژگونسازی مخلوط کرد. تصویر فوق یک مرحله از واژگونسازی را نشان میدهد. نمونهگیری در لولههای ژلدار با فعالکننده لخته نیاز به 5 بار واژگونسازی برای تماس بیشتر خون با سطح ژل دارد
کرایوگلوبولین
کرایوگلوبولینها ایمونوگلوبینهایی معمولاً از جنسIgM هستند که در دمای زیر ۳۷ درجه ایجاد تجمعاتی با وزن مولکولی زیاد میکنند که در گستره خون محیطی قابل مشاهده است. رسوب کرایوگلوبولین در اندازههای گوناگون ممکن است بهعنوان گلبولهای سفید یا پلاکت شمرده شود و افزایش کاذب این گلبولها را سبب شود. اندکسهای گلبول قرمز غالباً نرمال بوده و با گرم کردن خون در ۳۷ درجه میتوان به شمارش صحیح دست یافت.
گستره خون محیطی در حضور کرایوگلوبولین، تودههای آمورف با تهرنگ آبی در زمینه را نشان میدهد. گاهی رسوب در زمینه موجب ناهنجار کردن مورفولوژی گلبولهای قرمز به شکل عجیب و غریب گردیده و گاهی مانند یک لایه کمرنگ سراسر گستره را میپوشاند و بهندرت بهصورت تودههای گلوبولار مشاهده میگردد. رسوب کرایوگلوبولین در بیماریهای اتوایمیون و هپاتیت C گزارش شده و ازاینرو گزارش کردن آن سهم مهمی در تشخیص بیماری دارد.
رسوب کرایو در زمینه گستره محیطی بهصورت تودههای کروی آبی رنگ یا بهصورت اشکال آمورف سراسر گستره را پوشانده و فشار ناشی از رسوب این ذرات موجب پدیدار شدن مرفولوژی عجیب و غریب گلبولهای قرمز میشود
از مهمترین علل کاهش کاذب پلاکت، حضور پلاکتهای ژیانت، تجمع پلاکتی ناشی از EDTA، پدیده اقماری پلاکت، القای تجمع پلاکتی ناشی از EDTA توسط اتوآنتیبادی از جنس IgG، IgM و یا IgA علیه اپیتوپ گلیکوپروتئینی IIb است. این اپیتوپ در حالت نرمال توسط یون کلسیم مخفی است و در حضور EDTA که با کلسیم پیوند میخورد، نمایان میشود و با آنتیبادی واکنش میدهد. این پدیده در ضد انعقادهای دیگر مانند سیترات و اگزالات کمتر رخ میدهد و در افراد مبتلا به بیماری گلانزمن به علت نبود گیرنده IIb اتفاق نمیافتد. در این حالت تهیه نمونه خون در ضدانعقاد سولفات منیزیوم (MgSo4) و یا سیترات سدیم به پخش پلاکتها کمک میکند و برای تشخیص پلاکتهای بههم چسبیده در نمونه EDTAدار میتوان ۲۰ میلیگرم کانامایسین به نمونه اضافه کرد و پس از مدتی شمارش پلاکتی را انجام داد. ضدانعقاد سولفات منیزیوم در غلظت 0/6 تا ۳ میلیمول به ازای هر لیتر از تجمع پلاکتی جلوگیری میکند.
تأخیر آنالیز در نمونه EDTA موجب تورم پلاکتی و پاره شدن آنها گردیده که هر پاره مانند یک پلاکت عمل میکند، گرانولوسیتها با تاخیر در تهیه گستره خون محیطی دارای لوبهای متراکم جدا از هم و هستهی پیکنوتیک میگردند که گاهی ممکن است با گلبولهای قرمز هستهدار اشتباه شوند. ایجاد شکاف در هسته لنفوسیتها که با لنفوسیتهای آتیپیک یا اختلالات لنفوپرولیفراتیو اشتباه میشود از معایب دیگر تاخیر در تهیه گستره میباشد.
نمونه همولیز:
فاکتورهای گوناگونی از قبیل زمان نمونهگیری تا انجام آزمایش، دمای مناسب نگهداری، جلوگیری از تابش نور به نمونه، نمونهگیری در زمان صحیح و نمونهگیری پس از تجویز دارو، همه در انجام آنالیز نقش دارند. جلوگیری از خطاهای پزشکی زمانی مورد توجه واقعی قرار گرفت که انستیتوی پزشکی در سال ۲۰۰۰ حدود ۴۴ هزار تا ۹۸ هزار مرگ قابل جلوگیری و حدود یک میلیون آسیب بیشتر به بیماران در نتیجه خطاهای پزشکی در سال در بیمارستانهای آمریکا را گزارش داد. خطاهای پرهآنالیتیکال ناشی از تداخل مواد اندوژن سردسته خطاهای آزمایشگاهی هستند. با وجودیکه تداخلات ناشی از همولیز، چربی و زردی با سنجشهای فتومتریک شناخته شده است، تداخل با روشهای توربیدومتریک و ایمونواسی نیز گزارش شده است. همولیز با پاره کردن غشای گلبولهای قرمز موجب ورود هموگلوبین و مواد داخل گلبولی به سرم یا پلاسما میشود. آنزیمهایی مانند LDH و AST و الکترولیتهایی مانند پتاسیم و منیزیوم که غلظت درونسلولی آنها بیشتر از سرم است در نتیجه همولیز وارد سرم یا پلاسما میگردند. در مواردی که همولیز شدید است با رها شدن آب درونسلولی به داخل سرم یا پلاسما موجب ایجاد پدیده رقت و کاهش برخی از آنالیتها میگردد.
بهطور طبیعی پلاسما حاوی کمتر از ۲ میلیگرم به ازای هر دسیلیتر و سرم حاوی کمتر از ۵ میلیگرم به ازای هر دسیلیتر از هموگلوبین آزاد است. تشخیص چشمی همولیز زمانی رخ میدهد که میزان هموگلوبین آزاد بیشتر از ۲۰ تا ۷۰ میلیگرم در دسیلیتر باشد. گفتنی است که سرم یا پلاسمای حاوی بیلیروبین بر مقدار همولیز پوشش میگذارد و برای مثال همولیز ۱۰۰ الی ۱۵۰ میلیگرم در دسیلیتر در حضور سرم ژاندیس ممکن است قابل مشاهده چشمی نباشد.
همولیز به دو صورت در بدن (In Vivo) و خارج از بدن (In Vitro) صورت میگیرد؛ برای مثال کمخونیهای اتوایمیون، اختلالات ارثی غشا، هموگلوبینوپاتیها، کمخونیهای میکروآنژیوپاتیک، واکنش همولیتیک حاد ناشی از ترانسفیوژن و هموگلوبیناوری حملهای شبانه و سرمایی، کمبود آنزیم G6PD در حمله حاد همولیز و لایز شدن گلبولهای قرمز ناشی از تهاجم مالاریا از مثالهای همولیز داخل بدن است.
همولیز در خارج از بدن ناشی از صدمات مکانیکی و خونگیری نامناسب است. این مهم است که آزمایشگاه بداند که آیا همولیز نمونه مربوط به داخل بدن یا خارج از بدن است زیرا در همولیز خارج بدن آنالیتهایی مانند پتاسیم و منیزیم و LDH خطا بوده و ممکن است آزمایشگاه گزارش نکند ولی در همولیز داخل بدن مقدار این آنالیتها مقدار واقعی در گردش خون است که برای مثال ممکن است قلب تحت اثر هایپرکالمی قرار گیرد و بایستی گزارش گردد. در همولیز داخل بدن آزمایش ادرار برای هموگلوبیناوری مثبت است و کاهش شدید هاپتوگلوبین مشاهده میگردد و علاوه بر این مشاهده گستره محیطی و شمارش رتیکولوسیت بسیار کمککننده است. نیمهعمر هاپتوگلوبین که با هموگلوبین آزاد کمپلکس داده، ۱۰ تا ۳۰ دقیقه بوده درحالیکه نیمهعمر هاپتوگلوبین آزاد ۵ روز است، ازاینرو در همولیز داخل عروقی بهسرعت میزان آن کاهش مییابد. هنگامی که میزان هموگلوبین آزاد متجاوز از ۱۵۰ میلیگرم به ازای هر دسیلیتر گردد، هاپتوگلوبین اشباع شده و بهسرعت پاکسازی میشود. توجه داشته باشید که کاهش سطح هاپتوگلوبین بدون همولیز داخل بدن در نوزادان و کودکان و نیز موارد ارثی، ممکن است مشاهده شود. گفتنی است که در اکثر مواردی که گلبولهای قرمز در داخل بدن همولیز میدهند، در محیط خارج از بدن در آزمایشگاه با لخته شدن نمونه و سانتریفیوژ کردن میزان همولیز بیشتر میشود و چه بهتر که نمونههای این بیماران برای اندازهگیری آنالیتها و جلوگیری از همولیز بیشتر در لیتیم هپارین گرفته شود و از سنجش پلاسمایی برای سنجش الکترولیتها و آزمایشهای بیوشیمی در موارد اورژانس استفاده گردد.
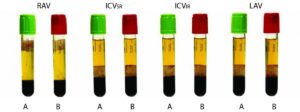
برای جداسازی بهتر سرم یا پلاسما از لولههای ژلدار حاوی هپارین و یا بدون هپارین استفاده میشود. ژلها پلیمرهای غیرمداخلهکننده در بسیاری از آزمایشهای روزمره هستند. ژلها از نظر فیزیکی تیکسوتروپ هستند؛ بدین مفهوم که وزن مخصوص آنها طوری کنترل میگردد که پس از سانتریفیوژ بین سرم و گلبولهای قرمز لخته شده قرار گیرند (لولههای A و B سمت راست). وزن مخصوص سرم یا پلاسما 1/026 گرم در سانتیمتر مکعب و وزن مخصوص لخته در طیف 1/092 تا 1/095 گرم در سانتیمتر مکعب است و ازاینرو وزن مخصوص ژلهای جداکننده در طیف 1/03 تا 1/09 قرار میگیرد. لولهی ژلدار حاوی لیتیوم هپارین با سرپوش سبز برای آزمایشهای CBC و آنالیز شیمی موارد اورژانس بسیار سودمند است. چنانچه پس از سانتریفیوژ ژل جداکننده در جایگاه غیرطبیعی قرار گیرد برای مثال بالای سرم یا پلاسما قرار گیرد، بایستی مواردی از قبیل سانتریفیوژ نامناسب، ژل نامرغوب و یا افزایش ویسکوسیته سرم یا پلاسمای ناشی از پروتئینهای مونوکلونال یا مواد حاجب عکسبرداری را درنظر گرفت. در این موارد چنانچه با نمونهگیری مجدد و شتاب بیشتر سانتریفیوژ، دوباره ژل بالای سرم قرار گیرد (اشکال A و B سمت چپ)، آنالیز سرم برای پروتئینهای مونوکلونال سفارش میشود
هموگلوبین آزاد در طولموج ۴۲۰ نانومتر جذب ماکزیمم دارد و افزایش جذب نوری بین ۳۴۰ و ۴۴۰ نانومتر و بین ۵۴۰ تا ۵۸۰ نانومتر نیز چشمگیر است، ازاینرو آنالیتهایی که در این طولموج اندازهگیری میشوند، تحت تأثیر قرار میگیرند؛ از طرف دیگر ورود هموگلوبین آزاد نهتنها در جذب اسپکتوفتومتری تداخل دارد بلکه با رها شدن اتم آهن در واکنشهای اکسیداسیون احیا یا واکنشهایی که بر سنجش هیدروژن پراکسید و پراکسیداز استوار است، دخالت میکند. توجه داشته باشید که تصحیح میزان آنالیتها مانند پتاسیم بر اساس میزان همولیز روش مناسبی نیست. شکسته شدن گلبولهای سفید مانند آنچه در لوسمیهای حاد و لوسمی مزمن لنفوسیتیک دیده میشود نیز موجب ورود مواد سیتوپلاسمی به داخل سرم یا پلاسما میگردد. در همولیز شدید، آب درون سلول به داخل پلاسما یا سرم آمده و موجب رقیق شدن آنالیت میگردد؛ برای مثال آزمایش PT و PTT ممکن است طولانی و یا گاهی به علت ترومبوپلاستین رهاشده کوتاه گردد و یا برای مثال رقیق شدن خون در همولیز شدید موجب کاهش گلوکز میگردد و از طرف دیگر هر تأخیر یک ساعته در جداسازی سرم از گلبولهای قرمز و لکوسیتها موجب افت ۷ تا ۱۰ میلیگرم گلوکز در هر دسیلیتر میگردد که این میزان با غلظت گلوکز، دمای بیشتر و افزایش شمارش لکوسیتی بیشتر میشود. افزایش AST و LDH در نمونه ممکن است بیماریهای اسکلتی و کبدی را مطرح کند ولی با نرمال شدن ALT امکان همولیز را مطرح میکند.
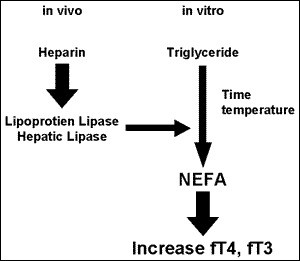
در پروسه تشکیل لخته، به علت فشار وارده از طریق پلیمرهای فیبرین محتویات داخل سیتوپلاسمی آنها مانند پتاسیم داخل سرم میگردد و این تداخلات در موارد ترومبوسیتوز و لکوسیتوز بسیار چشمگیر است. ازاینرو استفاده از لیتیم هپارین در سنجش آنالیتهای این دسته از بیماران ترجیح داده میشود. گفتنی است که هپارین ممکن است در آنالیز تأخیری آزمایشهای تیروئید دخالت کند.
جدول فوق اثرات داروها بهویژه هپارین بر متابولیسم و سطح هورمونهای تیروئیدی را نشان میدهد و ازاینرو پلاسمای هپارینه برای اندازهگیری هورمونهای تیروئیدی چندان مناسب نیست
لولههای آزمایش با سرپوشهای مختلف رنگی با ضدانعقادهای متفاوت همراه با ژل یا بدون ژل
هایپرلیپیدمی:
لیپیدمی برخلاف همولیز خارج از بدن بهسادگی قابل جلوگیری نیست. مواردی از قبیل الکلیسم، دیابت، کمکاری تیروئید، نارسایی مزمن کلیه، التهاب پانکراس، سیروز اولیه مجاری صفراوی، تزریق وریدی چربی و استفاده از داروهای استروئیدی و استروژنی و بازدارندههای پروتئازها با هایپرلیپیدمی همراه هستند. تداخل لیپیدمی در اندازهگیری آنالیتها مربوط به پراکنش نور توسط ذرات لیپوپروتئینها و جابهجا کردن آب (Displace plasma water) توسط این ذرات است. چنانچه کدورت ناشی از لیپیدها زیاد باشد، سنجش آنالیتها خارج از محدوده خطی آنالیزور قرار میگیرد. روشهای سنجش بر مبنای نفلومتری نیز تحت اثر پراکنش نوری ذرات لیپید قرار میگیرند. جابجا شدن آب پلاسما توسط غلظت بالای تریگلیسرید روی سنجش آنالیتهایی که در فاز آبی پلاسما قرار میگیرند، اثرگذار است، زیرا فرض بر این است که پلاسمای تمام نمونههای خون دارای ۹۳ درصد فاز آب است و ازاینرو نمونه با افزایش زیاد تریگلیسیرید دارای آب کمتری در حجم نمونه است که میتواند سبب کاهش کاذب سدیم در روشهایی که نمونه رقیق میگردد، شود.
با سانتریفیوژ کردن نمونه هایپرلیپیدمی، پخش یکنواخت لیپید در پلاسما یا سرم صورت نمیگیرد و لایههای بالاتر دارای مقدار بیشتری لیپید است و ازاینرو آنالیتهای فاز آبی مقدار کمتری را در این قسمت به علت افزایش جایگزینی چربی با آب نشان میدهند. عکس این موضوع برای سنجش لیپیدها و آنالیتهای محلول در چربی از قبیل برخی از داروها صادق است که با غلظت بالاتری مورد آنالیز قرار میگیرند.
علاوه بر تداخلهای اسپکتروفتومتری و جابجایی آب، ذرات لیپید در سازوکارهای فیزیک شیمی نیز دخالت میکنند؛ برای مثال چنانچه یک آنالیت در پوشش لیپیدی قرار گیرد ممکن است در دسترس سوبسترا یا آنتیبادی در آزمایشهای الیزا یا آزمایشهای ایمونواسی قرار نگیرد، از طرف دیگر هایپرلیپیدمی روی جداسازی آنالیتها با روش الکتروفورز و کروماتوگرافی تداخل دارد. لیپیدمی ممکن است ناشی از غذا خوردن اخیر یا اختلالات متابولیسم چربی باشد. تراکم تریگلیسرید بهویژه در شکل شیلومیکرون بین یک تا چهار ساعت پس از خوردن افزایش یافته و بقایای شیلومیکرون برای ۶ تا ۱۲ ساعت بالا است و ازاینرو بیمار بایستی حداقل ۱۲ ساعت قبل از نمونهگیری ناشتا باشد. بیمارانی که چربی وریدی میگیرند بایستی حداقل ۸ ساعت قبل از نمونهگیری درمان قطع شود.
تشخیص هایپرلیپیدمی از روی خون کامل مشکل بوده و نیاز به غلظت تریگلیسرید بیشتر از ۱۰۰۰ میلیگرم به ازای هر دسیلیتر دارد، درحالیکه غلظت بیشتر یا مساوی ۳۰۰ میلیگرم بر دسیلیتر موجب کدورت و یا شیریرنگ شدن پلاسما میگردد. قابلیت تریگلیسرید برای کدر کردن پلاسما بستگی به حضور تریگلیسرید در شیلومیکرون، لیپوپروتئین با دانسیته خیلی پایین (VLDL) یا لیپوپروتئین با دانسیته پایین (LDL) دارد. بیشتر آنالیزورها قادر به تشخیص هایپرلیپیدمی با اندازهگیری جذب نوری بالای ۶۰۰ نانومتر هستند. روشهایی از قبیل سانتریفیوژ با دور بالا، استخراج لیپیدها با حلالهای آلی و رسوب آنها و افزایش دترجنت به معرفهای آزمایشگاهی مطرح شده است. چنانچه کدورت نمونه ناشی از شیلومیکرون باشد، سانتریفیوژ با دور (g)۱۲۰۰۰ به جداسازی آن کمک میکند و چنانچه لیپیدها بهطور اولیه VLDL یا ذرات LDL باشند، نیاز به نیروی بیشتر سانتریفیوژ است.
لیپیدمی را میتوان از نمونههای مربوط به هماتولوژی با سانتریفیوژ جدا کرد؛ در این حالت پلاسمای کدر را برداشته و همحجم آن سرم فیزیولوژی اضافه میشود. توجه داشته باشید که چند میلیمتر بالای لایه بافیکوت را نگه دارید تا از کاهش شمارش سلولی جلوگیری شود. برخی از ذرات لیپوپروتئین با توانایی پراکنش نور در آستانه شمارش پلاکت قرار میگیرند. در یک نمونه هایپرلیپیدمی در آزمایش CBC، افزایش کاذب هموگلوبین و افزایش باورنکردنی ایندکسهای خون از جمله MCHC مشاهده میگردد. گلبول قرمز در رنگآمیزی دارای حاشیه مات (Blurred RBC) میگردد و گزارش مورفولوژی با مشکل مواجه میشود.
پارامتر هماتوکریت که در غالب آنالیزورها حاصل MCV*RBC است ممکن است چندان تحت اثر هایپرلیپیدمی قرار نگیرد. در نمونه همولیز در رابطه با شدت همولیز، شمارش گلبولهای قرمز کاهش یافته و با توجه به اینکه هموگلوبین آزاد وارد پلاسما میشود، مقدار هموگلوبین با توجه به شمارش گلبولهای قرمز افزایش مییابد. پارامتر MCH و MCHC افزایش نشان میدهد. با توجه به اینکه هیستوگرام حجم از روی شمارش گلبولهای سالم ترسیم میشود، محاسبات MCV و RDW از روی هیستوگرام است و ازاینرو این دو پارامتر چندان تحت اثر همولیز قرار نمیگیرند.
پراکنش نوری ذرات شیلومیکرون و VLDL در رابطه با اندازه آنها است، برای مثال ذرات VLDL در سه کلاس ریز ۲۷ تا ۳۵ نانومتر، متوسط ۳۵ تا ۶۰ نانومتر و بزرگ ۶۰ تا ۲۰۰ نانومتر قرار میگیرند و ازاینرو ذرات متوسط تا بزرگ در پراکنش نور مؤثر واقع میشوند. شیلومیکرونها مخلوطی غیریکنواخت از ذرات در طیف ۱۰۰۰-۷۰ نانومتر میباشند. از آنجایی که ذرات VLDL و شیلومیکرون از نظر اندازه و محتوای تریگلیسرید متفاوتند، اندازهگیری تریگلیسرید ارتباط ضعیفی با کدورت نمونه دارد. استفاده از ذرات مصنوعی امولسیون چربی در سایزهای ۲۰ تا ۶۰۰ نانومتر برای تقلید اثر تداخلی چربیهای آندوژن در سنجش آنالیتها موجب از دست دادن سایز بزرگ ذرات VLDL و سایزهای ریز شیلومیکرون میگردد و ازاینرو مانند پلاسمای هایپرلیپیدمی واقعی عمل نمیکنند.
بیلیروبین
افزایش سطح بیلیروبین یکی دیگر از مواد اندوژن مداخلهکننده است. افزایش جذب نوری بیلیروبین در طیف طولموجهای ۳۴۰ تا ۵۰۰ نانومتر بوده و ازاینرو سنجش آنالیتها در این طولموج در حضور افزایش بیلیروبین موجب خطا میگردد. بیلیروبین علاوه بر تداخل اسپکتروفتومتری توانایی واکنش شیمیایی با برخی معرفها را دارد؛ برای مثال بیلیروبین در سنجشهای بر اساس اکسیداز/ پراکسیداز که برای اندازهگیریهای گلوکز، کلسترول، تریگلیسرید و اسید اوریک به کار میرود، واکنش میدهد.
واکنش بیلیروبین با هیدروژن پروکساید تولیدشده در سیستم آزمایش موجب کاهش سطح آنالیت مورد نظر میگردد. بیلیروبین توانایی تداخل با رنگهایی که به آلبومین پیوند میدهند را دارد. کاهش جذب نوری بیلیروبین به علت اکسیداسیون در محیط قلیایی از موارد اصلی تداخل در برخی از روشهای ژافه در اندازهگیری کراتینین است. دستورالعملهایی برای ارزیابی عوامل مداخلهگر در سنجش آنالیتها ارائه شده است؛ یکی از این روشها مقایسه اندازهگیری آنالیتها با روشی است که تحت اثر تداخل اندوژن ها قرار نگیرد. برای سنجش اثرات مواد مداخلهگر، نمونهها را به قسمتهای مساوی تقسیم کرده و بهطور سریال غلظتهای زیاد مواد مداخلهگر اضافه و آنالیز بهطور سریال مورد سنجش قرار میگیرد. اثر مواد مداخلهگر با استفاده از آنالیز رگرسیون با ترسیم اندازهگیری آنالیت در مقابل غلظت مواد مداخلهگر ارزیابی میشود. چنانچه شیب آنالیز رگرسیون از یک مقدار اندازهگیریشده برای مثال 10± درصد تفاوت کند، میتوان نتیجه گرفت که ماده مداخلهگر در تست تأثیر داشته است.
واکنشهای غیرعفونی انتقال خون(2)
بررسی واکنشهای ناشی از انتقال خون (11)
مدیریت مقادیر بحرانی و اهمیت تهیه گستره محیطی در آزمایشگاه خونشناسی (1)
چگونه تداخل در ایمنیسنجی را شناسایی و برطرف کنیم
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام