آزمایشگاه تشخیص پزشکی و قارچشناسی کلینیکی
بخش دوم
دکتر محمد قهری
با توجه به روند رو به افزایش دامنهی ارگانیسمهای پاتوژن، عفونتهای مهلک بیش از گذشته گزارش میشوند. امروزه روشن شده است که هیچ ارگانیسم قارچی غیرپاتوژنی وجود ندارد و عملاً هر ارگانیسم قارچی میتواند در یک میزبان دارای اختلال در سیستم ایمنی یک میکوز خطرناک ایجاد کند. مؤسساتی که وظیفهی مراقبت از بیماران ایمیونوکامپرومایزد و در معرض خطر بالا را بر عهده دارند باید اولویت والایی برای به حداکثر رساندن توانائیهای تشخیصی خود برای جستجو و آشکارسازی سریع و بهموقع عفونتهای قارچی فرصتطلب فراهم نمایند. تشخیص موفقیتآمیز و مدیریت چنین عفونتهایی در بیمار مستعد بسیار وابسته به یک فعالیت تیمی متشکل از کلینیسینها، میکروبیولوژیستها و پاتولوژیستها است. در بخش نخست تکنیک آزمایش مستقیم میکروسکپی مورد بحث قرار گرفت، در ادامه روش کشت برای شناسایی عوامل قارچی مورد اشاره قرار میگیرد.
کشت
حساسترین روش تشخیص یک عفونت قارچی، جداسازی عامل یا عوامل عفونت بر روی محیط کشت است؛ با این حال در عفونتهای قارچی منتشره کشتهای منفی کاذب دیده میشود و حتی هنگامی که نتیجهی کشت مثبت است نتایج ممکن است با تأخیر بدست آید و یا تفسیر آن مشکل باشد. در بسیاری از موارد برای شناسایی اختصاصی عامل اتیولوژیک انجام کشت ضروری است و با کمک کشت است که میتوان برای تعیین حساسیت in vitro عامل قارچی نسبت به عوامل مختلف ضد قارچی اقدام نمود. تمام عفونتهای خطیر قارچی ممکن است انتشار خونی نداشته باشند و بنابراین موجب فونژمی نشوند، اما نشان دادن فونژمی در تشخیص عفونت فرصتطلب مربوط به گونههای کاندیدا، کریپتوکوکوس نئوفرمنس، گونههای تریکوسپورون، گونههای مالاسزیا، گونههای فوزاریوم و گاهی اوقات گونههای آکرومونیوم، پسیلومایسس، سپدونیوم و آسپرجیلوس ترئوس مفید است. کشتهای خون ممکن است در حضور یک بیماری منتشره منفی باشند، اگرچه به مدد پیشرفتهایی که در تکنولوژی کشت خون شده است، توانایی آزمایشگاهها را برای آشکار کردن فونژمی بهبود داده است. پیشنهاد شده است که آشکارسازی مطلوب فونژمی به جمعآوری حجمهای کافی از خون (20 الی 30 میلیلیتر) نیاز دارد و نیز اگر از روش کشت خون بر پایهی آبگوشت (vented, agitated) و آگار (لیز- سانتریفیوژ) استفاده شود نتایج بهتری حاصل میگردد.
با توجه به کلونیزاسیون غالب در محلهای معینی از بدن (مانند مجاری تنفسی، گوارشی و ادراری تناسلی) تفسیر نتایج کشتهای قارچی ممکن است مشکل باشد و آلودگی نمونهها یا کشتها با ارگانیسمهای محیطی مسئله را کمی پیچیدهتر نماید، همچنین بسیاری از این ارگانیسمهای محیطی میتوانند بهعنوان عوامل اتیولوژیک میکوزهای فرصتطلب عمل نمایند. در جایی که اکثر ایزولههای کاندیدا، کریپتوکوکوس نئوفرمنس، هیستوپلاسما کپسولاتوم و فوزاریوم از کشتهای خون جدا شوند به لحاظ کلینیکی اهمیت دارند در صورتی که جداسازی سایر قارچها مانند گونههای آسپرجیلوس (بهاستثنای آسپرجیلوس ترئوس) و گونههای پنیسیلیوم (بهاستثنای پنیسیلیوم مارنفئی) به احتمال زیاد بیانگر سودوفونژمی یا آلودگی است.
نتایج کشت هر نمونهی کلینیکی که مثبت است برای هریک از پاتوژنهای اندمیک دیمورفیک (هیستوپلاسما کپسولاتوم، بلاستومایسس درماتیتیدیس و کوکسیدیوئیدس ایمیتیس) در واقع همیشه از نظر کلینیکی بااهمیت در نظر گرفته میشوند. جداسازی گونههای آسپرجیلوس از کشتهای نمونههای مجاری تنفسی بهویژه مشکلساز است، زیرا این ارگانیسم در محیط شایع است و ممکن است راههای هوایی را کلونیزه کند بدون آنکه بیماری آشکاری ایجاد نماید. اهمیت کلینیکی جداسازی گونههای آسپرجیلوس از کشتهای مجاری تنفسی ممکن است بر اساس مشاهدهی میکروسکوپی مستقیم ارگانیسم در بافت زنده تأئید شود.
اکنون شواهد قابلتوجهی وجود دارند که نشان میدهد که تفسیر کشتهای مجاری تنفسی (خلط، لاواژ برونکوآلوئلار) که دربردارندهی گونههای آسپرجیلوس است بهوسیلهی در نظر گرفتن یا ملاحظه کردن میزان خطر گروهی مربوط به بیمار ممکن است مورد قضاوت قرار بگیرد.
در بین بیمارانی که برای آسپرجیلوزیس تهاجمی در معرض خطر بالا قرار میگیرند (گیرندگان پیوند آلوژنیک مغز استخوان، بیماران مبتلا به بدخیمیهای هماتولوژیک و بیماران مبتلا به نوتروپنی) یک کشت مثبت از نظر گونههای آسپرجیلوس اغلب با بیماری تهاجمی مرتبط است. ارزش پیشگویی مثبت یک کشت مثبت برای آسپرجیلوس برای گیرندگان پیوند اتولوگ مغز استخوان، گیرندگان پیوند عضو جامد و بیماران آلوده به HIV کمتر است؛ بعلاوه شناسایی اختصاصی قارچ جداشده از کشت تنفسی میتواند در تعیین اهمیت کلینیکال آن کمک کند، آسپرجیلوس نیجر بندرت یک ارگانیسم پاتوژن است در حالی که به لحاظ آماری نشان داده شده است که آسپرجیلوس ترئوس و آسپرجیلوس فلاووس هنگامی که از کشت نمونههای تنفسی جدا میشوند با آسپرجیلوزیس تهاجمی (IA) مرتبط هستند.
شناسایی خصوصیات قارچها
شناسایی قارچها در سطح جنس و گونه بهطور فزایندهای اهمیت مییابد زیرا دامنهی پاتوژنهای فرصتطلب در حال گسترش است. هرچند که تظاهرات کلینیکی بسیاری از عفونتهای قارچی ممکن است از یکدیگر غیرقابل تشخیص باشند، شناسایی گونههای عامل اتیولوژیک ممکن است اثر مستقیمی بر روی مدیریت فرآیند عفونی داشته باشند. امروزه برای مدیریت همه یا حتی اکثر عفونتهای قارچی بر روی یک روش درمانی واحد (بهعنوان مثال استفاده از آمفوتریسین B) نمیتوان تأکید کرد. در حالتی که با میکوزهای غیرمعمول مواجه هستیم بررسی تاریخچه و تجربهی دیگران و دوره و فرآیند عفونت و پاسخ به درمان باید مورد نظر و مطالعه قرار گیرند.
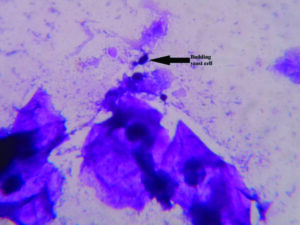
سلولهای مخمری در اسمیر ترشحات واژینال
شناسایی مخمرها
مخمرها معمولاً با توجه به ویژگیهای مرفولوژیک شناخته میشوند. مخمرها سلولهای منفردی هستند که یک جوانهی ساده تولید میکنند. اگرچه تحت شرایط ویژهای ممکن است برخی از آنها هایفی حقیقی، سودوهایفی، کپسول، آرتروکونیدی و سایر ساختمانهای تولیدمثلی را ایجاد نمایند. از آنجا که کاندیدا آلبیکنس اکثریت مخمرهای بدستآمده از نمونههای کلینیکی را به خود اختصاص میدهد، چندین تست سریع و ساده برای تشخیص آن از سایر مخمرها فراهم شده است.\
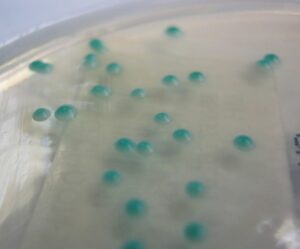
کاندیدا آلبیکنس (محیط کشت اختصاصی کروم آگار کاندیدا)
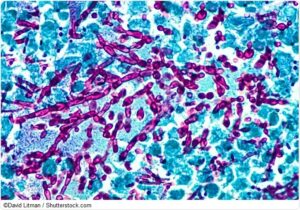
سودوهایفی و بلاستوسپورهای کاندیدا آلبیکنس (رنگآمیزی پاس)
در بین بیش از 100 گونه از جنس کاندیدا، 5 گونهی آلبیکنس، گلابراتا، پاراپسیلوزیس، تروپیکالیس و کروزی در حدود 95 الی 98 درصد موارد کاندیدیازیس تهاجمی را به خود اختصاص میدهند. گزارشهای سالیان اخیر نشان میدهند که تغییر شیفتی در انتشار گونههای غیر آلبیکنسی با ظهور کاندیدا گلابراتا، کاندیدا کروزی و کاندیدا لوزیتانیا و سایر گونههای کمتر شایع اتفاق افتاده است. عفونتهای ناشی از این گونههای مختلف نیازمند راههای درمانی متفاوتی است. در رابطه با پتانسیل پاتوژنیک کریپتوکوکوس نئوفرمنس، تمامی مخمرهای کپسولداری که از هر ناحیه از بدن جدا شده باشد، باید شناسایی شود. تستهای غربالگری متعددی برای شناسایی اولیه کریپتوکوکوس نئوفرمنس شامل تست اورهآز (که مثبت است)، تست نیترات (که منفی است) و تولید فنول اکسیداز (مثبت) وجود دارند. سایر مخمرهای غیر آلبیکنس با توجه به مقاومت وسیع نسبت به داروهای ضد قارچی قابل توجه هستند.
کلنیهای کاندیدا گلابراتا در محیط کشت کروم آگار کاندیدا
كانديدا آلبيكنس و گونههای شایع غیر آلبیکنسی در یک نگاه
| نكات عملي و قابل توجه |
| 1- عفونت کاندیدایی كه با آن برخورد كردهايد ممكن است ناشي از كانديدا آلبيكنس نباشد.
2- مقاومت به مواد ضد قارچي آزولي در بین گونههای کاندیدا در حال افزايش است. 3- مراقبين بهداشتي معمولاً ناقلين مخمرها بهوسيلة دستهای خود هستند. |
چگونه كانديدا آلبيكنس را از ساير گونهها تشخيص دهيم؟
تشخيص كانديدا آلبيكنس از ساير گونهها با كمك مشخصات مرفولوژي، بيوشيمي، تست جرم تيوب و تکنیکهای ملكولي صورت میگیرد.
- مرفولوژي: كشت در محيط كورن ميل آگار صورت میگیرد. كانديدا آلبيكنس در اين محيط بعد از 3 روز توليد كلاميدوكونيدي میکند. توليد سودوهايفي بدون كلاميدوكونيدي نشاندهندة گونههاي ديگر كانديدا است. توليد آرتروسپور نشاندهندة تريكوسپورون است. كانديدا گلابراتا در محيط كورن ميل آگار فقط بلاستوسپور ایجاد میکند.
کلنیهای كانديدا آلبيكنس در محيط گلوكز پپتون آگار در دماي 30 درجه به رنگ سفيد يا كرم، صاف و براق يا گاهي اوقات ناصاف و مات ديده میشود و اين اشكال در تشخيص چندان کمککننده نيستند.
كانديدا تروپيكاليس نيز نماي مشابهي دارد (هايفي حقيقي دارد اما فاقد كلاميدوسپور است)، ممكن است بلاستوسپور در فواصل بين سلولهای هايفي ديده شود. در تشخيص افتراقي آن از كانديدا آلبيكنس تستهای بيوشيمي کمککننده است.
كانديدا تروپيكاليس سوكروز را تخمير میکند.
كانديدا دوبلينینسيس از لحاظ مرفولوژيك و بيوشيميائي بسيار شبيه كانديدا آلبيكنس است و برای تفکیک این دو یا باید از چندین تست بیوشیمیایی یا فیزیولوژیکی استفاده کرد و یا اینکه از روش ملکولی (PCR-RFLP) سود جست.
كانديدا كروزئي هايفي حقيقي ندارد اگرچه سودوهايفي كه توليد میکند ممكن است بسيار شبيه هايفي حقيقي باشد. اين قارچ بلاستوسپورهاي بيضي شكل توليد میکند.
كانديدا لوزيتانيا سودوهايفي دراز با شاخههاي جانبي كم و بلاستوسپورهاي فراوان و بيضوي كوچك توليد میکند. جذب رامنوز از ویژگیهای بارز اين قارچ است.
كانديدا پاراپسيلوزيس داراي سودوهايفي است كه اغلب به يك سلول متورم منتهي میشود و گاهی اوقات بلاستوكونيديهاي نسبتاً گرد نيز ديده میشوند.
كانديدا گلابراتا سودوهايفي تشكيل نميدهد و به همين دليل قبلاً آن را بهعنوان تورولوپسيس میشناختند. داراي بلاستوكونيدي گرد تا بيضي كوچك است. (كانديدا فاماتا و كانديدا اينكونسپيكوزا و ساكارومايسس سرويسيه شبيه يكديگر و مشابه اين قارچ هستند).
کاندیدا گیلرموندی و کاندیدا گلابراتا برای رشد به انکوباسیون طولانیتری نیاز دارند.
کاندیدا تروپیکالیس، کاندیدا پاراپسیلوزیس و کاندیدا کروزی نسبت به سیکلوهگزامید حساس هستند.
- بيوشيمي: با استفاده از تست تخمير قندها میتوان به يك تشخيص احتمالي سريع دست يافت. البته اين تست به تنهایي كافي نيست و در كنار آن از مرفولوژي قارچ نيز هميشه بايد كمك گرفت.
- تست سرمي جرم تيوب: يك تست سريع و پیشنهادی براي كانديدا آلبيكنس است. روش انجام آن بدين صورت است كه مقدار بسيار كمي از كلني مخمري را در سرم اسب و یا سرم تازهی انسان و در دماي 37 درجه به مدت 2 تا 3 ساعت انكوبه كرده سپس با استفاده از اسلايد ميكروسكپي (لام مرطوب) چنانچه هايفيهاي كوتاه كه طول آنها بيش از دو برابر قطر سلول مخمر اوليه باشد مشاهده شوند، نتيجه تست مثبت در نظر گرفته میشود. نتايج منفي كاذب هم ديده میشود.
- تکنیکهای ملكولي: روشهای ملکولی مختلفی از قبیل PCR، PCR-RFLP، تعیین توالی اسیدهای نوکلئیک ژنومی و غیره برای شناسایی سریع و دقیق گونههای کاندیدا وجود دارند.
شکل ظاهری کلنیهای مخمری
کلنیهای مخمری از نظر رنگ، سفید تا کرم، کرم متمایل به زرد، زرد متمایل به نارنجی، نارنجی و قرمز رنگ هستند. بسته به شرایط غذایی و نگهداری، حاشیه یا مرز میسلیالی ممکن است در اطراف کلنی بعضی از گونهها ایجاد گردد. گرچه ظاهر کلنیهای مخمری در گونههای مختلف برعکس قارچهای میسلیال (کپکی) تفاوت چندانی با یکدیگر ندارند، ولی ایجاد رنگدانه یکی از ویژگیهای مهم در تعیین هویت آنها است. در صورتی که رنگ کلنی مخمری نارنجی تیره تا قرمز باشد، میتوان تعدادی از مخمرهای فوقالعاده پاتوژن مانند کریپتوکوکوس نئوفرمنس، انواع کاندیدا، مالاسزیا، گونههای ترایکوسپورون و شکل مخمری قارچهای دوشکلی (دیمورفیک) را کنار گذاشت. اگر کلنی به رنگ کرم یا کرم تیره و شدیداً موکوئید باشد، پاتوژنی که بیشتر محتمل است، کریپتوکوکوس نئوفرمنس بوده و بدین ترتیب میتوان کاندیدا آلبیکنس و یا انواع دیگر کاندیداهای پاتوژن را از لیست عوامل احتمالی حذف کرد.
ضمیمه:
دمای رشد (کشت)
برای مقایسه درجه رشد کشتهای مخمری نمیتوان از استریک (streak) کردن یک آنس از مخمر موردنظر بر روی محیط کشت موجود در لوله یا پلیت استفاده کرد زیرا مقدار زیاد مواد تلقیح شده موجب اشتباه در خواندن نتیجهی رشد خواهد شد؛ بنابراین بهتر است ابتدا از سلولهای مخمری، سوسپانسیونی در سرم فیزیولوژی تهیه کرده و یک آنس از سوسپانسیون فوق را روی آگار موجود در لوله یا پلیت و در دو سری استریک نمود. یک سری را در دمای 30 درجه و سری دیگر را در دمای 37 درجه نگهداری کرده و سپس در عرض مدت 2 تا 3 روز میزان رشد را در درجات حرارت مختلف مقایسه کرد.
تست لوله زایا برای تشخیص کاندیدا آلبیکنس
این تست یکی از ابتداییترین روشهای تشخیصی کاندیدا آلبیکنس است. 90 درصد ایزولههای کلینیکی کاندیدا در صورتی که درون سرم تازهی انسان و به مدت 2 تا 3 ساعت در دمای 37 درجه نگهداری شوند، لوله زایا ایجاد میکنند. لولههای زایا هایفیهای کوتاه و ابتدایی هستند که مستقیماً از سلولهای مخمری جدا میشوند. گاهی در شرایط مشابه، آرتروکونیدیاهای ژئوتریکوم و ترایکوسپورون ایجاد لولههای طویلی را مینمایند که با لولههای زایای کاندیدا آلبیکنس مشابهت دارند، ولی بههرحال کاندیدا آلبیکنس اولاً سلولهای جوانهزن فعال را نیز علاوه بر لولههای زایا ایجاد مینماید و ثانیاً فاقد آرتروکونیدیا و میسلیوم حقیقی بوده و بدین ترتیب از دو قارچ مذکور افتراق داده میشود. مانند سایر آزمایشها مقدار مخمر تلقیحی، محیط کشت مصرفی و درجه حرارت انکوباسیون در نتایج بدستآمده مؤثر هستند. سرم انسان یا حیوانات آزمایشگاهی برای انجام آزمایش مناسب است ولی بعلت احتمال وجود ویروسهای بیماریزا در سرم انسانی توصیه شده است که از سرم گوساله و یا سرم اسب استفاده شود. بالاترین میزان تولید لوله زایا در صورتی است که میزان ارگانیسم تلقیحشده در سرم، به تعداد یکصدهزار یا یک میلیون سلول در هر میلیلیتر باشد. اگر تعداد سلولها زیاد باشد ایجاد لوله زایا کاهش خواهد یافت. میتوان از واریتههایی از کاندیدا آلبیکنس که ایجاد لوله زایا میکنند بهعنوان شاهد مثبت و از کاندیدا تروپیکالیس بهعنوان شاهد منفی در طی آزمایش استفاده نمود.
یکی از سادهترین روشهای انجام این تست در زیر شرح داده شده است.
- توسط یک آنس استریل از کشت خالص مخمر برداشت کنید.
- سوسپانسیونی از مخمر در درون سرم گوساله، گاو، خرگوش یا انسان تهیه نمایید، بطوریکه حجم آن 0/3 تا 0/5 میلیلیتر بوده و حاوی حدود 100 الی 1000 سلول باشد.
- سوسپانسیون فوقالذکر را در دمای 37 درجه به مدت 2 تا 3 ساعت نگهداری نمایید.
- توسط یک آنس استریل یک قطره از سوسپانسیون فوق را روی یک لام استریل گذاشته و پس از پوشاندن آن توسط لامل، وجود یا فقدان لوله زایا را در زیر میکروسکوپ بررسی نمایید.
مروری بر تشخیص افتراقی گونههای کاندیدا
آزمایشگاه تشخیص پزشکی و قارچشناسی کلینیکی (1)
مخمرهای جدا شده از دستگاه ادراری در بیماران سونداژ شده
پیشرفتهای جدید در درک مکانیسمهای بیماریزایی قارچهای فرصت طلب (3)
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام